ECT2和E2F1蛋白在乳腺癌中的表达及临床意义
2017-08-31王宏坤郑绘霞梁建芳
王宏坤,郑绘霞,梁建芳,肖 虹
(山西医科大学第一医院病理科,太原 030001;*通讯作者,E-mail:huixiazheng62@126.com)
ECT2和E2F1蛋白在乳腺癌中的表达及临床意义
王宏坤,郑绘霞*,梁建芳,肖 虹
(山西医科大学第一医院病理科,太原 030001;*通讯作者,E-mail:huixiazheng62@126.com)
目的 探讨ECT2和E2F1蛋白在乳腺癌中的表达并分析其临床意义。 方法 应用免疫组织化学EnVision法检测在山西医科大学第一医院病理科收集的133例乳腺癌和80例正常乳腺组织中ECT2和E2F1蛋白的表达情况。 结果 ECT2和E2F1蛋白在乳腺癌中的阳性表达率分别为55.6%和74.4%,二者分别与正常组织(8.8%和2.5%)比较,差异有统计学意义(P<0.05);ECT2和E2F1蛋白表达与患者年龄、肿瘤大小及肿瘤类型无关(P>0.05),与肿瘤分级、淋巴结转移及TNM分期有关(P<0.05)。相关性分析显示,ECT2和E2F1蛋白在乳腺癌中的表达呈显著正相关性(r=0.344,P<0.05)。 结论 ECT2和E2F1蛋白表达在乳腺癌的发生发展过程中相互之间存在一定的作用,ECT2在乳腺癌中的作用可能受E2F/RB信号通路的调控,二者共同表达对评估患者预后有一定的价值。
乳腺癌; ECT2; E2F1
乳腺癌为恶性上皮性肿瘤,是上皮细胞恶性转化而形成的。在上皮细胞恶性转化的过程中可能存在多种基因蛋白的参与及多种信号通路的参与。与人类癌症发生密切相关的癌基因,ECT2(epithelial cell transforming sequence 2)即上皮细胞转化序列2,它的作用是在某些信号通路的参与下能将上皮细胞恶性转化,从而形成肿瘤[1]。E2F/RB信号通路在癌症的形成过程中起了重要的作用,是细胞周期中调控细胞分裂的重要通路,有研究显示,ECT2直接受E2Fs信号通路的调控,在敲除RB基因的骨肉瘤U-2 OS细胞中,ECT2表达受到抑制并且导致了细胞分裂的停滞,说明在RB缺失的细胞中,缺乏E2F介导的细胞分裂的调控是ECT2表达受抑制的主要原因[2]。本研究通过检测乳腺癌中ECT2和E2F1蛋白的表达情况,分析二者的表达关系及临床意义,初步探讨ECT2在乳腺癌中的作用机制。
1 材料与方法
1.1 材料
收集2012-01~2016-01间在山西医科大学第一医院病理科存档的乳腺癌根治标本133例,80例相应正常乳腺组织(标本均为乳腺癌根治标本中远离癌组织的正常乳腺)。全部病例术前均未行放疗、化疗,并已将资料不完整者排除(包括患者年龄、其他病史、放化疗史等不详的资料)。所有病理资料全部进行复查,均由2名资深的高级职称病理医师双盲做出诊断。
1.2 实验方法
ECT2抗体购自Sigma公司,E2F1鼠抗人单克隆抗体、免疫组化试剂盒和DAB显色试剂盒购自福州迈新生物技术有限公司。免疫组化按EnVision二步法进行检测。ECT2、E2F1浓度配比1 ∶100。实验步骤按试剂说明书进行,4 μm厚切片常规脱蜡至水,3%H2O2液处理标本,高压抗原修复冲洗,滴加一抗二抗,显色,苏木素复染,脱水、透明、封片。用已知阳性切片作阳性对照和PBS液代替一抗作阴性对照。
1.3 结果判断
显微镜下可见ECT2蛋白在肿瘤细胞胞核中表达,部分细胞胞质有微弱表达,E2F1以细胞核呈棕黄色为阳性,以染色强度和阳性细胞百分率判断,高倍镜(×400)下随机选取5个视野,每个视野计数50个细胞,取平均值作为阳性百分率(阴性为0,阳性细胞占1%-10%为1分,11%-50%为2分,51%-80%为3分,81%-100%为4分),染色强度不显色为0分,依次弱阳性1分、中等阳性2分、强阳性3分。两者积分相乘:≤4分为低表达/不表达,>4分为高表达。
1.4 统计学分析
所有统计结果采用SPSS16.0统计软件处理,计数资料应用χ2检验及Pearson相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 ECT2和E2F1蛋白在乳腺癌和正常乳腺组织中的表达
ECT2蛋白在133例乳腺癌中有74例阳性表达,阳性率为55.6%,与正常乳腺组织阳性率8.8%(7/80)比较差异有统计学意义(P<0.05);E2F1蛋白在乳腺癌中的阳性表达率为74.4%,正常乳腺组织为2.5%,二者比较差异有统计学意义(P<0.05,见表1)。免疫结果显示ECT2和E2F1在乳腺癌中呈高表达(见图1,2)。
表1 ECT2和E2F1蛋白在乳腺癌和正常乳腺组织中的表达情况
Table 1 The expression of ECT2 and E2F1 protein in breast cancer and normal breast tissues

分组ECT2E2F1+-χ2P+-χ2P乳腺癌 745946.6020.0009934103.6750.000正常乳腺组织773278
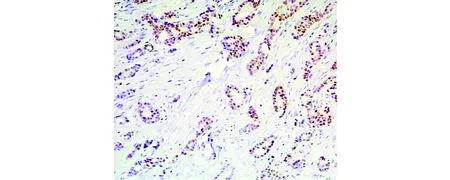
图1 ECT2在乳腺癌中高表达(EnVision法,×100)Figure 1 High expression of ECT2 in breast cancer (EnVision,×100)
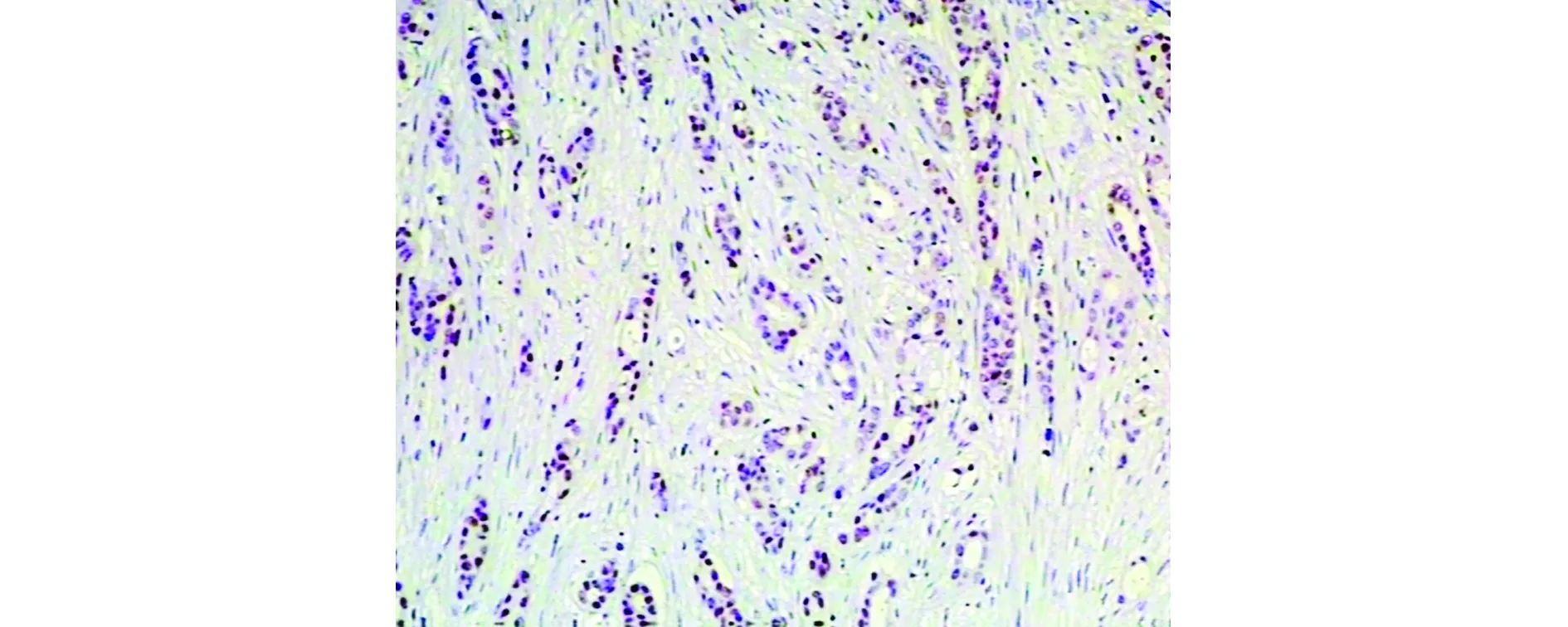
图2 E2F1在乳腺癌中高表达(EnVision,×100)Figure 2 High expression of E2F1 in breast cancer (EnVision,×100)
2.2 ECT2和E2F1蛋白在乳腺癌中的表达及与临床病理参数之间的关系
ECT2和E2F1蛋白表达与患者年龄、肿瘤大小及类型均无关(P>0.05),与肿瘤分级、淋巴结转移及TNM分期有关,统计学分析差异有统计学意义(P<0.05,见表2)。
2.3 乳腺癌中ECT2和E2F1蛋白表达之间的相关性分析
133例乳腺癌中ECT2蛋白与E2F1蛋白共同阳性表达65例(见表3),Pearson相关性分析显示,ECT2蛋白与E2F1蛋白二者表达呈显著正相关(r=0.344,P=0.000)。
3 讨论
乳腺癌的发生发展是多因素共同作用的结果,其中细胞的恶性转化是乳腺癌发生的主要原因之一,而细胞的恶性转化也需要多种基因蛋白或信号通路等复杂的网络调控过程的参与,因此乳腺癌的发生发展是一个复杂的过程。ECT2是鸟苷酸交换因子,定位于人染色体3q26,是一种具有高度保守性的基因,已被确定为原癌基因,它能将成纤维细胞转化为癌细胞,能与Rho GTP家族成员相互作用导致细胞恶性转化,引发细胞分裂,调控上皮细胞的极性,到目前为止,ECT2被认为与人类多种癌症相关,
表2 乳腺癌中ECT2和E2F1蛋白表达与临床指标之间的关系 (例)
Table 2 The relationships between expression of ECT2 and E2F1 protein and clinical parameters in breast cancer (cases)
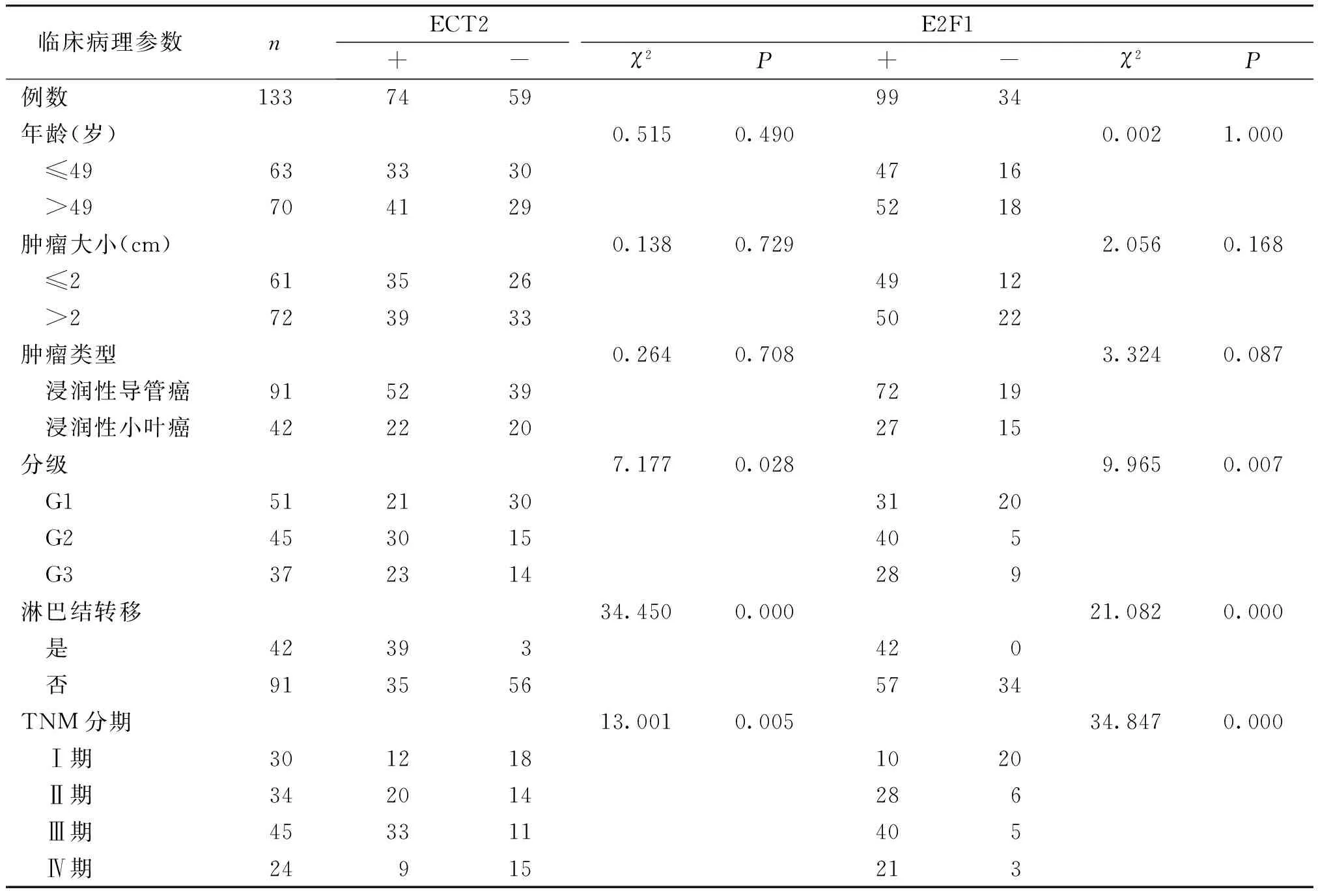
临床病理参数nECT2E2F1+-χ2P+-χ2P例数13374599934年龄(岁)0.5150.4900.0021.000 ≤496333304716 >497041295218肿瘤大小(cm)0.1380.7292.0560.168 ≤26135264912 >27239335022肿瘤类型0.2640.7083.3240.087 浸润性导管癌9152397219 浸润性小叶癌4222202715分级7.1770.0289.9650.007 G15121303120 G2453015405 G3372314289淋巴结转移34.4500.00021.0820.000 是42393420 否9135565734TNM分期13.0010.00534.8470.000 Ⅰ期3012181020 Ⅱ期342014286 Ⅲ期453311405 Ⅳ期24915213
表3 ECT2和E2F1蛋白在乳腺癌中的表达关系 (例)
Table 3 The relationship between the expression of ECT2 and E2F1 protein in breast cancer (cases)
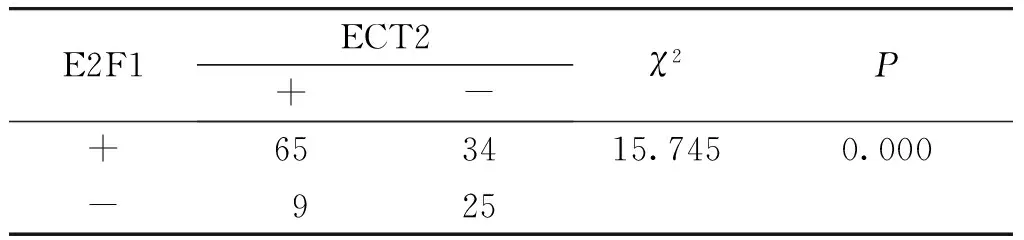
E2F1ECT2+-χ2P+653415.7450.000-925
甚至包括胶质瘤[1]。ECT2的表达与细胞周期调控及细胞分裂密切相关[3],ECT2的表达下调可以将细胞阻滞在G1期,ECT2表达可以动态调控整个细胞周期[4]。由此可见,ECT2在肿瘤发生机制中可能起了非常重要的作用。在肝癌的研究中显示,ECT2在肝癌组织中的表达显著高于癌旁正常组织,体外实验显示,过表达ECT2对HEP3B细胞的克隆增殖能力显著提高,并且显著增加了细胞的侵袭迁移能力,ECT2的表达上调与肝癌细胞上皮间充质转化密切相关[5]。消化道肿瘤如胃癌的研究发现,无论是在胃癌组织还是血清中,ECT2的表达都显著高于正常对照,而且ECT2的表达与临床病理参数包括肿瘤分级,TNM分期及淋巴结转移密切相关,ECT2在胃癌的发生发展过程中起了重要的作用,可能是胃癌诊断和靶向治疗的依据[6]。不仅在胃癌中发现ECT2,而且在食管癌和结直肠癌中同样发现ECT2在肿瘤中呈高表达,而且是患者预后差的重要标记物[7,8]。
本研究通过检测ECT2在乳腺组织中的表达,发现在癌阳性率明显高于正常对照;与临床病理参数比较,ECT2表达与肿瘤分级、淋巴结转移及TNM分期有关,肿瘤分级高者、淋巴结转移者及TNM分期高的病例ECT2表达明显增加,众所周知,此三类参数均是患者恶性进展甚至是预后判断的指标,由此可见,ECT2不但与乳腺癌的发生发展有关,还可能与患者的预后相关。
E2F转录因子家族在细胞的增殖分化及凋亡中起着非常重要的调节作用[9]。在E2F/RB信号通路中,当细胞周期蛋白激酶与RB结合后,磷酸化的RB释放E2F家族成员,激活后E2F能够引起下游基因的信号传导,从而调节与细胞周期相关的多种基因的表达[10,11]。E2F1是E2F家族重要的转录因子,在细胞周期的调节和凋亡中发挥着重要的作用。在肾透明细胞癌Caki-2细胞株中,未敲除E2F1的细胞中表达较高,而敲除E2F1后细胞的增殖能力、侵袭迁移能力都明显下降,提示E2F1在肾透明细胞癌中有促进肿瘤生长的作用,并认为E2F1在癌细胞中的异常表达可能是肾透明细胞癌未来潜在的治疗靶点[12]。在鼻咽癌细胞中,E2F1的表达能够显著抑制某药物诱导的放疗敏感性,而当敲除E2F1后,细胞对放疗的敏感性明显增强,细胞死亡率增加[13]。睾丸生殖细胞肿瘤中,E2F1的表达明显增高,而对照组织中则呈现低表达/不表达[14]。我们的实验结果显示,E2F1在正常组织中的表达明显低于癌组织,在癌组织中的表达与肿瘤分级、淋巴结转移及TNM分期有关,分级高、淋巴结转移者及TNM分期高者E2F1表达明显增加,可见E2F1在乳腺癌中的表达与乳腺癌的发生发展密切相关。
由于ECT2在细胞周期调控中起着重要的作用,转录因子E2F1在细胞周期的调控中同样有一定的作用。在某些癌细胞中,已经发现,ECT2基因在缺乏E2F介导的细胞中表达明显受到抑制,而存在E2F1的细胞中,在细胞分裂的过程中,E2F1能够提供转录调控,使ECT2在S期与其他一些因子相互调节,从而在G2/M期细胞分裂达到顶峰,导致细胞增殖[2,15]。本实验结果显示,133例乳腺癌中,ECT2与E2F1表达共阳性例数为65例,统计学分析,二者间表达存在显著正相关性,提示在乳腺癌的发生发展过程中,二者存在相互协同作用,ECT2在乳腺癌中的作用可能与E2F/RB信号通路有关,具体的作用机制需要从细胞体内外实验中才能证实。我们还发现,二者共同阳性病例中多数为肿瘤分级高、TNM分期高及淋巴结转移病例,可见ECT2与E2F1共同表达在评估乳腺癌的预后中也有一定的作用。总之,ECT2与E2F1在乳腺癌中均呈现高表达,二者在乳腺癌的发生发展过程中起了一定的作用,二者共表达的患者可能预后较差。
[1] Jin Y, Yu Y, Shao Q,etal.Up-regulation of ECT2 is associated with poor prognosis in gastric cancer patients[J].Int J Clin Exp Pathol,2014,7(12):8724-8731.
[2] Eguchi T, Takaki T, Itadani H,etal.RB silencing compromises the DNA damage-induced G2/M checkpoint and causes deregulated expression of the ECT2 oncogene[J].Oncogene, 2007,26(4):509-520.
[3] Tan H, Wang X, Yang X,etal.Oncogenic role of epithelial cell transforming sequence 2 in lung adenocarcinoma cells[J].Exp Ther Med,2016,12(4):2088-2094.
[4] Iyoda M, Kasamatsu A, Ishigami T,etal.Epithelial cell transforming sequence 2 in human oral cancer[J].PLoS One,2010,5(11):e14082.
[5] 袁媛,周闯,翟文龙.上皮细胞转化序列2诱导肝癌细胞上皮-间充质转化促进侵袭转移[J].中华实验外科杂志,2016,33(9):2144-2146.
[6] Wang HB, Yan HC, Liu Y.Clinical significance of ECT2 expression in tissue and serum of gastric cancer patients[J].Clin Transl Oncol, 2016,18(7):735-742.
[7] Luo Y, Qin SL, Mu YF,etal.Elevated expression of ECT2 predicts unfavorable prognosis in patients with colorectal cancer[J].Biomed Pharmacother,2015,73: 135-139.
[8] Hirata D, Yamabuki T, Miki D,etal. Involvement of epithelial cell transforming sequence-2 oncoantigen in Lung and Esophageal cancer progression[J].Clin Cancer Res, 2009,15(1):256-266.
[9] Polager S,Ginsberg D. E2F-at the crossroads of life and death[J].Trends Cell Biol,2008,18:528-535.
[10] Udayakumar T, Shareef MM, Diaz DA,etal.The E2F1/Rb and p53/MDM2 pathways in DNA repair and apoptosis: understanding the crosstalk to develop novel strategies for prostate cancer radiotherapy[J].Semin Radiat Oncol,2010,20(4):258-266.
[11] Mushtaq M, Gaza HV, Kashuba EV. Role of the RB-Interacting proteins in stem cell biology[J].Adv Cancer Res,2016,131:133-157.
[12] 高宇,范阳,陈伟浩,等.敲低E2F1基因对肾透明细胞癌细胞株Caki-2细胞增殖和侵袭力的影响[J].中华实验外科杂志,2013,30(2):333-335.
[13] Tan Y, Wei X, Zhang W,etal.Resveratrol enhances the radiosensitivity of nasopharyngeal carcinoma cells by downregulating E2F1[J].Oncol Rep, 2017,37(3):1833-1841.
[14] Rocca MS, Di Nisio A, Marchiori A,etal.Copy number variations of E2F1: a new genetic risk factor for testicular cancer[J].Endocr Relat Cancer,2017,24(3):119-125.
[15] Seguin L, Liot C, Mzali R,etal.CUX1 and E2F1 regulate coordinated expression of the mitotic complex genes Ect2, MgcRacGAP, and MKLP1 in S phase[J].Mol Cell Biol, 2009,29(2):570-581.
Expression and clinical significance of ECT2 and E2F1 protein in breast cancer
WANG Hongkun,ZHENG Huixia*,LIANG Jianfang,XIAO Hong
(DepartmentofPathology,FirstHospitalofShanxiMedicalUniversity,Taiyuan030001,China;*Correspondingauthor,E-mail:huixiazheng62@126.com)
ObjectiveTo explore the expression of ECT2 and E2F1 protein in breast cancer and its clinical significance.MethodsExpression of ECT2 and E2F1 protein was detected in 133 cases of breast cancer and 80 normal breast tissues from department of pathology in First Hospital of Shanxi Medical University using EnVision immunohistochemistry.ResultsThe positive expression rates of ECT2 and E2F1 protein were significantly higher than those of normal breast tissues(55.6%vs8.8%,74.4%vs2.5%,P<0.05). The expression of ECT2 and E2F1 was not correlated with age, tumor size and tumor type(P>0.05), but correlated with tumor grade, lymphatic metastasis and TNM staging(P<0.05). ECT2 expression was positively correlated with E2F1 expression in breast cancer (r=0.344,P<0.05).ConclusionThe expression of ECT2 and E2F1 protein plays a interaction role in the occurrence and deve-lopment of breast cancer. The role of ECT2 may be regulated by E2F/RB signaling pathway in breast cancer. The co-expression of two markers has some value in evaluating the prognosis of patients.
breast cancer; ECT2; E2F1
王宏坤,男,1979-10生,硕士,主治医师,E-mail:whk2005002@163.com
2017-04-27
R737.9
A
1007-6611(2017)08-0852-04
10.13753/j.issn.1007-6611.2017.08.021
