儿童尿液中PAEs代谢物浓度与居室装饰材料的关联
2017-08-28廖晨曦张佳玲时文明王雪颖邹志军路荣春孙婵娟赵卓慧
廖晨曦,刘 炜,张佳玲,时文明,王雪颖,蔡 姣,邹志军,路荣春,孙婵娟,王 恒,黄 晨*,赵卓慧*
儿童尿液中PAEs代谢物浓度与居室装饰材料的关联
廖晨曦1,刘 炜1,张佳玲1,时文明2,王雪颖1,蔡 姣1,邹志军1,路荣春1,孙婵娟1,王 恒3,黄 晨1*,赵卓慧2*
(1.上海理工大学环境与建筑学院,上海 200093;2.复旦大学公共卫生学院,上海 200032;3.舟山市疾病预防控制中心,浙江舟山 316021)
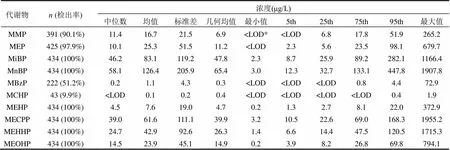
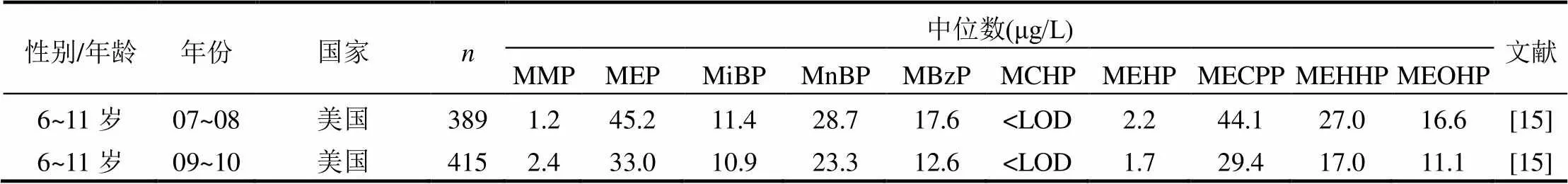
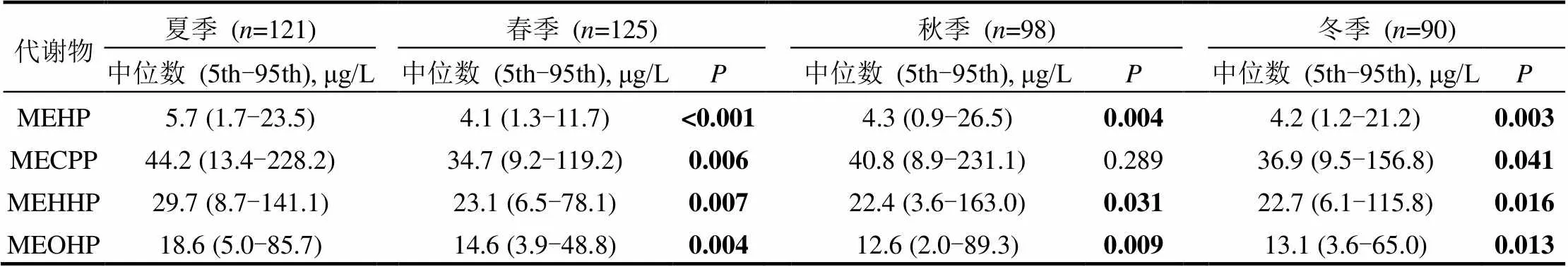
基于2013~2014年在上海地区开展的中国室内环境与儿童健康研究,分析了434位学龄儿童的晨尿PAEs代谢物浓度总体分布情况;并根据随访问卷获取的居室建筑特性信息,分析了PAEs代谢物与居室地板和墙面装饰材料的关系.我们利用HPLC-MS/MS法对儿童晨尿中10种PAEs代谢物进行定量检测,并采用非参数检验法比较了居室使用不同类型的地板和墙面装饰材料的儿童晨尿中PAEs代谢物的浓度差异.除MBzP(检出率:51.2%)和MCHP(9.9%)外,其他8种PAEs代谢物检出率均在90%以上.代谢物浓度[中位数(标准差)]从高到低依次为: MnBP, 58.1(205.9)μg/L; MiBP, 46.2(119.2)μg/L; MECPP, 39.0(111.1)μg/L; MEHHP, 24.7(92.6)μg/L; MEOHP, 14.5(45.1)μg/L; MMP, 11.4(21.4)μg/L; MEP, 10.1(51.5)μg/L; MEHP, 4.5(19.0)μg/L; MBzP, 0.2(4.3)μg/L; MCHP, 尿液;邻苯二甲酸酯类化合物;尿液代谢物;居室装饰材料;儿童;上海 邻苯二甲酸酯类化合物(phthalic acid esters, PAEs)是部分人造居室装饰材料常用的增塑剂[1]. PAEs具有半挥发性,在环境中较稳定,不易降解,可在室内环境中存在数年或更长时间[2].较多研究发现部分PAEs会导致系列健康危害[3-5],比如致癌、致畸形、生殖发育毒性、过敏性疾病及儿童的认知能力和行为异常等.住宅室内PAEs可存在于多种介质中,如颗粒物、材料表面、降尘和空气等,且研究发现居室环境中PAEs浓度非常高[6].Geens等[7]也发现与居室内未使用壁纸作为墙面装饰材料的青少年相比,居室内使用壁纸的青少年尿液中MnBP(=0.007)和MBzP (=0.02)浓度明显更高.然而,目前国内外关于居室内PAEs暴露水平评价及其与居室建筑装饰材料的关联性研究较少.2010~2011年王夫美等对住宅室内降尘和冬季室内空气颗粒物中的6类PAEs暴露水平进行现场采样检测发现: DBP和DEHP是主要污染物,且夏季降尘的PAEs 浓度明显高于冬季[8-9].同时除Geens等[7]的研究外, 也未发现有类似的研究对居室建筑装饰材料与学龄儿童尿液中的PAEs代谢物浓度的关联性进行分析. 本论文基于2013~2014年在上海地区针对学龄儿童居室环境进行的入室检测中获取的晨尿样本,分析了晨尿中PAEs代谢物浓度的总体分布情况,以此来反映上海地区居室内PAEs的总体暴露水平;并进一步分析了晨尿中PAEs代谢物浓度与居室地板和墙面装饰材料的关系. 1.1 研究对象和取样方法 2013年3月~2014年12月,本课题组在上海地区开展了中国室内环境与儿童健康(CCHH: China, Children, Homes, Health)研究的第二阶段-病例对照研究.此研究根据CCHH第一阶段的横断面群组问卷调查获得的信息,基于儿童哮喘史(经医生诊断,家长问卷报告)随机各选取200位左右的病例组儿童(有哮喘史)和对照组儿童(无哮喘史),对其居室室内环境进行现场检测和采样.最终,我们对分布在上海市4个市区行政区(杨浦区、虹口区、闸北区和静安区)和2个郊区行政区(宝山区和奉贤区)的454名5~10岁儿童的住宅室内环境进行了现场检测和调查,并获取了儿童早晨第一次的尿液样品.其中尿液样品由儿童家长协助收集在10mL的标准冷存管中,并集中保存在-40℃的冰箱中.现场调查期间也通过问卷获取了居室地板和墙面装饰材料的信息.其中房间内墙面装饰材料的类型包括:石灰、壁纸、乳胶漆、油漆;地板装饰材料的类型包括:水泥地板、实木地板、复合木地板、瓷砖石材.本项研究得到了复旦大学公共卫生学院伦理委员会的批准.更多关于这项研究的信息可参阅本课题组前期发表的文章[10]. 1.2 目标分析物与分析用仪器和试剂 对儿童晨尿中的10种PAEs代谢产物进行了分析(表1).其中,7种是初级代谢物(MMP、MiBP、MnBP、MEP、MCHP、MBzP和MEHP);3种是DEHP的次级代谢物(MEOHP、MEHHP和MECPP). 十种PAEs代谢物标准品均购于美国Cambridge Isotope Laboratories公司.9种PAEs代谢物的同位素内标:13C2-MMP,13C2-MEP,13C2-MECPP,13C4-MEHHP,13C2-MBP,13C4-MEOHP,13C2-MBzP,13C4-MCH和13C2-MEHP (Cambridge Isotope Laboratories Ins,美国).其中MiBP和MnBP的同位素内标均为13C2-MnBP. PAEs代谢物标准品母液及同位素内标母液的浓度均为100mg/L,-20℃贮存. 表1 10种PAEs及其代谢产物的缩写和中英文全称 样品分析过程中用到的主要仪器包括:带HESI源TSQ Vantage三重四级杆的液相色谱质谱联用仪(美国Thermos公司),固相萃取装置(美国Waters公司),SHB-3循环水真空泵(上海申生科技有限公司),Millipore超纯水系统(德国Merck Millipore公司), 雷磁PHS-3C pH计(上海精密科学仪器有限公司), HH-4型数显恒温振荡水浴锅(国华电器,中国),氮吹仪(上海安谱科学仪器有限公司), 和不同量程(200μL,1000μL,5000μL)的微量移液器(德国Eppendorf公司).分析用到的主要试剂包括:甲醇、乙腈(HPLC级,美国MERCK公司),高纯水(HPLC级,德国CNW公司),OASIS HLB固相萃取(SPE)柱(3mL/60mg,美国Waters公司),磷酸,磷酸二氢钠,甲酸,乙酸,乙酸钠,盐酸(分析纯,国药集团化学试剂有限公司),-葡萄糖醛酸酶(694300units/g,美国Sigma-Aldrich公司). 1.3 尿样前处理方法 将储存于-40℃的尿样自然解冻,准确移取尿样1.0mL,依次加入500μg/L的同位素内标混合使用液20μL、1mL乙酸钠缓冲液(pH6.5)、270units/mL的葡萄糖醛酸酶(以磷酸盐缓冲液(pH6.8)稀释)50μL,再移至37℃恒温振荡酶解过夜.酶解充分后加0.5mL 3.6mol/L的H3PO4终止酶解反应. SPE净化:以此加入3mL乙腈、3mL磷酸盐缓冲液(pH2.0)活化平衡HLB固相萃取柱,将酶解后的尿液全部移入经活化的HLB小柱中,依次使用2mL 0.1mol/L 的甲酸和1mL高纯水清洗除杂.清洗完成后用真空泵抽干,再依次使用2mL乙腈和2mL乙酸乙酯洗脱HLB小柱,收集洗脱液.洗脱液经37℃弱氮吹干,以乙腈/水(/,1:1)定容至200μL,涡旋至完全溶解,转移上清液至带250μL玻璃内插管的进样瓶待分析. 1.4 PAEs代谢物的分析方法和流程 利用高效液相色谱串联质谱分析(HPLC- MS/MS)的方法对尿液PAEs代谢物进行定量检测.色谱条件: Hypersil Gold Phenyl色谱柱(1.9 μm,100mm×2.1mm, Thermos Fisher公司,美国); 柱温30℃.流动相:0.1%乙酸水溶液(A)和0.1%乙酸乙腈(B).梯度洗脱0~7.8min,流动相B比例由20%升至50%;7.8~9.0min,流动相B比例由50%升至100%;10.5~10.51min,流动相B比例由100%降至20%.运行时间12min,进样量5μL.质谱条件:电喷雾离子源(HESI),负离子模式,多反应监测(SRM)扫描方式.喷雾电压:-2200V;雾化温度:350℃;毛细管温度:350℃;鞘气和辅助气均为高纯氮气,流量分别为35和3;扫描时间:0.02s;扫描宽度:1.0m/z;碰撞气为氩气,压力为1.5mTorr; Q1和Q3的分辨率均为0.70FWHM. 1.5 统计分析方法 运用 SPSS 19.0软件中的频率和均值统计儿童尿液中PAEs代谢物浓度现状和其在不同建材使用情况的差异.以非参数检验(Mann- Whitney U)分析不同建材的使用与儿童尿液中PAEs代谢物浓度的关联性.<0.05表示差异在统计学上显著. 2.1 PAEs代谢物浓度总体情况 本课题组调查的454名儿童中有434名儿童提供了晨尿样品.尿液中10种PAEs代谢物浓度结果见表2.除MBzP(51.2%)和MCHP(9.9%),其余代谢物检出率达90%以上.表2列出了这些代谢物浓度的总体分布情况.以中位数作为评判标准,DEHP的代谢物总浓度(MEHP、MEOHP、MEHHP和MECPP)最高,为82.7μg/L,剩下的浓度高低依次为MnBP > MiBP > MEP > MMP > MBzP > MCHP. MMP和MEP、MnBP和MiBP的几何均值相近.这些结果显示上海地区儿童的主要PAEs暴露为DEHP和DBP(代谢物为MnBP).这与2010~2011年王夫美等[8-9]对天津市住宅室内PAEs污染特征及暴露评价的研究中得出降尘和室内空气颗粒物均以DEHP 和 DBP 为主要 PAEs污染物的结论吻合. 表2 儿童尿液中PAEs代谢物浓度总体分布现状 注:* LOD,limit of detection 检出限. 另外,本文也分析比较了不同性别、年龄的儿童尿液中PAEs代谢物浓度(表3).代谢物浓度均为男孩高于女孩,且除MMP、MEP和MCHP外,其他代谢物浓度差异在统计学上均具有显著性.2010年Boas等检测了845名4~9岁儿童尿样中PAEs代谢物含量后发现MBzP、MEHP、MEHHP和MEOHP浓度均为男孩高于女孩[11].但2014年Langer等检测了441名3~6岁丹麦儿童尿样中PAEs代谢物浓度,发现女孩尿样中MEP、MnBP、MiBP和MBzP的浓度均略高于男孩[12].而2014年Gong等发现39名5~9岁北京市男孩女孩尿样中PAEs代谢物浓度显著差异[13].上述结果说明尿样中各种PAEs代谢物浓度在性别上可能存在明显差异.这可能与男孩女孩的代谢水平、日常活动量和接触或使用物品等存在差异有关[11-13].对于不同年龄的儿童,大体趋势为5~9岁儿童尿液中10种PAEs代谢物浓度高于10岁儿童,特别是MEP和MnBP,5~ 9岁儿童均显著高于10岁.有研究发现室内DEHP、DBP和BBP的浓度分别约为室外的43、180和362倍[14].由此可见室内PAEs的浓度远高于室外,而年龄较小的儿童处于室内的时间相对更长,这可能导致其PAEs暴露量和代谢物浓度更高. 表3 不同性别和年龄的儿童尿液中PAEs代谢物浓度比较 注:*<0.05,且数值小于0.05的值均为黑体,下同. 2.2 与其他国家或地区的类似研究的现状比较 表4中总结了2006~2016年间世界各国和地区(美国、加拿大、德国、丹麦、希腊、韩国、台湾和中国)儿童(£11岁)尿样中PAEs代谢物浓度.为与本研究结果进行合理的比较,筛选了采用溶液浓度(μg/L)中位数表征代谢物浓度的相关文献.对各国家或地区的10种PAEs代谢物浓度差异进行分析可以发现:各国或地区儿童所对应的最高浓度的PAEs代谢物种类分别是中国(MMP和MEHP)、丹麦(MiBP、MnBP)、希腊(MEP)、加拿大(MBzP)、台湾(MEOHP和MEHHP)和美国(MECPP),且浓度基本上明显高于其他国家或地区.除了MMP外,相对2007~ 2008年间,2009~2010年美国儿童尿样中其他9种PAEs代谢物浓度均不同程度地下降,特别是MECPP,下降幅度达33.3%[15].这很可能跟美国2008年开始禁止在玩具和儿童护理产品中添加某些PAEs有关.另外,PAEs代谢物在同一国家或地区间的差异相对于其他国家和地区较小,这说明了儿童尿样中PAEs代谢物浓度可能与国家政策和产品有着很大关联[16].此外,本研究中PAEs代谢物浓度值与另一项在上海、江苏和浙江针对8~11岁儿童开展的类似研究的结果[17]相对接近. 表4 世界不同国家或地区的儿童尿样中PAEs代谢物浓度现状比较 续表4 2.3 不同季节现状对比 表5比较了不同检测季节的儿童尿液中PAEs代谢物浓度.相对于夏季,不同的检测季节代谢物浓度分布差异明显(<0.05).10种代谢物中,除MEHP、MECPP和MEOHP外,其余7种代谢物浓度均为夏季最高,冬季最低.春季除了MBzP和MCHP,秋季除了MMP、MCHP和MECPP,冬季除了MCHP,其余代谢物浓度均相对于夏季具有显著差异.2012年Pilka等开展的类似研究也发现:冬夏季处于不同环境中的人群尿液中MEHP、MnBP、MEP和MiNP (Mono-iso- nonyl phthalate)的浓度存在明显差异;在特定的工作环境中,室内温度的提高会增加PAEs暴露量[29].2014年Gong等[13]对39名5~9岁儿童尿液中4种PAEs代谢物进行检测也得出了类似的结果,除了MBzP(检出率太低),夏季MEP、MiBP和MnBP 的浓度均明显高于冬季.由于夏季更高的房间和物体表面温度,从各种含有PAEs物体中挥发出PAEs的量相对冬季更高[30].相反地, 由于夏季换气次数高于冬季,这可能导致夏季室内空气中PAEs浓度低于冬季[31].由此,我们推断室内温度对室内PAEs暴露水平的影响可能大于室内通风. 表5 不同检测季节尿液中PAEs代谢物浓度的差异 续表5 2.4 代谢物浓度与地板和墙面材料的关联分析 表5显示不同检测季节的儿童尿液中PAEs代谢物浓度差异显著.因此,本文分别对不同季节的儿童尿液PAEs代谢物浓度与居室地板和墙面材料的关联进行了分析.结果发现:冬季卧室使用油漆作为墙面装饰材料的儿童尿液MiBP浓度的中位数约是使用石灰的3倍(=0.039).与实木地板相比,春季客厅使用复合木地板或使用瓷砖石材作为地板装饰材料的儿童尿液MEP, MiBP, MnBP, MEHP, MECPP, MEHHP和MEOHP浓度均普遍更高;其中使用实木地板和复合木地板的儿童尿液MEP和MnBP浓度间的差异具有统计学意义;使用实木地板和瓷砖石材作为地板装饰材料的儿童尿液中其他上述代谢物浓度间的差异具有统计学意义(图1).冬季客厅使用乳胶漆作为墙面装饰材料的儿童尿液MiBP浓度约为使用石灰的3.5倍(=0.047).冬季客厅使用实木地板和复合木地板的儿童尿液MiBP浓度分别约为使用水泥地板的3倍和3.5倍(图2).除2014年Geens等开展的类似研究[7]外,未发现有类似的研究分析了居室建筑装饰材料与儿童尿液中的PAEs浓度的关联性.但2011年春季Zhang等采集了215位南京市区儿童的住宅落尘和住宅装修建材信息并发现塑料地板材料是落尘中常见PAEs的重要来源[32].此外,2001-2002年冬春季在瑞典开展的类似研究采集了390位儿童的住宅落尘和住宅装修建材等信息,也发现聚氯乙烯(PVC)地板材料和墙面材料与室内落尘中的BBzP和DEHP的含量密切相关;且PVC相关材料使用量越多的儿童, 室内落尘中的BBzP和DEHP的含量越高[32].这两项研究侧面支持了我们的上述结果.这些结果说明复合木地板和塑料地板或墙面材料(PVC,油漆,乳胶漆)在居室内的使用可明显增加儿童的PAEs暴露水平. 除上述结果外,大部分其他季节取样的儿童的PAEs代谢物浓度与居室地板和墙面材料的关联无统计学意义(>0.05);甚至出现少量“反常”结果,比如夏季卧室墙面装饰材料使用油漆和乳胶漆的儿童MEP和MiBP浓度明显低于使用石灰的儿童. 2014年Geens等[7]在美国开展的研究发现:与未使用壁纸相比,居室内使用壁纸的青少年尿液MnBP(=0.007)和MBzP(=0.02)浓度明显更高.但本文的结果正好相反:与石灰(=9)相比,夏季客厅墙面材料使用壁纸(=6)的儿童尿液中MMP和MBzP浓度明显更低.这可能是与样品数量样本数过少从而结果存在偶然性有关;也可能与尿液中PAEs代谢物浓度受多因素影响有关.除居室装饰材料,PAEs还常见于家具、塑料容器和个人护理产品等物品中[6].同时儿童PAEs暴露水平也受家庭生活习性,儿童饮食习惯和居室通风等其他因素影响[32-34].我们后续将综合各类因素对上海地区学龄儿童PAEs代谢物浓度的相关因素进行全面分析. 3.1 上海地区学龄儿童尿液中PAEs代谢物个体水平存在较大差异;总体水平上存在明显的性别、年龄和检测季节的差异:男孩的代谢物浓度普遍高于女孩;10岁儿童的代谢物浓度普遍高于<10岁的儿童;夏季代谢物浓度普遍高于其他季节.不同国家或地区的儿童尿液中PAEs代谢物浓度差异较大. 3.2 中国的DMP和DEHP代谢物浓度明显高于其他国家或地区.相对于传统建材(水泥和石灰),居室使用复合木地板,乳胶漆和油漆等新型建材可能会明显增加儿童的PAEs暴露量,建议谨慎选用. [1] 王建龙,钱 易.邻苯二甲酸酯的生物降解研究 [J]. 环境科学, 1995,16(6):26-28. [2] 王立鑫,赵 彬,刘 聪,等.中国室内SVOC污染问题评述 [J]. 科学通报, 2010,55(11):967-977. [3] Hauser R, Calafat AM. Phthalates and human health [J]. Occupational & Environmental Medicine, 2005,62(11):806-818. [4] 曹昕伟,刘潇童,范宏成,等.DIDP和DINP暴露对小鼠的免疫毒性作用 [J]. 中国环境科学, 2017,37(2):740-744. [5] 张焕云,吴 卓,戴佳佳,等.DINP皮肤暴露对小鼠过敏性皮肤炎症的佐剂作用 [J]. 中国环境科学, 2015,35(12):3804-3809. [6] Wormuth M, Scheringer M, Vollenweider M, et al. What are the sources of exposure to eight frequently used phthalic acid esters in Europeans? [J]. Risk Analysis, 2006,26(3):803-824. [7] Geens T, Bruckers L, Covaci A, et al. Determinants of bisphenol A and phthalate metabolites in urine of Flemish adolescents [J]. Environmental Research, 2014,134C:110-117. [8] 王夫美,陈 丽,焦 姣,等.住宅室内降尘中邻苯二甲酸酯污染特征及暴露评价 [J]. 中国环境科学, 2012,32(5):780-786. [9] 王夫美,陈 丽,焦 姣,等.冬季天津家庭室内空气颗粒物中邻苯二甲酸酯污染研究 [J]. 环境科学, 2012,33(5):1446-1451. [10] Huang C, Wang XY, Liu W, et al. Household indoor air quality and its associations with childhood asthma in Shanghai, China: On-site inspected methods and preliminary results [J]. Environmental Research, 2016,151:154-167. [11] Boas M, Frederiksen H, Feldt-Rasmussen U, et al. Childhood Exposure to Phthalates: Associations with Thyroid Function, Insulin-like Growth Factor I, and Growth [J]. Environmental Health Perspectives, 2010,118(10):1458-1464. [12] Langer S, Bekö G, Weschler C J, et al. Phthalate metabolites in urine samples from Danish children and correlations with phthalates in dust samples from their homes and daycare centers [J]. International Journal of Hygiene & Environmental Health, 2014,217(1):78-87. [13] Gong M, Weschler C J, Liu L, et al. Phthalate metabolites in urine samples from Beijing children and correlations with phthalate levels in their handwipes [J]. Indoor Air, 2015,25(6):572-581. [14] Lee J, Lee JH, Kim CK, et al. Childhood exposure to DEHP, DBP and BBP under existing chemical management systems: A comparative study of sources of childhood exposure in Korea and in Denmark. Environment International, 2013,63C(3):77-91. [15] Pamphlet (or booklet). Forth National Report on Human Exposure to Environmental Chemicals [J]. Atlanta Ga Us Department of Health & Human Services CDC, 2013:197-237. [16] Ait BY, Araki A, Kawai T, et al. Comparisons of urinary phthalate metabolites and daily phthalate intakes among Japanese families [J]. International Journal of Hygiene & Environmental Health, 2015,218(5):461-470. [17] Wang B, Wang H, Zhou W, et al. Urinary excretion of phthalate metabolites in school children of China: implication for cumulative risk assessment of phthalate exposure [J]. Environmental Science & Technology, 2014,49(2):1120-1129. [18] Saravanabhavan G, Guay M, Langlois É, et al. Biomonitoring of phthalate metabolites in the Canadian population through the Canadian Health Measures Survey (2007~2009) [J]. International Journal of Hygiene & Environmental Health, 2013,216(6):652- 661. [19] Kasper-Sonnenberg M, Koch H M, Wittsiepe J, et al. Phthalate metabolites and bisphenol A in urines from German school-aged children: Results of the Duisburg Birth Cohort and Bochum Cohort Studies [J]. International Journal of Hygiene & Environmental Health, 2014,217(8):830-838. [20] Kaspersonnenberg M, Koch HM, Wittsiepe J, et al. Levels of phthalate metabolites in urine among mother-child-pairs - results from the Duisburg birth cohort study, Germany [J]. International Journal of Hygiene & Environmental Health, 2012,215(215):373- 382. [21] Koch H M, Wittassek M, Brüning T, et al. Exposure to phthalates in 5~6years old primary school starters in Germany-a human biomonitoring study and a cumulative risk assessment [J]. International Journal of Hygiene & Environmental Health, 2011,214(214):188-195. [22] Myridakis A, Chalkiadaki G, Fotou M, et al. Exposure of preschool-age Greek children (RHEA cohort) to bisphenol-A, parabens, phthalates and organophosphates [J]. Environmental Science & Technology, 2016,50(2):932-941. [23] Myridakis A, Fthenou E, Balaska E, et al. Phthalate esters, parabens and bisphenol-A exposure among mothers and their children in Greece (Rhea cohort) [J]. Environment International, 2015,83:1-10. [24] Cho SC, Bhang SY, Hong YC, et al. Relationship between environmental phthalate exposure and the intelligence of school-age children [J]. Environmental Health Perspectives, 2010, 118(7):1027-1032. [25] Lin S, Ku HY, Su PH, et al. Phthalate exposure in pregnant women and their children in central Taiwan [J]. Chemosphere, 2010,82(7):947-955. [26] Hsu NY, Lee CC, Wang JY, et al. Predicted risk of childhood allergy, asthma, and reported symptoms using measured phthalate exposure in dust and urine [J]. Indoor Air, 2012,22(3):186-199. [27] Zhang Y, Meng X, Li C, et al. Age and Sex-Specific Relationships between Phthalate Exposures and Obesity in Chinese Children at Puberty [J]. PLoS One, 2014,9(8):195-202. [28] Wang H, Zhou Y, Tang C, et al. Urinary phthalate metabolites are associated with body mass index and waist circumference in Chinese school children [J]. PLoS One, 2013,8(2):e56800. [29] Pilka T, Petrovicova I, Kolena B, et al. Relationship between variation of seasonal temperature and extent of occupational exposure to phthalates [J]. Environmental Science & Pollution Research, 2015,22(1):434-440. [30] Xiong J, Wei W, Huang S, et al. Association between the emission rate and temperature for chemical pollutants in building materials: general correlation and understanding [J]. Environmental Science & Technology, 2013,47(15):8540-8547. [31] Liu C, Zhang Y, Benning JL, et al. The effect of ventilation on indoor exposure to semivolatile organic compounds [J]. Indoor Air, 2015,25(3):285-296. [32] Zhang Q, Lu X M, Zhang X L, et al. Levels of phthalate esters in settled house dust from urban dwellings with young children in Nanjing, China [J]. Atmospheric Environment, 2013,69(3):258- 264. [33] Bornehag C G, Lundgren B, Weschler C J, et al. Phthalates in indoor dust and their association with building characteristics [J]. Environmental Health Perspectives, 2005,113(10):1399-1404. [34] Romero-Franco M, Hernández-Ramírez RU, Calafat AM, et al. Personal care product use and urinary levels of phthalate metabolites in Mexican women [J]. Environment International, 2011,37(5):867-871. 致谢:论文作者特别感谢参与本研究和提供尿液样本的儿童及其家属;感谢清华大学的张寅平教授和Jan Sundell教授、重庆大学的李百战教授及天津大学的孙越霞副教授对全国CCHH研究的支持和指导;也特别感谢在研究期间在样品收集和数据整理过程中提供帮助的老师和学生志愿者们. Associations between urinary concentrations of PAEs metabolites and residential decoration materials. LIAO Chen-xi1, LIU Wei1, ZHANG Jia-ling1, SHI Wen-ming2, WANG Xue-ying1, CAI Jiao1, ZOU Zhi-jun1, LU Rong-chun1, SUN Chan-juan1, WANG Heng3, HUANG Chen1*, ZHAO Zhuo-hui2* (1.School of Environment and Architecture, University of Shanghai for Science and Technology, Shanghai 200093, China;2.Department of Environmental Health, School of Public Health, Fudan University, Shanghai 200032, China;3.Zhoushan Municipal Center for Disease Control and Prevention, Zhoushan 316021, China)., 2017,37(8):3166~3174 434 morning urinary samples of school-age children accompanied by the characteristics information of their residences were obtained from rom the CCHH (China, Children, Homes, Health) study in Shanghai during 2013~2014. The overall distributions for urinary concentrations of PAEs metabolites and their associations with household decoration materials (floor and wall coverings) were investigated. Ten PAEs metabolites were analyzed by HPLC-MS/MS (high-performance liquid chromatography with tandem mass spectrometric detection). Non-parametric test was preformed to compare the concentration differences of PAEs metabolites among children living in the environment with different floor and wall coverings materials. The detection rates of these PAEs metabolites were above 90%, except for MBzP (51.2%) and MCHP (9.9%). The median concentrations (standard deviation) of these metabolites from high to low were as follows: MnBP, 58.1 (205.9) μg/L; MiBP, 46.2 (119.2) μg/L; MECPP, 39.0 (111.1) μg/L; MEHHP, 24.7 (92.6) μg/L; MEOHP, 14.5 (45.1) μg/L; MMP, 11.4 (21.4) μg/L; MEP, 10.1 (51.5) μg/L; MEHP, 4.5 (19.0) μg/L; MBzP, 0.2 (4.3) μg/L; MCHP, urine;phthalic acid esters (PAEs);urinary metabolites;residential decoration materials;children;Shanghai X503.1 A 1000-6923(2017)08-3166-09 廖晨曦(1991-),女,四川德阳人,上海理工大学硕士研究生,研究方向为中国室内环境与儿童健康. 2017-01-10 国家自然科学基金资助项目(51278302);上海市教委重点创新项目(14ZZ132) * 责任作者, 黄晨, 教授, hcyhyywj@163.com; huangc@usst.edu.cn; 赵卓慧, 副教授, zhzhao@fudan.edu.cn1 研究对象与方法

2 结果与讨论



3 结论
