皆伐油松林不同恢复措施下团聚体与球囊霉素分布特征
2017-10-13史君怡王国梁梁楚涛周昊翔
景 航,史君怡,王国梁,*,薛 萐,,梁楚涛,周昊翔
皆伐油松林不同恢复措施下团聚体与球囊霉素分布特征
景 航1,史君怡1,王国梁1,2*,薛 萐1,2,梁楚涛2,周昊翔1
(1.西北农林科技大学水土保持研究所,陕西杨凌712100;2.中国科学院水利部水土保持研究所,陕西杨凌712100)
以未扰动油松林为对照,研究了油松林皆伐后在不同措施下恢复为幼林地、灌木地和撂荒地0~20cm土层团聚体稳定性、团聚体中球囊霉素相关土壤蛋白(GRSP)和有机碳(SOC)含量变化特征.结果表明:与对照相比,幼林地团聚体稳定性显著降低(<0.05),而灌木地及撂荒地团聚体稳定性显著增加.不同恢复措施团聚体中易提取球囊霉素相关土壤蛋白(EE-GRSP)分布的变化趋势与团聚体稳定性一致,灌木地团聚体中EE-GRSP含量相比对照显著增加且最大.灌木地和撂荒地大团聚体(>250μm)中总量球囊霉素相关土壤蛋白(T-GRSP)含量相比对照显著增加而撂荒地粉黏粒团聚体(<53μm)中T-GRSP含量显著减小.粉黏粒团聚体中EE-GRSP含量普遍大于其他粒径团聚体;微团聚体(53~250μm)中T-GRSP含量普遍大于其他粒径团聚体.相比于其他粒径团聚体,大团聚体中T-GRSP可以更准确的反映土壤碳库的变化,团聚体稳定性更依赖于大团聚GRSP.
球囊霉素相关土壤蛋白;团聚体;皆伐;土壤有机碳
球囊霉素相关土壤蛋白(GRSP)是由丛枝菌根真菌(AMF)分泌的一种高稳定性疏水蛋白质,根据分析提取的难易程度将这种蛋白质分为总量球囊霉素(T-GRSP)和易提取球囊霉素(EE-GRSP)[1-2].相关的研究表明,GRSP比其他碳水化合物的黏附能力强3~10倍[2],被称为“超级胶水”.它能将细小的土壤颗粒粘结成较大的土壤团粒形成稳定的土壤结构[3-4],而土壤稳定性的提高可以减少有机质的分解,增加有机碳(SOC)的积累[5-6].另外,GRSP作为土壤有机质的主要组成部分,是SOC形成的重要来源,对于土壤碳库变化有很好的指示作用[7].因此,GRSP在土壤结构稳定性的提高、土壤质量的改善以及碳库变化方面具有重要意义.目前,GRSP研究主要集中在不同植被类型以及土壤剖面分布方面[8-11],团聚体中GRSP的研究主要集中在1000~2000μm等较大粒径范围内[12],但是最近发现有20%左右的GRSP存在于较小粒径团聚体中[13].只有查明GRSP在不同粒径团聚体中的分布才能全面评价土壤结构的稳定性以及碳库的变化规律.
GRSP广泛分布于不同的生态系统中[14],森林生态系统作为全球碳循环的重要组成部分其土壤中GRSP的分布状况关系重大[15].已有的研究表明,林地土壤中GRSP含量大于耕地和果园[16],且GRSP多集中于表层0~20cm范围内,此外,不同土壤类型会导致GRSP含量显著差异[11].黄土高原林区生态系统较为脆弱,容易受到外界环境变化的影响,其GRSP的分布变化将会直接影响到土壤结构的稳定以及碳的循环过程[17].
皆伐是营林的重要措施之一,而油松则是华北地区常见的人工林种类.本研究以黄土高原人工油松林为对象,对其皆伐后恢复的不同植被群落地(幼林地、灌木地、撂荒地)团聚体稳定性及其GRSP和SOC分布特征进行了分析,旨在揭示GRSP在黄土高原油松林区的分布特征以及对林业管理措施的响应规律,为黄土高原地区林业管理提供科学依据.
1 材料与方法
1.1 研究区概况
实验在延安市宜川县铁龙湾林场林区开展,本区处黄龙山林区东缘(35°39′N,110°06′E).海拔860~1200m,坡度20°~25°,年平均气温9.8℃,年平均降水量574.4mm,土壤为灰褐色森林土.林下土壤pH值8.6,阳离子交换量13.01g/100kg干土,全氮(N)、全磷(P)含量分别为0.39g/kg和0.63g/kg.供实验用油松人工林为1963年植造,现保存1400~1800株/hm2.区内平均郁闭度0.7,胸径10.0cm,树高11.2m.林分蓄积量75.5m3/hm2;叶面积指数6.34.乔木层生物量112.96t/hm2;灌木层生物量3.56t/hm2;草本层生物量8.28t/hm2.群落的植物多样性指数为0.51(用Simpson法计算),植物种群数有20多个.林下灌木主要有胡颓子()、黄刺玫()、绣线菊()、忍冬()、荚迷()等,覆盖度30%;草本植物主要为大披针苔草(),覆盖度30%~50%.
1.2 实验设计
实验地选在气候、位置、林龄及地形条件基本一致的人工油松林地.1999年,对该油松人工林地部分地块进行皆伐,对照处理(CK)为未进行人为干扰的油松人工林,实验处理为油松人工林皆伐后3种不同恢复措施,包括皆伐后人为控制更新为油松幼林(幼林地Young Plantation Land)、灌木林(灌木地Shrub Land)以及皆伐后翻耕并撂荒(撂荒地Abandoned Forestland,翻耕深度为犁底层0~20cm).每种处理设置4个样地,每块样地5×10m2,以铁丝围封.
2015年10月进行土壤样品采集.采集样品时,3种不同恢复措施下,皆伐后的地块已恢复为油松幼林地,灌木地(以虎榛子()群落为主)及撂荒地(以披针苔草群落为主).土壤按照原状土采集方法实施,在预先布设好的样地内随机取土,将确定的取样点地表有机覆盖物去掉,用铝制方盒小心取出0~20cm的原状土样.土样小心运回实验室,土块较大的可沿着自然裂隙手工轻轻掰开,全部土样过8mm筛后风干.每个样地采集3个原状土壤样品,风干混合后用于团聚体稳定性、SOC含量和GRSP含量分析.
1.3 测定项目与方法
团聚体稳定性采用团聚体平均重量直径(MWD),几何平均直径(GMD)来衡量[18],MWD是评价团聚体分布的综合指标,其值越大说明大粒径团聚体含量高稳定性也高,GMD是概括团聚体主要粒级分布的指标,其值越大说明土壤结构以大粒级团聚体分布越多,孔隙度越好,土壤团聚体稳定性也越好[19].对团聚体分级采用湿筛法测定土壤水稳性团聚体含量[20].取100g制备好的土样在去离子水中静置5min,水面需刚好淹没土样,撇去水面上漂浮的少许杂质,在250μm样品筛内湿筛2min,上下频率控制在50次/min,振幅约3cm.通过250μm的土样继续在53μm的筛上湿筛3min.>250μm的土样为大团聚体,250~53μm为微团聚体,冲出来的为粉黏团聚体(<53μm).所有样品在55℃下烘干测定重量后用于GRSP和SOC含量测定[21].
GRSP含量测定:GRSP含量按改进后的考马斯亮蓝法测定[22].浸提:T-GRSP浸提,称取1g土样于10mL离心管,加入8mL柠檬酸缓冲液,121℃高温高压浸提60min,迅速10000r/min离心5min,将上清液倒入50mL离心管中,10mL离心管中剩余土样浸提5次,浸提液混匀可在4℃条件下保存3d,EE-GRSP浸提与上述方法一致,浸提次数1次.比色:取浸提液1mL于10mL离心管,加入5mL考马斯亮蓝,显色2min后于595nm下比色.
SOC含量测定采用重铬酸钾氧化外加热法测定.
1.4 数据处理与分析
团聚体稳定性指标计算采用下面公式:
式中:MWD为平均重量直径mm;GMD为几何平均直径mm;x为任一粒径范围团聚体的平均重量直径mm;w为任一粒径范围团聚体的重量占土壤样品干重的分数;为所有粒径团聚体的级数.
利用SPSS(20.0)中的LSD方法(<0.05)对不同恢复群落之间进行差异显著性检验.Excel (2010)用于数据基础整理与绘图.
2 结果与分析
2.1 团聚体特征
不同处理团聚体特征如图1所示,由图1A可知,研究区土壤结构以大团聚体(>250μm)为主,粉黏粒(<53μm)含量最少.与对照相比撂荒地以及灌木地大团聚体含量显著增加(<0.05),微团聚体(53~250μm)只有撂荒地显著减小.皆伐后恢复的群落土壤团聚体稳定性有所差异,不同群落团聚体MWD以及GMD都有显著变化(图1B<0.05)并且变化趋势相类似.与对照相比,幼林地MWD和GWD显著减小,团聚体稳定性降低;而撂荒地以及灌木地MWD和GWD显著增加,团聚体稳定性有所提高,其中以虎榛子群落为主的灌木地土壤团聚体稳定性最高.
不同小写字母表示处理之间有显著差异<0.05
2.2 团聚体GRSP分布特征
不同处理各粒径团聚体T-GRSP和EE- GRSP含量分布特征如图2所示,从图2中可以看出粉黏粒团聚体(<53μm)EE-GRSP含量大于其他粒径,而微团聚体(53~250μm)中的T-GRSP含量普遍大于其他粒径(对照处理除外).皆伐后恢复的不同群落土壤团聚体GRSP分布有显著差异(<0.05).与团聚体MWD和GMD的变化趋势一致:相比对照处理,幼林地团聚体中EE-GRSP含量不同程度降低(粉黏粒团聚体除外),而撂荒地和灌木地团聚体EE-GRSP含量增加,其中灌木地团聚体EE-GRSP含量显著增加(图2B<0.05).团聚体中T-GRSP对恢复群落有不同程度的响应(图2A),撂荒地和灌木地大团聚体(>250μm)T-GRSP含量相比对照处理显著增加,而撂荒地粉黏粒团聚体(<53μm)T-GRSP含量显著减小.
不同小写字母表示该粒径不同处理GRSP含量有显著差异<0.05
2.3 团聚体SOC分布特征
不同处理团聚体SOC含量如表1所示,由表1可知,不同处理土壤团聚体SOC分布有显著差异(<0.05).与对照相比,灌木地土壤各粒径团聚体SOC含量显著增加,其他群落团聚体SOC分布变化不明显.不同处理中各粒径团聚体SOC含量均表现出大团聚体(>250μm)>微团聚体(53~250μm)>粉黏粒(<53μm).
2.4 全土SOC、团聚体稳定性参数与团聚体GRSP的相关性
全土SOC含量与土壤团聚体T-GRSP、EE-GRSP含量之间的关系见图3A,B.全土SOC含量与不同粒径团聚体GRSP含量普遍显著相关(<0.05.除全土SOC与微团聚体T-GRSP,大团聚体EE-GRSP的关系不显著之外),其中全土SOC与大团聚体(>250μm)T-GRSP的相关性最为显著(2=0.7486,<0.01).团聚体稳定性参数与团聚体T-GRSP、EE-GRSP含量之间的关系见图3C,D,E,F.不同粒径团聚体T-GRSP、EE-GRSP含量与团聚体稳定性参数相关性有所差异,其中大团聚体T-GRSP、EE-GRSP含量与团聚体稳定性参数均显著相关(<0.05).
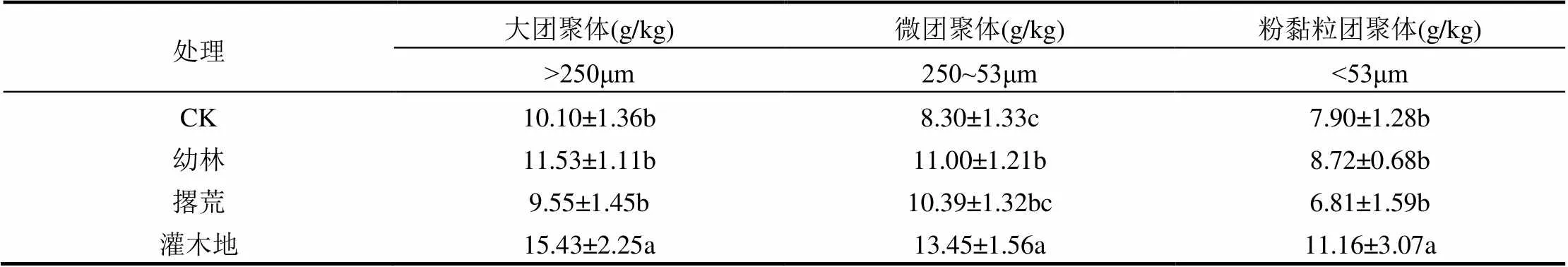
表1 不同处理团聚体SOC含量
注:不同小写字母表示不同处理同一指标差异显著(<0.05).
3 讨论
3.1 团聚体特征
土壤结构是由土壤团粒、水分和空气组成的特殊结构,团聚体的分布特征以及稳定性直接决定土壤结构的优劣以及植物的生长状况[15].特别是土壤肥力的高低与大团聚体含量直接相关,大团聚体含量越高土壤质量越好[20].研究表明,油松人工林土壤以大团聚体(>250μm)为主,粉黏粒(<53μm)含量最低(图1A);土壤质量明显好于农地和园地[23].不同恢复群落土壤大团聚体的分布差异显著(<0.05).与对照相比,撂荒地以及灌木地大团聚体含量显著增加,从而可以使土壤质量提高.实验结果表明,黄土高原地区油松人工林土壤团聚体MWD主要集中在1.40~1.58mm范围内,而GMD主要集中在0.71~0.93mm范围内(图1B).这与曾全超等对黄土高原森林植被带团聚体稳定性的研究成果基本一致[24].与黄土高原中部半湿润丘陵区油松刺槐混交林团聚体稳定性相比[25],单一油松人工林团聚体稳定性有所降低,这主要是由于不同的造林模式以及地理位置导致的土壤结构稳定性差异.环境条件的改变必然会造成团聚体稳定性的相应改变.实验还发现撂荒地、灌木地土壤团聚体稳定性显著增加并且灌木地团聚体稳定性最高,这可能与团聚体GRSP以及有机碳含量变化有关,本文将在接下来的内容中进行讨论.
3.2 团聚体GRSP分布特征
造成团聚体稳定性改变的因素很多,其中团聚体GRSP是影响团聚体稳定性的一个主要因素[21],而研究不同粒径团聚体中GRSP分布可以揭示更多团聚体稳定机制[26].本研究表明,团聚体中EE-GRSP含量、T-GRSP含量分别在0.09~ 0.41g/kg、0.38~1.57g/kg范围内(图2A,B),结果符合对不同地区植被类型条件下团聚体GRSP含量的调查范围[5].不同粒径团聚体GRSP含量分布小于前人的相关研究[21,27],这与植被种类、土壤类型以及肥力水热条件有很大关系.不同恢复群落土壤团聚体GRSP分布显著不同,相比于对照处理油松幼林地各粒径团聚体EE-GRSP含量不同程度减少(粉黏粒团聚体例外)而撂荒地以及灌木地团聚体EE-GRSP含量有所增加(撂荒地微团聚体例外)并且灌木地EE-GRSP含量最高(图2B).不同恢复群落团聚体EE-GRSP分布的变化情况与团聚体稳定性的变化类似,说明EE-GRSP作为新近产生的蛋白容易受到外界环境变化的影响,并且团聚体稳定性与EE-GRSP的变化趋势一致.与对照相比,撂荒地以及灌木地大团聚体T-GRSP含量显著增加而撂荒地粉黏粒团聚体T-GRSP显著减小(图2A),这与团聚体稳定性的变化不一致,而这主要是由于T-GRSP中包括易提取和难提取部分,性质十分稳定不容易发生改变导致的[28].灌木地团聚体GRSP含量显著大于其他处理主要是由于群落的主要物种虎榛子属桦木科直立灌木,根系发达,根瘤菌含量丰富容易促进GRSP的产生[29].而撂荒地中草本根系主要集中于表层土壤,对于GRSP的形成也有促进作用.粉黏粒团聚体(<53μm)EE-GRSP含量大于其他粒级,微团聚体(53~250μm)T-GRSP含量大于其他粒级,该结果与前人的研究有所不同.Dai等[27]研究显示,GRSP在>250μm和<2μm团聚体中含量最高.而农田土壤团聚体GRSP在不同施肥模式下分布也不同[21].这些结果说明GRSP在团聚体中的分布受到不同土壤类型、植被、气候等因素的影响.
3.3 团聚体SOC分布特征
最近的研究发现,SOC、N、P以及各种土壤酶活性等与GRSP显著正相关,其中SOC的相关性最大[11,17].Rillig等[30]的研究发现,菌根菌丝生长繁殖时SOC含量成为限制GRSP产生的主要因素.不同处理团聚体SOC含量不同,与对照相比,灌木地团聚体SOC显著增加而其他处理没有显著的变化(表1),这与团聚体T-GRSP分布变化趋势较为相似.杜介方等对不同施肥处理GRSP变化进行研究时也发现,SOC与T-GRSP变化的相关性要好于EE-GRSP,而这主要是由于T- GRSP比EE-GRSP浸提了土壤中更多的GRSP而且T-GRSP是土壤SOC的重要组成部分导致的.SOC含量的变化取决于生成量和分解量的相对大小[31],幼林地和撂荒地土壤SOC分布与对照相比没有显著变化,可能与近几年地表碳输入量比刚皆伐时有所提高,油松幼林地枯落物归还慢,撂荒地草本植物根系主要存在于土壤表层等因素有关.而灌木地土壤团聚体SOC显著增加,与虎榛子具有发达的根系,容易产生根瘤菌以及丰富的落叶有直接关系,随着群落的正向演替土壤质量可以改善并不断提高.霍莉莉的研究也发现将小叶章湿地开垦为容易形成根瘤菌的豆科植物农地比开垦为水稻农地土壤中SOC存留时间更长[32].
3.4 全土SOC、团聚体稳定性与团聚体GRSP的相关性
团聚体GRSP对于全球碳循环的变化具有一定指示作用[11],其作为土壤有机质的重要稳定组分能在一定程度上反映土壤碳库的动态变化[30].本研究发现,全土SOC含量与团聚体T-GRSP和EE-GRSP含量之间的关系普遍表现为显著正相关(图3A,B).但是团聚体T-GRSP和EE-GRSP与全土SOC 之间的相关性不随粒径变化.说明团聚体GRSP指示土壤碳库变化的复杂性,其中全土SOC与大团聚体(>250μm)中T-GRSP含量的相关性最好,可作为指示土壤碳库变化的优选指标.另外我们的实验发现不同粒径团聚体T-GRSP、EE-GRSP含量与团聚体稳定性参数之间的关系有所差异,其中大团聚体T- GRSP、EE-GRSP均与团聚体稳定性参数显著相关,说明团聚体稳定性更依赖于大团聚GRSP.Wright等[22]的研究发现不同类型全土GRSP含量与团聚体稳定性显著正相关,而其他的研究在耕地、草地和林地土壤中发现了不同的结果[33-35].出现这些不同结果的潜在机制可能与土壤不同粒径团聚体中GRSP与团聚体稳定性关系有所差异有关,本文从这个方面进行了证实.
4 结论
4.1 幼林地团聚体稳定性相比对照处理显著减小而撂荒地和灌木地有增大趋势并且灌木地优于其他处理.
4.2 不同恢复群落团聚体EE-GRSP含量变化与团聚体稳定变化一致,相比于对照,灌木地团聚体EE-GRSP含量显著增加并且大于其他处理.撂荒地以及灌木地大团聚体T-GRSP含量显著增加,而撂荒地微团聚体T-GRSP含量显著减小.
4.3 不同粒径团聚体中粉黏粒团聚体(<53μm) EE-GRSP含量普遍大于其他粒径团聚体,微团聚体(53~250μm)T-GRSP含量普遍大于其他粒径团聚体.
4.4 相比于其他粒径团聚体,大团聚体T-GRSP可以作为反映土壤碳库变化的优选指标.而土壤团聚体的稳定性更依赖于大团聚体GRSP.
[1] Wright S F, Sara F, Upadhyyaya A, et al. Extraction of an abundant and unusual protein from soil and comparison, with hyphal protein of arbuscularmycorrhizal fungi [J]. Soil Science, 1996,161(9):575-586.
[2] Wright S F, Upadhyyaya A. A survey of soils for aggregate stability and glomalin, a glycoprotein produced by hyphae of arbuscularmycorrhizal fungi [J]. Plant and Soil, 1998,198(1): 97-107.
[3] 彭思利,申 鸿,郭 涛.接种丛枝菌根真菌对土壤水稳性团聚体特征的影响[J]. 植物营养与肥料学报, 2010,16(3):695-700.
[4] Rillig M C, Mummey D L. Mycorrhizas and soil structure [J]. New Phytologist, 2006,171(1):41–53.
[5] Treseder K K, Turner K M. Glomalin in ecosystems [J]. Soil Science Society of America Journal, 2007,71(4):1257-1266.
[6] Bothe H, Turnau K, Regvar M. The potential role of arbuscularmycorrhizal fungi in protecting endangered plants and habitats [J]. Mycorrhiza, 2010,20(7):445-57.
[7] Matthias C, Rillig M C. Arbuscularmycorrhizae, glomalin, and soil aggregation [J]. Canadian Journal of Soil Science, 2004, 84(4):355-363.
[8] Roldan A, Salinas J R. Soil sustainability indicators following conservation tillage practices under subtropical maize and bean crops [J]. Soil & Tillage Research, 2007,93(2):273-282.
[9] 唐宏亮,刘 龙,王 莉,等.土地利用方式对球囊霉素土层分布的影响[J]. 中国生态农业学报, 2009,17(6):1137-1142.
[10] 谢 靖,唐 明.黄土高原紫穗槐丛枝菌根真菌与土壤因子和球囊霉素空间分布的关系[J]. 西北植物学报, 2012,32(7):1440- 1447.
[11] 贺海升,王 琼,裴忠雪,等.落叶松人工林球囊霉素相关土壤蛋白与土壤理化性质空间差异特性[J]. 生态学杂志, 2015, 34(12):3466-3473.
[12] Tisdall J M, Oades J M. Organic matter and water-stable aggregates in soils [J]. European Journal of Soil Science, 1982,33(2):141–163.
[13] Wright S F, Green V S, Cavigelli M A. Glomalin in aggregate size classes from three different farming systems [J]. Soil & Tillage Research, 2007,94(2):546–549.
[14] 杜介方,张 彬,解宏图,等.不同施肥处理对球囊霉素土壤蛋白含量的影响[J].土壤通报, 2011,42(3):573-577.
[15] Rillig M C, Wright S F, Eviner V T. The role of arbuscularmycorrhizal fungi and glomalin in soil aggregation: Comparing effects of five plant species [J]. Plant and Soil, 2002,238(2):325-333.
[16] 王 建,周紫燕,凌婉婷.球囊霉素相关土壤蛋白的分布及环境功能研究进展[J]. 应用生态学报, 2016,27(2):634-642.
[17] 冯欣欣,唐 明,龚明贵,等.黄土高原狼牙刺丛枝菌根与球囊霉素的空间分布[J]. 西北农林科技大学学报自然科学版, 2011,39(6):96-102.
[18] Bedini S, Pellegrino E, Avio E, et al. Changes in soil aggregation and glomalin-related soil protein content as affected by the arbuscularmycorrhizal fungal species Glomusmosseae and Glomusintraradices [J]. Soil Biology & Biochemistry, 2009, 41(7):1491-1496.
[19] Nimmo J R, Perkins K S. Aggregate stability and size Distribution [M]. California: Methods of Soil Analysis Part Physical Methods, 2002:317-328.
[20] Six J, Eilliott E T, Paustian K, et al. Aggregation and soil organic matter accumulation in cultivated and native grassland soils [J]. Soil Science Society of America Journal, 1998,62(5):1367-1377.
[21] Xie H T, Li J W, Zhang B, et al. Long-term manure amendments reduced soil aggregate stability via redistribution of the glomalin-related soil protein in macro aggregates [J]. Scientific Reports, 2015,5:14687.
[22] Wright S F, Upadhyaya A, Buyer J S. Comparison of N-linked oligosaccharides of glomalin from arbuscularmycorrhizal fungi and soils by capillary electrophoresis [J]. Soil Biology & Biochemistry, 1998,30(13):1853–1857.
[23] 张嘉宁.黄土高原典型土地利用类型的土壤质量评价研究[D]. 杨凌:西北农林科技大学, 2015.
[24] 曾全超,董扬红,李 鑫,等.基于Le Bissonnais法对黄土高原森林植被带土壤团聚体及土壤可蚀性特征研究[J]. 中国生态农业学报, 2014,22(9):1093-1101.
[25] 段而军,于 清.黄土高原中部半湿润丘陵区不同树种林地土壤团聚特征的比较[J]. 安徽农业科学, 2010,38(21):11355- 11358.
[26] Wright S F, Anderson R L. Aggregate stability and glomalin in alternative crop rotations for the central Great Plains [J]. Biology and Fertility of Soils, 2000,31(3):249-253.
[27] Dai J, Hu J L, Zhu A N, et al. No tillage enhances arbuscularmycorrhizal fungal population, glomalin-related soil protein content, and organic carbon accumulation in soil macroaggregates [J]. Journal of Soils and Sediments, 2015, 15(5):1055-1062.
[28] Lovelock C E, Wright S F, Clark D A, et al. Soil stocks of glomalin produced by arbuscularmycorrhizal fungi across a tropical rain forest landscape [J]. Journal of Ecology, 2004,92(2): 278-287.
[29] 白淑兰,白玉娥,方 亮,等.土生空团菌与虎榛子形成的菌根及其对虎榛子生长的影响[J]. 林业科学, 2004,40(6):194-196.
[30] Rillig M C, Wright S F, Nichols K A, et al. Large contribution of arbuscularmycorrhizal fungi to soil carbon pools in tropical forest soils [J]. Plant and Soil, 2001,233(2):167-177.
[31] 宇万太,姜子绍,李新宇,等.不同土地利用方式对潮棕壤有机碳含量的影响[J]. 应用生态学报, 2007,18(12):2760-2764.
[32] 霍莉莉,吕宪国.垦殖方式对小叶章湿地表土团聚体有机碳分布的影响[J]. 中国环境科学, 2011,31(10):1711-1717.
[33] Rillig M C, Maestre F T, Lamit L J. Microsite differences in fungal hyphal length, glomalin, and soil aggregate stability in semiarid Mediterranean stepps [J]. Soil Biology & Biochemistry, 2003,35(9):1257-1260.
[34] Spohn M, Giani L. Water-stable aggregates, glomalin-related soil protein, and carbohydrates in a chronosequence of sandy hydromorphic soils [J]. Soil Biology & Biochemistry, 2010,42(9): 1505-1511.
[35] Wu Q S, He X H, Cao M Q, et al. Relationships between glomalin-related soil protein in water-stable aggregate fractions and aggregate stability in citrus rhizosphere [J]. International Journal of Agriculture & Biology, 2013,15(3):603-606.
Distribution of the glomalin-related soil protein and aggregate fractions in different restoration communities after clear-cuttingplantation.
JING Hang1, SHI Jun-yi1, WANG Guo-liang1,2*, XUE Sha1,2, LIANG Chu-tao2, ZHOU Hao-xiang1
(1.Institute of Soil and Water Conservation, Northwest A & F University, Yangling 712100, China;2.Institute of Soil and Water Conservation, Chinese Academy of Sciences, Ministry of Water Resources, Yangling 712100, China)., 2017,37(8):3056~3063
The objectives of this study were to evaluate the soil aggregate stability, distribution of glomalin-related soil protein (GRSP) and soil organic carbon (SOC) in different size aggregates from three restoration communities (young plantation land, shrub land and abandoned forestland) after clear-cuttingplantation, undisturbedplantation were control treatment. The results showed that soil aggregates were dominated by macro aggregate (>250μm). Aggregate stability were significantly different among those restoration communities (<0.05). The soil aggregate stability in young plantation land was significantly lower than that in the control treatment, while the aggregate stability in shrub land and abandoned forestland were significantly higher than those in the control treatment. Content of easily extractable GRSP (EE-GRSP) had similar changes with aggregate stability among all restoration communities; Content of total GRSP (T-GRSP) in shrub land significant higher than that in the control treatment. On the other hand, the content of EE-GRSP in clay-silt aggregate (<53μm) was highest than other size aggregates, while the content of T-GRSP in micro aggregate (53~250μm) was the highest than other size. The aggregate stability significantly varied among restoration communities, and the changes of EE-GRSP content was consistent with aggregate stabilities among restoration communites. Our results indicated content of T-GRSP in macro aggregate was a better index to reflect SOC pool than those in other size aggregates. Moreover, the aggregate stability was mainly depending on the GRSP in macro aggregate.
glomalin-related soil protein;soil aggregates;clear-cutting;soil organic carbon (SOC)
X171.1
A
1000-6923(2017)08-3056-08
景 航(1991-),男,陕西宝鸡人,西北农林科技大学硕士研究生,主要研究方向为植被恢复与流域管理.
2016-12-22
国家自然科学基金项目(41371508,41671513);国家“十二五”科技支撑课题(2015BAC01B03)
* 责任作者, 副研究员, glwang@nwsuaf.edu.cn
