去泛素化酶Usp46基因在系统性红斑狼疮患者血液中的表达及意义
2017-08-22郭惠芳郑桂敏张莲之彭媛媛刘淑霞
张 玮,魏 群,郭惠芳,郑桂敏,张莲之,彭媛媛,刘淑霞
(1.河北医科大学 病理教研室,河北 石家庄 050017;2.河北省人民医院医院 a.感染管理科;b.免疫风湿科,河北 石家庄 050051;3.河北医科大学第二医院 免疫风湿科,河北 石家庄 050000)
·论著·
去泛素化酶Usp46基因在系统性红斑狼疮患者血液中的表达及意义
张 玮1,魏 群2a,郭惠芳3,郑桂敏2b,张莲之1,彭媛媛1,刘淑霞1
(1.河北医科大学 病理教研室,河北 石家庄 050017;2.河北省人民医院医院a.感染管理科;b.免疫风湿科,河北 石家庄 050051;3.河北医科大学第二医院 免疫风湿科,河北 石家庄 050000)
目的 研究泛素特异性蛋白酶46 (Usp46)基因在系统性红斑狼疮(SLE)患者及健康人外周血中的表达水平,并探讨其在SLE发病中的作用。方法 收集73例SLE患者及75 例健康人临床资料,采用Real-timePCR法检测外周血中Usp46基因mRNA的表达情况,分析其表达水平与临床指标的关系。结果 与健康对照组相比,SLE患者血液中Usp46基因的mRNA表达水平明显升高(Z=-6.98,P<0.01);在SLE患者中Usp46基因的mRNA表达水平与红细胞沉降率(ESR)、IgG、IgM和谷丙转氨酶(ALT)呈正相关(P<0.05)。结论Usp46基因的mRNA表达水平在SLE患者血液中明显增高,提示Usp46基因可能参与SLE疾病的发生发展过程。
红斑狼疮, 系统性;基因;血沉;泛素特异性蛋白酶46
系统性红斑狼疮(SLE)是一种复杂的自身免疫性疾病,累及多系统、多器官,以自身抗体产生、补体激活、免疫复合物沉积以及多种组织器官损伤为特征,病死率极高[1],是一种严重危害人类健康的常见病。SLE的病因至今未明,发病机制复杂,已有研究表明SLE的发生和发展与激素水平、环境诱因和遗传易感性等多种因素有关[2]。其中免疫系统的过度活化可导致自体抗体的产生、免疫复合物的沉积以及致炎因子的释放,最终引发SLE中各个脏器的损伤[3]。最近研究发现泛素特异性蛋白酶46 (Usp46)基因作为一种去泛素化酶,通过去泛素化PH结构域富含亮氨酸重复蛋白磷酸酶1(PHLPP1)参与调控Akt信号通路[4],在结直肠癌中发挥着抑癌基因的作用,而且新近研究报道该基因与EB病毒核抗原(EBNA)家族一同参与调控淋巴细胞的生长和分化[5],可能在免疫系统中发挥重要作用,然而其是否在SLE的发病中发挥作用仍是未知,本研究采用Real-timePCR法检测SLE患者及健康人外周血中Usp46基因mRNA的表达情况,分析其表达水平与临床指标的关系,初步探讨Usp46基因在SLE患者发病中的可能作用。
1 资料与方法
1.1 研究对象 2015年1月至2017年1月在河北医科大学第二医院免疫风湿科诊断的SLE患者73例,男7例,女66例,年龄(35.0±2.8)岁。SLE诊断均符合美国2009年风湿病学会修订的诊断标准。选取同期健康献血者75例作为对照,男10例,女65例,年龄(38.0±1.2)岁。两组性别、年龄等一般资料比较差异无统计学意义(P>0.05)。研究对象均已签署知情同意书且已通过伦理委员会批准。
1.2 方法 所有研究对象抽取空腹静脉血用于红细胞沉降率(ESR)、IgA、IgG、IgM、C3、C4及丙氨酸转氨酶(ALT)检测。
1.2.1 总RNA提取及cDNA合成 用PAXgeneBloodRNATubes(Quagen)保存血液,保证血液中RNA的稳定性,运用PAXgeneBloodRNAKit(Quagen)试剂盒提取总RNA,检测其纯度和浓度后,采用FastQuantRTKit(天根)试剂盒反转录合成cDNA,本试验是在河北省肾脏病重点实验室完成。
1.2.2 引物设计 根据Usp46(NM_022832.3)和内参基因GAPDH(NM_002046)基因序列设计引物,由上海生工生物公司合成,引物序列见表1。

表1 引物序列
1.2.3Real-timePCR检测Usp46基因表达水平 用荧光定量PCR检测仪(AgilentMX3000P,美国)进行PCR扩增,Real-time反应体系由SYBRGreenMix10μl、上游引物和下游引物各0.5μl(终浓度为12.5μM)、cDNA1μl、无RNA酶的去离子水8μl构成20μl体系。反应条件为95 ℃ 2分钟预变性,95 ℃ 5秒,55 ℃ 30秒,72 ℃ 30秒共40个循环,同时检测熔解曲线。确定循环阈值(Ct)后,目标基因Usp46相对于内参基因GAPDH进行相对定量,采用2-△△Ct法计算相对表达量,并比较两组间的基因表达水平的差异[6-7]。PCR扩增产物经2.5%琼脂糖凝胶电泳以检测基因特异性。
1.3SLEDAI评分对SLE病情的判断依据 0~4分,基本无活动;5~9分,轻度活动;10~14分,中度活动;≥15分,重度活动。
2 结 果
2.1 临床指标SLE患者SLEDAI评分为中度活动;患者存在血液系统、肾脏、皮肤及神经系统损伤;ESR明显加快,高于正常水平;补体C3、C4低于正常水平,见表2。
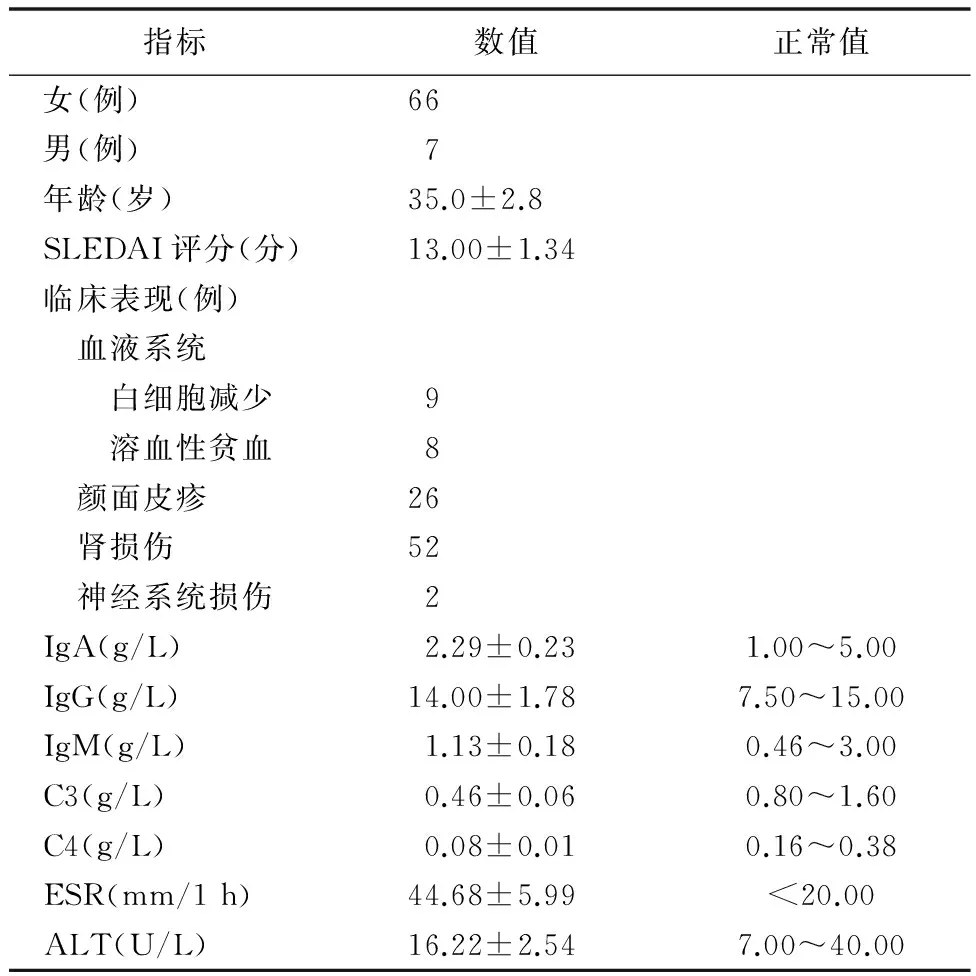
表2 73例SLE患者临床资料
2.2 血液标本RNA健康对照组RNA浓度为(48.50±5.28)g/L,纯度OD比值为(1.89±0.05),SLE组RNA浓度为(85.60±7.06)g/L,纯度OD比值为(1.98±0.03),采用1%琼脂糖凝胶电泳结果显示18s和28s条带清晰,28s的亮度是18s的2倍左右,说明完整性良好。
2.3 实时荧光定量PCR实时荧光定量RCR结果显示扩增良好(图1a);溶解曲线均为单峰(图1b,左侧为Usp46基因,右侧为GAPDH基因),将PCR产物进行2.5%琼脂糖电泳结果显示条带单一、大小正确(图1c)。
2.4Usp46基因mRNA表达水平Real-timePCR结果显示,两组均表达Usp46基因mRNA,SLE组Usp46基因的表达水平4.22 (1.30,17.02)健康对照组1.00(0.84,1.11),两组比较差异有统计学意义(Z=-6.98,P<0.01)。
2.5 相关性分析SLE患者Usp46基因的mRNA表达水平与ESR、IgG、IgM和ALT呈正相关(P<0.05),与SLEDAI评分、IgA、C3、C4无相关性。见图2。
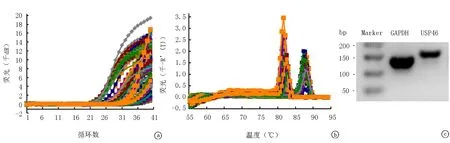
图1 GAPDH和Usp46基因实时荧光定量PCR结果 a.扩增曲线;b.融解曲线;c.荧光定量PCR产物的琼脂糖电泳结果
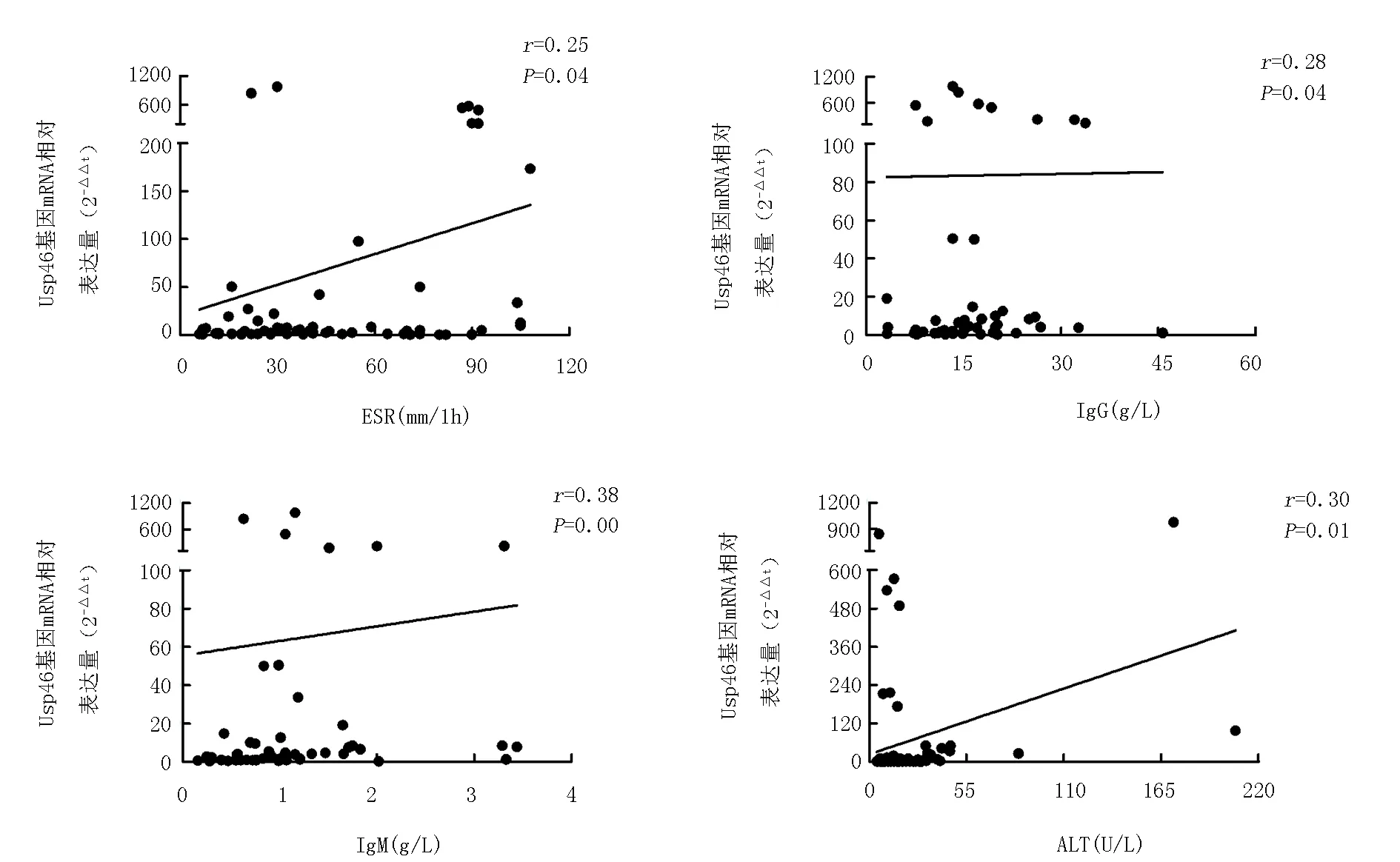
图2 SLE患者Usp46基因表达水平与临床指标的相关性
3 讨 论
SLE是目前临床上最常见的自身免疫性疾病,患者血清中常含有多种自身抗体,病变可以累及体内泌尿、神经、循环、运动、呼吸、血液、消化等多个系统,导致患者出现狼疮性肾炎、狼疮性脑病、狼疮性心脏病等多种并发症,严重影响患者的生存质量,如不控制甚至可以威胁患者的生命,然而SLE缺乏早期发现和早期诊断的分子标记物,病情往往进展到并发症阶段,有明显临床症状后才就医,严重影响患者的预后及生活质量,因而寻找早期分子标记物是早诊断、早治疗,提高患者生存质量的关键。
研究发现泛素-蛋白酶体通路[8]通过特异性地降解细胞内的蛋白质参与调控多种细胞进程,包括细胞周期[9]、肿瘤生长[10]及炎症[11]等,而且还参与免疫反应的调控[12-13],去泛素化酶是该通路中重要的质量控制因子,通过对底物蛋白的去泛素化来调控蛋白质的寿命[14],去泛素化酶表达水平、基因突变及功能异常与多种自身免疫性疾病的发生发展有关,如肿瘤坏死因子α诱导蛋白3(TNFAIP3)基因突变与SLE、风湿性关节炎等自身免疫性疾病、淋巴瘤及哮喘等疾病[15-16],Usp18通过调控转化生长因子β激活激酶 1(TAK1)及TAB(TAK1 结合蛋白1)在辅助性T细胞17(Th17)分化和自身免疫反应中发挥作用[17],另外Usp7表达水平增加及活性增强使多种抑癌基因P53、第10号染色体缺失的磷酸酶张力蛋白同源物(PTEN)稳定性下降[18],而且Usp7还参与调控核因子κB(NF-κB)信号通路[19-20]。
Usp46基因为人类100多种去泛素化酶[21]中的一种,属于泛素特异性蛋白酶亚家族,Usp46基因的生理功能目前仍不明确,有研究表明Usp46基因为小鼠“行为抑郁”的责任基因[22-23],且通过去泛素化谷氨酸受体α-氨基-3 羟基-5 甲基-4 异恶唑受体(AMPAR)调控大脑的兴奋性突触传递[24],提示Usp46基因很可能参与神经系统疾病的发生发展。此外研究发现其在组蛋白H2A和H2B的去泛素化[25]和大肠癌细胞的Akt信号转导[4, 26]等方面发挥重要作用,而且该基因与EB病毒核抗原3(EBNA3)家族中的EBNA3A和EBNA3C相互作用发挥着调控淋巴细胞的生长和分化的作用[5],提示该基因很可能在免疫系统中也发挥重要作用,然而其是否在SLE中发挥作用,仍无报道,本研究发现与健康人比较,SLE患者外周血中Usp46基因mRNA表达水平明显升高,提示该基因可能与SLE的发病有关。
那么该基因能否作为SLE早期诊断的分子标记物呢?本研究发现该基因的表达水平与SLE患者多项临床指标存在相关性。ESR是反应炎症的非特异性指标,一般在风湿热、类风湿关节炎、血管炎等结缔组织病的活动期升高,可以作为判断疾病活动及预后的指标,以往研究表明大多数活动期SLE患者ESR增高,而临床缓解期SLE患者ESR基本正常,提示ESR检测可以动态观察SLE患者病情活动的变化[27]。本研究显示Usp46基因mRNA与ESR呈正相关,提示该基因与SLE疾病进展有关。然而其与SLEDAI评分无相关性,可能是样本量较少的原因。
此外,SLE患者早期或活动期会出现血清免疫球蛋白及补体的异常变化[28-30],当自身抗体与组织有免疫反应出现时,免疫复合物增多,补体系统活化并与免疫复合物结合,在此过程中补体消耗较多,血液中补体成分降低,下降程度与患者病情活动程度相符,因而免疫球蛋白和补体常与自身抗体一起被用于SLE的临床诊断及病情疗效评估。本研究发现Usp46基因的表达水平与IgG、IgM呈正相关,进一步提示Usp46基因可用于SLE患者的病情评价。本研究还发现Usp46基因表达水平与ALT呈正相关,该基因是否与狼疮性肝损伤有关仍有待进一步研究。
总之,本研究发现Usp46基因mRNA表达水平在SLE患者中明显升高,约为健康人群的4.22倍,提示Usp46基因可能与SLE的发病有关,而且与ESR、IgG、IgM呈正相关,进一步提示Usp46基因与SLE的病情进展有关,然而其是否能作为SLE辅助诊断的分子标记物,仍需要进一步扩大样本量进行研究。
[1]ChoiJ,KimST,CraftJ.Thepathogenesisofsystemiclupuserythematosus-anupdate[J].CurrOpinImmunol,2012,24 (6): 651-657.
[2]O'NeillS,CerveraR.Systemiclupuserythematosus[J].BestPractResClinRheumatol,2010,24(6): 841-855.
[3]AnayaJM,ShoenfeldY,CerveraR.Systemiclupuserythematosus2014[J].AutoimmuneDis,2014,2014: 274323.
[4]LiX,StevensPD,YangH,etal.ThedeubiquitinationenzymeUSP46functionsasatumorsuppressorbycontrollingPHLPP-dependentattenuationofAktsignalingincoloncancer[J].Oncogene,2013,32(4): 471-478.
[5]OhashiM,HolthausAM,CalderwoodMA,etal.TheEBNA3familyofEpstein-BarrvirusnuclearproteinsassociateswiththeUSP46/USP12deubiquitinationcomplexestoregulatelymphoblastoidcelllinegrowth[J].PLoSPathog,2015,11(4):e1004822.
[6]SchmittgenTD,LivakKJ.Analyzingreal-timePCRdatabythecomparativeC(T)method[J].NatProtoc,2008,3(6):1101-1108.
[7]LivakKJ,SchmittgenTD.Analysisofrelativegeneexpressiondatausingreal-timequantitativePCRandthe2(-DeltaDeltaC(T))Method[J].Methods,2001,25(4):402-408.
[8]TaiHC,SchumanEM.Ubiquitin,theproteasomeandproteindegradationinneuronalfunctionanddysfunction[J].NatRevNeurosci,2008,9(11): 826-838.
[9]WalczakH.TNFandubiquitinatthecrossroadsofgeneactivation,celldeath,inflammation,andcancer[J].ImmunolRev,2011,244(1): 9-28.
[10]HussainS,ZhangY,GalardyPJ.DUBsandcancer:theroleofdeubiquitinatingenzymesasoncogenes,non-oncogenesandtumorsuppressors[J].CellCycle,2009,8(11): 1688-1697.
[11]TokunagaF,IwaiK.LUBAC,anovelubiquitinligaseforlinearubiquitination,iscrucialforinflammationandimmuneresponses[J].MicrobesInfect,2012,14(7-8):563-572.
[12]SimicekM,LievensS,LagaM,etal.ThedeubiquitylaseUSP33discriminatesbetweenRALBfunctionsinautophagyandinnateimmuneresponse[J].NatCellBiol,2013,15(10): 1220-1230.
[13]JiangX,ChenZJ.Theroleofubiquitylationinimmunedefenceandpathogenevasion[J].NatRevImmunol,2012,12(1): 35-48.
[14]LoveKR,CaticA,SchliekerC,etal.Mechanisms,biologyandinhibitorsofdeubiquitinatingenzymes[J].NatChemBiol,2007,3(11): 697-705.
[15]SchuijsMJ,WillartMA,VergoteK,etal.FarmdustandendotoxinprotectagainstallergythroughA20inductioninlungepithelialcells[J].Science,2015,349(6252): 1106-1110.
[16]MaA,MalynnBA.A20:linkingacomplexregulatorofubiquitylationtoimmunityandhumandisease[J].NatRevImmunol,2012,12(11): 774-785.
[17]LiuX,LiH,ZhongB,etal.USP18inhibitsNF-kappaBandNFATactivationduringTh17differentiationbydeubiquitinatingtheTAK1-TAB1complex[J].JExpMed,2013,210(8): 1575-1590.
[18]BrooksCL,LiM,HuM,etal.Thep53--Mdm2--HAUSPcomplexisinvolvedinp53stabilizationbyHAUSP[J].Oncogene,2007,26(51): 7262-7266.
[19]ColleranA,CollinsPE,O'CarrollC,etal.DeubiquitinationofNF-kappaBbyUbiquitin-SpecificProtease-7promotestranscription[J].ProcNatlAcadSciUSA,2013,110(2): 618-623.
[20]LiT,GuanJ,LiS,etal.HSCARGdownregulatesNF-kappaBsignalingbyinteractingwithUSP7andinhibitingNEMOubiquitination[J].CellDeathDis,2014,5:e1229.
[21]FraileJM,QuesadaV,RodríguezD,etal.Deubiquitinasesincancer:newfunctionsandtherapeuticoptions[J].Oncogene,2012,31(19): 2373-2388.
[22]TomidaS,MamiyaT,SakamakiH,etal.Usp46isaquantitativetraitgeneregulatingmouseimmobilebehaviorinthetailsuspensionandforcedswimmingtests[J].NatGenet,2009,41(6): 688-695.
[23]ImaiS,MamiyaT,TsukadaA,etal.Ubiquitin-specificpeptidase46 (Usp46)regulatesmouseimmobilebehaviorinthetailsuspensiontestthroughtheGABAergicsystem[J].PloSOne,2012,7(6):e39084.
[24]HuoY,KhatriN,HouQ,etal.ThedeubiquitinatingenzymeUSP46regulatesAMPAreceptorubiquitinationandtrafficking[J].JNeurochem,2015,134(6): 1067-1680.
[25]JooHY,JonesA,YangC,etal.RegulationofhistoneH2AandH2BdeubiquitinationandXenopusdevelopmentbyUSP12andUSP46[J].JBiolChem,2011,286(9): 7190-7201.
[26]WenYA,StevensPD,GasserML,etal.DownregulationofPHLPPexpressioncontributestohypoxia-inducedresistancetochemotherapyincoloncancercells[J].MolCellBiol,2013,33(22): 4594-4605.
[27] 裴秀云. 红细胞沉降率检测在系统性红斑狼疮患者中的意义探讨[J]. 基层医学论坛,2015,19(15): 2059-2060.
[28] 陈伟华,王薇.SLE患者血清免疫球蛋白及补体水平与自身抗体相关性研究[J]. 河北医药,2014,36(8): 1157-1158.
[29]SjöwallC,OlinAI,SkoghT,etal.C-reactiveprotein,immunoglobulinGandcomplementco-localizeinrenalimmunedepositsofproliferativelupusnephritis[J].Autoimmunity,2013,46(3): 205-214.
[30] 孙家祥, 李艳, 刘利洪, 鄂建飞. 系统性红斑狼疮患者外周血T淋巴细胞亚群、免疫球蛋白及补体变化分析[J]. 临床和实验医学杂志,2013,12(9): 654-655.
Roleofubiquitin-specificproteases46geneinbloodofpatientswithsystemiclupuserythematosus
ZhangWei1,WeiQun2a,GuoHuifang3,ZhengGuimin2b,ZhangLianzhi1,Pengyuanyuan1,LiuShuxia1
1.DepartmentofPathology,HebeiMedicalUniversity,Shijiazhuang050017,China; 2a.DepartmentofNosocomialInfectionControl;2b.DepartmentofRheumatology,HebeiGeneralHospital,Shijiazhuang050051,China; 3.DepartmentofRheumatology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China
LiuShuxia,Email:susanliu1976@163.com
ObjectiveToinvestigatetheroleofubiquitin-specificproteases46 (Usp46)inthebloodofsystemiclupuserythematosus(SLE)patientsandhealthypopulation.MethodsRealtimepolymerasechainreactionanalysiswasusedtodeterminetheUsp46expressioninthebloodof73patientswithSLEand75healthycontrols.ResultsThemRNAexpressionlevelofUsp46wassignificantlyincreased,about4.22(1.30,17.02)folds,insamplesfromSLEpatientscomparedtohealthypopulation(Z=-6.98,P<0.01).Inaddition,therewassignificantlypositivecorrelationbetweentheexpressionlevelofUsp46andESR,IgG,IgMandALT(P<0.05).ConclusionThemRNAexpressionlevelofUsp46wassignificantlyhigherinSLEpatientsthaninhealthypopulation,whichindicatesthatUsp46mayparticipateinthedevelopmentofSLEprocess.
lupuserythematosus,systemic;genes;bloodsedimentation;ubiquitinspecificprotease46
河北省自然科学基金(H2015206449);河北省卫生厅重点科技研究计划(ZD20140034);河北省大学生创新创业训练计划(201510089038)
刘淑霞,Email:susanliu1976@163.com
R
A
1004-583X(2017)08-0686-05
10.3969/j.issn.1004-583X.2017.08.010
2017-07-06 编辑:王秋红
