血友病B基因治疗研究进展
2017-08-22严红任兆瑞曾溢滔
严红,任兆瑞,曾溢滔
血友病B基因治疗研究进展
严红,任兆瑞,曾溢滔
血友病 B 是一种 X 染色体连锁的隐性遗传性出血性疾病,患者多为男性,女性患者极为罕见,男性人群的发病率约为 1/25000。因患者凝血因子 IX(factor IX,FIX)基因突变导致 FIX 水平缺乏引起,症状的严重程度与体内FIX 水平相关;重症患者血浆 FIX 含量小于正常人的 1%,因而频繁发生自发性出血,如关节内出血、软组织血肿、腹腔出血和脑出血等,最终导致严重的关节病、慢性疼痛,严重影响患者生活质量甚至寿命。目前,血友病 B 的主要疗法是静脉注射 FIX 生物制品,但患者需要频繁地接受注射,且 FIX 制品价格昂贵,造成患者及其家庭严重的经济负担[1]。
自 20 世纪 80年代 FVIII(凝血因子 VIII)和 FIX基因先后被成功克隆以来,基因治疗一直为血友病研究领域的热点[2-3]。近 30年来血友病 B 基因治疗领域的研究成果尤为突出,临床研究也取得了长足的进展。下面就血友病 B基因治疗的研究进展及展望作一评述。
1 凝血因子 IX 的结构和功能
FIX 是一类具有丝氨酸蛋白酶活性的凝血因子,主要由肝脏产生并以无活性的酶原形式分泌入血浆,它在血浆中浓度较低(2.5~5 mg/L),半衰期仅为 24 h[4]。全长 FIX 蛋白共含有 461 个氨基酸,其中包括一段 28 个氨基酸的信号肽和一段 18 个氨基酸的前肽。与凝血因子 VII 和 X一样,FIX 是维生素 K 依赖性蛋白,含有一个 γ-羧基谷氨酸(GLA)区域,该区域包含 12 个 γ-羧基化位点,这些位点的正确羧基化是维持 FIX 活性所必需的[5]。血液凝集过程中,FIX 可被凝血因子 XIa 或组织因子/凝血因子VIIa 激活,形成活性形式 FIXa;随后在 Ca2+和磷脂存在的条件下,FIXa 与 FVIII 的活性形式 FVIIIa 共同激活下游的凝血因子 X,最终导致血液凝集。
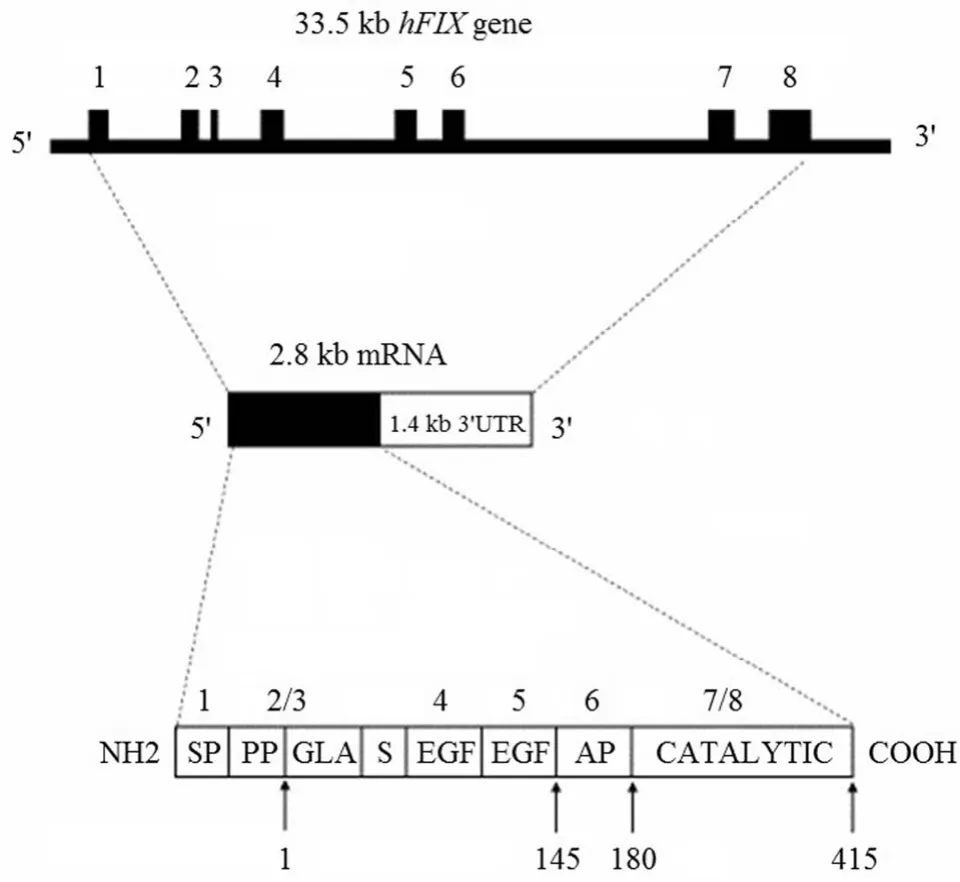
图1 FIX 基因及蛋白结构示意图
FIX 基因位于 X 染色体上,全长约 33.5 kb,由 8 个外显子和 7 个内含子组成,mRNA 全长 2802 bp。FIX 基因的 8 个外显子共编码蛋白的 6 个主要结构域,外显子1 和 2 分别编码信号肽和前肽;外显子 3 编码 GLA 结构域;外显子 4 和 5 编码表皮生长因子样结构域(EGF-1 和EGF-2);外显子 6 编码活化结构域,该区域在 FIX 被激活时被切割,从而变成 FIX 的活性形式;外显子 7 和 8编码催化结构域,该区域在激活 FIX 过程中起着十分重要的作用,FIX 基因及蛋白结构如图 1 所示。血友病 B 主要因患者 FIX 基因突变导致的 FIX 蛋白活性不足而引发,其中点突变是最常见的基因突变类型(约占总突变的64%)[4]。根据血友病 B 患者体内 FIX 水平的不同,可以将患者分为 3 类:当 FIX 水平低于正常水平 1% 时为重型,患者会频繁发生自发性出血,通常需要经常输注外源性FIX 控制出血;当 FIX 水平在 1%~5% 之间时为中间型,患者有自发性出血倾向,小手术或外伤后可发生严重出血;当 FIX 水平在 5%~40% 之间时,为轻型,患者通常只在大手术或外伤时可致严重出血,罕有自发性出血发生[1]。基因突变不仅可引起 FIX 凝血活性的降低,也可增加 FIX的凝血活性。我们早期的研究发现,当 FIX 蛋白 338 位由精氨酸变为丙氨酸(R338A)时,FIX 的体内外凝血活性可提高 2.5~3 倍[6]。在一个意大利家族中也发现一类 FIX功能获得性突变,FIX 蛋白的 338 位由精氨酸变为亮氨酸(R338L,也被称为 FIX Padua),该突变导致 FIX 凝血活性增加 5~10 倍。这些功能获得性突变的研究对血友病 B的基因治疗和药物开发都起到重要的作用[7]。
FIX 的结构及其作用特征使血友病 B 具有以下特点而成为研究基因治疗的理想疾病模型:①由单基因突变引起,致病机制明确;② FIX 的 cDNA 长度较短,便于载体携带;③ FIX 水平少量提高即能显著改善疾病症状,据现有临床研究报告,血浆 FIX 提高至正常血浆水平的 1% 以上即可显著降低重症患者自发性出血事件发生率;④ FIX治疗的有效范围较宽(达到正常血浆水平的 1%~100% 均可),不需对 FIX 表达水平进行严格控制;⑤ FIX 的主要表达器官是肝脏,但多种组织细胞都能正确地表达和修饰FIX,并分泌进入血液;⑥已建立良好的模型动物,包括大动物(血友病 B 犬)和小动物(血友病 B 小鼠)模型。
2 血友病 B 基因治疗现状
早在 2000年,美国费城儿童医院的研究人员就用腺相关病毒(adeno-associated virus,AAV)作为载体,向重型血友病 B 患者的骨骼肌细胞导入了正常人 FIX 基因。研究选择骨骼肌细胞主要出于安全性考虑,注射处的骨骼肌可在发生严重不良反应时被切除以及时终止研究,保证受试者的安全;且骨骼肌细胞虽并非人 FIX 的主要表达细胞,但体外研究表明骨骼肌细胞可以正确表达并修饰 FIX 蛋白[8]。相关临床前研究中骨骼肌表达的 FIX 实现了对血友病 B 小鼠和犬的表型纠正并能维持相对较长的时间(血友病 B 小鼠中治疗效果维持超过 12 个月,血友病 B 犬中治疗效果维持超过 2.5年),但在此次临床试验中参加研究的 3 例血友病 B 患者均未显示同样的治疗效果[9]。后续研究表明人骨骼肌注射位点处可检测到 FIX 的表达,并且表达可持续超过 10年,但产生的 FIX 总量不足以起到治疗效果,接受治疗后患者血浆 FIX 浓度仍然 < 1%[10-11];而每个注射位点的注射剂量和注射次数均有限制,无法通过反复注射进一步增加骨骼肌 FIX 的表达[12]。此次试验的尝试虽未获得治疗效果,但研究中也未出现严重安全问题,这为后续临床研究的开展奠定了基础。
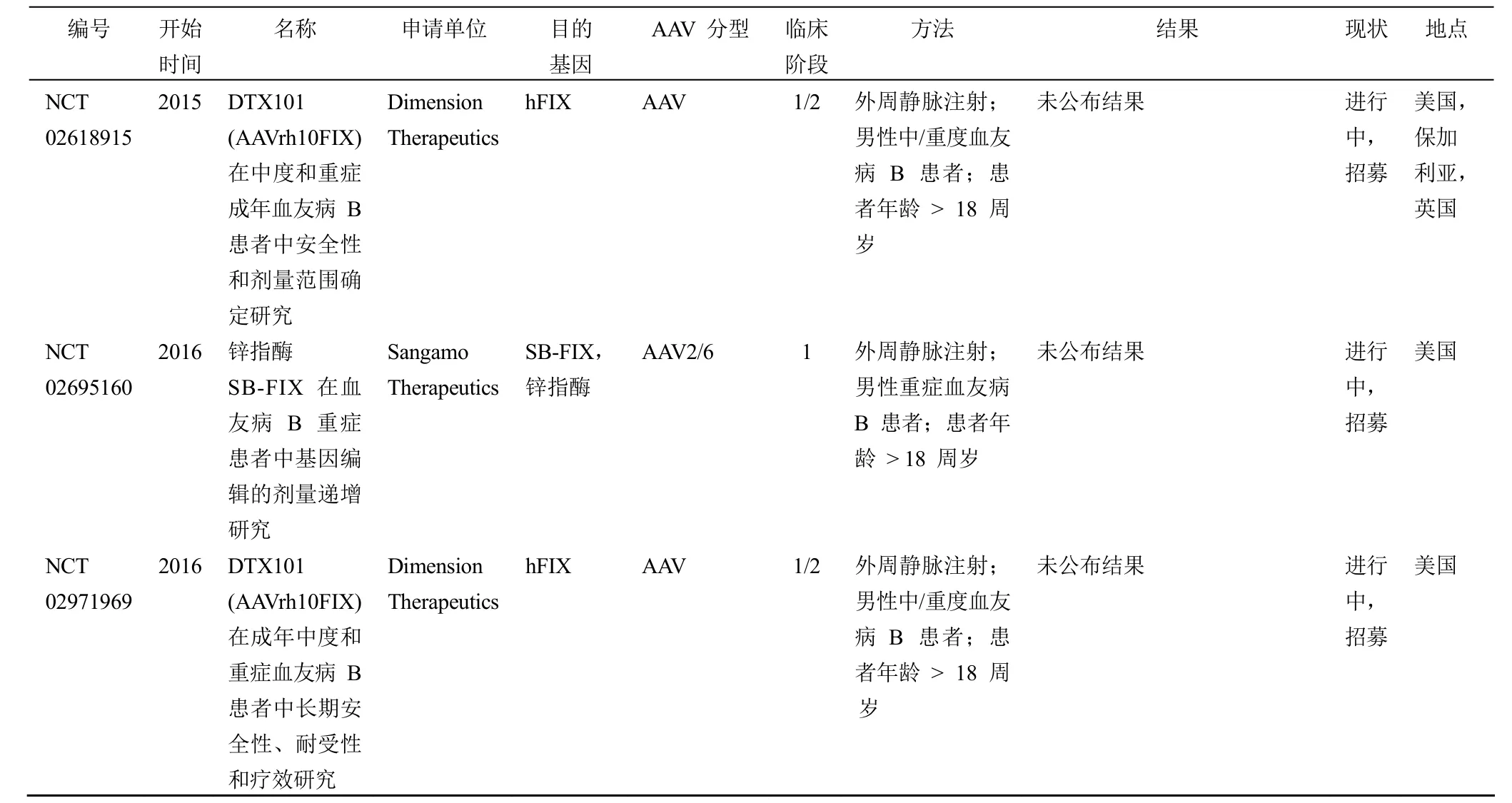
此后,有 10 项血友病 B 基因治疗的研究方案陆续进入临床试验阶段(表 1)。吸取之前基因治疗研究的经验,后续的研究均将靶器官设定为 FIX 的主要表达器官——肝脏,并利用 AAV 病毒作为载体实现肝细胞特异性地表达人 FIX,和上次试验不同之处在于使用的载体或表达的目的基因有相应的优化。其中,由圣裘德儿童研究医院发起的临床研究(clinicaltrials.gov,编号:NCT00979238)首先传来捷报。该项研究利用 FIX 密码子优化的、自互补(self-complementary)AAV(scAAV2/8-LP1-hFIXco)作为载体,对 10 名重症患者进行了临床研究。相比之前研究采用的载体,scAAV2/8-LP1-hFIXco 的不同之处在于用双链、互补的 DNA 代替 AAV 原本的单链 DNA,因此 AAV 感染细胞后无需依赖宿主细胞将单链基因组转变为有转录活性的双链基因组,从而大幅增加了感染效率;除此之外还对目的基因 FIX 进行了密码子的优化以增加表达量。先期披露的结果显示,scAAV2/8-LP1-hFIXco 可增加患者体内FIX 水平,并在 4 个月内达到稳定水平(正常水平的 1% ~6% 之间),且可稳定维持 3年以上,目前这些患者仍在随访中。患者的 FIX 水平与治疗剂量相关,其中高剂量组(2 × 1012μg/kg)6 名患者的 FIX 水平均有升高,FIX 平均值达到(5.1 ± 1.7)%,患者的出血事件发生率及相应用药减少了 90% 以上。试验中并无严重安全事件发生,但高剂量组 4 位患者在接受治疗后 7~10 周出现了无症状的转氨酶升高(转氨酶升高被认为与肝脏损伤或炎症相关),接受类固醇(氢化泼尼松)治疗后,患者转氨酶水平在 5 d内恢复正常。这是一项里程碑式的研究,成功证明 AAV 作为载体的基因治疗能在人体中维持较长时间的相对稳定的FIX 表达,并实现患者表型由重型到轻型的转换[13-14]。
其他几个仍在进行的临床研究,有两项对表达的目的基因 FIX 进行了优化,采用 FIX 高活性变体(FIX-Padua,其 FIX 的 338 位碱基从精氨酸变为亮氨酸,相比于野生型 FIX 活性增加 5~10 倍)作为目的基因,试图通过增加 FIX 活性提高基因治疗效果(clinicaltrials.gov,编号NCT01687608 和 NCT02484092,分别于 2012年和 2015年由 Baxalta US 和 Spark Therapeutics 公司发起)。由于体内表达非天然蛋白有可能产生强烈的免疫原性,因此人们最为关注的是这两项试验是否会出现严重的安全问题。目前这两项研究仍在进行中,尚未有 FIX-Padua 特异的安全问题出现。Spark Therapeutics 公司在 2017年的止血与血栓研究学会(HTRS)科学讨论会上对研究进展做了报告。研究结果显示,10 名重型患者接受载体治疗后(剂量为 5 ×1011μg/kg),出血事件减少 96%、治疗用药减少 99%,其中 9 名患者无需再注射 FIX 制品控制出血。治疗 12 周后患者体内 FIX 活性水平可稳定维持于 14%~81%,平均值为 33%,比先前的研究结果有大幅的提高。值得注意的是研究中并未发现严重的安全风险,未见大家普遍关注的FIX 抑制物生成且无血栓事件发生,但有 2 名患者出现了无症状的转氨酶瞬时升高及 FIX 活性降低的情况,推测原因可能是由人体对载体的免疫反应引起。在接受口服皮质类激素治疗后,患者转氨酶水平回归正常值,FIX 活性维持稳定水平,其中 1 位患者 FIX 活性最终稳定在 15% 左右,而另一位患者维持在 70%~80% 之间,维持时间超过9 周。这些研究结果表明,在发生病毒衣壳免疫的患者中皮质类激素的耐受性良好,并可控制衣壳免疫反应。本项治疗方案已于 2016年 7月获得美国 FDA 的突破性疗法认定[15]。
尽管临床研究捷报频传,然而血友病 B 基因治疗的临床研究过程并非一帆风顺。早期 AAV 载体靶向肝脏的临床研究中(clinicaltrials.gov,编号:NCT00076557),1 位高剂量组(2 × 1012μg/kg)患者接受治疗后 2 周内 FIX 水平即上升至 11.8%,出血症状得到了有效的改善,甚至在手部撞击柜子时都未出血(以往这种情况需要注射 FIX 控制出血)[10]。但是随着患者体内转氨酶水平的迅速升高,同时FIX 水平也急速下降。转氨酶水平在第 5 周达到最高值,以后缓慢下降,到第 12 周时恢复正常水平,与此同时患者体内 FIX 水平直降至基线水平[10,16]。这种 FIX 水平骤然下降、治疗效果不能维持的现象在模型动物上并未出现过。这一现象引起了大家的广泛关注并拉开了基因治疗中抗AAV 病毒衣壳免疫研究序幕。后续的相关研究表明,T 细胞介导的对 AAV 衣壳蛋白的免疫反应是导致 AAV 及AAV 感染的肝细胞被机体清除的机制,最终导致患者 FIX活性水平显著下降。其具体机制的一种可能的解释是患者在接受基因治疗之前可能已经感染过相应野生型 AAV 病毒,从而体内已有抗 AAV 的记忆 T 细胞,当再次接触 AAV时会产生大量病毒特异的 CD8+T 细胞,降低感染效率;此外,患者肝细胞被 AAV 感染后,可将病毒的衣壳蛋白递呈于细胞表面,T 细胞识别后最终导致 AAV 感染的肝细胞被特异性清除,导致治疗效果不能维持[17]。据报道,全球约有 50% 的人群携带有 AAV 的天然抗体,这就极大地制约了 AAV 基因治疗的应用[18]。此外,目前所有患者在接受 AAV 基因治疗后都会产生对病毒衣壳特异的免疫反应,并产生高滴度的抗 AAV 抗体,限制了同类型 AAV 基因治疗的重复进行[19]。
续表 1
上述通过 AAV 作为载体向靶细胞中导入正常人 FIX基因进行基因治疗的方法,其导入的目的基因并未或者很少整合进入靶细胞的基因组。因此有的研究方案就试图通过锌指酶介导的基因组编辑的方式直接向患者自身肝细胞导入FIX 基因(clinicaltrials.gov,编号 NCT02695160,由Sangamo Therapeutics 公司发起,正在招募患者)。该项研究计划是将目的基因定点整合于白蛋白基因位点(肝脏高表达的内源基因,且普遍被认为是安全位点),从而实现外源基因的安全、高效表达。虽然还不是直接替换异常的 FIX基因,但也是首次试图在人体中进行定点 FIX 整合。相关的临床前研究中,研究人员在小鼠 ROSA26 位点导入人FIX 的一个无义突变基因(Y155stop F9 minigene),构建了一个人 FIX 突变小鼠模型,并用该模型检测了锌指酶在该小鼠体内的基因纠正情况。小鼠模型的相关结果显示锌指酶在宿主 DNA 上实现了双链剪切,通过同源重组修复了异常基因,并在小鼠模型实现人 FIX 的表达,其平均活性水平为 23%[20]。但这种通过基因编辑导入目的基因的方法可能存在脱靶效应,从而造成非特异性剪切,具有一定的安全风险。脱靶效应不仅与使用的内切酶类别相关,也与内切酶的表达时间和表达水平相关。脱靶效应是基因编辑疗法面临的最主要安全问题。
3 影响血友病 B 基因治疗效果的因素
3.1 载体的影响
1998年研究人员曾采用质粒作为载体对血友病 B 进行过研究,但由于转染效率低下且难于实现目的基因的持续表达,无法真正应用于临床。目前基因治疗多用转导效率更高的病毒作为载体,主要分为两类:整合型病毒,如慢病毒、逆转录病毒,该类病毒感染细胞后可将目的基因整合入宿主细胞的基因组;非整合型病毒,如 AAV,这类病毒感染细胞后并不将目的基因整合入宿主细胞基因组,插入突变的风险较低,但需要感染寿命长的静止期细胞来实现目的基因的长期表达,如肝细胞、神经细胞或肌肉细胞。表 2 列出了基因治疗常用病毒载体的情况。
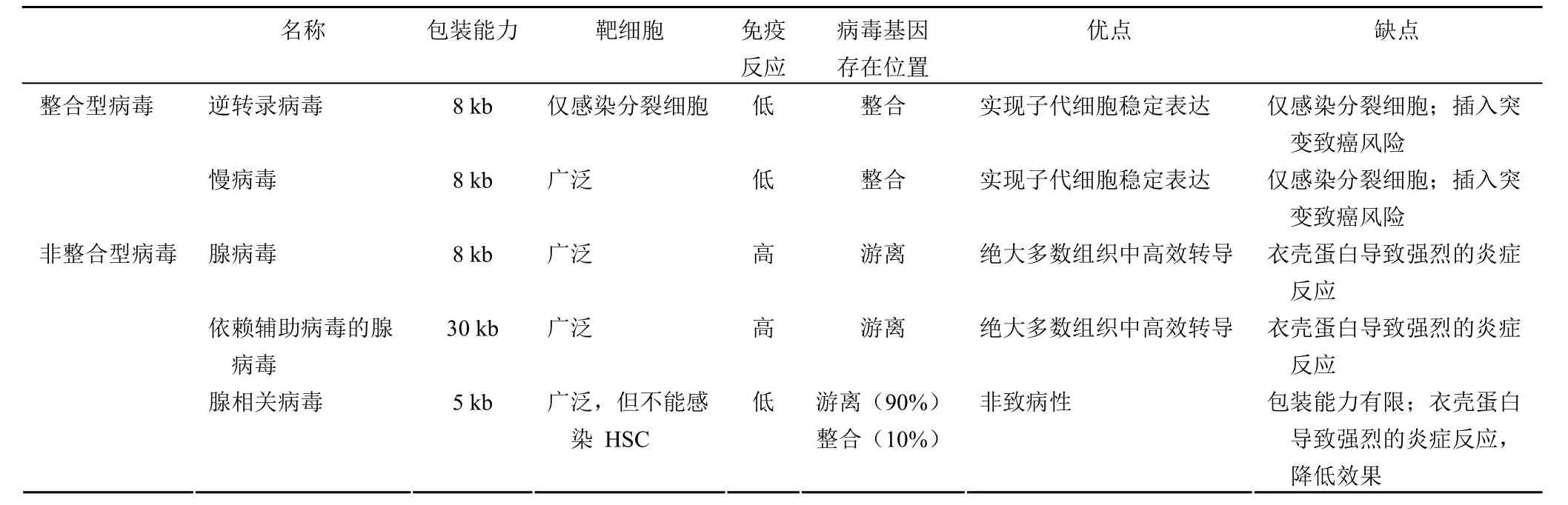
表2 基因治疗常用病毒载体及特点
出于安全性考虑,目前血友病 B 基因治疗主要采用AAV 作为载体,经外周静脉注射靶向肝脏表达人 FIX。但如前所述,人群中存在一定比例的人携带 AAV 天然抗体,一项对健康欧洲人群的研究结果显示,有 59% 的人含有AAV2 天然中和抗体,19% 的人含有 AAV8 天然中和抗体,5% 的人含有 AAV5 天然中和抗体[21]。AAV 天然中和抗体及对 AAV 衣壳蛋白特异的细胞免疫,是 AAV 作为载体治疗血友病 B所面临的主要问题,限制了其在肝炎患者及携带天然抗体的患者中的应用。另外接受过 AAV 治疗的患者可能会对相应亚型的载体产生抗体,无法重复进行同种载体的基因治疗。
相对于 AAV,慢病毒可携带更长的目的基因,更适用于血友病 A 的基因治疗(FVIII 的 cDNA 长度更长);此外,近年来对慢病毒载体的改进使得它的安全性有了很大提升;已知对慢病毒有天然抗体的人也较少,这些因素使得慢病毒在临床研究中也具有一定的优势[21]。
早期基因治疗使用的病毒载体中包含大量的空载病毒(> 80%),这可能是引起免疫反应的主要因素;但是也有研究认为空载病毒能起到“陷阱”作用,拦截患者体内原本存在的抗 AAV 中和抗体,或者作为衣壳特异细胞毒 T 细胞的靶点,提高目的基因的感染效率,但是这种理论还有待证实[21-24]。现可通过增加纯化步骤来降低产品中空载病毒的比例,让最终产品中空载病毒的含量不超过 10%。目前,FIX-Padua 的两项临床研究都采用这种空载病毒含量低的产品进行研究,最终空载病毒是否效果更好还需进一步的评判[21]。
3.2 宿主细胞的影响
宿主细胞的选择对于基因治疗的成功起着关键作用。血友病 B 的临床研究最初选择的宿主细胞是骨骼肌细胞,因当时病毒载体还需要通过肝动脉注射感染肝脏细胞,有一定的安全风险;且可通过切除相应骨骼肌组织随时终止研究以保证患者的安全。问题是骨骼肌细胞虽然可以表达 FIX,但表达量却不足以实现表型纠正[9]。目前,血友病 B 基因治疗研究的宿主细胞均为 FIX 的原始表达细胞——肝细胞,它可高效表达并完整地对 FIX 进行翻译后修饰。
但是对一些不能以肝脏作为靶器官的患者(如肝病患者等),发展他种靶细胞进行基因治疗仍有一定的意义。除了直接输注病毒感染体内细胞的基因治疗外,还可以通过体外感染靶细胞,再经体外扩增、移植靶细胞的方式进行基因治疗,这种方式称为离体基因治疗,也常被称为细胞治疗。早在 1996年,我国科学家就曾尝试用患者自身成纤维细胞作为靶细胞,以逆转录病毒作为载体进行过相关研究,结果表明成纤维细胞治疗的安全性较好,未有严重的安全问题,FIX 的活性水平最高达 4%,但表达为瞬时的,不能维持较长的时间[25]。细胞治疗通常选择具有增殖能力的细胞作为靶细胞,如造血干细胞、成纤维细胞、间充质干细胞等。其中,间充质细胞因易于分离、培养和扩增,且免疫原性低、能定植于多种脏器、组织,实现外源基因的长久表达而成为细胞治疗的常用细胞。我们曾在血友病 A 小鼠模型上进行过间充质干细胞的治疗研究,结果表明间充质干细胞可表达具有生物活性的人 FVIII,并能够改善血友病模型动物表型,但仍存在不能长期稳定表达的问题[26]。因在体外进行病毒感染,可避免机体与病毒载体的直接接触从而有更高的安全性,但如何实现在靶细胞中 FIX 的高水平表达和长期表达还是需要解决的问题[27]。
3.3 目的基因的影响
FIX 存在一系列功能增强型突变型,如前述的FIX-Padua,单个碱基的突变可使 FIX 活性增加 5~10 倍。临床研究中很难通过加大病毒载体剂量的方式来提高体内FIX 活性水平,而使用这种高活性 FIX 突变型可降低病毒载体剂量,增加安全性,或在同等剂量条件下增加体内 FIX水平,实现表型的“治愈”。不过表达非天然存在蛋白有引起免疫毒性的风险,这是人们最为关注的问题。但现有的临床研究中并未发现相关安全风险,也未见 FIX 抑制物生成。这与在小鼠模型、犬模型中的临床前研究结果一致。临床前动物试验还表明,基因治疗有诱导免疫耐受的潜在作用,具体机制还不明确,推测可能是通过调节 T 细胞功能实现,而临床结果似乎与临床前研究结果相符合[21,28-29]。
4 小结与展望
血友病 B 基因治疗研究迄今已经历了 20 余年,是遗传病基因治疗研究的一个典范。当前血友病 B的基因治疗主要通过 AAV 病毒向靶细胞导入正常 FIX 基因表达活性 FIX 蛋白的方式进行。可喜的是,近期的临床研究显示,基因治疗已实现了对血友病 B 患者的表型纠正,有效地控制了出血症状。但是,AAV 载体带来的相关风险仍然存在,限制了对携带有天然 AAV 中和抗体的患者及肝炎患者的应用,且无法对患者进行 AAV 重复治疗来增强治疗效果,这是血友病 B 的 AAV 病毒载体基因治疗目前所面临的一个主要问题。
最为理想的基因治疗方式应该是在 DNA 水平实现对异常基因的“修复”。随着基因组编辑技术的发展,如锌指酶,转录激活因子样效应核酸酶(TALEN),特别是规律成簇间隔短回文重复序列/规律成簇间隔短回文重复序列-相关蛋白 9(CRISPR/Cas9)系统的发展,基因组编辑效率得到了很大提升,基于基因组编辑的血友病 B 基因治疗,将会是血友病 B 基因治疗领域的重点研究方向。基因组编辑的安全性风险主要是非特异剪切和核酸酶的免疫原性;提高基因组编辑的效率,在靶细胞中产生足够量的 FIX 蛋白是面临的主要技术问题。
基因治疗是最有可能治愈血友病的疗法,尽管目前还面临着安全、伦理、普及性和费用等诸多方面带来的困难和挑战,但随着科学技术的进步,更高效、安全策略的出现,通过基因治疗并最终治愈血友病 B 的愿望不久将能实现。
[1]The hematology branch of thrombosis and hemostasis group of Chinese medical association, China hemophilia collaboration group.Diagnosis and treatment of hemophilia China expert consensus (2013 edition).Chin J Hematol, 2013, 34(5):461-463.(in Chinese)
中华医学会血液学分会血栓与止血学组, 中国血友病协作组.血友病诊断与治疗中国专家共识(2013年版).中华血液学杂志, 2013,34(5):461-463.
[2]Gitschier J, Wood WI, Goralka TM, et al.Characterization of the human factor VIII gene.Nature, 1984, 312(5992):326-330.
[3]Choo KH, Gould KG, Rees DJ, et al.Molecular cloning of the gene for human anti-haemophilic factor IX.Nature, 1982, 299(5879):178-180.
[4]Horava SD, Peppas NA.Recent advances in hemophilia B therapy.Drug Deliv Transl Res, 2017, 7(3):359-371.
[5]Presnell SR, Stafford DW.The vitamin K-dependent carboxylase.Thromb Haemost, 2002, 87(6):937-946.
[6]Yan JB, Wang S, Huang WY, et al.Transgenic mice can express mutant human coagulation factor IX with higher level of clotting activity.Biochem Genet, 2006, 44(7-8):347-360.
[7]Simioni P, Tormene D, Tognin G, et al.X-linked thrombophilia with a mutant factor IX (factor IX Padua).N Engl J Med, 2009, 361(17):1671-1675.
[8]Arruda VR, Hagstrom JN, Deitch J, et al.Posttranslational modifications of recombinant myotube-synthesized human factor IX.Blood, 2001, 97(1):130-138.
[9]Kay MA, Manno CS, Ragni MV, et al.Evidence for gene transfer and expression of factor IX in haemophilia B patients treated with an AAV vector.Nat Genet, 2000, 24(3):257-261.
[10]Manno CS, Pierce GF, Arruda VR, et al.Successful transduction of liver in hemophilia by AAV-Factor IX and limitations imposed by the host immune response.Nat Med, 2006, 12(3):342-347.
[11]Buchlis G, Podsakoff GM, Radu A, et al.Factor IX expression in skeletal muscle of a severe hemophilia B patient 10 years after AAV-mediated gene transfer.Blood, 2012, 119(13):3038-3041.
[12]Herzog RW, Fields PA, Arruda VR, et al.Influence of vector dose on factor IX-specific T and B cell responses in muscle-directed gene therapy.Hum Gene Ther, 2002, 13(11):1281-1291.
[13]Nathwani AC, Tuddenham EG, Rangarajan S, et al.Adenovirus-associated virus vector-mediated gene transfer in hemophilia B.N Engl J Med, 2011, 365(25):2357-2365.
[14]Nathwani AC, Reiss UM, Tuddenham EG, et al.Long-term safety and efficacy of factor IX gene therapy in hemophilia B.N Engl J Med,2014, 371(21):1994-2004.
[15]Spark Therapeutics, Inc.Spark therapeutics presents updated preliminary data from hemophilia B phase 1/2 trial suggesting consistent and sustained levels of factor IX Activity at the hemostasis and thrombosis research society (HTRS) 2017 scientific symposium.(2017-04-29).http://ir.sparktx.com/phoenix.zhtml?c=253900&p=irolnewsArticle&ID=2260344.
[16]High KA.Gene therapy for hemophilia: the clot thickens.Hum Gene Ther, 2014, 25(11):915-922.
[17]Mingozzi F, High KA.Therapeutic in vivo gene transfer for genetic disease using AAV: progress and challenges.Nat Rev Genet, 2011,12(5):341-355.
[18]Calcedo R, Vandenberghe LH, Gao G, et al.Worldwide epidemiology of neutralizing antibodies to adeno-associated viruses.J Infect Dis,2009, 199(3):381-390.
[19]George LA, Fogarty PF.Gene therapy for hemophilia: past, present and future.Semin Hematol, 2016, 53(1):46-54.
[20]Li H, Haurigot V, Doyon Y, et al.In vivo genome editing restores haemostasis in a mouse model of haemophilia.Nature, 2011,475(7355):217-221.
[21]Monahan PE.Gene therapy in an era of emerging treatment options for hemophilia B.J Thromb Haemost, 2015, 13 Suppl 1:S151-S160.
[22]Mingozzi F, High KA.Immune responses to AAV vectors:overcoming barriers to successful gene therapy.Blood, 2013, 122(1):23-36.
[23]Mingozzi F, Anguela XM, Pavani G, et al.Overcoming preexisting humoral immunity to AAV using capsid decoys.Sci Transl Med, 2013,5(194):194ra192.
[24]Gao K, Li M, Zhong L, et al.Empty virions in AAV8 vector preparations reduce transduction efficiency and may cause total viral particle dose-limiting side-effects.Mol Ther Methods Clin Dev, 2014,1(9):20139.
[25]Qiu X, Lu D, Zhou J, et al.Implantation of autologous skin fibroblast genetically modified to secrete clotting factor IX partially corrects the hemorrhagic tendencies in two hemophilia B patients.Chin Med J (Engl), 1996, 109(11):832-839.
[26]Wang Q, Gong X, Gong Z, et al.The mesenchymal stem cells derived from transgenic mice carrying human coagulation factor VIII can correct phenotype in hemophilia A mice.J Genet Genomics, 2013,40(12):617-628.
[27]Fomin ME, Togarrati PP, Muench MO.Progress and challenges in the development of a cell-based therapy for hemophilia A.J Thromb Haemost, 2014, 12(12):1954-1965.
[28]Crudele JM, Finn JD, Siner JI, et al.AAV liver expression of FIX-Padua prevents and eradicates FIX inhibitor without increasing thrombogenicity in hemophilia B dogs and mice.Blood, 2015,125(10):1553-1561.
[29]Annoni A, Cantore A, Della VP, et al.Liver gene therapy by lentiviral vectors reverses anti-factor IX pre-existing immunity in haemophilic mice.EMBO Mol Med, 2013, 5(11):1684-1697.
第一届中国生物诊断高峰论坛圆满结束
为适应政府职能转变的社会需求,积极发挥行业组织的前台服务功能,更好地促进我国体外诊断(IVD)技术进步与产业规范化健康发展。在中国食品药品检定研究院的直接参与和鼎力支持下,由中国医药生物技术协会生物诊断技术分会主办、郑州安图生物工程有限公司承办的“第一届中国生物诊断高峰论坛”于 2017年 7月 20 – 22日在中原大地古都郑州召开。
本次大会荣幸地邀请到在生物诊断领域具有卓越成就的庄辉院士、程京院士、国家相关管理部门和中国食品药品检定研究院的领导以及相关知名专家就当今生物诊断技术的最新研究进展与应用、我国生物诊断技术与产品的管理标准与新政解读发表主旨演讲。来自全国各地生物诊断领域“产、学、研、用、管”各方面的专家和代表共计 500 多人参加了交流和讨论。
大会开幕式由中国医药生物技术协会生物诊断技术分会主任委员李银太主持,他首先代表大会组委会对所有在百忙中出席这次高峰论坛的嘉宾和同行们表示热烈的欢迎和诚挚的谢意!对为本次大会成功召开付出辛劳的单位、个人,以及为大会提供支持的相关企业一并表示衷心的感谢!
随后,中国食品药品检定研究院王佑春副院长代表大会组委会致欢迎词;河南省食品药品监督管理局尹建副局长和中国医药生物技术协会李少丽副理事长分别发表了热情洋溢的讲话。
为了能给出席会议的代表提供更多学习和掌握信息的机会,本次论坛采用主会场特邀报告与分会场专题研讨相结合的方式开展交流。
在 7月 21日上午主论坛上,中国工程院庄辉院士、程京院士,军事医学科学院王升启研究员,重庆医科大学黄爱龙教授,中国食品药品检定研究院王佑春研究员,中国计量科学研究院医学与生物计量研究所王晶研究员,分别发表了“乙肝诊断与疗效监测新进展”、“感染性疾病的精准诊断”、“表面增强拉曼检测技术及其应用”、“精准诊断与精准治疗——乙肝血清学标志物再认识”、“二代测序诊断试剂的技术要求及质量评价”与“国家生物计量和质量控制标准”的主旨演讲。
7月 21日下午,大会分别开设了“血液筛查与输血安全”、“生物诊断新技术新方法与检测原材料标准化”、“分子诊断”、“临床检验技术发展与转化”4 个专题分论坛进行研讨。先后有 30 多位知名专家分别针对相关热点作了精彩的报告。
7月 22日上午,大会特邀国家食品药品监督管理总局医疗器械注册管理司一处胡雪燕副调研员、药品化妆品注册管理司生物制品处白鹤副调研员、国家药典委员会生物制品标准处郭中平处长、中国食品药品检定研究院体外诊断试剂检定所白东亭所长、医疗器械标准管理研究所母瑞红副所长分别就“诊断试剂法规解读”、“我国血源筛查试剂管理法规解读与发展趋势”、“《中国药典》体外诊断试剂质量标准建立相关原则”、“国家体外诊断试剂标准物质研制进展”、“新形势下医疗器械标准管理新进展”等发表了主旨演讲。
此外,生物芯片上海国家工程中心主任郜恒骏教授、第四军医大学附属西京医院检验科主任郝晓柯教授还应邀分别发表了“从样品到产品的转化研究与精准医疗”、“外泌体在肿瘤诊断与治疗中的应用”的精彩报告。
在中国医药生物技术协会的领导下,在与会专家和代表的共同努力下,第一届中国生物诊断高峰论坛受到与会人员的高度评价和认可,取得了圆满成功。大会组委会感谢所有给予关心和支持的广大同行,期待着下次会议再相聚。
10.3969/j.issn.1673-713X.2017.04.007
中国工程院咨询研究项目(2016XY36);国家自然科学基金(81500108)
200040 上海交通大学附属儿童医院/上海市儿童医院/上海交通大学医学遗传研究所/卫生部医学胚胎与分子生物学重点实验室/上海市胚胎与生殖工程重点实验室
曾溢滔,Email:ytzeng@stn.sh.cn
2017-05-15
