HIV-1始祖病毒Vpu和Vif拮抗宿主限制因子的能力
2017-08-22黄宇明赵建元岑山魏涛
黄宇明,赵建元,岑山,魏涛
HIV-1始祖病毒Vpu和Vif拮抗宿主限制因子的能力
黄宇明*,赵建元*,岑山,魏涛
目的研究始祖病毒的生物学和早期进化特征,有助于阐明HIV-1 建立感染的关键因素。
方法以过表达的方法比较了始祖病毒和同一亚型的慢性感染病毒 Vpu 蛋白降解宿主限制因子 BST-2 的能力,利用流式细胞术检测两者对内源性 BST-2 细胞表面水平的影响。利用已构建的含荧光素酶报告基因的单循环感染始祖病毒表达质粒,比较了始祖病毒与同一亚型的慢性感染株下调BST-2 的能力。用过表达的方法检测了 Vif 蛋白拮抗宿主限制因子 hA3G 的能力。
结果对过表达以及细胞表面内源性 BST-2,始祖病毒Vpu 蛋白降解宿主限制因子 BST-2 的能力均显著高于同一亚型的慢性感染病毒。但在始祖病毒拮抗 BST-2 抗病毒活性的能力分析中,尽管始祖病毒 Vpu 表现出较强的下调BST-2 的能力,仍然不足以拮抗外源过量表达的 BST-2 的抗病毒活性。在 Vif 降解 hA3G 的实验中,始祖病毒 Vif降解 hA3G 的能力弱于慢性感染病毒 pMJ4 或与之类似。
结论始祖病毒具有更高的拮抗宿主天然免疫的能力,有助于其建立早期感染。
vpu 基因产物,人免疫缺陷病毒; vif 基因产物,人免疫缺陷病毒; HIV-1 始祖病毒
www.cmbp.net.cn 中国医药生物技术, 2017, 12(4):303-309
艾滋病(acquired immunodeficiency syndrome,AIDS)是由人免疫缺陷病毒(human immunodeficiency virus,HIV)感染所导致[1]。根据血清学反应和病毒核酸序列测定可分为 HIV-1 和HIV-2 两种亚型。HIV-1 在感染人数上占有绝对优势,是引起艾滋病全球流行的主要亚型。HIV-1 基因组由两条单股正链 RNA 组成,每个基因组长度约为 9.8 kb,结构上包括 LTR、结构蛋白编码区(gag)、多种酶活性的蛋白编码区(pol)、外膜蛋白编码区(env)以及 6 个调节基因(vif、vpr、rev、vpu、tat和nef)。HIV-1 调节基因编码的辅助蛋白在病毒的生活周期中起到至关重要的作用,特别是在拮抗宿主限制因子的抑制作用,保证病毒逃避宿主天然免疫的过程中发挥重要生物学功能[2]。
在生物进化的漫长过程中,宿主细胞会形成针对 HIV-1 的固有免疫体系,其中最有代表性的是 HIV-1 宿主限制因子载脂蛋白 B mRNA 编辑酶催化多肽 3G(human protein apoliprotein B mRNA-editing enzyme-catalytic polypeptide-like-3G,hA3G)和病毒蛋白骨髓基质细胞抗原 2(bone marrow stromal cell antigen 2,BST-2,又名Tetherin/HM1.24/CD317)。hA3G 是在人的淋巴细胞中表达的一种 RNA/DNA 编辑酶,归属于APOBEC 蛋白超家族。hA3G 可以将病毒的单链DNA 上的脱氧胞嘧啶残基脱氨形成脱氧尿嘧啶,导致 HIV-1 病毒基因组的 GA 超突变,从而高效抑制病毒的复制,或通过非脱氨基抗病毒机制特异性地抑制病毒逆转录。BST-2 属 II 型单跨膜整合膜蛋白[3-4],可以阻止新生的成熟 HIV-1 病毒从细胞膜表面释放。作为病毒的拮抗手段,HIV-1 的 Vif蛋白可以特异性地结合 hA3G,通过泛素介导的蛋白酶体降解途径降解 hA3G,从而阻断了宿主细胞hA3G 抗病毒系统对 HIV-1 病毒复制的抑制作用。与之类似,HIV-1 Vpu 特异性地结合 BST-2,通过泛素化介导的溶酶体降解途径,下调细胞表面的 BST-2,提高病毒释放[5]。
在 HIV-1 黏膜传播过程中,病毒的遗传多样性是显著减少的,表现出严重的“遗传瓶颈”效应和有限的早期进化。研究发现,只有少数的一株或几株 HIV-1 病毒可以建立有效感染,这种病毒被称为始祖病毒(transmitted/founder virus)[6]。研究始祖病毒的生物学和早期进化特征,有助于阐明HIV-1 建立感染的关键因素。目前,对始祖病毒的研究多侧重于包膜蛋白的进化特征[7-8]。始祖病毒是否在拮抗宿主限制因子能力上具有一定的优势,并进而协助其建立感染,目前尚未报道。在本研究中,我们比较了始祖病毒和慢性感染病毒的 Vpu 和Vif 拮抗 BST-2 和 hA3G 的能力,发现始祖病毒Vpu 蛋白降解宿主限制因子 BST-2 的能力显著高于同一亚型的慢性感染病毒。这一结果提示始祖病毒具有更高的拮抗宿主天然免疫的能力,有助于其建立早期感染。
1 材料与方法
1.1 材料
1.1.1 细胞株 人胚肾上皮细胞 HEK293T 和人宫颈癌细胞 HeLa 均为本实验室自有,用含 10%FBS 的 DMEM 培养基传代培养。人 T 淋巴细胞SupT1 用含 10% FBS 的 RPMI1640 培养基传代培养。
1.1.2 质粒 pZM246F-10 和 pZM247Fv1 为编码 C 亚型 HIV-1 始祖病毒基因组的质粒,由美国国立卫生研究院(NIH)惠赠;pIndie-C1 质粒由加拿大麦吉尔大学梁臣教授惠赠;含荧光素酶报告基因的单循环感染质粒 pIndie-C1(Luc)、pZM246(Luc) 和 pZM247(Luc) 为本实验室构建;pcDNA4TM/TO/myc-His B 表达载体购自美国Invitrogen 公司;质粒 pcDNA3.1 购自美国 Life Technologies 公司;表达 C 端含有 HA 标签BST-2 的质粒 pcDNA-BST-2 由美国 Paul D Bieniasz 教授提供;pNL-Luc-E-、pHCMV-G(VSV-G)和 pcDNA-hA3G-HA 为本实验室保存;pMJ4-Vpu 和 pMJ4-Vif 是根据 pMJ4 的全基因序列,由苏州金唯智生物科技有限公司合成。
1.1.3 试剂 DMEM、RPMI1640 培养基和胎牛血清(FBS)购自美国 Gibco 公司;含 EDTA 的0.25% 胰酶购自美国 Hyclone 公司;限制性内切酶和 T4 DNA 连接酶购自日本 Takara 公司;PCR扩增酶 Easypfu PCR SuperMix、DNA 分子量marker、大肠杆菌感受态 DH5α 购自北京全式金生物技术有限公司;PVDF 膜、0.22 μm 滤膜购自美国 Millipore 公司;5 × 蛋白上样缓冲液、脱脂奶粉购自北京普利莱基因技术有限公司;DNA 转染试剂 Lipofectamine2000 购自美国 Invitrogen 公司;HA-probe 鼠单克隆抗体(sc-7392)购自美国Santa Cruz 公司;Anti-c-myc 兔单克隆抗体购自美国 Sigma 公司;Vif 抗体(#2221)由 NIH AIDS research and reference reagent program 提供;β-actin鼠单克隆抗体购自英国 Abcam 公司;HRP 标记山羊抗兔抗体和 HRP 标记山羊抗小鼠抗体均购自北京中杉金桥生物技术有限公司;荧光二抗 Infrared IRDye®labeled secondary antibodies(LI-COR)驴抗兔或抗小鼠购自香港基因有限公司。
1.2 方法
1.2.1Vpu和Vif表达质粒的构建 以始祖病毒株 ZM246F-10 和 ZM247Fv1 的基因组为模板,利用 PCR 扩增Vpu基因片段并连接到pcDNA4TM/TO/myc-His B 表达载体,得到带有c-myc-标签的Vpu表达质粒 pZM246-Vpu、pZM247FV1-Vpu,并通过测序验证。Vpu基因扩增引物序列:

同Vpu的构建方法类似,Vif基因扩增引物:
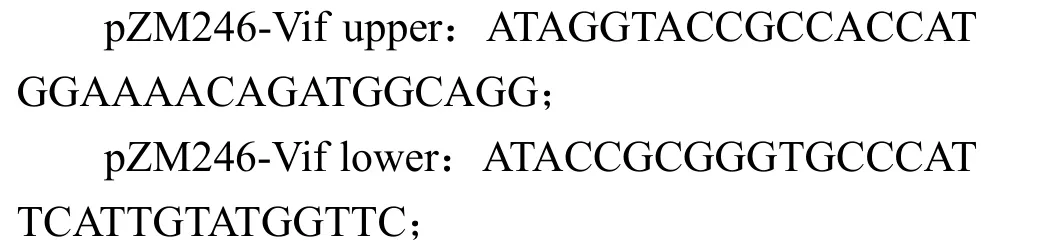
pZM247-Vif 基因扩增引物序列同 pZM246-Vif相同。
1.2.2 细胞培养及转染 HEK293T 和 HeLa 细胞培养于含 10% FBS 的 DMEM 培养基中,分别采用 Lipofectamine2000 和 Transeasy,按产品说明书方法转染相应的表达质粒。
1.2.3 Western blot 检测 转染 48 h 后收获细胞,加入 RIPA 裂解细胞,然后加入蛋白上样缓冲液。样品经聚丙烯酰胺蛋白电泳分离和转膜后,先后加入一抗 anti-c-myc(1∶3000)、β-actin(1∶5000)、anti-Vif(1∶5000)。二抗为山羊抗兔或山羊抗小鼠IgG(1∶5000),进行 Western blot 分析。
1.2.4 流式细胞仪分析 细胞经含 2% BSA 的PBS 清洗,用 70% 乙醇 4 ℃ 固定 24 h 以上。加入 anti-myc-(1∶800)或 anti-BST-2(1∶800),冰上孵育 60 min。PBS 清洗细胞后,加入 FITC 标记山羊抗兔抗体(1∶200)或 TRITC 标记山羊抗鼠抗体(1∶200),然后用流式细胞仪检测。
1.2.5 近红外双激光成像系统分析 蛋白样品经SDS-PAGE 分离并转膜,先后与一抗和二抗孵育。一抗使用 myc-Vpu(1∶5000)、HA-BST-2(1∶5000)、β-actin(1∶5000)。荧光二抗使用驴抗兔(1:10000)、驴抗小鼠(1∶10000)抗体。应用近红外双色激光成像系统检测。
1.2.6 HIV-1 始祖病毒 Vpu 蛋白下调细胞表面内源性 BST-2 的能力 首先用 200、400 和 800 ng的 pMJ4-Vpu、pZM246-Vpu 和 pZM247-Vpu 转染内源性表达 BST-2 的 HeLa 细胞。48 h 后收取样品,用 FACS 测定细胞表面的 BST-2 水平。
1.2.7 HIV-1 始祖病毒下调 BST-2 的能力分析 HEK293T 细胞通过共转染始祖病毒pZM246(Luc) 或 pZM247(Luc) 以及 VSV-G 质粒,同时在对照组中共转染 pIndie-C1(Luc) 和VSV-G。转染 48 h 后,收集细胞培养上清中的假型始祖病毒和慢性感染病毒,并以等量病毒(同一p24 水平)感染 HeLa 细胞。利用 Western blot 测定感染细胞中 BST-2 水平。
1.2.8 HIV-1 始祖病毒拮抗 BST-2 抗病毒活性的能力分析 HEK293T 细胞中共表达单循环感染的始祖病毒或慢性感染病毒表达载体和 VSV-G表达质粒,同时转染梯度增加(50、100 和 300 ng)的 BST-2 表达质粒。然后,应用等体积的含假型病毒细胞上清感染 SupT1 细胞,测定感染细胞中假型病毒报告基因荧光素酶的活性,分析不同表达水平 BST-2 对病毒感染性的影响。
1.3 统计学处理
实验数据用±s表示,显著性分析采用excel 软件中的数据分析工具进行t检验,所有实验数据 n ≥ 3。
2 结果
2.1 HIV-1 始祖病毒 Vpu 蛋白下调 BST-2 的活性研究
我们首先分别以慢性感染病毒 pMJ4、始祖病毒 pZM246 和 pZM247 为模板,构建了相应的Vpu 表达载体 pMJ4-Vpu、pZM246-Vpu 和pZM247-Vpu。然后,分别将不同量的 Vpu 表达质粒与 BST-2 表达质粒共转染 293T 细胞,通过Western blot(图 1A 和 1C)和近红外双色激光成像定量(图 1B和 1D)两种手段,研究不同 Vpu 对外源表达的 BST-2 水平的影响。结果显示,伴随着 Vpu 表达质粒用量(300 ng、500 ng 和 1 μg)的提高,BST-2 水平逐渐下降(图 1E)。在不同剂量组内,始祖病毒 pZM246 和 pZM247 的 Vpu下调 BST-2 的能力均强于慢性感染病毒 pMJ4 的Vpu。在最高剂量组(1 μg Vpu 表达质粒)中,尽管 pMJ4-Vpu 的表达水平甚至强于 pZM246-Vpu和 pZM247-Vpu,但其下调 BST-2 仅 30% 左右,明显低于 pZM246-Vpu 和 pZM247-Vpu 的 68%和 75%。该研究结果表明,始祖病毒 Vpu 下调BST-2 的能力明显强于慢性感染病毒。
2.2 HIV-1 始祖病毒 Vpu 蛋白下调细胞表面内源性 BST-2 的能力
BST-2 通过细胞内转运系统定位于细胞表面,进而阻止新生 HIV-1 病毒的释放。为了进一步明确始祖病毒 Vpu 拮抗 BST-2 抗病毒活性的能力,我们利用流式细胞术(FACS)研究了其对内源性BST-2 细胞表面水平的影响。结果显示,始祖病毒Vpu 下调细胞表面的 BST-2 均强于慢性感染病毒的 Vpu(图 2),但两者之间的差异并未像对胞内总 BST-2 水平(图 1)影响那么明显。
2.3 HIV-1 始祖病毒下调 BST-2 的能力分析
为了明确在病毒感染情况下,始祖病毒是否具有优于慢性感染病毒的下调 BST-2 的能力,我们利用已构建的含荧光素酶报告基因的单循环感染始祖病毒表达质粒,比较了始祖病毒与同一亚型的慢性感染株 pIndie-C1(Luc) 下调 BST-2 的能力。如图 3 所示,与空质粒对照相比,始祖病毒可下调 BST-2 约 60%,而同一亚型的慢性感染株pIndie-C1(Luc) 表达仅降低 25% 左右的 BST-2。该结果表明始祖病毒可下调 BST-2 的能力明显高于慢性感染株,且与单独表达相应 Vpu 的结果(图 1)十分类似,这也提示始祖病毒较强的下调BST-2 能力源于其 Vpu 的特性。
2.4 HIV-1 始祖病毒拮抗 BST-2 抗病毒活性的能力分析
始祖病毒较强的下调 BST-2 能力提示其对于BST-2 的抑制病毒复制活性具有较好的抗性。如图 4A 所示,低水平表达 BST-2(50 和 100 ng BST-2 质粒)对产毒细胞 HEK293T 中始祖病毒和慢性感染病毒的表达均无明显影响。尽管伴随着HEK293T 细胞中外源 BST-2 表达量的上升,病毒的感染性逐渐下降,但始祖病毒和慢性感染病毒之间并无明显区别(图 4B)。上述结果表明,尽管始祖病毒 Vpu 表现出较强的下调 BST-2 的能力,但仍然不足以拮抗外源过量表达的 BST-2 的抗病毒活性。
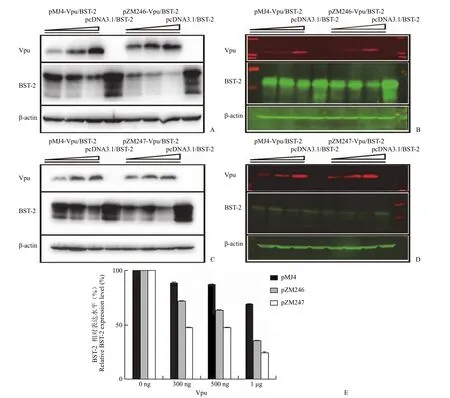
图1 HIV-1 始祖病毒 Vpu 降解 BST-2 活性(A:pZM246-Vpu 细胞蛋白免疫印迹分析;B:pZM246-Vpu细胞蛋白近红外双色激光成像分析;C:pZM247-Vpu 细胞蛋白免疫印迹分析;D:pZM247-Vpu 细胞蛋白近红外双色激光成像分析;E:定量分析结果)Figure 1 Effect of Vpu from HIV-1 founder virus on the levels of BST-2 (A: Western blot analysis of pZM246-Vpu; B: Odyssey analysis of pZM246-Vpu; C: Western blot analysis of pZM247-Vpu; D: Odyssey analysis of pZM247-Vpu; E: Quantification analysis of B and D)
2.5 HIV-1 始祖病毒 Vif 蛋白下调 hA3G 的活性分析
为了考察是否始祖病毒的 Vif 蛋白下调hA3G 的能力与慢性感染病毒不同,我们首先分别以慢性感染病毒 pMJ4、始祖病毒 pZM246 和pZM247 为模板,构建了相应的 Vif 表达质粒pMJ4-Vif、pZM246-Vif 和 pZM247-Vif。然后,分别将不同量的 Vif 表达质粒与 hA3G 表达质粒共转染 293T 细胞,通过 Western blot 检测细胞内hA3G 的水平。结果显示,始祖病毒的 Vif 降解hA3G 的能力弱于慢性感染病毒 pMJ4 或与之类似(图 5)。
2.6 始祖病毒 Vpu 和 MJ4 Vpu 氨基酸序列比对及突变位点分析
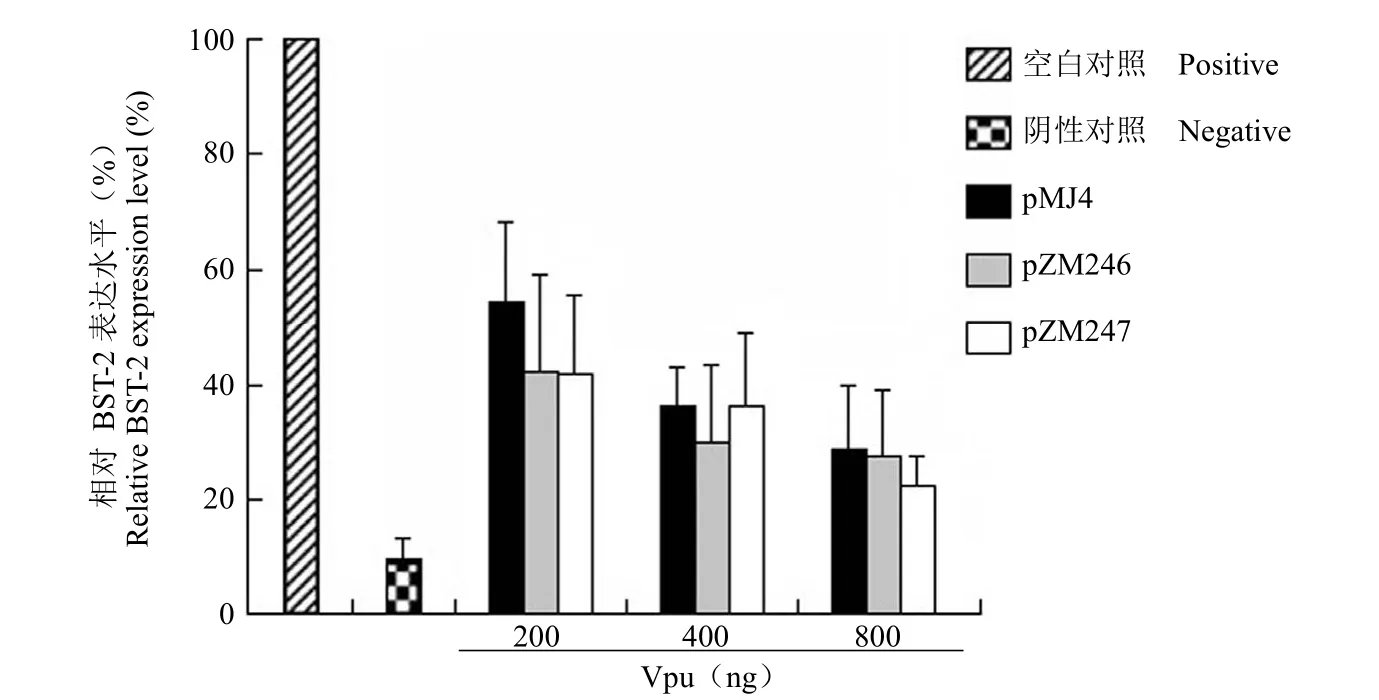
图2 HIV-1 始祖病毒 Vpu 蛋白下调细胞表面内源性 BST-2 的能力Figure 2 Down-regulation effect of Vpu from HIV-1 founder virus on the levels of endogenous BST-2 at cell surface
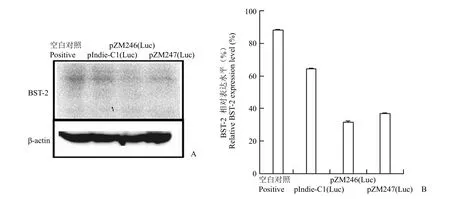
图3 HIV-1 始祖病毒下调 BST-2 的活性(A:细胞蛋白免疫印迹分析;B:定量分析)Figure 3 Effect of HIV-1 founder virus on the level of BST-2 (A: Western blot analysis of cellular protein; B: Quantification analysis of Western blot)
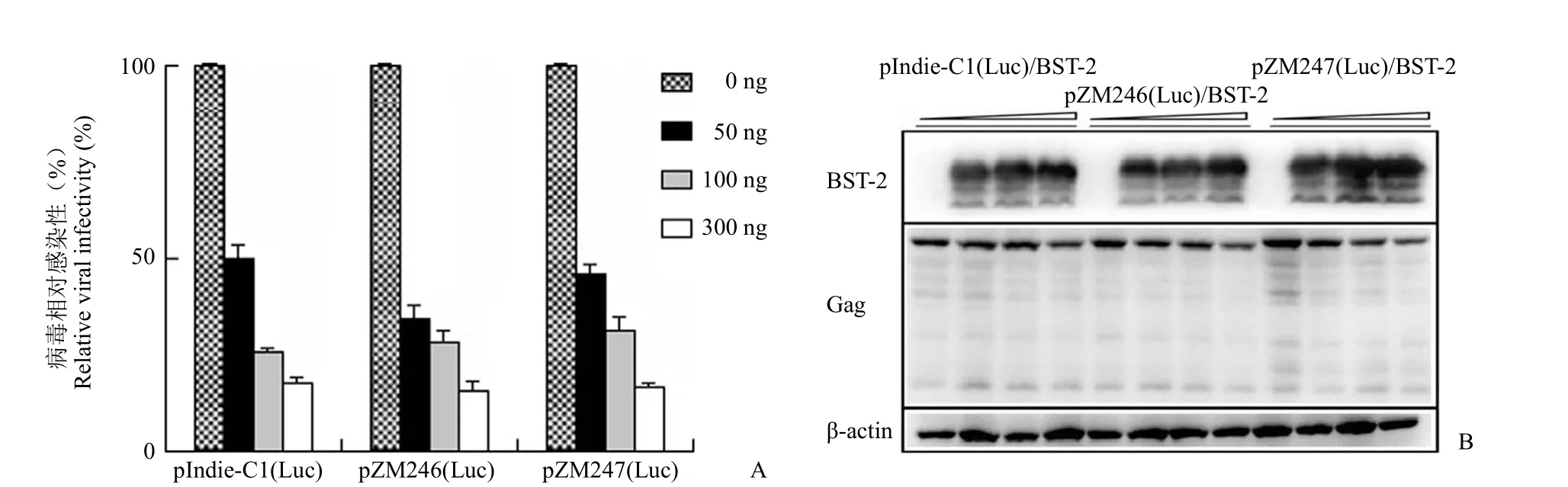
图4 HIV-1 始祖病毒对 BST-2 的抗性(A:产出病毒感染性分析;B:病毒产生细胞的免疫印迹分析)Figure 4 The resistance of HIV-1 founder virus to antivial activity of BST-2 (A: The infectivity of viruses; B: Western blot analysis of virion-producing cell lysate)
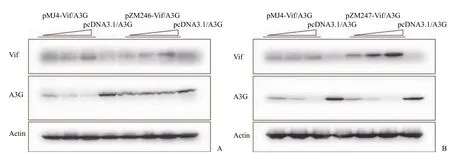
图5 始祖病毒 Vif 对细胞内 hA3G 的影响(A:pZM246;B:pZM247)Figure 5 Effect of Vif from founder virus on the level of hA3G (A: pZM246; B: pZM247)
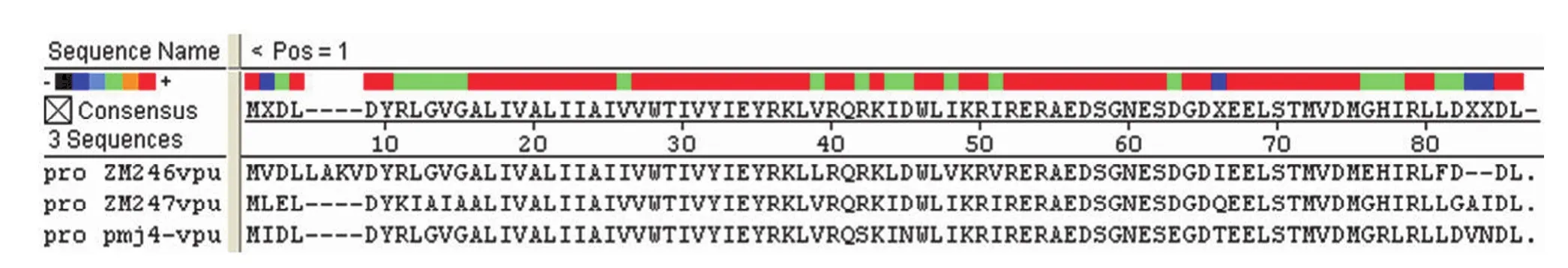
图6 始祖病毒 Vpu 和 MJ4 Vpu 氨基酸序列比对及突变位点分析Figure 6 The amino acid sequence alignments between founder virus Vpu and pMJ4 Vpu
对始祖病毒和慢性感染病毒 MJ4 Vpu 氨基酸序列进行比对,结果(图 6)显示,始祖病毒 ZM246毒株的 Vpu 与 MJ4 的 Vpu 氨基酸相似度为78.2%,共发现 L5M、A6I、K7D、V8L、I26V、L39V、R42S、L44I、D45N、V48I、V51I、D63E、66T、E76G、H77R、I78L、F81L 共 17 个点突变;而 ZM247 毒株的 Vpu 与 MJ4 的 Vpu 氨基酸相似度为 80.5%,其中包括 L2I、E3D、K7R、I8L、A9G、I10V、A11G、R38S、D41N、D59E、Q62T、H73R、I74L、G78D、A79V、I80N 共计 16 个点突变。对于影响 Vpu 与 BST-2 相互作用的一些关键位点,始祖病毒 Vpu 蛋白的一些关键氨基酸也存在相应的点突变,但具体的发生机制还有待进一步阐明。
3 讨论
本研究对 C 亚型 HIV-1 始祖病毒株和慢性感染株 MJ4 的 Vpu 降解 BST-2 及 Vif 下调hA3G 的能力进行比较,发现始祖病毒 Vpu 下调BST-2 的能力显著高于慢性感染株,但其 Vif 下调hA3G 的能力并无显著差别。这一结果提示始祖病毒有可能通过早期进化,提升其拮抗 BST-2 抗病毒活性的能力,促进 HIV-1 早期建立感染。尽管始祖病毒 Vpu 表现出较强的下调 BST-2 的能力,但在外源过量表达 BST-2 时,未表现出明显的生长优势,说明其提升的下调 BST-2 的能力仍不足以拮抗过量的 BST-2。考虑到内源性 BST-2 水平远低于过表达,始祖病毒可能在正常生理水平的BST-2 下具有复制优势。
本研究推动了始祖病毒的早期进化和生物学特征的研究,有助于进一步阐明 HIV-1在新宿主内成功复制的关键环节,为有效阻断新感染的防治策略发展提供了理论基础。
[1]Barré-Sinoussi F, Chermann JC, Rey F, et al.Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS).1983.Rev Invest Clin, 2004, 56(2):126-129.
[2]Malim MH, Emerman M.HIV-1 accessory proteins--ensuring viral survival in a hostile environment.Cell Host Microbe, 2008, 3(6):388-398.
[3]Kupzig S, Korolchuk V, Rollason R, et al.Bst-2/HM1.24 is a raft-associated apical membrane protein with an unusual topology.Traffic, 2003, 4(10):694-709.
[4]Ohtomo T, Sugamata Y, Ozaki Y, et al.Molecular cloning and characterization of a surface antigen preferentially overexpressed on multiple myeloma cells.Biochem Biophys Res Commun, 1999,258(3):583-591.
[5]Neil SJ, Zang T, Bieniasz PD.Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu.Nature, 2008, 451(7177):425-430.
[6]Keele BF.Identifying and characterizing recently transmitted viruses.Curr Opin HIV AIDS, 2010, 5(4):327-334.
[7]Sagar M, Laeyendecker O, Lee S, et al.Selection of HIV variants with signature genotypic characteristics during heterosexual transmission.J Infect Dis, 2009, 199(4):580-589.
[8]Salazar-Gonzalez JF, Bailes E, Pham KT, et al.Deciphering human immunodeficiency virus type 1 transmission and early envelope diversification by single-genome amplification and sequencing.J Virol, 2008, 82(8):3952-3970.
Abilities of HIV-1 founder virus Vpu and Vif to counteract host restriction factor
HUANG Yu-ming, ZHAO Jian-yuan, CEN Shan, WEI Tao
ObjectiveTo study the biology and early evolutionary characteristics of founder virus for better understanding of the key factors involved in establishment of new infection.
MethodsWith the methods of over-expression, we compared the ability of Vpu protein from transimitted/founder (T/F) virus and chronic strain to counteract host restriction factors BST-2 and the effect on endogenous BST-2 on the cell surface by flow cytometer.Using the constructed single-cycle infectious virus within luciferase reporter gene, we compared the ability of down-regulation of BST-2 in T/F virus and chronic virus.The ability of the Vif protein to antagonize the host restriction factor hA3G was also examined by overexpression.
ResultsThe results showed that Vpu of T/F virus exhibited significantly improved ability to reduce the level of BST-2, as compared with that of chronic strain, while no difference in the Vif-mediated hA3G degradation was observed.
ConclusionT/F virus may possess better ability to counteract with host innate immunity to facilitate the establishment of new infection.
vpu gene products, human immunodeficiency virus; vif gene products, human immunodeficiency virus; HIV-1 founder virus
WEI Tao, Email: weitao@buu.edu.cn
10.3969/j.issn.1673-713X.2017.04.003
国家自然科学基金(31470076、31470272);国家重大科学研究计划(2012CB911102)
100015 北京,首都医科大学附属北京地坛医院(黄宇明);100050 北京,中国医学科学院北京协和医学院医药生物技术研究所(赵建元、岑山);100192 北京联合大学生物化学工程学院(魏涛)
魏涛,Email:weitao@buu.edu.cn
2017-04-17
*同为第一作者
Author Affiliations:Beijing Ditan Hospital, Capital Medical University, Beijing 100015, China (HUANG Yu-ming); Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China (ZHAO Jian-yuan, CEN Shan); College of Biochemical Engineering of Beijing Union University, Beijing 100192, China (WEI Tao)
www.cmbp.net.cn Chin Med Biotechnol, 2017, 12(4):303-309
协会第五届第六次常务理事会在京召开2017年 6月 28日,中国医药生物技术协会第五届第六次常务理事会在北京召开。李少丽副理事长主持会议,吴朝晖秘书长做 2017年上半年工作汇报。会议主要内容还有:①通过了新分支机构——慢病社区与家庭管理技术专业委员会的设立申请;②审定了章程修订案和第五届第二次全国委员代表大会召开方案;③审定了协会车辆置换申请和新申请入会单位名单;④听取了第八届中国医药生物技术论坛筹备情况汇报等。
