质粒介导的摩氏摩根菌KL-225对氨基糖苷类和氟喹诺酮类抗生素的耐药
2017-08-22黄树超郝雪秦关艳邓琪韩江雪肖春玲刘忆霜
黄树超,郝雪秦,关艳,邓琪,韩江雪,肖春玲,刘忆霜
质粒介导的摩氏摩根菌KL-225对氨基糖苷类和氟喹诺酮类抗生素的耐药
黄树超,郝雪秦,关艳,邓琪,韩江雪,肖春玲,刘忆霜
目的研究摩氏摩根菌 KL-225 的超广谱耐药机制,为新型抗菌药物的研发奠定基础。
方法提取纯化摩氏摩根菌 KL-225 的 pKL2683 和pKL5933 质粒,并进行序列测定,将测序结果进行生物信息学分析找到其可能的耐药基因,再通过将质粒转化入摩氏摩根标准菌株和大肠杆菌,对耐药基因进行验证。
结果pKL2683 质粒携带的qnrD基因导致氟喹诺酮类抗生素对 KL-225 的 MIC 升高;pKL5933 质粒携带的aac(6′)-Ib-cr4 基因导致 KL-225 对氨基糖苷类和氟喹诺酮类抗生素的 MIC 升高。
结论摩氏摩根菌 KL-225 对氨基糖苷类抗生素的耐药主要来源于 pKL5933 质粒上携带的aac(6′)-Ib-cr4 基因;pKL2683 质粒携带的qnrD基因和 pKL5933 质粒携带的aac(6′)-Ib-cr4 基因导致 KL-225 对氟喹诺酮类抗生素敏感性降低。
摩氏摩根菌; 质粒; 氟喹诺酮类耐药; 氨基糖苷类耐药
www.cmbp.net.cn 中国医药生物技术, 2017, 12(4):317-324
细菌耐药问题是 21 世纪最严重的公共健康问题之一,具有复杂耐药机制的革兰阴性(G-)菌耐药问题尤为突出,以表达新德里金属 β-内酰胺酶-1(NDM-1)[1]为特征的“超级细菌”的出现使细菌耐药问题成为了全社会关注的热点。摩氏摩根菌(M.morganii)KL-225 是从病死鲍鱼体内分离得到的“超广谱”、高水平耐药的 G-菌,其对β-内酰胺类(I、II 代固有耐药)、氨基糖苷类、四环素类(固有耐药)、氟喹诺酮类、叶酸抑制剂、氯霉素类、磷霉素类、大环内酯类(非抗阴性菌药物)、林可酰胺类(非抗阴性菌药物)、多肽类等众多抗菌药物的耐药性均有显著提高,且对青霉素、替卡西林、头孢噻吩、环丙沙星、磺胺甲噁唑、甲氧苄啶、氯霉素、磷霉素等抗菌药物表现出高水平耐药[2]。菌株M.morganiiKL-225 的耐药谱已超过了通常意义的多药耐药,因此可称之为“超级”耐药菌,推测该菌株具有多种耐药机制。深入研究和阐明M.morganiiKL-225 的超广谱耐药机制,评价以此菌株作为模式菌株的可行性,对于筛选和研制新型抗菌药物具有重要意义。
在提取 KL-225 基因组的过程中,发现KL-225 携带了多个质粒,推测这些质粒的存在可能与其耐药性有关。因此,我们率先从提取其携带的质粒入手,研究 KL-225 的耐药机制。
1 材料与方法
1.1 材料
1.1.1 菌株M.morganiiKL-225 由福建水产研究所从病死鲍鱼体内分离和保存,中国微生物菌种保藏管理委员会普通微生物中心(CGMCC)保藏,编号 CGMCC3655,保藏日期 2010年 3月10日。M.morganii标准菌株 ATCC25830 购自美国标准生物品收藏中心(ATCC)。
1.1.2 培养基 MH 固体培养基:牛肉浸粉 6 g、可溶性淀粉 1.5 g、酸水解酪蛋白胨 17.5 g、琼脂13 g,pH(7.4 ± 0.2),定容至 1000 ml;MH 肉汤培养基:牛肉浸粉 6 g、可溶性淀粉 1.5 g、酸水解酪蛋白胨 17.5 g、pH(7.4 ± 0.1),定容至 1000 ml;LB 液体培养基:胰蛋白胨 10 g、酵母提取物 5 g、氯化钠 10 g,pH 7.4,定容至 1000 ml。
1.1.3 试剂 所有抗菌药物购于中国食品药品检定研究院;T 载体(T-Vector PMD19 Simple)试剂盒购于日本 Takara 公司;感受态细胞E.coliDH5α购于北京全式金生物有限公司;DNA 超螺旋marker 购于日本 Takara 公司和美国 NEB 公司;质粒提取试剂盒、胶回收试剂盒购于德国 Qiagen公司。
1.1.4 器材及仪器 超净工作台 BCM-1000A 为江苏苏净公司产品;高压灭菌锅 mlS-3750 和超低温冰箱 MDF-U32865 为日本 Sanyo 公司产品;高速微量台式离心机 Legend Micro 17、紫外分光光度仪 Biomate 3S 和高速冷冻离心机 Legend Mach 1.6R 为美国 Thermo 公司产品;DNAEngine PCR 仪、BASIC 电泳仪、MicroPulser 电击转化仪和 XR+凝胶成像仪为美国 Bio-Rad 公司产品;WD-9403D 型紫外仪和 WD-2101 型电泳系统为北京六一仪器厂产品;DHP-420 型电热恒温培养箱为北京市永光明医疗仪器厂产品;Innova 43 温控摇床为美国 New Brunswich 公司产品。
1.2 方法
1.2.1 细菌培养 挑取M.morganiiKL-225 单菌落接种在 LB 液体培养基中,37 ℃、200 r/min 条件下培养至对数生长期(OD600≈ 0.6)。
1.2.2 质粒提取与纯化 用质粒提取试剂盒提取M.morganiiKL-225 质粒,并用胶回收试剂盒纯化pKL2683 和 pKL5933。
1.2.3 测序 通过限制性内切酶Sau3AI 将质粒消化为小片段,并随机克隆测序,以测出序列为模板设计引物,双方向扩增质粒,将扩增产物连接到T 载体中进行测序。
1.2.4 生物信息学分析 利用 BLAST(http://blast.ncbi.nlm.nih.gov/)和 ORF Finde(rhttps://www.ncbi.nlm.nih.gov/orffinder/)对测序结果进行生物信息学分析。
1.2.5 测定固体平板上卡那霉素和环丙沙星对M.morganii标准菌株的 MIC 将抗菌药物配制成浓度为 25.6 mg/ml 的母液,然后将配制好的 20 ml MH 琼脂培养基在微波炉中加热至完全溶解,待凉至约 45 ℃(保持液态);分别加入 200、100、50、25、12.5、6.25 μl 浓度为 25.6 mg/ml 的抗菌药物至 20 ml 仍保持液态的 MH 琼脂培养基中,充分混匀,制成浓度为 256、128、64、32、16、8 μg/ml的含有抗菌药物的 MH 琼脂培养基,分别倒入培养皿中冷却凝固,约 20 ml/培养皿。实验结果表明,在固体平板上,卡那霉素对M.morganii标准菌株的 MIC 为 32 μg/ml;环丙沙星对M.morganii标准菌株的 MIC 为 0.0625 μg/ml。
1.2.6 电击转化 用M.morganii标准菌株制作感受态细胞,将 pKL2683 和 pKL5933 电击转入M.morganii标准菌株,转化菌株分别命名为M.m(pKL2683) 和M.m(pKL5933),分别用含有环丙沙星(0.125 μg/ml)和卡那霉素(64 μg/ml)的 MH 琼脂培养基进行筛选,在 37 ℃ 恒温培养箱中培养 24 h;观察细菌生长情况,有菌落生长的判为阳性转化菌。
1.2.7 阳性转化菌验证 用质粒提取试剂盒提取M.m(pKL2683) 和M.m(pKL5933) 的质粒。
1.2.8 在E.coli中验证耐药基因 分别从pKL2683 的qnrD基因内部和qnrD基因以外的位置扩增 pKL2683,保证qnrD基因的断裂与完整(图 1 和图 2),并连接到 T 载体上转化入E.coli,从qnrD基因内部克隆的转化菌株命名为E.coli(T-pKL2683*),从qnrD基因外部克隆的转化菌株命名为E.coli(T-pKL2683);分别从 pKL5933的aac(6′)-Ib-cr4 基因内部和aac(6′)-Ib-cr4 基因以外的位置扩增 pKL5933,保证aac(6′)-Ib-cr4 基因的断裂与完整(图 3 和图 4),并连接到 T 载体上转化入E.coli,从aac(6′)-Ib-cr4 基因内部克隆的转化菌株命名为E.coli(T-pKL5933*),从aac(6′)-Ib-cr4 基因外部克隆的转化菌株命名为E.coli(T-pKL5933)。
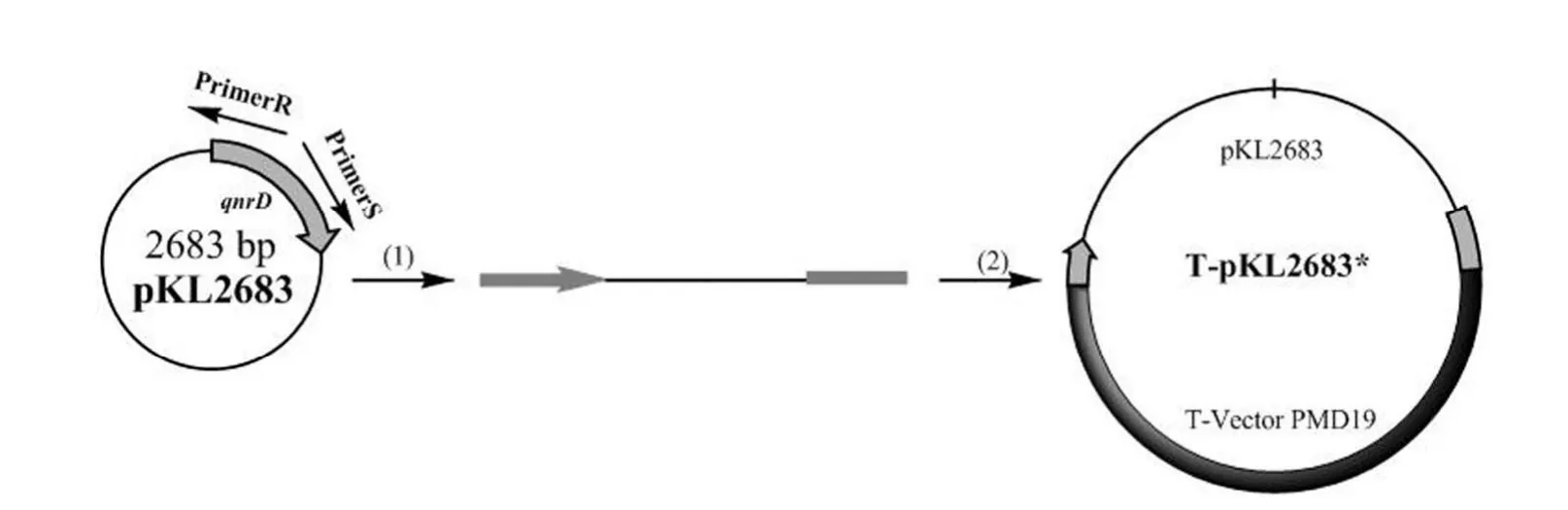
图1 从qnrD基因内部扩增 pKL2683 并连接到 T 载体上Figure 1 pKL2683 was amplified fromqnrDgene and connected to the T-Vector PMD19
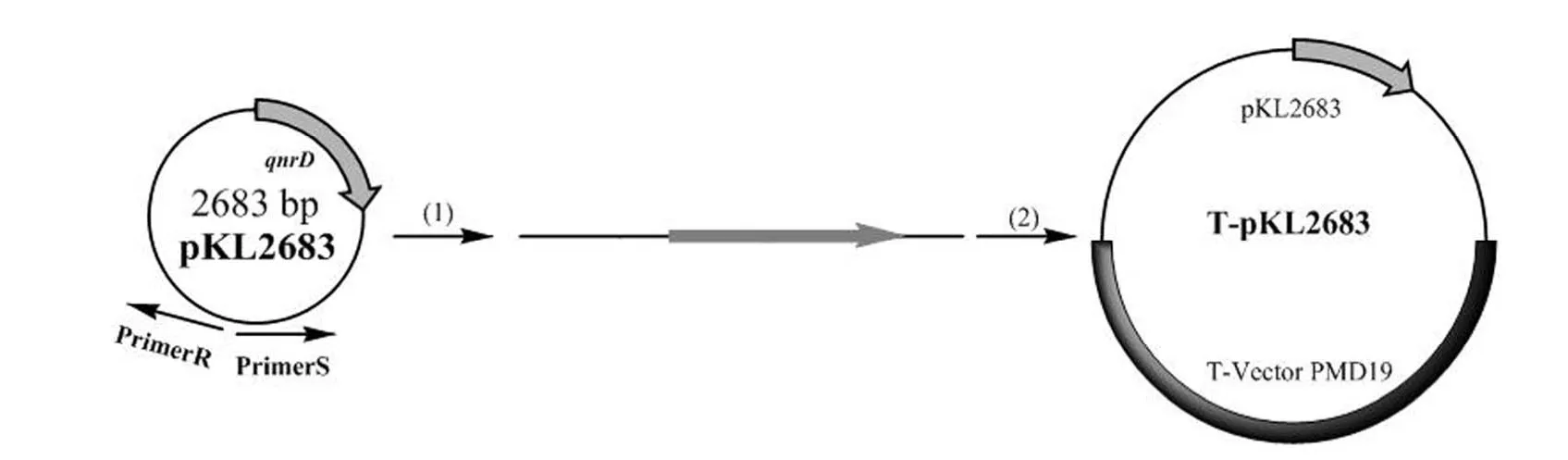
图2 从 qnrD 基因以外的位置扩增 pKL2683 并连接到 T 载体上Figure 2 pKL2683 was amplified from the position outside of the qnrD gene and connected to the T-Vector PMD19
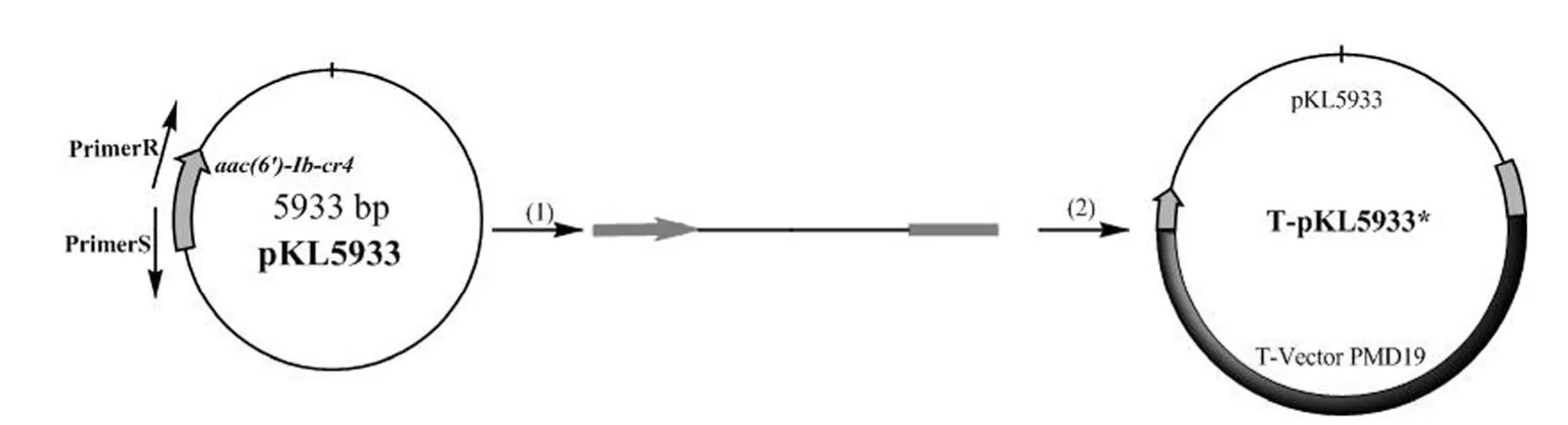
图3 从 aac(6′)-Ib-cr4 基因内部扩增 pKL5933 并连接到 T 载体上Figure 3 pKL5933 was amplified from aac(6′)-Ib-cr4 gene and connected to the T-Vector PMD19
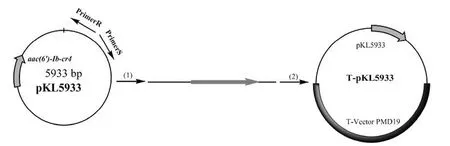
图4 从 aac(6′)-Ib-cr4 基因以外的位置扩增 pKL5933 并连接到 T 载体上Figure 4 pKL5933 was amplified from the position outside of the aac(6′)-Ib-cr4 gene and connected to the T-Vector PMD19
1.2.9 微孔法测定各种抗菌药物对各转化菌株和M.morganii标准菌株的 MIC 将 96 孔板、U 型槽等在紫外灯下照射 30 min 灭菌;将菌株的培养液用新鲜的 MH 液体培养基稀释,使其终浓度约为 1.5 × 105cfu/ml;用排式微量移液器将新鲜培养的菌液加入到 96 孔板中,第 1 排 198 μl,2~12 排每孔 100 μl;于第 1 排每孔加入浓度为25.6 mg/ml 的抗菌药物 2 μl 混匀,使混合液中药物浓度为 256 μg/ml;从第 1 排吸取 100 μl 液体加入到第 2 排中混匀,使混合液中药物浓度为128 μg/ml;2~12 排按上述步骤方法,使抗菌药物浓度依次 2 倍递减,第 12 排浓度为 0.125 μg/ml(环丙沙星第 1 排的浓度为 64 μg/ml,第 12 排浓度为 0.3125 μg/ml);将 96 孔板放置在 37 ℃恒温培养箱中培养 18 h;观察结果,以细菌生长完全受抑制的最小浓度记为最低抑菌浓度(MIC 值)。
2 结果
2.1 M.morganii KL-225 质粒电泳图
由图 5 可知,M.morganiiKL-225 含有 5 个质粒。
2.2 生物信息学分析结果
pKL2683 大小为 2683 bp,G+C 含量 41.8%,携带氟喹诺酮类耐药基因qnrD以及 3个功能未知的 ORF 区(图 6);pKL5933 大小 5933 bp,G+C 含量 51.0%,携带氨基糖苷 N(6')-乙酰转移酶基因aac(6′)-Ib-cr4。pKL5933 与最早报道的鼠伤寒沙门菌 DT104B 携带的 pMdT1 质粒[3]一致性为 99.85%,与 pMdT1 相比,pKL5933 在aac(6′)-Ib-cr4 基因区域以外有 9 个碱基变化(图 7)。
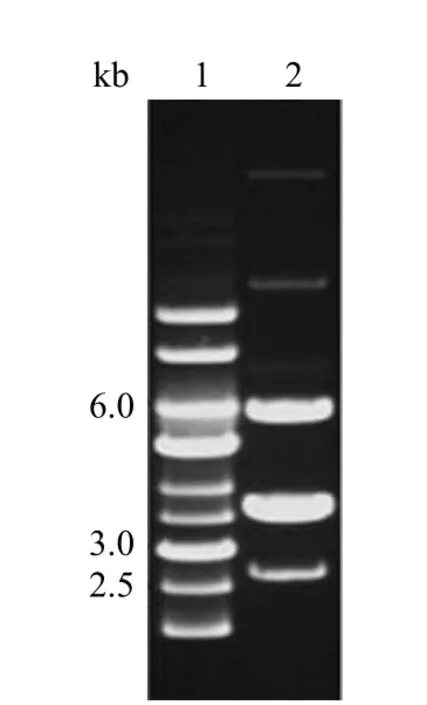
图5 M.morganiiKL-225 质粒电泳图Figure 5 M.morganiiKL-225 plasmids profile
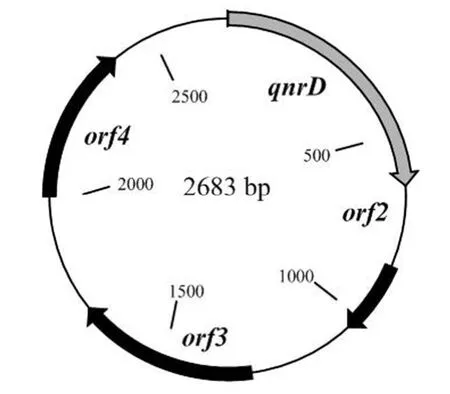
图6 pKL2683 质粒图谱Figure 6 pKL2683 plasmid profile
2.3 pKL2683 和 pKL5933 转化菌验证
如图 8 可知,质粒 DNA 在 marker 指示下DNA 大小在 2~3 kb 之间并接近 3 kb,符合实验设计,测序后确定 pKL2683 已经成功转入M.morganii标准菌株中。
如图 9 可知,质粒 DNA 在 marker 指示下约为 6 kb,符合实验设计,测序后确定 pKL5933已经成功转入M.morganii标准菌株中。
2.4 测定多种类型抗菌药物对各种转化菌和标准菌的 MIC 值
比较各种抗菌药物的耐药性差异,结果如表 1~ 4。在测定细菌 MIC 时,2 倍之内的 MIC 值差异在误差范围之内。在比较药物对两种细菌的 MIC差异时,4 倍以上的差异判定为耐药性显著改变。
与M.morganii标准菌株相比,氟喹诺酮类的环丙沙星对M.m(pKL2683) 的 MIC 值有显著提高,说明 pKL2683 导致M.morganiiKL-225 对氟喹诺酮类抗生素的敏感性降低(表 1)。
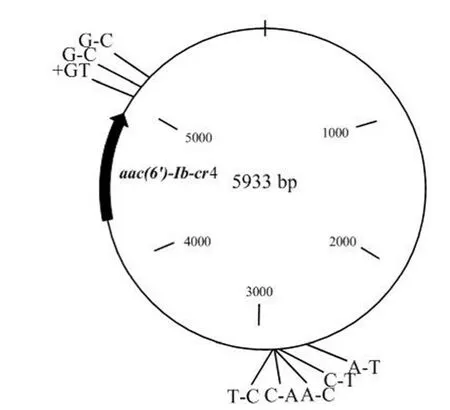
图7 pKL5933 质粒图谱Figure 7 pKL5933 plasmid profile
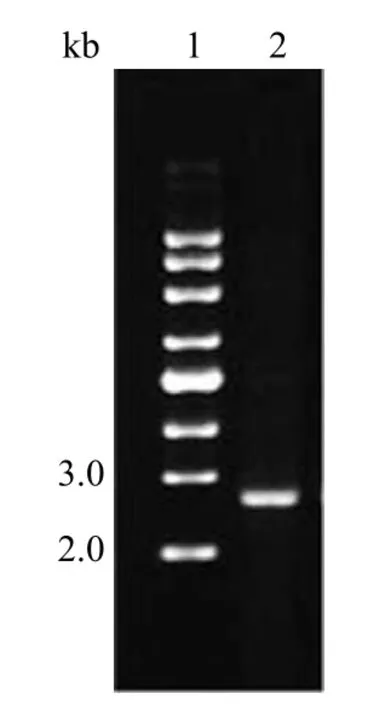
图8 pKL2683 转化菌验证电泳图Figure 8 Validation of pKL2683 transformants
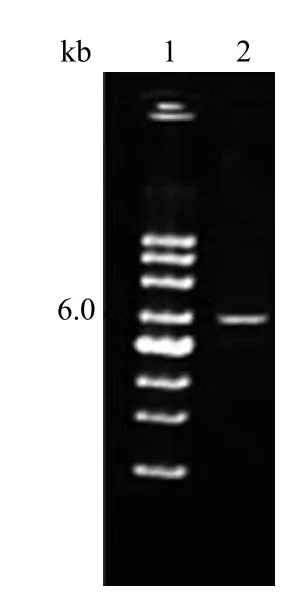
图9 pKL5933 转化菌验证电泳图Figure 9 Validation of pKL5933 transformants
与M.morganii标准菌株相比,氟喹诺酮类的环丙沙星和氨基糖苷类的卡那霉素与阿米卡星对M.m(pKL5933) 的 MIC 值有显著提高,说明pKL5933 导致M.morganiiKL-225 对氨基糖苷类抗生素耐药并对氟喹诺酮类抗生素的敏感性降低(表 2)。
由表 3 可知,与E.coli(T-pKL2683*) 相比,环丙沙星对E.coli(T-pKL2683) 的 MIC 有显著提高,而其他类型抗生素的 MIC 没有变化,说明pKL2683 携带的qnrD基因导致M.morganiiKL-225 对喹诺酮类抗生素的敏感性降低。
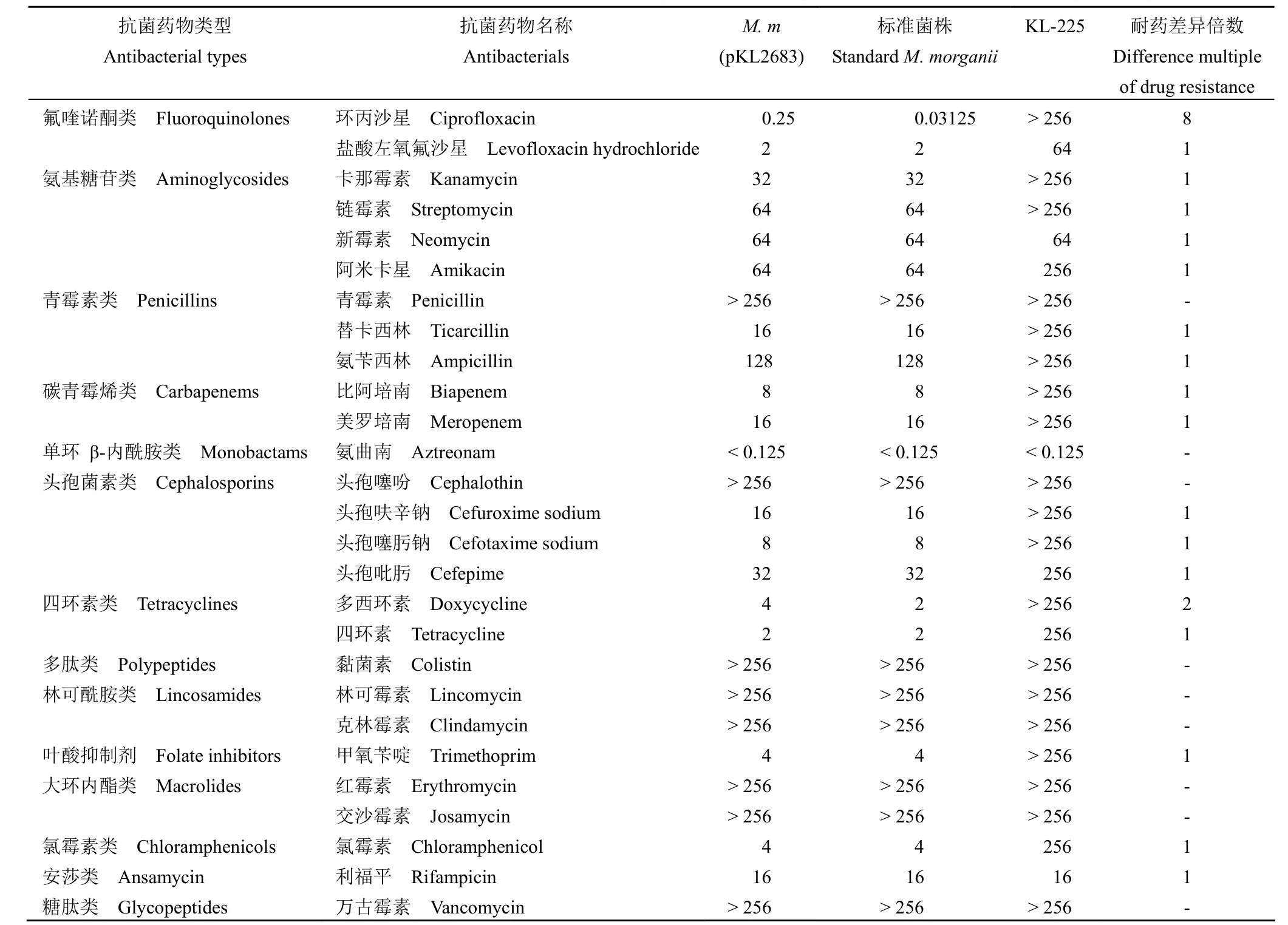
表1 各种抗菌药物对 M.m (pKL2683) 和 M.morganii 标准菌株的 MIC(μg/ml)Table 1 MIC of the M .m (pKL2683) and standard M.morganii bacteria against various antimicrobial agents (μg/ml)
由表 4 可知,与E.coli(T-pKL5933*) 相比,卡那霉素对E.coli(T-pKL5933) 的 MIC提高了32 倍以上,而其他类型抗生素的 MIC 没有变化,说明 pKL5933 携带的aac(6′)-Ib-cr4 基因导致M.morganiiKL-225 对氨基糖苷类抗生素的耐药。
3 讨论
细菌对抗生素的耐药性日益严重,由细菌耐药引起的死亡人数在逐年增加[4]。然而与细菌耐药性不断出现相对的是新型抗菌药物的匮乏[5-7]。M.morganiiKL-225 是超广谱耐药菌,以此作为抗菌药物筛选的模式菌株,可以排除被其耐药的已知类型抗菌活性化合物,从而增加了获得新结构、新机制的抗 G-耐药菌药物的可能性。本研究旨在通过耐药机制的研究,阐明 KL-225 作为模式菌株的可行性。
本阶段对其携带的 2 个质粒进行了深入研究,明确了这 2 个质粒携带的耐药基因,并通过实验证明了 pKL2683 质粒携带的qnrD基因和 pKL5933 质粒携带的aac(6′)-Ib-cr4 基因与M.morganiiKL-225 对于氨基糖苷类和氟喹诺酮类抗生素的耐药密切相关。值得注意的是,质粒pKL2683 与在奇异变形杆菌中发现的质粒pM510[8]高度同源(在qnrD基因以外的位置仅有1 个碱基差异),一致性为 99.99%;其他肠杆菌科中也存在着与 pKL2683 高度同源的质粒,如雷氏普罗威登斯菌携带的两个质粒 pDIJ09-518a 和pGHS09-09a[9],与 pKL2683 的一致性分别为99.85%(在qnrD基因以外的位置有 4 个碱基差异)和 99.78%(在qnrD基因以外的位置有 6 个碱基差异)。这些质粒可能来源于同一亲本菌株,是原质粒在菌株间穿梭的过程中形成的不同的变体。在其他肠杆菌科中也存在着与 pKL5933 高度同源的质粒,如:鼠伤寒沙门菌 DT104B 携带的pMdT1[3]质粒与 pKL5933 的一致性为 99.85%(在aac(6′)-Ib-cr4 基因以外的位置有 9 个碱基差异),pMdT1 宿主菌株对氨基糖苷类和氟喹诺酮类抗生素的耐药性与 pKL5933 转化菌一致;在阴沟肠杆菌 CY01 中也发现了与 pKL5933 的一致性为99.93%(在aac(6′)-Ib-cr4 基因内部有 4 个碱基差异)的质粒 pCY-MdT[10]。说明该质粒能在不同的肠杆菌科细菌中穿梭并传播耐药性,除了肠杆菌科细菌外,此类型的质粒能否在其他类型细菌中复制和穿梭,有待进一步的实验证明。
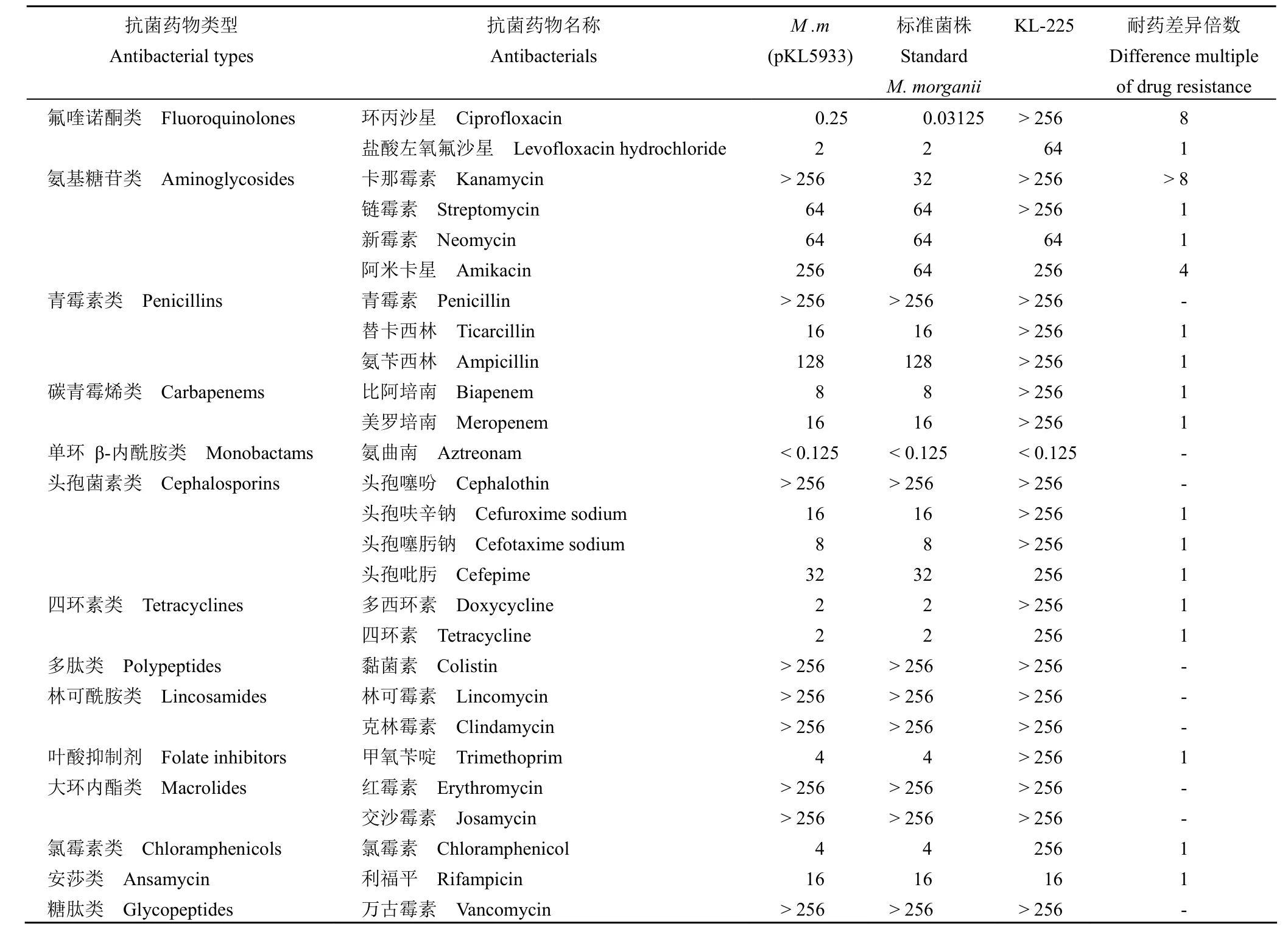
表2 各种抗菌药物对M.m(pKL5933) 和M.morganii标准菌株的 MIC(μg/ml)Table 2 MIC of theM.m(pKL5933) and standardM.morganiibacteria against various antimicrobial agents (μg/ml)
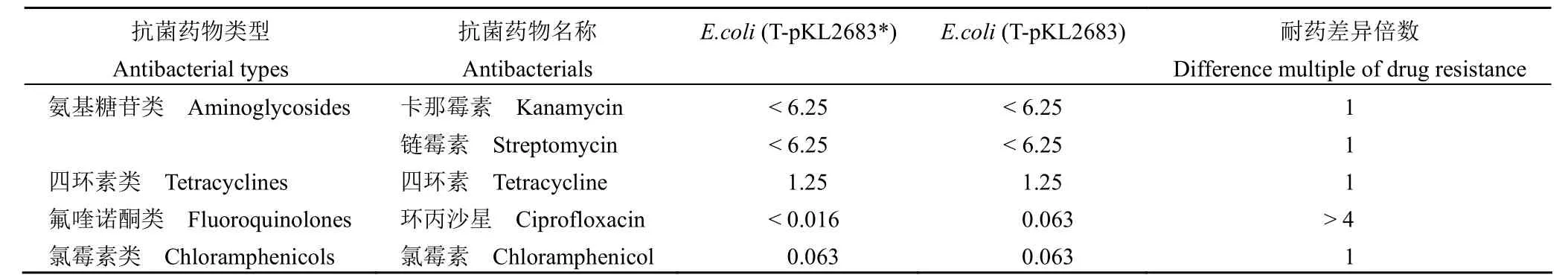
表3 各种抗菌药物对E.coli(T-pKL2683*) 和E.coli(T-pKL2683) 的 MIC(μg/ml)Table 3 MIC of theE.coli(T-pKL2683*) andE.coli(T-pKL2683) against various antimicrobial agents (μg/ml)
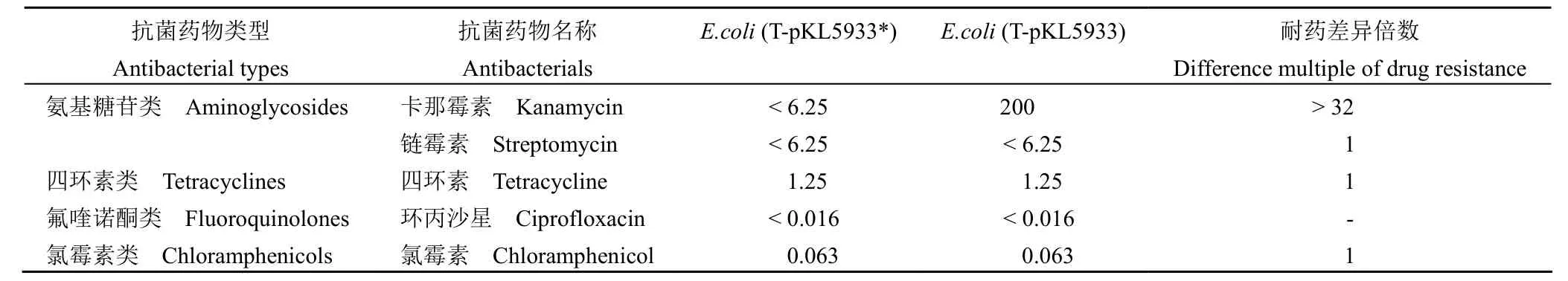
表4 各种抗菌药物对E.coli(T-pKL5933*) 和E.coli(T-pKL5933) 的 MIC(μg/ml)Table 4 MIC of theE.coli(T-pKL5933*) andE.coli(T-pKL5933) against various antimicrobial agents (μg/ml)
本研究仅仅阐明了 2 个质粒介导了M.morganiiKL-225 对氨基糖苷类和氟喹诺酮类抗生素的耐药,而M.morganiiKL-225 具有超广谱的耐药性,表明了在M.morganiiKL-225 基因组和其余质粒中可能还存在着其他的耐药机制。在后续研究中通过对M.morganiiKL-225 和M.morganii标准菌株 ATCC25830 基因组序列进行比对,对差异序列进行生物信息学分析,推测可能耐药相关基因并在E.coli和M.morganii标准菌株中克隆表达来验证其耐药相关性。对于M.morganiiKL-225其余质粒的研究,较小质粒的测序方法同 pKL2683和 pKL5933 质粒,较大的质粒需要对其进行高通量测序,将测序结果进行生物信息学分析找到其可能的耐药相关基因,通过本研究类似方法来验证其耐药相关性。通过这些研究对M.morganiiKL-225的耐药机制展开深入研究,阐明其复杂的耐药机制。
另一方面,以M.morganiiKL-225 为模式菌株进行筛选,可提高新结构、新机制抗菌活性化合物的筛选效率。因此在对M.morganiiKL-225 的耐药机制加以阐明之后,以M.morganiiKL-225 为模式菌株构建抗多药耐药 G-菌药物筛选模型,筛选出对M.morganiiKL-225 具有良好抑菌活性,且不被M.morganiiKL-225 耐药(对M.morganiiKL-225与M.morganii标准菌株 ATCC25830 活性无显著差异)的化合物,通过成药性研究,可能从中获得具有良好成药前景的新型抗多药耐药 G-菌候选药物;同时,利用诱导耐药突变、蛋白质组芯片等方法对这些候选药物进行作用靶标的研究,将获得全新的抗 G-菌药物靶标,为具有全新机制的抗G-菌药物的研发奠定基础。
[1]Kumarasamy KK, Toleman MA, Walsh TR, et al.Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK: a molecular, biological, and epidemiological study.Lancet Infect Dis,2010, 10(9):597-602.
[2]Liu YS, Hao XQ, Guan Y, et al.The establishment and application of the screening model of the "XDR" Morganella morganii as a model strain.Chin J Antibiot, 2015, 40(11):801-807.(in Chinese)
刘忆霜, 郝雪秦, 关艳, 等.以“广谱耐药”的摩氏摩根菌为模式菌株的筛选模型的建立及应用.中国抗生素杂志, 2015, 40(11):801-807.
[3]de Toro M, Rodríguez I, Rojo-Bezares B, et al.pMdT1, a small ColE1-like plasmid mobilizing a new variant of the aac(6')-Ib-cr gene in Salmonella enterica serovar Typhimurium.J Antimicrob Chemother,2013, 68(6):1277-1280.
[4]World Health Organization.WHO's first global report on antibiotic resistance reveals serious, worldwide threat to public health.World Health Organization, 2014 (2014-04-30) [2017-4-27].http://www.who.int/mediacentre/news/releases/2014/amr-report/en/.
[5]Freire-Moran L, Aronsson B, Manz C, et al.Critical shortage of new antibiotics in development against multidrug-resistant bacteria-Time to react is now.Drug Resist Updat, 2011, 14(2):118-124.
[6]Fernebro J.Fighting bacterial infections-future treatment options.Drug Resist Updat, 2011, 14(2):125-139.
[7]Vergidis PI, Falagas ME.Multidrug-resistant Gram-negative bacterial infections: the emerging threat and potential novel treatment options.Curr Opin Investig Drugs, 2008, 9(2):176-183.
[8]Wei T, Miyanaga K, Tanji Y.Persistence of antibiotic-resistant and-sensitive Proteus mirabilis strains in the digestive tract of the housefly (Musca domestica) and green bottle flies (Calliphoridae).Appl Microbiol Biotechnol, 2014, 98(19):8357-8366.
[9]Guillard T, Cambau E, Neuwirth C, et al.Description of a 2,683-base-pair plasmid containing qnrD in two Providencia rettgeri isolates.Antimicrob Agents Chemother, 2012, 56(1):565-568.
[10]Yang L, Wu AW, Su DH, et al.resistome analysis of Enterobacter cloacae CY01, an extensively drug-resistant strain producing VIM-1 metallo-β-lactamase from China.Antimicrob Agents Chemother, 2014,58(10):6328-6330.
www.cmbp.net.cn Chin Med Biotechnol, 2017, 12(4):317-324
第十届中国生物产业大会在广州开幕
7月 3日,第十届中国生物产业大会在广州开幕,此次大会主题为“促进生物产业新发展,培育生物经济新动能”,来自全球百位顶尖专家在高层论坛和 16 个专业分论坛上针对各自细分领域进行专业探讨。中央政治局委员、广东省委书记胡春华同志出席了开幕式。
其中,由我会主办、多赢时代转化医学研究院协办的“再生医学与健康产业高峰论坛”在白云国际会议中心 4 号楼一楼清远厅举办。本次论坛邀请到日本再生医学论坛(FIRM 协会)和国内有关专家就“再生医学与健康产业”等专业问题进行了深入交流。协会李少丽副理事长和吴朝晖秘书长出席会议。
Plasmids-mediated aminoglycosides resistance and fluoroquinolones resistance in Morganella morganii KL-225
HUANG Shu-chao, HAO Xue-qin, GUAN Yan, DENG Qi, HAN Jiang-xue, XIAO Chun-ling, LIU Yi-shuang
ObjectiveTo study the mechanisms of broad-spectrum resistance inM.morganiiKL-225 and lay foundation for the development of novel antibacterial drugs.
MethodspKL2683 and pKL5933 inM.morganiiKL-225 were extracted and purified, then sequenced.Bioinformatics analysis was performed on the sequencing results to find out possible resistance-related genes.The plasmids were transferred into theM.morganiistandard strains and resistance genes were expressed inEscherichia colifor verification.
ResultsqnrDgene carried by pKL2683 increased the fluoroquinolones MICs for KL-225; The pKL5933 plasmid carriesaac(6')-Ib-cr4gene, which increased the aminoglycosides and fluoroquinolones MICs for KL-225.
ConclusionM.morganiiKL-225 is resistant to aminoglycosides mainly because of the pKL5933 plasmid which carries theaac(6′)-Ib-cr4 gene.Theaac(6′)-Ib-cr4 gene carried by pKL5933 plasmid andqnrDgene carried by pKL2683 plasmid decreased the susceptibility to fluoroquinolones in KL-225.In order to completely clarify the mechanisms of broad-spectrum resistance inM.morganiiKL-225, it is necessary to study the genome and other plasmids.
Morganella morganii; Plasmid; Resistance to fluoroquinolones; Resistance to aminoglycosides
LIU Yi-shuang, Email: yishuang@gmail.com
10.3969/j.issn.1673-713X.2017.04.005
国家高技术研究发展计划(863计划)青年科学家专题(2015AA020911);国家自然科学基金青年科学基金(81102353)
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所国家新药(微生物)筛选实验室
刘忆霜,Email:yishuang@gmail.com
2017-04-27
Author Affiliation:Department of National Laboratory for Screening New Microbial Drugs, The Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
