人视网膜母细胞瘤Y79细胞依托泊苷耐药株的建立及其耐药机制初探
2017-08-22宋文凭张诚玥张燕李毅曹睿叶程张琳邵荣光李亮赵军阳
宋文凭,张诚玥,张燕,李毅,曹睿,叶程,张琳,邵荣光,李亮,赵军阳
人视网膜母细胞瘤Y79细胞依托泊苷耐药株的建立及其耐药机制初探
宋文凭,张诚玥,张燕,李毅,曹睿,叶程,张琳,邵荣光,李亮,赵军阳
目的通过构建人视网膜母细胞瘤 Y79 细胞的依托泊苷耐药株,比较耐药株的药物敏感性和细胞生长情况,观察耐药相关基因及细胞信号通路的变化,从而阐释人视网膜母细胞瘤对依托泊苷的耐药机制。
方法以不同浓度梯度的依托泊苷处理 Y79 细胞,采用浓度递增不间断刺激法构建依托泊苷耐药株,观察耐药株细胞的形态学变化和细胞生长增殖情况以及对依托泊苷细胞毒作用的敏感性;以 caspase 3/7 酶活性来评估耐药株的细胞凋亡程度,并通过 Western blot 方法研究与细胞增殖和耐药相关蛋白的表达变化。
结果成功构建耐受依托泊苷的人视网膜母细胞瘤耐药株Y79/EDR,最大耐药浓度为 500 nmol/L。和亲本细胞相比,耐药细胞具有较强的生长增殖能力,倍增时间缩短 14.5 h(P< 0.001);且对依托泊苷的敏感性显著下降,耐药指数达 29.47。Caspase 3/7 活性检测结果显示,给予亲本及耐药细胞不同浓度的依托泊苷后,耐药细胞中 caspase 3/7 活性明显低于亲本细胞,凋亡减少,且呈药物浓度依赖性。Western blot 结果表明,耐药细胞中磷酸化 AKT(p-AKT)表达明显高于亲本细胞,提示其 p-AKT 的活性明显增强,p-AKT 促进其下游蛋白 MDM2 的磷酸化从而抑制 p53的磷酸化,而凋亡相关蛋白 Bax/Bcl-2 的比值明显降低。多药耐药性蛋白 P-糖蛋白(P-gp)的表达下调,Rb1 蛋白表达水平无明显变化,提示耐药株 Y79/EDR 的耐药并不依赖于 P-gp 而产生,且与 Rb1 蛋白无关,而可能通过增加肿瘤驱动蛋白 AKT 的磷酸化,激活其所介导的下游信号通路,增加靶蛋白 MDM2 的表达,从而抑制抑癌蛋白 p53 的表达;同时增加抗凋亡蛋白 Bcl-2 和降低抑凋亡蛋白 Bax的表达水平;最终导致细胞通过增殖显著增强和凋亡明显减少而产生耐药。
结论成功构建依托泊苷耐药株 Y79/EDR,初步结果表明,其耐药细胞株可能通过促进细胞生长与增殖,同时抑制细胞凋亡而导致耐药,这将为深入研究人视网膜母细胞瘤的病变机制,阐释其对依托泊苷的耐药机制,寻找有效的耐药逆转方案提供一定的前期实验基础。
视网膜母细胞瘤; 依托泊苷; 化疗耐药细胞株; Y79 细胞系
www.cmbp.net.cn 中国医药生物技术, 2017, 12(4):297-302
视网膜母细胞瘤(retinoblastoma,RB)是一种多发于儿童的眼内恶性肿瘤,病因多为人类首个发现的抑癌基因 RB1 及其等位基因的失活[1]。在全球每年新生儿中,该疾病发病率基本稳定在1/16 000~1/18 000,大约每年新增 8000 例患者[2]。亚洲、非洲等欠发达国家的视网膜母细胞瘤患者死亡率达到 40%~70%,欧美发达国家仅为 3% ~5%;而且欠发达国家包括中国在内的患者多为高风险的 D、E 晚期,常伴有复发转移,预后差[3]。视网膜母细胞瘤的治疗以保住患者性命为第一要务,其次是眼球和视力的保留[4]。
根据患者的发病年龄、肿瘤大小、肿瘤所在位置以及肿瘤周边组织等情况,视网膜母细胞瘤可以采用多种治疗手段,如眼球摘除术、放射疗法、经瞳孔温热疗法、激光光凝术、冷冻疗法、多种给药途径的化学疗法等[5]。上述一些治疗手段易引发辐射性视网膜病变、白内障、面部畸形以及诱发二次肿瘤等相关并发症,因此,全身化疗是治疗视网膜母细胞瘤的最好选择[6]。目前,我国视网膜母细胞瘤的一线标准疗法是眼球摘除后三药(卡铂、依托泊苷、长春新碱)联合静脉疗法[4]。针对复发转移的晚期高风险视网膜母细胞瘤的治疗仍为一大难题,大部分患者由于产生耐药性而影响疗效,进而复发、侵袭外转移,甚至死亡。
因此,本研究力图建立人视网膜母细胞瘤细胞Y79 对依托泊苷的耐药株(Y79 etoposide drug resistant,Y79/EDR),从而探讨其可能产生耐药的内在机制,为后续治疗视网膜母细胞瘤,克服对依托泊苷及其他化疗药物所产生耐药的机制研究提供初步的实验依据,从而促进针对晚期高风险视网膜母细胞瘤的耐药复发进行新型靶向药物的研发。
1 材料和方法
1.1 材料
1.1.1 细胞及药物 人视网膜母细胞瘤 Y79 细胞购自中国医学科学院肿瘤医院;药物依托泊苷购自美国 Sigma-Aldrich 公司。
1.1.2 实验试剂 细胞培养用 1640 培养基、胎牛血清、10 000 U/ml 青霉素及 10 000 μg/ml 链霉素均购自美国 Thermo Fisher Scientific 公司;Cell counting kit-8(CCK-8)购自日本 Dojindo 公司;Caspase-glo 3/7 assay 试剂盒购自美国 Promega 公司;苏木素-伊红(HE)染色套液、细胞总蛋白的提取及定量所用 RIPA 裂解液和 BCA 试剂购自上海碧云天生物技术研究所;无水乙醇、95% 乙醇、甲醛购自北京化工厂;Western blot 所用一抗购自美国 Cell Signaling Technology 公司;辣根过氧化物酶标记的二抗购自北京中杉金桥生物技术有限公司;化学发光液购自美国 Millipore 公司。
1.1.3 实验仪器 甩片机为美国 Thermo Scientific公司产品;倒置显微镜为日本 Olympus公司产品;酶标仪为美国 BioTek 公司产品;化学发光检测仪为美国 SpectraMax 产品;凝胶成像分析仪为美国 FluorChem HD2 产品。
1.2 方法
1.2.1 细胞培养及药物配制 人视网膜母细胞瘤Y79 细胞培养在含 20%(V/V)胎牛血清、100 U/ml青霉素、100 μg/ml 链霉素的 1640 培养基中,培养条件为:37 ℃、5% CO2。药物依托泊苷用 DMSO配制成 100 mmol/L 母液,之后处理细胞所用浓度均以无菌 PBS 缓冲液或含血清培养基做相应稀释。
1.2.2 耐药细胞株 Y79/EDR 的建立及其形态特征 选用人视网膜母细胞瘤 Y79 细胞进行依托泊苷耐药株 Y79/EDR 的构建,以三倍浓度梯度增长的依托泊苷处理亲本 Y79 细胞,从最低浓度1 nmol/L 直到最大耐受浓度 500 nmol/L 持续作用达 6 个月,得到能在 500 nmol/L 的依托泊苷中稳定生长的细胞株。取细胞密度为 1 × 105个/ml 的亲本 Y79 细胞和 Y79/EDR 耐药细胞各 200 μl,于甩片机中以 1000 r/min 离心 4 min,PBS 缓冲液洗 3 次,4% 多聚甲醛磷酸盐缓冲液中固定30 min,常规 HE 染色,显微镜下观察并比较亲本及耐药细胞株的形态学特征。
1.2.3 细胞生长曲线的测定及倍增时间的计算 利用 CCK-8 观察细胞的增殖,其原理即通过与活细胞中的去氧脱氢酶反应,生成水溶性的橘黄色甲瓒,根据其 450 nm 处的吸光度(A450)来测定生长速率。将亲本及耐药细胞按照每孔 5 ×103个/200 μl 的密度接种于 96 孔板中,孔板边缘用无菌 PBS 缓冲液填充,以单加培养基的孔为空白对照,将 11 块培养板置于 37 ℃、5% CO2的孵箱中,每隔 24 h 取出一块板,于每孔中加入 20 μl CCK-8试剂,在孵箱中继续孵育 2 h 后用酶标仪测其A450。空白对照孔校准后,绘制细胞生长曲线。
细胞倍增时间的计算公式为:
tD= t × lg 2/(lgNt– lgN0),其中,tD为倍增时间,t 为培养时间,N0、Nt分别代表接种后及接种t 小时后的细胞数。
1.2.4 药物敏感性检测 取对数生长期的亲本Y79 细胞和 Y79/EDR 耐药细胞,按照每孔 2.0 ×104个/180 μl 密度接种于 96 孔板中,培养 24 h后加入不同浓度的依托泊苷 20 μl,使其终浓度分别为 0.1、1、10、100、1000、10 000、100 000、1 000 000 nmol/L,对照孔加入相同体积的无菌 PBS缓冲液,以单加培养基的空白孔为调零孔,不同处理组分别对应 3 个副孔。药物作用 48 h 后加入20 μl 的 CCK-8 试剂于孵箱中继续培养 2 h,测其A450。计算依托泊苷对 Y79 和 Y79/EDR 的半数抑制率(IC50)。
细胞抑制率(%)=[(对照组A450– 调零孔A450)–(实验组A450– 调零孔A450)]/(实验组A450– 调零孔A450)× 100%
耐药指数(RI)= IC50(Y79/EDR)/IC50(Y79)
1.2.5 Caspase 3/7 酶活性测定 取对数生长期的亲本 Y79 细胞和 Y79/EDR 耐药细胞,按照每孔 1.0 × 104个/90 μl 细胞密度接种于 96 孔酶标板中,培养 24 h 后加入 10 μl 不同浓度的依托泊苷,使其终浓度分别为 1 μmol/L 和 10 μmol/L,对照孔加入相同体积的无菌 PBS 缓冲液,单加培养基的孔作为调零孔。药物作用 48 h 后,取caspase-glo 3/7 assay 试剂盒,放置到室温后,将caspase 3/7 底物及缓冲液混合均匀,吸取 100 μl加入上述酶标板孔中,室温下混合孵育 1 h 后,化学发光检测仪检测其荧光强度,确定 caspase 3/7酶的活化程度。
1.2.6 Western blot 检测 收集对数生长期的Y79 和 Y79/EDR 细胞,用含 1% 苯甲基磺酰氟(PMSF)的 RIPA 裂解液提取细胞中的总蛋白,冰上裂解 30 min,4 ℃、12 000 r/min 离心 20 min后取上清,并用 BCA 试剂进行蛋白定量。各取25 μg 总蛋白进行 SDS-PAGE 电泳,电泳完成后,将凝胶中的蛋白转印至 PVDF 膜上,5% 脱脂奶粉封闭;一抗(1∶1000)4 ℃ 过夜孵育,PBST(含 0.1%吐温 的 PBS 缓冲液)洗涤 3 次,每次 5 min;加入 1∶5000 稀释的 HRP 标记的二抗,室温孵育2 h,PBST 洗涤 3 次,每次 5 min;化学发光液显色,凝胶成像仪扫描拍照。
1.3 统计学处理
实验数据以±s表示,组间比较采用t检验,P< 0.05 为差异具有统计学意义。
2 结果
2.1 耐药细胞株 Y79/EDR 的建立及其形态学特征
利用人视网膜母细胞瘤细胞 Y79 进行依托泊苷耐药细胞株的构建,药物浓度从 1 nmol/L 开始三倍浓度递增,经过 6 个月的诱导,得到能在 500 nmol/L 依托泊苷中稳定生长的耐药株Y79/EDR。如图 1 所示,与亲本 Y79 细胞(1A)比较,Y79/EDR 耐药细胞(1B)的形态学特征发生明显变化,细胞体积增大,且分裂相细胞数明显增多,说明细胞增殖加快。
2.2 耐药细胞株 Y79/EDR 的生长增殖速率明显加快
经过 CCK-8 试验得到的两种细胞体外生长速率显示(图 2),亲本 Y79 细胞在培养 9 d 后达到生长增殖的高峰,而 Y79/EDR 耐药细胞在第7 天就达到生长增殖高峰。Y79 的体外倍增时间为(31.80 ± 2.54)h,而 Y79/EDR 的倍增时间为(17.24 ± 0.81)h。与 Y79 相比,Y79/EDR 的倍增时间缩短 14.5 h(P< 0.001),表现出较强的生长增殖能力。
2.3 耐药细胞株 Y79/EDR 对依托泊苷的敏感性明显减弱

图1 Y79(A)和 Y79/EDR(B)的形态学特征(40 ×)Figure 1 Morphological characteristics of Y79 (A) and Y79/EDR (B) (40 ×)
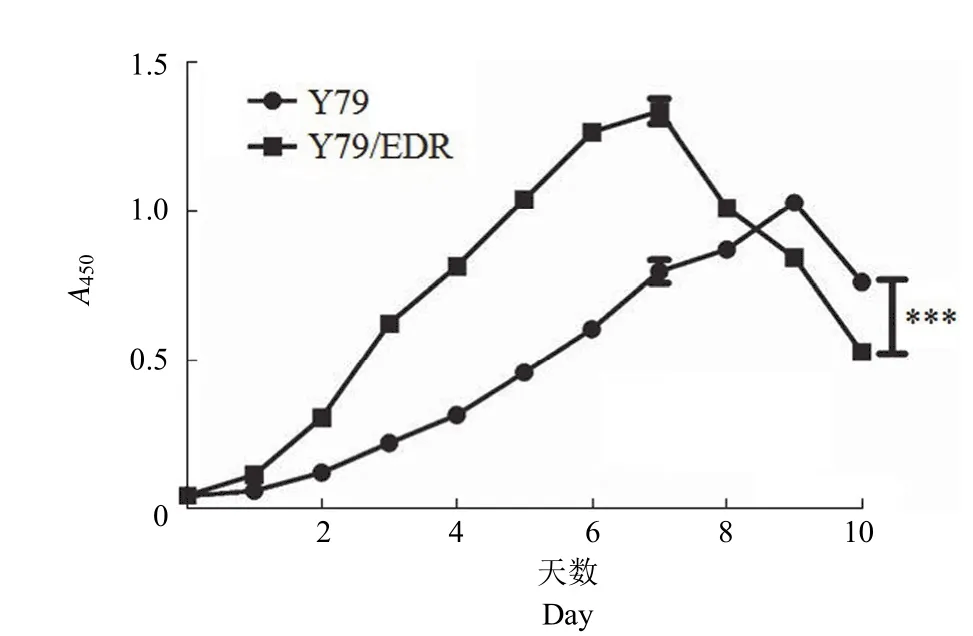
图2 Y79 和 Y79/EDR 细胞的生长曲线(***P< 0.001)Figure 2 Growth curve of Y79 and Y79/EDR cells (***P<0.001)
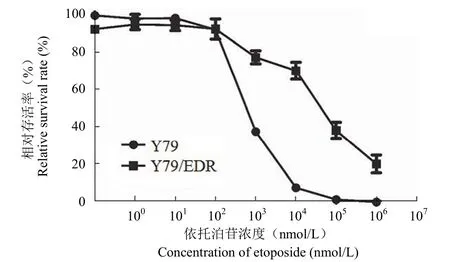
图3 Y79 和 Y79/EDR 细胞对依托泊苷的剂量-存活率曲线Figure 3 The dose-survival curves of Y79 and Y79/EDR exposed to etoposide
图3 为亲本 Y79 细胞和 Y79/EDR 耐药细胞对依托泊苷的剂量-存活率曲线。其中,Y79 的IC50为(1.20 ± 0.02)μmol/L,而 Y79/EDR 表现出对依托泊苷较强的耐受性,IC50为(35.36 ±3.41)μmol/L,耐药指数为 29.47。
2.4 耐药细胞株 Y79/EDR 经依托泊苷诱导所致的 caspase 3/7 酶活性明显降低

图4 Y79 和 Y79/EDR 细胞依托泊苷处理后的 caspase 3/7 活性(**P< 0.01,***P< 0.001)Figure 4 Activities of caspase 3/7 in Y79 and Y79/EDR cells after exposure to etoposide (**P< 0.01,***P< 0.001)
与对照组相比,在给予不同浓度的依托泊苷后,亲本 Y79 细胞和 Y79/EDR 耐药细胞中的caspase 3/7 酶活性均升高,但两者存在显著性差异(1 μmol/L:P< 0.001;10 μmol/L:P< 0.01);相较 Y79,在相同浓度的依托泊苷作用下,Y79/EDR的 caspase 3/7 酶活性明显降低,提示其细胞的凋亡程度减少,且呈浓度依赖性(图 4)。
2.5 耐药细胞株 Y79/EDR 的相关功能蛋白的表达变化
Western blot 结果(图 5)表明,相较亲本 Y79细胞,Y79/EDR 耐药细胞中 p-AKT 的表达显著升高,促进 MDM2 蛋白的磷酸化,进而抑制 p53 的磷酸化,且细胞凋亡相关蛋白 Bcl-2 增加,Bax 降低,Bax/Bcl-2 比例明显降低,揭示 Y79/EDR 的耐药可能是通过 p-p53 的表达水平降低,进而增加抗凋亡蛋白 Bcl-2 和降低促凋亡蛋白 Bax 的表达,抑制细胞凋亡的产生。此外,与亲本 Y79 细胞相比,Y79/EDR 耐药细胞中 Rb1 蛋白的表达无变化,P-糖蛋白(P-glycoprotein,P-gp)的表达无增反降,提示该耐药机制并非通过 Rb1 和 P-gp介导的细胞耐药来完成,而有可能通过对 AKT 磷酸化的增强,AKT 活性增加,从而促进下游靶蛋白 MDM2 的磷酸化,降低抑癌蛋白 p53 的磷酸化,使凋亡相关蛋白 Bcl-2 增加和 Bax 降低而导致耐药。
3 讨论
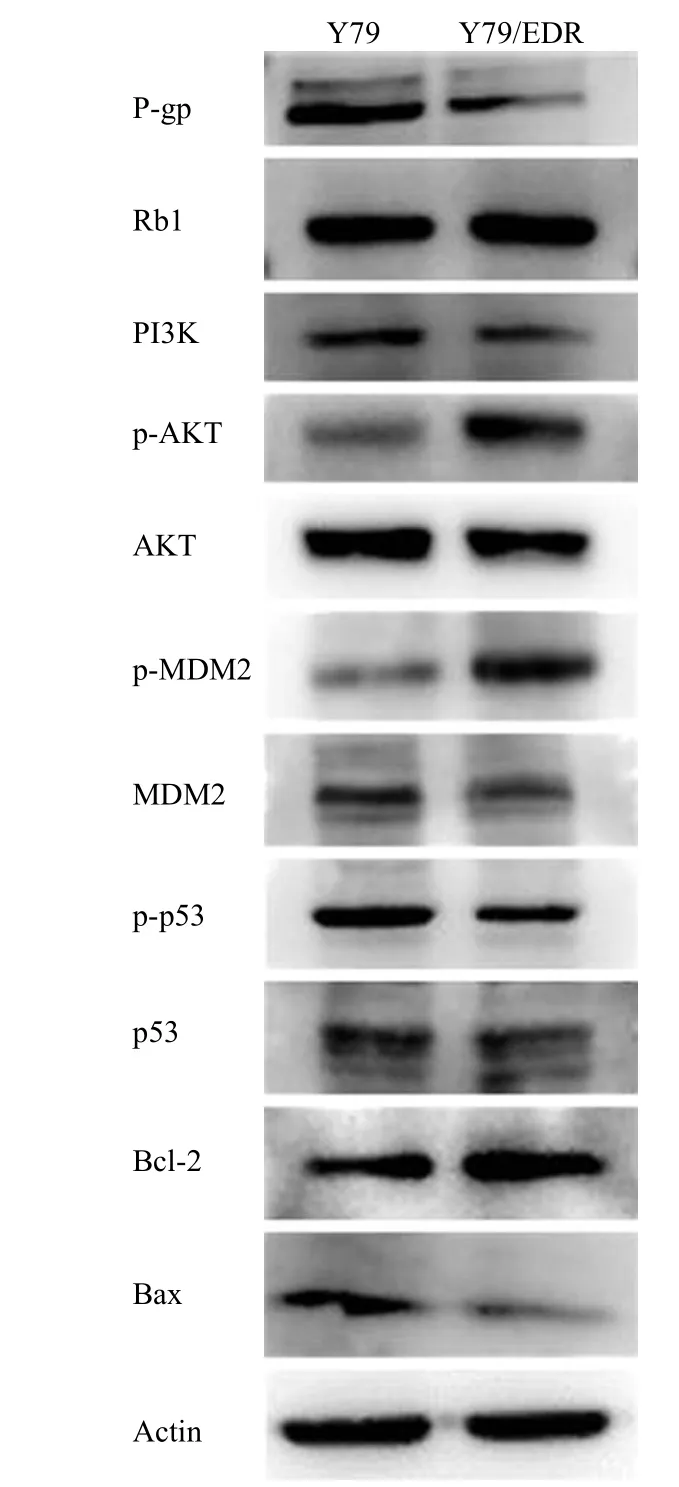
图5 Y79 和 Y79/EDR 细胞中增殖、凋亡及多药耐药相关蛋白的表达情况Figure 5 Expressions of proteins associated with proliferation,apoptosis and multi-drug resistance in Y79 and Y79/EDR cells
依托泊苷是从鬼臼脂中分离出来的木脂体类有效成分,是一种细胞周期特异性抗肿瘤药物,作用于细胞分裂 S 晚期或 G2 期,它通过与 DNA拓扑酶 II 相结合从而抑制其活性,导致受损的DNA 不能得到修复[7]。依托泊苷广泛用于多种肿瘤的治疗,如霍奇金病、肺癌、卵巢癌、骨髓瘤、胃癌、乳腺癌等[8-11]。已有研究表明,化疗药物耐药可能产生的主要原因是药物的细胞渗透性比较差,与多药耐药相关蛋白相互作用而导致耐药[12-14]。由MDR1 基因表达的 P-gp 相当于一个药物泵,能将药物排出到细胞外,从而导致耐药;此外,MDR 相关蛋白的表达也在化疗耐药中起着重要作用[15-18]。而本研究成功构建的依托泊苷耐药株 Y79/EDR,Western blot 结果显示,P-gp 的表达并没有升高,说明此耐药株不是通过高表达 P-gp 而耐药。
已有研究证实,PI3K-AKT 信号通路在调节肿瘤细胞的增殖和存活中起着至关重要的作用[19]。本研究结果表明,相较亲本 Y79 细胞,Y79/EDR 耐药细胞的倍增时间明显缩短,而且进一步实验结果显示,耐药株中 p-AKT 表达上调,促进细胞增殖及存活。p53 作为一个抑癌基因,能通过促进细胞凋亡来达到抑制肿瘤的作用[20],本研究发现,与亲本 Y79 细胞相比,Y79/EDR 耐药细胞中促凋亡基因 p53 的磷酸化水平下调。线粒体凋亡途径在细胞凋亡过程中起着至关重要的作用,而作为 Bcl-2家族主要成员的 Bcl-2 和 Bax 在调节细胞线粒体凋亡途径中作用巨大。Bcl-2 通过抑制 Cyt C 从线粒体释放阻止凋亡,与之相反的是,Bax 能够促进凋亡,因此,Bax/Bcl-2 的比值是公认的与细胞凋亡相关的指标[21]。本研究结果显示,相较亲本 Y79细胞,Y79/EDR 耐药细胞中 Bcl-2 表达上调而Bax 表达下调,且实验结果也证实其下游 caspase 3/7 活性降低,说明耐药细胞株通过调节 Bcl-2、Bax 的表达,从而抑制 caspase 3/7 的活性,起到抗凋亡的作用。综上,初步研究结果表明,耐药细胞 Y79/EDR 是通过促进自身增殖及存活同时抑制细胞凋亡达到耐药目的。
本研究初步探索了视网膜母细胞瘤细胞株Y79 对依托泊苷耐药的分子机制,但对耐药株停止给药后,耐药性是否发生变化及其耐药的深层机制有待进一步探索。本研究将为未来深入研究人视网膜母细胞瘤对依托泊苷耐药的机制和寻找有效的耐药逆转方案奠定基础。
[1]Friend SH, Bernards R, Rogelj S, et al.A human DNA segment with properties of the gene that predisposes to retinoblastoma and osteosarcoma.Nature, 1986, 323(6089):643-646.
[2]Dimaras H, Corson TW, Cobrinik D, et al.Retinoblastoma.Nat Rev Dis Primers, 2015, 1:15021.
[3]Zhao J, Li S, Shi J, et al.Clinical presentation and group classification of newly diagnosed intraocular retinoblastoma in China.Br J Ophthalmol,2011, 95(10):1372-1375.
[4]Pandey AN.Retinoblastoma: An overview.Saudi J Ophthalmol, 2014,28(4):310-315.
[5]Shields CL, Shields JA.Retinoblastoma management: advances in enucleation, intravenous chemoreduction, and intra-arterial chemotherapy.Curr Opin Ophthalmol, 2010, 21(3):203-212.
[6]Mitra M, Dilnawaz F, Misra R, et al.Toxicogenomics of nanoparticulate delivery of etoposide: potential impact on nanotechnology in retinoblastoma therapy.Cancer Nanotechnol, 2011,2(1-6):21-36.
[7]Ashley DM, Meier L, Kerby T, et al.Response of recurrent medulloblastoma to low-dose oral etoposide.J Clin Oncol, 1996,14(6):1922-1927.
[8]Benekli M, Smiley SL, Younis T, et al.Intensive conditioning regimen of etoposide (VP-16), cyclophosphamide and carmustine (VCB)followed by autologous hematopoietic stem cell transplantation for relapsed and refractory Hodgkin's lymphoma.Bone Marrow Transplant, 2008, 41(7):613-619.
[9]Shirasawa M, Nakahara Y, Niwa H, et al.Interstitial pneumonia following administration of pegfilgrastim during carboplatin and etoposide chemotherapy for small-cell lung cancer.Mol Clin Oncol,2016, 5(6):714-716.
[10]Nagano H, Tachibana Y, Kawakami M, et al.Patients with advanced ovarian cancer administered oral etoposide following taxane as maintenance chemotherapy.Case Rep Oncol, 2016, 9(1):195-204.
[11]Benson DM Jr, Elder PJ, Lin TS, et al.High-dose melphalan versus busulfan, cyclophosphamide, and etoposide as preparative regimens for autologous stem cell transplantation in patients with multiple myeloma.Leuk Res, 2007, 31(8):1069-1075.
[12]Horowitz NS, Hua J, Gibb RK, et al.The role of topotecan for extending the platinum-free interval in recurrent ovarian cancer: an in vitro model.Gynecol Oncol, 2004, 94(1):67-73.
[13]Rautio J, Humphreys JE, Webster LO, et al.In vitro p-glycoprotein inhibition assays for assessment of clinical drug interaction potential of new drug candidates: a recommendation for probe substrates.Drug Metab Dispos, 2006, 34(5):786-792.
[14]Chen G, Teicher BA, Frei E 3rd.Differential interactions of Pgp inhibitor thaliblastine with adriamycin, etoposide, taxol and anthrapyrazole CI941 in sensitive and multidrug-resistant human MCF-7 breast cancer cells.Anticancer Res, 1996, 16(6B):3499-3505.
[15]Chan HS, Lu Y, Grogan TM, et al.Multidrug resistance protein (MRP)expression in retinoblastoma correlates with the rare failure of chemotherapy despite cyclosporine for reversal of P-glycoprotein.Cancer Res, 1997, 57(12):2325-2330.
[16]Chan HS, Thorner PS, Haddad G, et al.Multidrug-resistant phenotype in retinoblastoma correlates with P-glycoprotein expression.Ophthalmology, 1991, 98(9):1425-1431.
[17]Krishnakumar S, Mallikarjuna K, Desai N, et al.Multidrug resistant proteins: P-glycoprotein and lung resistance protein expression in retinoblastoma.Br J Ophthalmol, 2004, 88(12):1521-1526.
[18]Wilson MW, Fraga CH, Rodriguez-Galindo C, et al.Expression of the multi-drug resistance proteins and the pregnane X receptor in treated and untreated retinoblastoma.Curr Eye Res, 2009, 34(5):386-394.
[19]De Santis MC, Sala V, Martini M, et al.PI3K signaling in tissue hyper-proliferation: from overgrowth syndromes to kidney cysts.Cancers (Basel), 2017, 9(4).pii:E30.
[20]Ferraiuolo M, Verduci L, Blandino G, et al.Mutant p53 protein and the hippo transducers YAP and TAZ: a critical oncogenic node in human cancers.Int J Mol Sci, 2017, 18(5).pii:E961.
[21]Mahdavi S, Khodarahmi P, Roodbari NH.Effects of cadmium on Bcl-2/ Bax expression ratio in rat cortex brain and hippocampus.Hum Exp Toxicol, 2017, 1:960327117703687.
Generation of etoposide-resistant subline of human retinoblastoma Y79 cells and preliminary study on the mechanism of drug resistance
SONG Wen-ping, ZHANG Cheng-yue, ZHANG Yan, LI Yi, CAO Rui, YE Cheng, ZHANG Lin, SHAO Rong-guang, LI Liang,ZHAO Jun-yang
ObjectiveTo generate etoposide-resistant cell line of human retinoblastoma Y79 cells (Y79 etoposide-drug-resistant, Y79/EDR)and explore the underlying mechanism of etoposide resistance.
MethodsThe etoposide-resistant subline of human retinoblastoma Y79 cells were selectedin vitroby prolonged exposure to 3-fold stepwisely increasing concentrations of etoposide.Y79/EDR cells were finally maintained in culture with 500 nmol/L of etoposide,followed by cell counting kit (CCK-8) and caspase-glo 3/7 assays for testing the growth rate, cytotoxicity and apoptosis induced by etoposide in both Y79 and Y79/EDR cells, respectively.Western blot assay was performed to determine if any cell signaling pathways might be involved in etoposide resistance in Y79/EDR cells.
ResultsY79/EDR cells were obtained after 6 months constitutive treatment at the concentration of 500 nmol/L.The growth rate of Y79/EDR significantly increased and its doubling time was shortened by 14.5 h as compared to Y79 parental cells (P< 0.001) with the resistance index of 29.47.The activity of caspase 3/7 in Y79/EDR cells was significantly decreased as compared to Y79 cells in a manner of etoposide concentration dependent (P< 0.01).The results from Western blot assay indicated that AKT and p53 mediated cellular proliferation signaling pathways might be involved in etoposide resistance of Y79/EDR cells, whereas the expression levels of Rb1 and P-glycoprotein (P-gp) genes had no alteration.
ConclusionOur preliminary results suggested that the mechanisms of acquired resistance to etoposide in human retinoblastoma Y79 cells might be involved in the promotion of cellular proliferation and inhibition of cell apoptosis mediated by AKT signaling pathway.
Retinoblastoma; Etoposide; Chemoresistance resistant cell line; Y79 cell line
s:LI Liang, Email: liliang@imb.pumc.edu.cn; ZHAO Jun-yang; Email: zhaojunyang@163.com
10.3969/j.issn.1673-713X.2017.04.002
国家自然科学基金(81472787)
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所肿瘤室(宋文凭、李毅、曹睿、叶程、邵荣光、李亮);100045北京,首都医科大学附属北京儿童医院眼科(张诚玥、张燕、赵军阳);100075 北京联合大学特殊教育学院(张琳)
李亮,Email:liliang@imb.pumc.edu.cn;赵军阳,Email:zhaojunyang@163.com
2017-06-06
Author Affiliations:Department of Oncology, Institute of Medicinal Biotechnology of Chinese Academy of Medical Sciences &Peking Union Medical College, Beijing 100050, China (SONG Wen-ping, LI Yi, CAO Rui, YE Cheng, SHAO Rong-guang, LI Liang); Ophthalmology Department, Beijing Children's Hospital, Capital Medical University, Beijing 100045, China (ZHANG Cheng-yue, ZHANG Yan, ZHAO Jun-yang); Beijing United University Special Education College, Beijing 100075, China (ZHANG Lin)
www.cmbp.net.cn Chin Med Biotechnol, 2017, 12(4):297-302
