克拉霉素制剂的稳定性及其在胃液中的溶出与降解研究
2017-08-16隋思博宫丽婷
隋思博,程 晶,宫丽婷,李 竹
(1.吉林省药品检验所,吉林 长春 130033;2.辽宁惠康检测评价技术有限公司,辽宁 沈阳 110000;3.长春金赛药业有限责任公司,吉林 长春 130000)
・实验研究・
克拉霉素制剂的稳定性及其在胃液中的溶出与降解研究
隋思博1,程 晶2,宫丽婷1,李 竹3
(1.吉林省药品检验所,吉林 长春 130033;2.辽宁惠康检测评价技术有限公司,辽宁 沈阳 110000;3.长春金赛药业有限责任公司,吉林 长春 130000)
目的探索克拉霉素制剂的稳定性,对其在胃液中的溶出与降解进行研究。方法考察温度、湿度对克拉霉素制剂的性状、有关物质以及含量的影响;采用HPLC法测定克拉霉素在人工胃液中的溶出与降解率,并对过程进行分析。结果克拉霉素颗粒、胶囊、片剂、分散片的含量与有关物质对温度很稳定,在60℃40天内无明显变化;RT90%放置的样品比较稳定,性状、有关物质总量、含量均无明显变化;克拉霉素在酸性的胃液环境下易降解,最大只能达到17%的溶出率,其他都以降解产物的形式存在,主要降解产物为去克拉啶糖的克拉霉素。结论克拉霉素制剂在不同温度湿度条件下稳定性较好,建议延长考察药物长期稳定性的时间,制定合理的药物保存期限;克拉霉素在胃液的降解情况为其做成缓释制剂提供了依据。
克拉霉素;稳定性;溶出;降解
药物的稳定性用于评价药物安全性和有效期,也是核定药物使用期的主要依据[1],影响药物稳定性的因素主要包括处方因素和环境因素。处方因素包括辅料、溶液酸碱度、溶剂、表面活性剂等因素,环境因素包括温度、湿度、光线以及包装材料等[2-3]。大环内酯类药物在胃液中均较容易降解,生物利用度比较低。如红霉素,作为第一代大环内酯类抗生素的代表,由于6位氢氧根、8位氢和9位羰基的相互作用,其活性降低,因此红霉素在胃酸中及不稳定,失去了抗菌活性,被降解为无活性的副产物,降低了生物利用度[4-5]。第二代大环内酯类抗生素——克拉霉素、阿奇霉素、罗红霉素等相继产生,并于二十世纪九十年代上市[6]。本文探索克拉霉素片在胃液中的溶出过程与降解过程,为真实反映克拉霉素片在人体内吸收前的过程提供依据,为克拉霉素缓释剂型的合理性提供参考。
1 仪器与试剂、试药
RC806溶出度测定仪,sartorius BT25S电子天平,岛津LC-20A液相色谱仪,色谱乙腈,超纯水,试剂均为国产分析纯。
2 实验方法
2.1 克拉霉素制剂稳定性考察
样品裸露在相对湿度30%、温度分别为40℃、60℃条件下,分别对放置3天、10天、20天、40天样品的性状、有关物质、含量进行测定;在相对湿度90%、温度20℃条件下,分别对放置3天、10天、20天、40天样品的性状、有关物质、含量进行测定。考察温度、湿度对克拉霉素制剂的影响。
2.2 克拉霉素在胃液中的溶出与降解
2.2.1 溶出度实验参数:溶出介质为人工胃液,浆法,溶出介质900 ml,转速50转/分。
2.2.2 HPLC参数:流动相A相:磷酸盐缓冲液,流动相B相:乙腈。梯度洗脱,0~31 minA相-B相(75:25),32~34 minA相-B相(40:60);35~42 minA相-B相(75:25)。进样量为20μl,柱温为40℃,检测波长为205 nm,流速为1.1 ml/min。
2.2.3 样品:取上海雅培制药0.25 g规格的克拉霉素片6片,投入同一溶出杯中,分别在1 min、2 min、3 min、4 min、5 min、8 min、10 min、15 min、20 min、30 min、45 min、60 min时精密量取续滤液2.5 ml置50 ml量瓶(量瓶中预先加入40 ml pH5.5的磷酸盐乙腈缓冲液),再用pH5.5磷酸盐乙腈缓冲液稀释至刻度,滤过,进样20 μl,测定主峰面积与降解产物峰面积。
2.2.4 对照溶液:精密称取克拉霉素对照品,用pH5.5磷酸盐乙腈缓冲液制成55 μg/ml的溶液,作为对照溶液。
2.2.5 空白辅料:取雅培混合辅料,按主药与辅料的处方比例配制成空白辅料溶液,进样20 μl,采用非标有关物质方法测定。
3 实验结果与分析
3.1 克拉霉素制剂稳定性考察结果
3.1.1 温度的影响:表1显示在40℃放置40天的样品比较稳定,性状、有关物质、含量均无明显变化。在60℃放置40天的样品性状、有关物质无明显变化,含量稍微增高,可能与高温环境下,水分含量降低有关。
结果显示克拉霉素颗粒、胶囊、片剂、分散片的含量与有关物质对温度很稳定,在60℃40天内无明显变化。说明克拉霉素制剂在高温环境的稳定性较好。
3.1.2 湿度的影响:结果显示,在25℃,RT90%放置的样品稳定,性状、有关物质总量、含量均无明显变化。说明在高湿环境的稳定性较好。
3.2 克拉霉素在胃液中的溶出与降解结果
3.2.1 HPLC结果:克拉霉素主峰保留时间为12.1 min,主要降解产物在4.9 min出峰,次要降解产物在18.0 min出峰。
3.2.2 溶出与降解过程分析:从3 min左右开始检测到克拉霉素,在克拉霉素的溶出的同时开始了降解过程,8 min左右开始检测到降解产物,克拉霉素的溶出度在20 min达到了峰值17%,此后降解行为超过溶出行为,降解产物逐渐增多,在60 min时达到74%,主峰逐渐减小,到60 min降解到4.3%。说明克拉霉素在酸性的胃液环境下非常容易降解,最大只能达到17%的溶出率。其降解产物一般被认为是3-O-去克拉啶糖基克拉霉素[7-8]。见表2。

表1 高温(40℃,RT30%)加速试验样品各项指标变化情况
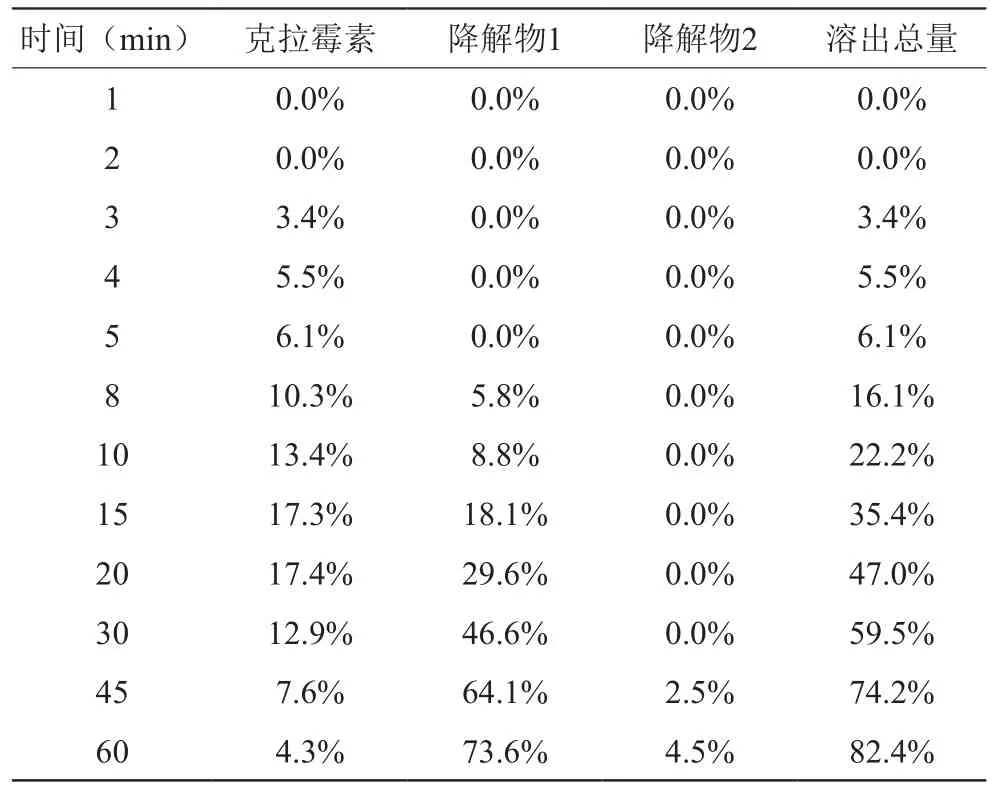
表2 克拉霉素片随时间的溶出率与降解率
4 结 论
药物的稳定性是有关药品安全性的重要方面,考察其稳定性有助于制定适宜的储存条件,寻找影响药品质量的因素。克拉霉素制剂在高温(60℃)、高湿环境(湿度90%)的性状、有关物质、含量均无明显变化,稳定性较好。由于温度、湿度对样品的影响很小,故克拉霉素制剂的在适宜的保存条件下可适当放宽保存期限,原研药厂雅培的克拉霉素片的保存期限为60个月,而国产药物的保存期限一般为24个月,为避免不必要的浪费,建议药厂延长考察药物长期稳定性的时间,制定合理的药物保存期限。
从第一代大环内脂类抗生素的研制至今已有40余年,其中以酮内酯类为主的第三代大环内脂类,因其具有不良反应少,不会引起细菌的耐药性成为研究的热点[9]。可见降低或消除细菌的耐药性成为抗生素研发的主要问题之一,头孢氨苄缓释胶囊是国内第一个抗生素缓释制剂[10],至此以后缓释制剂在医药领域蓬勃发展,缓释制剂不仅仅局限于释药速度的控制,更要注重于定位定时定速释药[11]可以坚信,随着科技的进步,现代仪器的分析联用技术,以及研究方法的多元化[12-13],抗生素新型制剂的研发技术具有极大的提升空间,对于推动制药工业具有重要意义。
[1]杨颖.改善药物稳定性的方法综述[J].中国药师,2007,02:138-139.
[2]郗超,张玉.影响药物制剂稳定性因素及提高方法[J].医学信息(中旬刊),2011,02:717-718.
[3]穆晓攀,杜晓明.药物稳定性研究[J].首都医药,2010,20:42-43.
[4]李喆宇,崔玉彬,张静霞,唐克慧.大环内酯类抗生素的研究新进展[J].国外医药(抗生素分册),2013,01:6-15.
[5]曾繁旭,乔建军.多烯大环内酯类抗生素的研究进展[J].中国抗生素杂志,2014,03:171-181.
[6]Drusano G.Pharmacodynamic and Pharmacokinetic considerations in antimicrobial selection:focus on telithromycin[J].Clin Microbiol Infect ,2001,7(3) 524 -526.
[7]冯玉玲,孙京国.硅醚化制备克拉霉素中相关杂质的色谱分离与检验[J].中国现代应用药学,2009,03:234-236.
[8] 孙立权,张喻雯,范新苑,刘聪,姚国伟,罗爱芹.克拉霉素相关物的研究进展[J].化学试剂,2012,12:1083-1088.
[9]张建民.第三代大环内酯酮内酯类抗生素市场机遇[J].上海食品药品监管情报研究,2007,01:22-25.
[10]贺芬,徐瑛,侯惠民,高申.头孢氨苄缓释胶囊的开发及人体生物利用度研究[J].上海医药,1996,05:27-28.
[11]何浩,许颖,徐希明,余江南.抗生素缓控释制剂的研究进展[J].中国药学杂志,2012,19:1530-1534.
[12]范晋勇.一种新型大环内酯类抗生素的分离纯化研究[D].天津大学,2004.
[13]王艺晓,邝文珍.克拉霉素缓释片处方及制剂工艺研究[J].北方药学,2015,12:90+195.
本文编辑:李新刚
R917
B
ISSN.2095-8242.2017.029.5564.02
