奥沙利铂联合希罗达用于结直肠癌术后患者的安全性及疗效观察
2017-08-12夏晓天贾正飞
夏晓天 贾正飞
奥沙利铂联合希罗达用于结直肠癌术后患者的安全性及疗效观察
夏晓天 贾正飞
目的 探讨奥沙利铂联合希罗达用于结直肠癌术后患者的安全性及疗效。方法 选择108例原发性结直肠癌术后患者,按照术后化疗方案的不同分为实验组与对照组,对照组仅采用希罗达治疗,实验组则在对照组的基础上联合奥沙利铂治疗。比较2组患者的生存率、复发率、远处转移率、不良反应及生存质量Karnofsky评分情况。结果 实验组2年生存率为96.43%,显著高于对照组84.62%;实验组复发率、远处转移率为10.71%、35.71%,显著低于对照组17.31%、44.23%,比较差异均具有统计学意义(P<0.05)。实验组腹泻、神经毒性、手足综合征、皮肤色素沉着、白细胞减少及恶心呕吐等不良反应与对照组比较,差异均无统计学意义(P>0.05)。治疗后2组患者Karnofsky评分均有所降低,组间比较差异无统计学意义(P>0.05);治疗后6个月实验组Karnofsky评分升高明显,显著优于对照组,比较差异具有统计学意义(P<0.05)。结论 奥沙利铂联合希罗达用于结直肠癌术后患者辅助化疗能够延长患者生存时间,减少局部复发率及远处转移率,提高患者生存质量,并且具有较高的安全性。
奥沙利铂;希罗达;结直肠癌;术后辅助化疗;安全性;疗效
(ThePracticalJournalofCancer,2017,32:1331~1333)
结直肠癌是临床较为常见的恶性肿瘤之一,与胃癌、食管癌是消化道发病率较高的三大恶性肿瘤[1]。近年来,随着生存环境的改变、生活节奏的加快等,结直肠癌的发病率呈逐年上升趋势。对于中早期患者临床上以手术治疗为主,但术后仍有着较高的局部复发及远处转移风险,术后化疗对降低转移、复发起着极其重要的作用,因此术后应行辅助化疗[2]。
1 资料与方法
1.1 临床资料
选择2011年1月至2014年6月在我院接受治疗的108例Ⅱ~Ⅲ期原发性结直肠癌术后化疗患者,均经术后病理学确诊,按照术后化疗方案的不同分为实验组与对照组,其中实验组56例,对照组52例。男性63例,女性45例;年龄31~73岁,平均年龄(49.62±6.27)岁;Ⅱ期42例,Ⅲ期66例;直肠癌52例,结肠癌56例。2组患者在性别、年龄、临床分期、病理类型等一般临床资料比较,具有可比性。见表1。
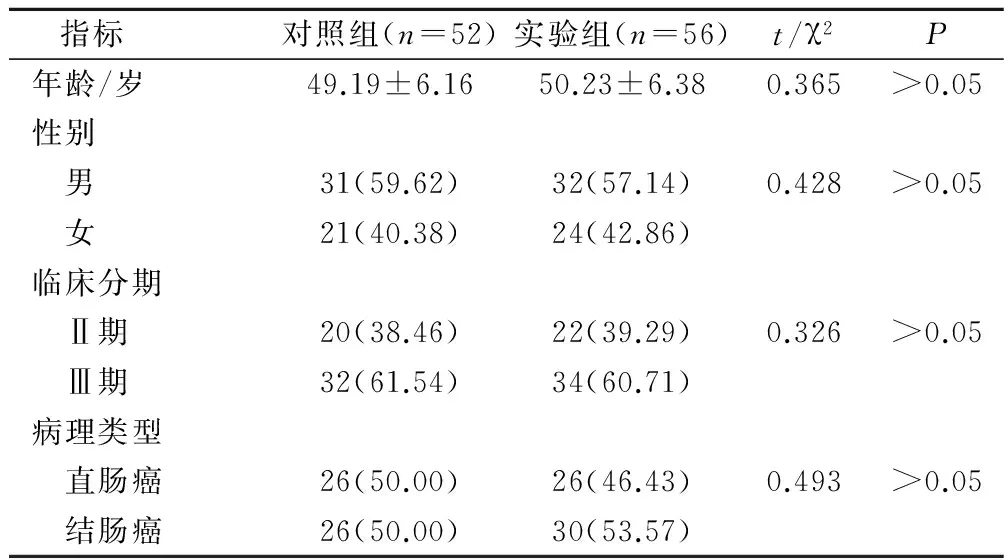
表1 2组患者临床一般资料比较(例,%)
1.2 方法
对照组:仅给予对照组患者希罗达治疗,每日2 500 mg/m2,每日总剂量分早晚2次于饭后0.5 h用水吞服。连用2周,休息1周,3周为1个治疗疗程,连续治疗8个疗程。实验组:应用希罗达联合奥利沙铂进行治疗,每天给予患者2次希罗达,早晚各1次,每次给予口服希罗达1 000 mg/m2;同时对患者进行静脉滴注奥沙利铂注射液,将130 mg/m2与5%葡萄糖溶液进行稀释,稀释成500 ml,继续进行2 h的静脉滴注。如患者无明显不良反应发生,可每隔3周给药1次,1个治疗疗程为3周,连续治疗8个疗程。
1.3 纳入、排除标准[3]
纳入标准:①Karnofsky评分≥60分;②至少有1个可测量病灶;③无化疗禁忌;④心、肝、肾功能及血液学检查基本正常;⑤未经化疗;⑥了解此次研究的目的、意义,并在知情同意书上签字。排除标准:①Karnofsky评分<60分;②无可测量病灶或发生多处远处转移;③存在化疗禁忌,不适宜进行化疗治疗;④经检查心、肝、肾功能存在严重障碍,血液指标不正常;⑤接受过手术或放化疗者;⑥不知情或未在知情同意书上签字者。
1.4 观察指标
采用Karnofsky评分对2组患者接受治疗前、后以及接受治疗后6个月的生存质量进行评估。治疗结束出院后1年内每1~2个月随访1次,第2年3个月随访1次,随访时间为24个月。患者治疗期间腹泻、神经毒性、手足综合征、皮肤色素沉着、白细胞减少及恶心呕吐等不良反应按照WHO评价标准评定。
1.5 统计学处理
采用SPSS 18.0统计学软件对数据进行统计学分析。计数资料采用χ2检验,计量资料采用t检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 2组患者生存率、复发及远处转移率比较
实验组2年生存率为96.43%,显著高于对照组84.62%;实验组复发率、远处转移率为10.71%、35.71%,显著低于对照组17.31%、44.23%,比较差异均具有统计学意义(P<0.05)。见表2。

表2 2组患者生存率、复发及远处转移率比较(例,%)
2.2 2组患者不良反应比较
实验组腹泻、神经毒性、手足综合征、皮肤色素沉着、白细胞减少及恶心呕吐等不良反应与对照组比较,差异均无统计学意义(P>0.05)。见表3。

表3 2组患者不良反应比较(例,%)
2.3 2组患者生存质量Karnofsky评分情况比较
治疗前2组患者的生存质量Karnofsky评分比较,差异无统计学意义(P>0.05);治疗后2组患者Karnofsky评分均有所降低,组间比较差异无统计学意义(P>0.05);治疗后6个月实验组Karnofsky评分升高明显,显著优于对照组,比较差异具有统计学意义(P<0.05)。见表4。

表4 2组患者生存质量Karnofsky评分情况比较
3 讨论
结直肠癌在我国有着较高的发病率,对于早中期患者主要治疗手段为手术治疗。虽然近年来手术人员素质及技术水平不断提高,但术后仍然有着较高的远处转移率及局部复发率,5年生存率为20%~50%[4]。因此,患者术后常辅助化疗以降低局部转移率及远处复发率,提高手术效果,延长生存时间。有研究指出,结直肠癌患者术后辅助化疗能够使患者的预后得到明显改善[5]。
希罗达为新型口服氟嘧啶氨基甲酸酯药物,有独特的肿瘤内选择性激活途径,可模拟持续输注5-氟尿嘧啶抗肿瘤作用。希罗达可快速被胃肠道吸收,在肝脏内经羧基酯酶(CE)转化为 5'-脱氧-5-氟胞苷(5-DFCR),并经肝脏及肿瘤细胞中胞苷脱氨酶(CD)转化为中间体5-DFUR,最终由肿瘤相关性血管生成因子即胸磷化酶(TP)催化,在肿瘤部位转化为 5-FU,发挥抗肿瘤作用,导致肿瘤组织DNA合成受阻,限制RNA及蛋白质的合成[6]。TP在肿瘤组织中有着较高的水平,显著高于正常组织浓度,对于其他化疗药物不敏感的乏氧区TP有着更高的活性[7]。有研究表明,5-氟尿嘧啶优化于人的癌细胞中,患者服用希罗达后会优先在直肠癌中活化,而通过静脉滴注5-氟尿嘧啶无此现象[8]。由于希罗达在肿瘤组织中选择性地产生5-Fu的特点,其无细胞毒性,不良反应较轻,有着较高的安全性。奥沙利铂为第3代铂类抗癌药物,能够形成庞大的复合体体积,可有效抑制DNA的合成,有着较强的细胞毒作用,在较短时间内完成全部DNA的结合,与希罗达具有较好的协同作用[9]。多个临床试验已经证明了奥沙利铂联合希罗达等同步放化疗的耐受性和疗效,对结直肠癌患者术后的治疗具有显著的促进作用[10]。本次研究提示奥沙利铂联合希罗达治疗结肠癌术后患者能够延长患者生存时间,减少局部复发率及远处转移率。治疗后6个月实验组Karnofsky评分升高明显,显著优于对照组,提示奥沙利铂联合希罗达能够明显改善患者的生存质量。在安全性比较中,联合应用奥沙利铂较单纯应用希罗达引起的腹泻、神经毒性、手足综合征、皮肤色素沉着、白细胞减少及恶心呕吐等不良反应并无明显差异,在出现轻度或中度不良反应时,暂停用药后即可恢复,实验组患者中仅3例患者出现Ⅲ度恶心呕吐,2例患者出现Ⅲ度白细胞减少,无其他Ⅲ度、Ⅳ度不良反应,具有较高的安全性。
综上所述,奥沙利铂联合希罗达用于结直肠癌术后患者辅助化疗能够延长患者生存时间,减少局部复发率及远处转移率,提高患者生存质量,安全性较高。
[1] 李小兵,付 浩,邹瑜斌.放疗联合奥沙利铂和希罗达治疗直肠癌术后患者临床观察〔J〕.中国现代医生,2008,46(24):136-137.
[2] 刘海英,赵广章,刘孝伟.结直肠癌术后患者采用改良SOLROX6方案治疗的疗效观察〔J〕.中国肿瘤临床与康复,2014,21(1):65-67.
[3] 葛小红.直肠癌根治术联合化疗治疗直肠癌的疗效观察〔J〕.海南医学,2011,22(24):51-52.
[4] 刘 霞.希罗达与奥沙利铂联合治疗晚期结直肠癌的临床疗效分析〔J〕.职业卫生与病伤,2014,29(6):427-429.
[5] 刘正勇,刘宝华,张安平,等.直肠癌术后早期化疗疗效观察〔J〕.临床和实验医学杂志,2012,11(18):1473-1475.
[6] 徐志巧,李 宁,高 岭,等.奥沙利铂和希罗达或醛氢叶酸等治疗结直肠癌研究〔J〕.医药论坛杂志,2007,28(8):59-60.
[7] 李永恒,李小凡,李金銮,等.Ⅱ、Ⅲ期直肠癌术后奥沙利铂联合5-FU同步放化疗的疗效〔J〕.世界华人消化杂志,2013,21(8):729-733.
[8] 陆忠华,王建华,许锡元,等.Ⅱ、Ⅲ期直肠癌根治术后放疗同步希罗达化疗的疗效〔J〕.世界华人消化杂志,2009,17(32):3351-3354.
[9] 付朝江,崔 明,莫 平,等.奥沙利铂联合5-FU、LV治疗直肠癌术后26例临床观察〔J〕.华南国防医药,2008,18(6):872-873.
[10] 李永亮,邢姗姗,罗 以,等.替加氟或氟尿嘧啶联合奥沙利铂对结直肠癌术后辅助化疗的疗效比较〔J〕.世界华人消化杂志,2013,21(31):3460-3463.
(编辑:甘 艳)
Safety and Efficacy of Oxaliplatin and Xeloda for Colorectal Cancer after Surgery
XIA Xiaotian,JIA Zhengfei.
Huai’an First People's Hospital Affiliated to Nanjing Medical University,Huai’an,223300
Objective To investigate the safety and efficacy effect of oxaliplatin and xeloda for colorectal cancer after surgery.Methods 108 cases of primary colorectal cancer patients after surgery,according to postoperative chemotherapy regimen were divided into the experimental group and the control group,the control group was only treated with xeloda,the experimental group on the basis of the control group
oxaliplatin treatment,recurrence rates,distant metastasis rates,adverse reactions and quality of life of Karnofsky score of the 2 groups were compared.Results 2-years survival rate of the experimental group was 96.43%,which was significantly higher than that of the control group,84.62%;the recurrence rate and distant metastases rate of the experimental group were 10.71% and 35.71%,which were significantly lower than the control group,17.31% and 44.23%(P<0.05).There were no significant differences in the adverse effects such as diarrhea,neurotoxicity,hand foot syndrome,skin pigmentation,white blood cell reduction and nausea and vomiting between the 2 groups(P>0.05).After treatment,Karnofsky score of the 2 group patients were all decreased,the difference between the 2 groups had no statistical significance(P>0.05),6 months after the treatment,Karnofsky score of the experimental group increased significantly,which was significantly better than the control group,the difference had statistical significance(P<0.05).Conclusion Oxaliplatin combined with xeloda in adjuvant chemotherapy for colorectal cancer after resection can prolong the survival time of the patients,reduce the local recurrence rate and distant metastasis rate,and improve the quality of life of the patients,and has higher security.
Oxaliplatin;Xeloda;Colorectal cancer;Postoperative adjuvant chemotherapy;Security;Efficacy
223300 南京医科大学附属淮安第一医院
贾正飞
10.3969/j.issn.1001-5930.2017.08.033
R735.3+5;R735.3+7
A
1001-5930(2017)08-1331-03
2016-08-24
2017-03-09)
