斑点叉尾鮰病原中温和气单胞菌的分离鉴定及药敏特性分析
2017-08-12杨移斌胥宁董靖杨秋红刘永涛艾晓辉
杨移斌,胥宁,董靖,杨秋红,刘永涛,艾晓辉
(1.中国水产科学研究院长江水产研究所,武汉 430223;2. 淡水水产健康养殖湖北省协同创新中心,武汉 430223;3. 中国水产科学研究院,农业部水产品质量安全控制重点实验室, 北京100141)
斑点叉尾鮰病原中温和气单胞菌的分离鉴定及药敏特性分析
杨移斌1,2,3,胥宁1,2,3,董靖1,2,3,杨秋红1,2,3,刘永涛1,2,3,艾晓辉1,2,3
(1.中国水产科学研究院长江水产研究所,武汉 430223;2. 淡水水产健康养殖湖北省协同创新中心,武汉 430223;3. 中国水产科学研究院,农业部水产品质量安全控制重点实验室, 北京100141)
对患出血病斑点叉尾鮰进行病原分离、鉴定及药敏实验,以期为斑点叉尾鮰出血病的防控提供参考。从患病斑点叉尾鮰血水、腹水及重要组织器官中分离纯化病原菌,并进行分离株理化特性测定、gyrB序列分析及回归感染实验,并通过K-B法进行分离菌株药物敏感性分析。结果显示,回归感染实验鱼出现与自然发病类似症状,并经细菌再分离获得相同分离株,表明分离株是引发本次斑点叉尾鮰疾病的病原菌。分离株理化特性与温和气单胞菌基本一致,gyrB基因序列分析分离株与温和气单胞菌同源性达100%,故分离株鉴定为温和气单胞菌。分离株对多西环素及头孢噻肟高度敏感,对氟苯尼考、阿奇霉素及左氧氟沙星中度敏感。分离菌株是斑点叉尾鮰病原菌,紧急时可选用多西环素等药物进行防控。[中国渔业质量与标准,2017,7(4):45-50]
斑点叉尾鮰;温和气单胞菌;分离鉴定;药敏特性;回归感染实验
斑点叉尾鮰(Ictalunespunctatus)又名沟鲶、美洲鲶等,其分类地位为于鲶形目(Siluriformes)、鮰科(Ictaluridae)[1]。自1984年由湖北水产科研机构引入中国养殖推广[2],因其适应中国养殖环境,并具有无肌间刺、肉质鲜美及营养价值高等特点,迅速在国内掀起养殖热潮。目前斑点叉尾鮰养殖区域遍布全国几十个省市,养殖总量不断上升,形成了一个完整的产业链。但由于养殖过程中环境恶化,养殖技术水平跟不上产业的快速发展[3-6],大规模病害时有发生,给养殖户造成了较大经济损失,阻碍了产业的进一步发展。2015年9月湖北仙桃某养殖场出现斑点叉尾鮰大规模死亡的病例。斑点叉尾鮰死亡呈暴发性,发病迅速,死亡快,死亡率高约为20%,死亡规格多为1.2~1.5 kg。其主要症状表现眼球突出,胸鳍腹鳍及头部有出血,黏液增多,解剖时发现肾脏充血发黑,肝脏呈土灰色,脾脏黑色,腹腔有大量血水积聚,肠道出现红肿无食物。取病鱼腹水及血水分离纯化出了1株优势菌,本研究对该优势菌进行病原学分析、鉴定及药敏特性研究,以期为斑点叉尾鮰病害防控增添新的内容。
1 材料与方法
1.1 材料
1.1.1 实验用鱼
发病斑点叉尾鮰取自湖北仙桃某养殖场;感染用斑点叉尾鮰(50~75 g)购置武汉白沙洲水产市场,体格健壮,活力强,无伤病,取暂养7 d无异常的活跃健康鱼用于实验。
1.1.2 主要试剂
普通营养琼脂、普通营养肉汤、MH琼脂、BHI液体培养基、革兰氏染色液、药敏纸片及细菌生化微量鉴定管均购自杭州微生物试剂有限公司;PCR 所用试剂、特异性引物及细菌基因组DNA 提取试剂盒均购自生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 细菌分离纯化
取体表严重出血的的斑点叉尾鮰数尾,在无菌环境下取血水、腹水及肝肾脾肠等用于细菌分离,用无菌接种环蘸取划线于普通营养琼脂平板上, 置于28 ℃恒温培养24 h,挑取形态大小、颜色均一,优势度较高的菌落再纯化,分离得到优势菌1株,将其与25%甘油混匀后,于-80 ℃冰箱保藏。
1.2.2 回归感染
将纯化细菌接种于营养琼脂平板上,28 ℃培养18 h,用无菌生理盐水洗下菌苔,并调整菌悬液浓度[7]依次为2.8×104、2.8×105、2.8×106、2.8×107及2.8 × 108CFU/mL。
取健康的斑点叉尾鮰,分为A、B、C、D、E及F组,每组10尾实验鱼,每组均设置3个重复,其中F组为对照组。实验过程中,溶氧6.0~7.5 mg/L,水温23~26 ℃,隔日换水,水质良好,不喂食。实验A、B、C、D、E组于腹鳍基部分别注射2.8 × 108~2.8 × 104CFU/mL不同浓度菌液0.1mL/尾,对照组F注射等量0.65%无菌生理盐水。每6 h观察斑点叉尾鮰活动情况,同时记录发病死亡斑点叉尾鮰,并进行解剖观察及细菌的再分离。
1.2.3 理化特性测定
将分离菌株接种于NA平板上,28 ℃培养24 h,进行革兰氏染色,采用细菌生化微量鉴定管,参照文献[8]测定生理生化指标。具体指标如下:硫化氢、运动性、M.R反应、V-P 反应、产生吲哚、KCN生长、鸟氨酸脱羧酶、苯丙氨酸脱氨酶、赖氨酸脱羧酶、精氨酸双水解酶、麦芽糖、鼠李糖、柠檬酸盐、丙二酸盐、半乳糖、甘油、尿素、山梨醇、阿拉伯糖、纤维二糖、明胶液化、D-葡萄糖产酸、D-葡萄糖产气、D-甘露醇、D-甘露糖。
1.2.4 细菌分子鉴定
1.2.4.1gyrB基因分析 引物参照Yamamoto等[9]为UP1(正向引物):5′-GAA GTC ATC ATG ACC GTT CTG CAY GCNGGN GGN AAR TTY GA-3′,UP2(反向引物):5′-AGCAGG GTA CGG ATG TGC GAG CCR TCN ACR TCNGCR TCN GTCAT-3′。其中,Y、N、R为混合碱基符号Y,表示C+T;N表示A+C+G+T;R表示A+G。PCR 反应条件为参照邴旭文等[10]。扩增片段直接送生工生物工程(上海)股份有限公司纯化测序。
1.2.4.2 系统发育树构建 将纯化菌株gryB基因与NCBI中已有序列进行比对,根据比对结果检索出同源性较高的序列,采用Clustal X软件进行多序列匹配分析,通过MEGA5.1软件Neighbor-Joining法构建系统进化树,1 000次Bootstrap检验置信度。
1.2.5 药敏特性分析
将纯化得到的细菌接种于营养肉汤培养基,28 ℃振荡(200 r/min)培养18 h后,调整菌液浓度为3.2×107CFU/mL。取150 μL菌液均匀涂布于MH平板上,等距离贴上不同药物的药敏纸片,28 ℃培养24 h后测量不同药物的抑菌圈直径(mm)。根据杭州微生物试剂有限公司药敏纸片抑菌圈标准,确定致病菌株对药物的敏感程度。
2 结果
2.1 细菌分离
本研究从患病鱼血水、腹水中分离到同一株优势菌,暂命名ah01。ah01株置于28 ℃培养24 h后,在NA平板上出现圆形、边缘无缺刻、凸起、光滑、淡黄色的菌落(图1)。
图1 病原菌分离结果Fig.1 Result of pathogen separation
2.2 回归感染
经回归感染实验,结果显示细菌ah01对斑点叉尾鮰有较强毒力,腹腔注射后,实验A、B组24 h内实验鱼全部死亡,C组48 h内全部死亡,D在15 d攻毒实验结束后总死亡率为80%,而对照组F与实验组E组未出现死亡。死亡斑点叉尾鮰出现体表大面积出血,肛门有大量血液流出,解剖其组织器官出现不同程度充血。经过细菌再分离获得一株与ah01相同的菌株,表明菌株ah01是斑点叉尾鮰病原菌。
2.3 细菌鉴定
经生理生化特性分析,菌株ah01为革兰氏阴性菌,详细理化特性如表1所述。参考文献[8],初步判定ah01株生理生化特性与温和气单胞菌(Aeromonassobria)一致。经gyrB基因序列与NCBI已有序列比对,其结果表明菌株ah01与气单胞菌属种类同源性最高;系统发育树分析(图2)表明,ah01株与温和气单胞菌(Aeromonassobria)聚为一支,同源性高达99%。结合ah01理化特性,因此综合判定ah01株是温和气单胞菌(Aeromonassobria)。
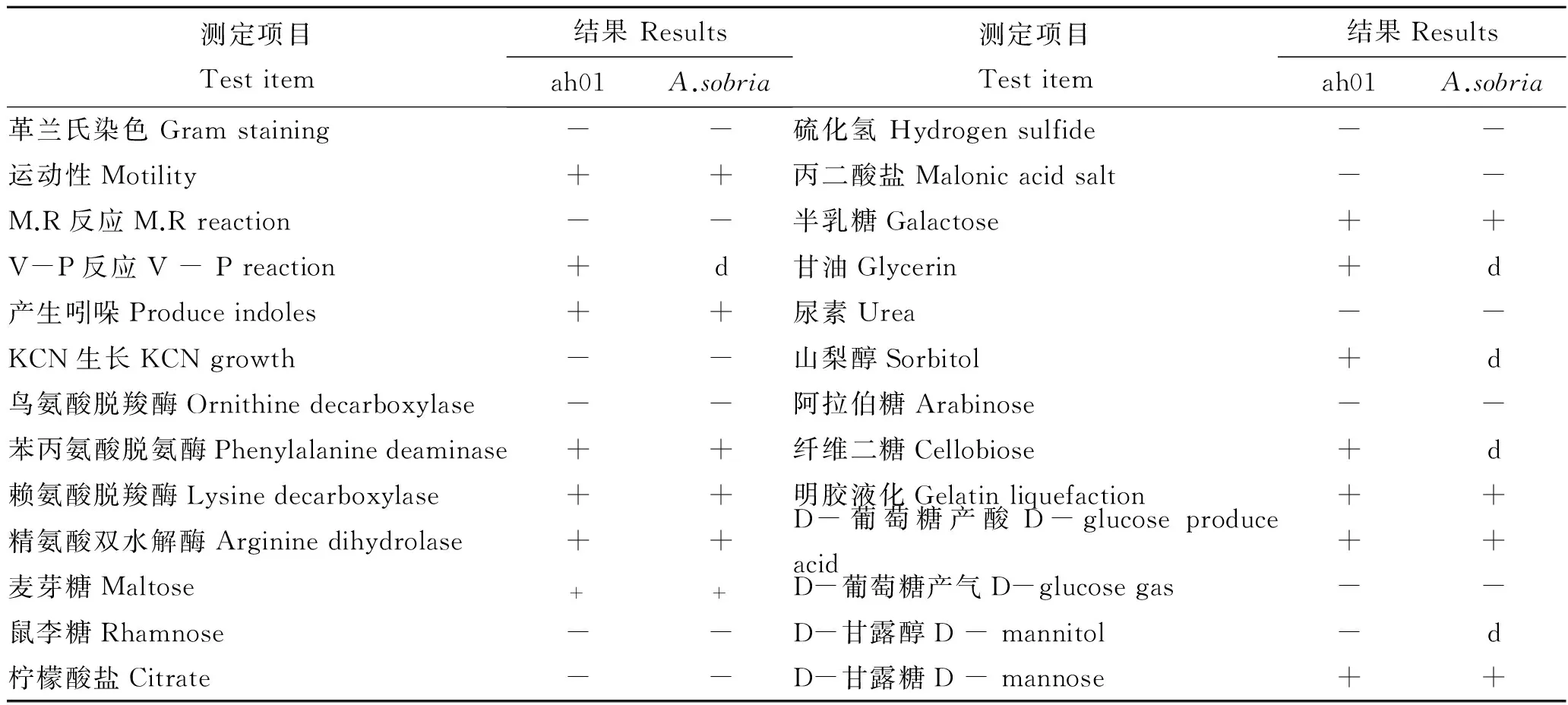
表1 病原菌的生理生化特征Tab.1 Physiologic and biochemical characteristics of the pathogenic bacteria strains
注: “+”示阳性; “-”示阴性; “d”示 11%~89%菌株为阳性。
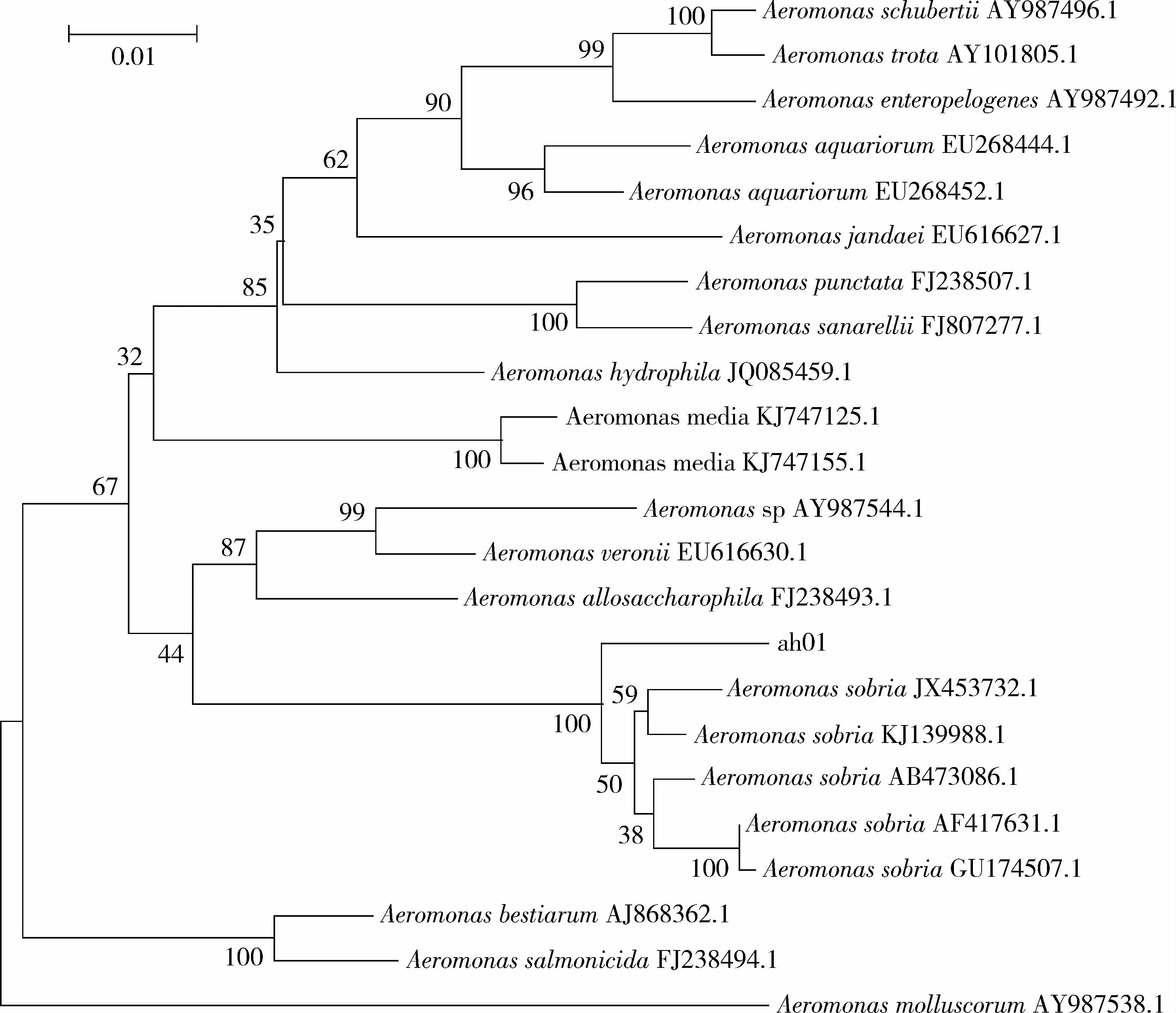
图2 基于菌株ah01的gyrB 基因序列构建的系统进化树Fig.2 Phylogenetic tree based on gyrB gene sequence of ah01 strain
2.4 细菌药敏特性
通过纸片扩展法测试了菌株ah01对14种药物的敏感性,具体如表2所述。结果显示,分离菌株ah01对多西环素及头孢唑林高度敏感;对氟苯尼考、阿奇霉素及左氧氟沙星中度敏感;对阿莫西林、磺胺异噁唑、克林霉素、新霉素、链霉素、妥布霉素、庆大霉素、丁胺卡那霉素及苯唑西林耐药。
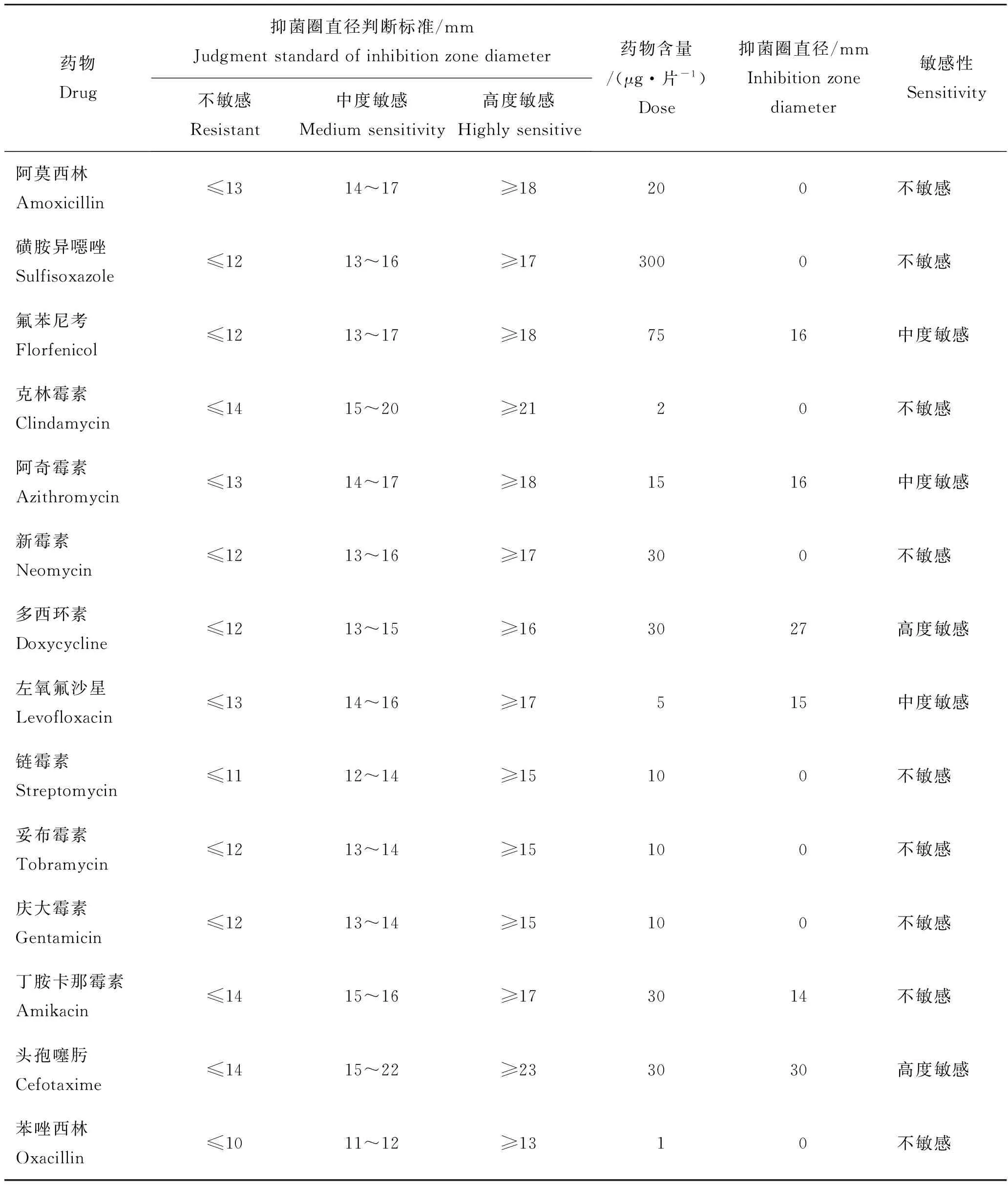
表2 菌株ah01的药敏试验结果Tab.2 Antibiotic sensitivity test of strain ah01
3 讨论
细菌分子鉴定工具目前通用的是16S rDNA序列分析[11],但近年来研究表明编码DNA解旋酶B亚单位的基因(gyrB基因)兼具保守与变异性,其碱基相对进化速度快,在细菌种间鉴定比16S rDNA更具有优势[12]。为此本研究采用测定分离株gyrB基因,经过同源性比对及系统发育分析,分离菌株ah01温和气单胞菌(Aeromonassobria)聚为一支,并经常规形态学、理化特性鉴定,故综合判定ah01株为温和气单胞菌(Aeromonassobria)。
温和气单胞菌(Aeromonassobria)又名寡源气单胞菌及苏伯利气单胞菌,隶属于气单胞菌科、气单胞菌属[13]。温和气单胞菌广泛分布于养殖环境中,是条件病原菌,其主要致病因子是多种溶血素及肠毒素,具备感染发病率高、发病迅速及死亡快等特点[14],常引起水生动物大规模发病[15]。主要报道病例包括鲟、似鲶高原鳅、泥鳅、加州鲈、鳖类及高体革等皮肤溃烂[16-21],罗非鱼急性败血[22]及黄颡鱼肌肉腐烂[23]等。同时温和气单胞菌也可导致人类食物中毒、腹泻等病症[24-25],亦可引起禽类发病[26-28],因此温和气单胞菌属于人-畜-鱼共患病原菌。本研究中患病斑点叉尾鮰出现严重出血,与温和气单胞菌引起罗非鱼发病症状类似,从患病斑点叉尾鮰体内分离到菌株ah01,经过回归感染及鉴定,确定温和气单胞菌为斑点叉尾鮰此次发病的病原菌。本研究丰富了斑点叉尾鮰细菌性疾病理论内容,也表明温和气单胞菌对水生动物的危害正在进一步增大。
本研究从湖北仙桃养殖的斑点叉尾鮰体内分离得到温和气单胞菌对多西环素及头孢噻肟高度敏感;对氟苯尼考、阿奇霉素及左氧氟沙星等3种药物中度敏感;对新霉素、链霉素、妥布霉素及庆大霉素等9种抗生素耐药。由此可知,分离菌株ah01具有较强的耐药性,对大多数水产常用抗生素都耐药。为此在养殖过程时首先应当选择合适养殖模式,充分改善养殖环境,通过投喂中草药或者注射疫苗等方式进行预防,必要时选择多西环素等高度敏感药物进行治疗,与此同时注意用量及疗程,做到精准用药,轮换用药,确保减少耐药菌株的产生。另本次药敏实验结果与其他地区分离的温和气单胞菌耐药情况有差异[29-31],其主要原因可能在于养殖环境及用药情况不同造成的。
[1] 萧培珍, 伍代勇, 叶元土, 等. 斑点叉尾鮰矿物元素营养与需求研究进展[J]. 饲料研究, 2009(3): 12-15.
[2] 杜小溪. 斑点叉尾鮰巨噬细胞移动抑制因子(MIF)基因序列克隆及多态性分析[D]. 大连:辽宁师范大学, 2014.
[3] 刘韬, 王二龙, 汪开毓, 等. 河南中牟地区斑点叉尾鮰突发性败血症病原分离及鉴定[J]. 中国预防兽医学报, 2016, 38(1): 53-57.
[4] 曾令兵, 徐进, 李艳秋, 等. 斑点叉尾鮰出血病病原呼肠孤病毒的分离与鉴定[J]. 病毒学报, 2009(6): 460-466.
[5] 耿毅, 汪开毓, 陈德芳, 等. 斑点叉尾鮰一株致病菌的分离鉴定及系统发育分析[J]. 微生物学报, 2006, 46(4): 649-652.
[6] 黄小丽, 吴春艳, 邓永强, 等. 斑点叉尾鮰维氏气单胞菌病的病理组织学观察[J]. 中国兽医科学, 2010(7): 738-742.
[7] 姚东瑞, 邴旭文, 朱明, 等. 泥鳅(Misgurnusanguillicaudatus)病原温和气单胞菌(Aeromonassobria)分子鉴定及耐药性研究[J]. 海洋与湖沼, 2010, 41(5): 756-762.
[8] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[9] Yamamoto S, Harayama S. PCR amplification and directsequencing ofgyrB genes with universal primers and theirapplication to the detection and taxomonic analysis ofPseudomonasputidastrains[J]. Appl Environ Microbiol, 1995, 61(3): 1104-1109.
[10] 邴旭文, 阎斌伦, 张晓君, 等. 泥鳅(Misgurnusanguillicaudatus)病原霍乱弧菌(Vibriocholerae)的表型与分子鉴定[J]. 海洋与湖沼, 2009, 40(6): 692-698.
[11] 周素明, 李安兴, 马跃, 等. 养殖鱼类链球菌病病原的分离鉴定及其16S rDNA分析[J]. 中山大学学报(自然科学版), 2007, 46(2): 68-71.
[12] 张嵘, 蔡加昌, 张书梅, 等.gyrB基因和16S rRNA基因序列分析在沙门菌属细菌鉴别中的临床应用评价[J]. 中华微生物学和免疫学杂志, 2007, 27(4): 368-369.
[13] 李梅, 游卓霖, 陈锋, 等. 广东省南美白对虾豚鼠气单胞菌的分离鉴定[J]. 上海海洋大学学报, 2015, 24(4): 579-586.
[14] 何长民. 医用微生物学实验技术[M]. 兰州: 甘肃人民出版社, 1981.
[15] 陈瑞. 抗嗜水气单胞菌单克隆抗体和抗温和气单胞菌单克隆抗体的制备及鉴定[D]. 西安:第四军医大学, 2007.
[16] 肖艳翼, 王斌, 夏永涛, 等. 鲟病原性温和气单胞菌的分离鉴定及药敏试验[J]. 南方农业学报, 2015(10): 1909-1914.
[17] 徐敬钧, 耿毅, 汪开毓, 等. 似鲶高原鳅温和气单胞菌的分离鉴定及其感染的病理损伤[J]. 四川动物, 2014, 33(5): 708-714.
[18] 张晓君, 邴旭文, 姚东瑞, 等. 泥鳅溃疡病及病原温和气单胞菌生物学及分子特征研究[J]. 水产科学, 2010, 29(12): 696-702.
[19] 黄钧, 黄艳华, 温华成, 等.水库网箱养殖加州鲈体表溃烂病的诊治报告[J]. 广西畜牧兽医, 2011, 27(6): 323-326.
[20] 童桂香, 韦信贤, 黎小正, 等. 黄沙鳖温和气单胞菌的分离鉴定及药敏试验[J]. 广东农业科学,2010(12): 124-126.
[21] 陈言峰, 冯伟强, 张辉华, 等. 高体革鯻温和气单胞菌的分离鉴定及药敏试验[J]. 安徽农业科学, 2015(3):133-135.
[22] 蔡完其, 孙佩芳. 罗非鱼温和气单胞菌病的病原研究和药敏试验[J]. 中国水产科学, 2002, 9(3): 243-246.
[23] 刘方, 孟丽华, 杨淑英, 等. 黄颡鱼肌肉腐烂病研究及治疗技术初探[J]. 中国渔业质量与标准, 2016, 6(1): 63-70.
[24] 董利平, 周缀琴. 一起嗜水气单胞菌引起的食物中毒[J]. 中国人兽共患病学报, 2005, 21(7): 637-637.
[25] 赵安敏, 高鹏. 温和气单胞菌的调查和鉴定[J].疾病监测, 1994(1): 12-16.
[26] 孔繁德, 黄印尧, 吴文忠, 等. 两株气单胞菌的分离与鉴定[J].中国兽医科技, 1997, 27(2): 23-24.
[27] 潘秀文, 桂剑峰, 张琼. 野鸭温和气单胞菌及产碱假单胞菌的分离与鉴定[J]. 中国家禽, 2001,23(11): 11-12.
[28] 刘金鹏, 陈永林, 胥哲. 黑天鹅温和气单胞菌的分离与鉴定[J]. 中国兽医杂志, 2001(5): 56-57.
[29] 梁利国, 马昕羽, 谢骏. 黄金鲫温和气单胞菌鉴定及溶血素基因检测[J]. 水生态学杂志, 2013, 34(5): 76-81.
[30] 彭亚, 刘杰, 胡大胜,等. 黄沙鳖疖疮病的病原菌分离鉴定及药敏试验[J]. 南方农业学报, 2014, 45(7): 1296-1301.
[31] 胡琳琳, 房文红, 梁思成, 等. 金鱼温和气单胞菌的分离鉴定及药敏试验[J]. 上海海洋大学学报, 2008, 17(3): 285-290.
Isolation and identification ofAeromonassobriafromIctalunespunctatusand its antimicrobial susceptibility
YANG Yibin1,2,3, XU Ning1,2,3, DONG Jing1,2,3, YANG Qiuhong1,2,3, LIU Yongtao1,2,3, AI Xiaohui1,2,3*
(1. Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, China; 2. Hubei Freshwater Aquaculture Collaborative Innovation Center, Wuhan 430223, China; 3. Key Laboratory of Control of Qualityand Safety for Aquatic Products, Ministry of Agriculture, Beijing 100141, China)
The present study reports isolation, identification and antibiotic sensitivity of a pathogen fromIctaluruspunctatusuffering from bleeding disorder. The pathogenic bacteria were isolated and purified from blood and important tissues and organs ofIctaluruspunctatu. The identification of the isolated was conducted, using the biochemical identification and 16S rRNA gene sequence determination. The artificial infection test was performed, and antimicrobial susceptibility test was conducted by K-B method. The bacterial strains isolated from artificial infection fish showed similar morphological and biochemical characteristics to those naturally infected fish. Therefore, the isolate was pathogenic bacteria giving rise toIctalunespunctatus. According to morphological and biochemical characteristics as well as the result of gyrB gene sequence analysis, the isolate wasAeromonassobria. The isolate was susceptible to doxycycline and cefotaxime. Meanwhile, it showed medium sensitivity to florfenicol, azithromycin and levofloxacin. Our results demonstrated that isolate was the pathogen which caused high mortality inIctaluruspunctatus, and the disease may be prevented by administering drugs such as doxycycline in emergency. [Chinese Fishery Quality and Standards, 2017, 7(4):45-50]
Ictalunespunctatus;Aeromonassobria; isolation and identification; antimicrobial susceptibility
AI Xiaohui, aixh@yfi.ac.cn
10.3969/j.issn.2095-1833.2017.04.007
2017-01-22;接收日期:2017-04-17
公益性行业(农业)科研专项(201503108-CC-1;201203085)
杨移斌(1988-),男,助理研究员,硕士,研究方向为水生动物病害临床诊断及其防控技术,yangyb1988@126.com 通信作者: 艾晓辉,研究员,博士,研究方向为水产动物药理及药物控制技术,aixh@yfi.ac.cn
S94
A
2095-1833(2017)04-0045-06
