单环刺螠的人工苗种生产研究Ⅰ.环境因子对单环刺螠受精与孵化的影响
2017-08-12王力勇胡丽萍姜黎明孙灵毅王鹤
王力勇,胡丽萍*,姜黎明,孙灵毅,王鹤
(1.烟台市水产研究所,山东 烟台 264003;2.山东东方海洋科技股份有限公司,山东 烟台 264000)
单环刺螠的人工苗种生产研究Ⅰ.环境因子对单环刺螠受精与孵化的影响
王力勇1,胡丽萍1*,姜黎明2,孙灵毅1,王鹤1
(1.烟台市水产研究所,山东 烟台 264003;2.山东东方海洋科技股份有限公司,山东 烟台 264000)
为对单环刺螠(Urechisunicinctus)的人工苗种生产提供科学有效的基础资料,进行了受精方式和环境因子对单环刺螠受精与孵化的影响研究。结果表明,自然受精的受精率(95.67±2.32)%显著高于人工授精(8.79±6.02)%~(57.83±8.23)%(P<0.05);人工授精中,精卵比例为5∶1~10∶1时的受精率显著高于其他人工授精组实验组(P<0.05),可达50%左右。环境因子中,水温在15.0~21.0 ℃时,孵化率均达86%以上,显著高于其他水温组(P<0.05);盐度为24.1~30.0的实验组中有幼虫孵化,且盐度为27.2时孵化率最高,为(86.70±2.24)%,与其他盐度组差异均显著(P<0.05);pH为6.96~9.01的实验组中有幼虫孵化,且pH为8.02时孵化率最高,为(84.26±4.20)%,与其他pH组差异均显著(P<0.05);受精卵密度为1 ind./mL时的孵化率为(89.43±2.34)%,较其他实验组稍高,但差异不显著(P>0.05);充气+搅动实验组的孵化率为(90.50±2.23)%,显著高于其他组(P<0.05),通过搅动水体可将孵化率提高30%以上,而充气可将孵化率提高10%以上。综上所述,受精方式的不同以及环境因子(水温、盐度、pH、充气方式等)的变化会直接影响单环刺螠的受精率和孵化率。本研究通过对比实验,获得了单环刺螠人工授精的最佳精卵比例以及在较大实验水体中受精卵孵化的最适环境因子条件,这将为单环刺螠的全人工苗种繁育工作提供参考依据。[中国渔业质量与标准,2017,7(4):37-44]
单环刺螠;人工苗种生产;受精;孵化;环境因子
单环刺螠(Urechisunicinctus),属螠虫动物门(Echiurioidea)、螠纲(Echiurida)、无管螠目(Xenopneusta)、刺螠科(Urechidae)、刺螠属(Urechis),俗称“海肠子”,系真体腔原口动物,自然分布于俄罗斯、朝鲜、日本以及中国的黄、渤海沿岸。单环刺螠对海水中的硫化物具有较强的耐受与解毒能力,对水质调节及海洋污染的缓解具有积极作用[1]。因其富含蛋白质、氨基酸和其他营养物质,味道鲜美,具有很高的经济食用价值,是一类极具增养殖前景的海洋动物资源。
根据单环刺螠所具有的生长快、抗病力强等优势和特点,尽快开展苗种繁育、养殖技术的研究,不仅可以缓解和改善因过度捕捞而日趋衰竭的自然资源量,提高经济效益,也可以大大提高增殖放流个体的成活率,有效地补充自然资源,在保护生态平衡和种质资源方面具重大的应用意义。
目前有关单环刺螠的研究,主要涉及其对环境的适应性[2-3]、繁育及配子发生[4-7]、器官发生[8-9]、营养组分及活性肽分析[10-13]、代谢调节[1,14]以及分子生物学[15-16]等领域。牛从从等[5]曾报道海水盐度和pH对单环刺螠胚胎发育中受精率和孵化率的影响,康庆浩等[17]对水温在胚胎发育及幼体培育中的影响做了研究。然而,作为人工繁育的初始关键环节,有关单环刺螠受精与孵化方面还缺乏较为系统全面的研究数据。因此,本研究对人工繁育前期过程中,人工授精的精卵比例、孵化水温、盐度、pH、充气方式等环境因子对单环刺螠的受精与孵化等的影响进行了测定分析,以期为实现单环刺螠全人工苗种繁育及育苗生产提供可靠的理论依据。
1 材料与方法
1.1 材料
实验用个体为肾管饱满的单环刺螠成体,取自“烟台海肠”地理标志产品保护范围的牟平金山港海域,取材时间为2015年5月9-15日。个体体长10~18 cm,体质量86~132 g。
1.2 方法
1.2.1 不同受精方法的受精率检测
1.2.1.1 自然受精
选取肾管饱满的单环刺螠亲体200只,放于6.0 m×3.3 m×1.0 m的水泥池中。实验用的海水为过滤海水,控制水温在(18.0±1)℃,盐度(29.0±1),pH 7.8。待亲体出现自然排放后,拣出正在排放的雄性个体,以避免精液过多;当水中卵子密度达到2 ind./mL时,将亲体全部取出;精、卵在水中自然受精,1 h后,用200目筛网随机捞取卵子,于Olympus CX21显微镜下观察放出极体的情况,随机选取几个视野,计数100个卵子,统计受精卵数量,按照公式(1)计算受精率。实验重复3次。

式(1)
1.2.1.2 人工授精
选取肾管饱满的单环刺螠雄性个体10只,人工解剖法由肾管获取成熟的精子,混合均匀后取精液3滴,滴加到100mL过滤海水中,再次混合均匀,即得精子悬液。在50cm×30cm×40cm玻璃水槽内进行人工授精。取同一雌体的卵子,计数后放入水槽内,保证不同实验组水槽内的卵子数量相当,约为1~2ind./mL;按照精卵比例为2∶1、5∶1、10∶1、20∶1、30∶1、40∶1等6个梯度加入精子悬液并混匀。每组3个重复,实验重复3次。1h后随机取样,并按照1.2.1.1的方法计数受精卵数量和计算受精率。
1.2.2 环境因子对受精卵孵化的影响
每个环境因子实验均取同一雌体的受精卵为实验对象,人工授精的精卵比例为10∶1,受精卵的密度为1 ind./mL(除密度组以外)。实验在50 cm×30 cm×40 cm玻璃水槽内进行,实验水体45 000 mL。除不充气实验组外,水槽内均设置100目散气石2个,孵化过程中连续微量充气,每间隔0.5 h搅水1次。每个实验组均设3个平行组,实验重复3次,每组计数受精卵数量不少于100只。孵化率按照下列公式(2)计算。

式(2)
1.2.2.1 水温对孵化的影响实验
设置 9.0、12.0、15.0、8.0、21.0、24.0、27.0 ℃共7个温度实验组,通过在玻璃水槽外加冰或在水槽内用控温电热棒调节实验海水的温度,观察不同水温对孵化的影响。培育海水盐度为29.0,pH为7.81。
1.2.2.2 盐度对孵化的影响实验
设置15.0、17.8、20.9、24.1、27.2、30.0、32.9、36.1共8个盐度实验组,使用过滤海水加蒸馏水或加食盐来调配实验海水的盐度。培育海水温度保持在(18.0±0.5)℃,pH为7.81。
1.2.2.3pH对孵化的影响实验
设置4.98、5.97、6.96、8.02、9.01、9.98共6个pH实验组,使用1%的NaOH溶液和1%的HCL溶液调配实验海水的pH。培育海水温度保持在(18.0±0.5)℃,盐度为29.0。
1.2.2.4 充气方式对孵化的影响实验
设置不充气+不搅动、不充气+搅动、充气+不搅动、充气+搅动共4种不同充气方式实验组,充气为连续微量充气,搅动为每0.5h搅动水体1次,使沉在水底的卵浮起。培育海水温度保持在(18.0±0.5)℃,盐度为29.0,pH为7.81。
1.2.2.5 密度对孵化的影响实验
设置0.5、1、2、4、8ind./mL共5个孵化密度实验组,观察不同密度对孵化效果的影响。培育海水温度保持在(18.0±0.5)℃,盐度为29.0,pH为7.81。
1.3 数据分析
采用SPSS 19.0 软件包对数据进行单因子方差分析,检验方差齐性,并对数据进行Duncan多重比较,显著性水平为P<0.05。
2 结果与分析
2.1 自然受精的受精率高于人工授精
生殖季节,雄性肾管中精液的密度为4.2×109ind./mL。由图1可见,自然受精的受精率(95.67±2.32)%,显著高于人工授精(8.79±6.02)%~(57.83±8.23)%(P<0.05);人工授精方法中,精卵比例为5∶1和10∶1的受精率分别为(43.47±8.54)%和(57.83±8.23)%,两者差异不显著(P>0.05),但显著高于其他精卵比例实验组(P<0.05)。
通过显微镜观察可见,多数卵子周边的精子数在2~4个;精卵比例过低或过高时的受精率均较低:精卵比例较低时,精子与卵相遇机会较小从而导致受精率下降;反之,当精卵比例较高时,卵子周边附着的精子过多,精子间会存在较大的竞争,也将导致受精率的下降。
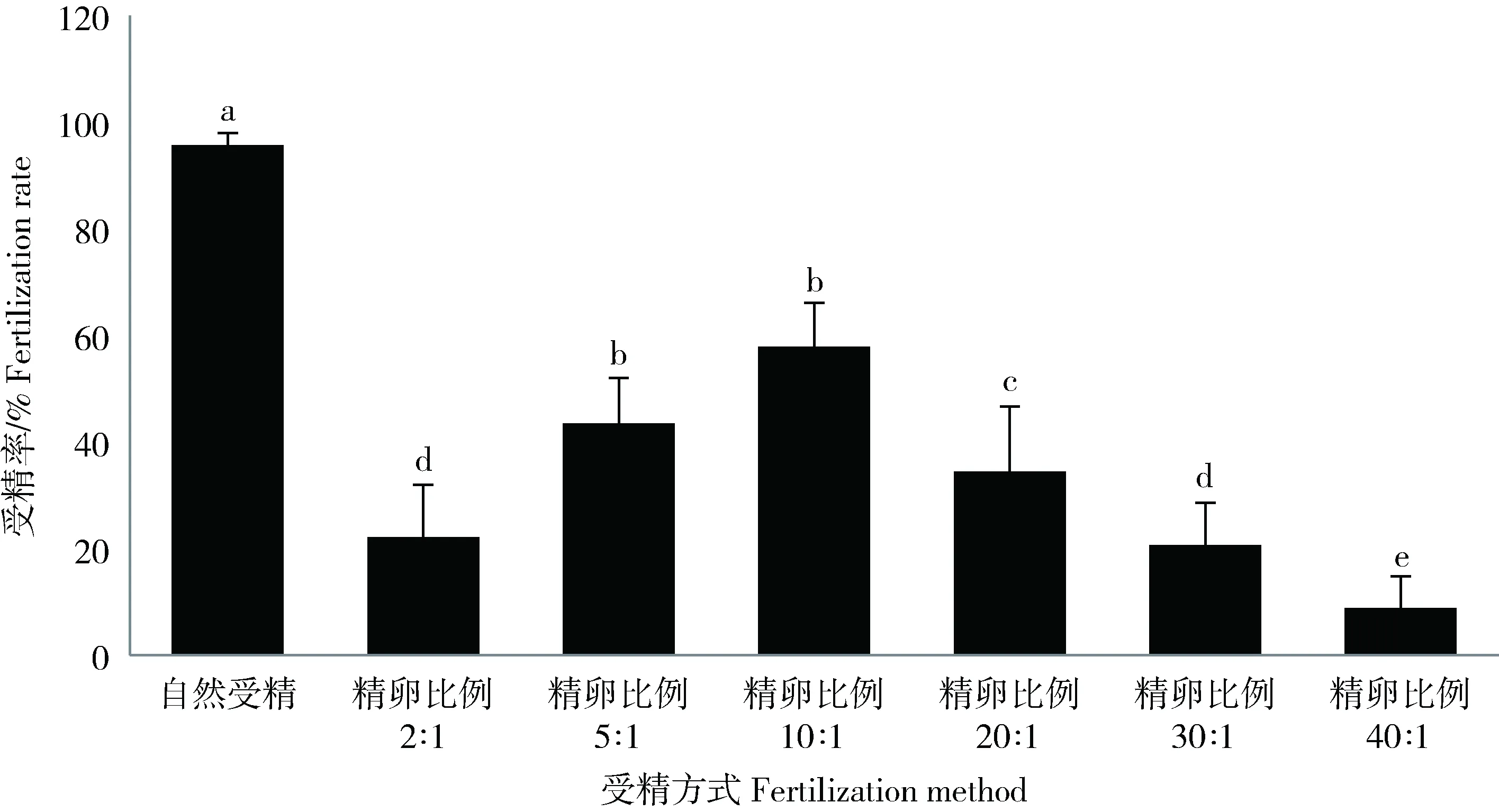
图1 不同受精方法的受精率同一指标中标有不同小写字母表示组间差异显著(P<0.05),标有相同小写字母表示组间差异不显著(P>0. 05),下同。Fig.1 Fertilization rates by different fertilization methods In the same index, the differences between the groups with different lowercase letters were significant (P<0.05),and the same lowercase letters were not significant (P>0.05), the same below.
2.2 环境因子对受精卵孵化的影响
2.2.1 水温对孵化的影响较大
实验结果表明,单环刺螠的孵化时间受水温的影响较大。9.0~24.0 ℃时,受精卵均可孵化,但所需时间为54.0~19.0 h不等,水温与孵化时间呈现负相关性;27 ℃时,胚胎发育可以持续至囊胚,之后发育停滞,胚胎逐渐死亡并分解,水体变浑浊并有异味产生。不同水温条件下,胚胎发育不同阶段所需时间详见表1。
水温对受精率和孵化率均构成一定影响(图2)。经SPSS软件Duncan法多重比较分析表明,除9.0 ℃水温时的受精率(41.29±4.41)%显著低于其他水温实验组的受精率(P<0.05)外,其他各组受精率无显著差异(P>0.05),较小的差异表现为:15.0~21.0 ℃水温条件下,受精率可达50%以上;12和24.0 ℃条件下,受精率接近50%。
相较受精率,孵化率受水温的影响较大。15.0~21.0 ℃时,孵化率均达86%以上,显著高于其他水温实验组(P<0.05);24.0 ℃时的孵化率也较高,达到(82.11±2.32)%,显著高于9.0和12.0 ℃时的孵化率;27 ℃条件下,单环刺螠卵虽可正常受精,受精率为(45.29±2.32)%,但受精卵却不能完成孵化过程。从胚胎发育以及后期生长情况来看,单环刺螠的适宜孵化水温为15.0~21.0 ℃。

表1 不同水温下受精卵孵化所需要的时间Tab.1 The incubation time of fertilized eggs at different water temperatures
注:盐度29.0,pH 7.81。

图2 不同水温对单环刺螠受精和孵化的影响盐度:29.0;pH:7.81。Fig.2 Effects of different water temperature on fertilization and hatching of Urechis unicinctus Salinity: 29.0; pH: 7.81.
2.2.2 盐度对孵化有一定影响
如图3所示,受精2 h时,盐度为24.1、27.2和30.0的实验组己有80%以上的受精卵卵裂为2细胞或4细胞,这3个不同盐度实验组的卵裂率相互之间差异不显著(P>0.05),但却显著高于其他不同盐度实验组(P<0.05);盐度15.0~20.9及盐度36.1的实验组90%以上的受精卵尚未卵裂,并且已经卵裂的受精卵分裂球不正常,近50%为畸形。
受精36h时,只有盐度为24.1、27.2和30.0的实验组中有幼虫孵化,孵化率以盐度27.2实验组最高,达(86.70±2.24)%,显著高于其他各组;盐度24.1与30.0的实验组孵化率差异不显著,分别为(61.53±2.24)%和(69.22±2.26)%。盐度32.9和36.1的实验组中胚胎大部分在囊胚期停止发育,培养水体稍有浑浊;盐度15.0、17.8和20.9的实验组中卵己经分解,水体变浑浊。由此可见,单环刺螠受精卵孵化的适宜盐度为24.1~30.0。

图3 不同盐度对单环刺螠受精和孵化的影响水温:(18.0±0.5)℃;pH:7.81。Fig.3 Effects of different salinity on fertilization and hatching of Urechis unicinctus Water temperature: (18.0±0.5) ℃; pH: 7.81.
2.2.3pH对孵化有一定影响
由图4可见,受精2h时,pH为6.96、8.02和9.01的实验组受精卵已开始卵裂,3组的卵裂率差异不显著(P>0.05),且均在70%以上,其中以pH 8.02的实验组卵裂比例最高,为(86.93±4.21)%;其他pH实验组的卵裂率均显著低于以上3组(P<0.05),其中pH 4.98的实验组中的胚体未见有正常卵裂的胚胎,大部分仍为未受精卵,并有相当一部分为畸形卵。
受精36 h时,只有pH为6.96、8.02和9.01的实验组中有幼虫孵化,其中,pH 8.02实验组中的孵化率最高,为(84.26±4.20)%,显著高于pH 9.01实验组(67.95±6.56)%和pH 6.96实验组(59.44±4.28)%。pH 4.98的实验组中部分卵已经分解,水体变浑浊;pH 5.97和9.98的实验组中均无幼虫孵化,大部分发育停止在囊胚期,水体也变浑浊。根据实验结果可认为单环刺螠受精卵孵化的适宜pH为6.96~9.01。

图4 不同pH对单环刺螠受精和孵化的影响水温:(18.0±0.5) ℃;盐度:29.0。Fig.4 Effects of different pH on fertilization and hatching of Urechis unicinctus Water temperature: (18.0±0.5) ℃; salinity: 29.0.
2.2.4 充气方式对孵化影响显著
不同的充气方式对卵子受精几乎无影响,但对受精卵孵化效果却影响很大(图5)。充气+搅动实验组孵化率最高,达到(90.50±2.23)%,显著高于其他各组(P<0.05)。搅动组和充气组的孵化率差异显著(P<0.05),且两者显著高于既不充气也不搅动实验组(60.67±2.23)%(P<0.05)。单环刺螠的受精卵为沉性卵,通过搅动水体可将孵化率提高32.41%~34.36%,而充气可将孵化率提高10.85%~12.49%。

图5 不同充气方式对单环刺螠受精和孵化的影响水温:(18.0±0.5)℃;盐度:29.0;pH:7.81。下同。Fig.5 Effects of different ways of inflating on fertilization and hatching of Urechis unicinctus Water temperature: (18.0±0.5)℃; salinity: 29.0; pH: 7.81. The same below.
2.2.5 密度对孵化影响较小
随着孵化密度的增加,孵化率总体呈下降态势;最高为1ind./mL孵化密度时的(89.43±2.34)%,最低为8ind./mL孵化密度时的(77.62±2.34)%(图6)。不同孵化密度组间的孵化率差异不显著(P>0.05),即受精卵孵化密度对孵化率影响较小。
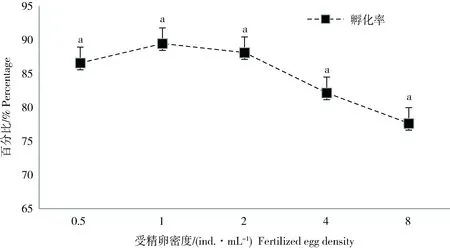
图6 不同密度对单环刺螠受精卵孵化的影响Fig.6 Effects of different densities on the hatching of Urechis unicinctus
3 讨论
大部分海洋无脊椎动物的早期胚胎发育均为经过完全卵裂后形成有腔囊胚,然后经内陷、内卷、分层等过程发育为原肠胚,包括像棘皮动物、多数软体动物及环节动物等[18-19]。胚体继续发育形成幼虫,大多数海洋无脊椎动物能产生浮游生活的幼虫,幼虫经过一系列形态结构的变化,包括变态和固着等,发育成为幼体或成虫[19]。在胚胎发育中,环境因子对其起着至关重要的作用,如海水的各种理化因子(如温度、盐度、pH和各种离子等)、饵料及生存底质等对胚胎发育影响显著。本研究实验结果表明,温度、盐度和pH均对单环刺螠的受精率和孵化率有不同程度的影响。
通过对单环刺螠受精卵孵化的环境因子分析得出,在较大培育水体(45 000 mL)中,单环刺螠孵化的适宜盐度范围为24.1~30.0,最适盐度为27.2;适宜pH范围为6.96~9.01,最适pH为8.02。该结论与牛从从等[5]的实验室250 mL培育水体研究结果基本一致。本研究获得的单环刺螠适宜孵化水温为15.0~21.0 ℃,24.0 ℃时的受精卵孵化率也较高,与康庆浩等[17]报道单环刺螠幼体培育的适宜水温为15.0~20.0 ℃略有差异。分析原因为康庆浩等[17]研究中幼体培育所涉及的阶段较多,包括了从受精卵到13体节期的整个过程,而本研究是针对最初担轮幼虫期前的培育温度进行的实验测定。与其研究结论一致的是:在一定温度范围内,单环刺螠的胚胎发育速度随水温升高而加快,有明显的正相关性。
需要指出的是,本文中获得的对单环刺螠受精炼孵化的适宜环境因子数据,均是在环境单因素变化条件下得出的,对于不同环境因子间的相互影响未做验证。在后续研究工作中,课题组将开展对不同环境因子的正交试验设计和分析,以期获得更准确的单环刺螠受精炼孵化的适宜环境因子数据。
另外,实验还发现,单环刺螠孵化过程对温度、盐度和pH的适应范围要比受精时对3个环境因子的适应范围缩小。这说明随着发育的进行,胚胎逐渐开始对环境因子,包括海水温度、盐度和pH等的作用敏感。这可能与前期胚胎发育有卵膜的保护有关,当发育至幼虫失去卵膜的保护而与水体直接接触时,环境因子对其影响变大,该结果与牛从从等[5]的实验结论相吻合。
本课题组还对单环刺螠成体暂养阶段对环境因子的耐受能力做了研究(未发表)。研究结果表明,单环刺螠成体对盐度的适应能力较强,适应盐度范围19~35,适宜pH范围6.5~8.5。对比单环刺螠在生长发育的初始阶段与成体阶段,其幼虫孵化时期对盐度和pH的适应能力均要弱一些。这是由于单环刺螠随着发育到成体,机体功能已经完善和增强,对环境的适应能力也变的更强。因此,单环刺螠的胚胎发育阶段在人工养殖过程中对环境的要求尤其严苛,做好受精与孵化阶段的水质管理,为胚胎发育提供适宜的环境条件是做好单环刺螠苗种繁育工作的前提。
4 结论
人工授精是单环刺螠全人工苗种繁育的第一步,水温、盐度、pH等环境因子对单环刺螠的受精卵孵化均构成较大影响。本研究确定了人工授精适宜的精卵比例为5∶1~10∶1;单环刺螠受精卵孵化的适宜水温为15.0~21.0 ℃,适宜盐度为24.1~30.0,适宜pH为6.96~9.01;受精卵孵化时应连续充气并伴以搅动,可有效提高孵化率。
[1] Ma Y, Zhang Z, Shao M, et a1. Sulfide: qujnone oxidoreductase from echiuran wormUrechisunicinctus[J]. Mar Biotechnol, 2011, 13(1): 93-107.
[2] 李诺, 宋淑莲, 唐永政, 等. 单环刺螠增养殖生物学的研究[J]. 齐鲁渔业, 1998, 15(1): 11-14.
[3] 郑岩, 白海娟, 王亚平. 单环刺螠对水温、盐度和pH的耐受性的研究[J]. 水产科学, 2006, 25(10): 513-516.
[4] 李诺, 宋淑莲, 唐永政. 单环刺螠生活史研究[J]. 齐鲁渔业, 1995, 12(6): 24-27.
[5] 牛从从, 张志峰, 邵明瑜. 单环刺螠虫精子生物学特征和环境因子的关系[J]. 中国水产科学, 2005,12(5): 556-561.
[6] 王航宁, 邵明瑜, 张志峰. 单环刺螠精巢年周期发育及精子发生[J]. 中国水产科学, 2011, 18(5): 1189-1195.
[7] 李昀, 王航宁, 邵明瑜, 等. 单环刺螠生殖腺的发生及雌体的生殖周期[J]. 中国海洋大学学报, 2012, 42(6): 81-84.
[8] Lehrkea J, Bartolomaeusb T. Comparative morphology of spermatozoa in Echiura[J]. Zool Anz, 2009, 248(1): 35-45.
[9] 陈宗涛, 张志峰, 康庆浩, 等. 单环刺螠消化道的发生和分化[J]. 中国水产科学, 2006, 13(5): 700-704.
[10] 孟祥欣, 郭承华, 董新伟, 等. 单环刺螠(Urechisunicinctus)废弃内脏营养成分分析[J]. 烟台大学学报, 2008, 21 (3): 232-234.
[11] 李诺, 宋淑莲, 唐永政. 单环刺螠体壁氨基酸组分与含量的分析[J]. 齐鲁渔业, 2000, 17(5): 26-28.
[12] Jo H Y, Jullg W K, Kim S K. Purification and characterization of a novel anticoagulant peptide from marine echiuroid worm,Urechisunicinctus[J]. Process Biochem, 2008, 43(2): 179-184.
[13] Sung W S, Park S H, Lee D G. Antimicrobial effect and membrane-active mechanism of Urechistachykinins, neuropeptides derived fromUrechisunicinctus[J]. FEBS Letters, 2008, 582 (16): 2463-2466.
[14] Wang S F, Zhang F, He C, et a1. The effect oftoxic sulfide exposure on oxygen consumption and oxidation products inUrechisunicinctus(Echiura: Urechidae) [J]. J Ocean U China, 2010, 9(2): 157-161.
[15] 陈宗涛, 张志峰, 牛从从, 等. 单环刺螠虫变态前幼虫发育的同工酶及酶学研究[J]. 中国水产科学, 2005, 12(3): 233-238.
[16] 吴志刚. 单环刺螠线粒体全基因组及其系统发生研究[D]. 青岛:中国科学院海洋研究所, 2008, 52(2): 558-562.
[17] 康庆浩, 郑家声, 金在敏. 单环刺螠(Urechisunicinctus)的人工苗种生产研究.Ⅰ.水温对胚胎发育及幼体培育的影响[J]. 青岛海洋大学学报, 2002, 32(2): 273-278.
[18] 张天荫. 动物胚胎发育讲座(一)——动物胚胎早期发育概况[J]. 生物学通报, 1994(7): 26-28.
[19] 张红卫. 发育生物学[M]. 北京: 高等教育出版社, 2006.
Artificial seed production ofUrechisunicinctusⅠ. Influence of environmentalfactors on fertilization and hatchingUrechisunicinctus
WANG Liyong1, HU Liping1*, JIANG Liming2, SUN Lingyi1, WANG He1
(1.Yantai Fisheries Research Institute, Yantai 264003, China;2.Shandong Oriental Ocean SCI-TECH CO., LTD, Yantai 264000, China)
In order to obtain the basic data for artificial seeding production ofU.unicinctus, the fertilization methods and environmental factors that affected the fertilization and hatching ofU.unicinctuswere investigated in the study. The results showed that the fertilization rate of natural insemination (95.67±2.32)% was significantly higher than that of artificial insemination(8.79±6.02)%~(57.83±8.23)% (P<0.05). In the experiment of artificial insemination, the fertilization rate with the sperm and egg ratio of 5∶1 to 10∶1 was significantly higher than that of the other groups (P<0.05), and it was about 50%. In respect of the environmental factors, the hatching rate was above 86% when the water temperature was 15.0~21.0℃, significantly higher than that of the other water temperature groups (P<0.05). The larvae hatched in the 24.1 ~ 30.0 salinity and the highest hatching rate (86.70 ± 2.24)% happened at the salinity of 27.2, which was significantly different from the other groups (P<0.05). The larvae hatched in the pH 6.96~9.01 and the highest hatching rate (84.26 ± 4.20)% appeared at pH 8.02, which was significantly different from the other groups (P<0.05). The hatching rate of the fertilized eggs at 1 ind./mL was (89.43 ± 2.34)%, which was relatively higher than the other experimental groups, but the difference was not significant (P>0.05). The hatching rate of the group with aeration and agitation (90.50 ± 2.23)% was significantly higher than that of the other groups (P<0.05). The hatching rate was increased by more than 30% by agitating the water, and it was increased by more than 10% by aeration. In conclusion, the fertilization rate and hatching rate ofU.unicinctuswere significantly affected by the different fertilization methods and the changes of environmental factors (water temperature, salinity, pH, means of aeration etc.). In the present study, the optimal proportion of sperm-egg artificial insemination and the optimum environmental factors for hatching of fertilized eggs in large experimental water were obtained, which would provide a reliable reference for the whole artificial seed breeding ofU.unicinctus. [Chinese Fishery Quality and Standards, 2017, 7(4):37-44]
Urechisunicinctus; artificial seeding production; fertilization; hatching; environmental factors
HU Liping, liping.hu1985@163.com
10.3969/j.issn.2095-1833.2017.04.006
2017-01-16;接收日期:2017-04-06
山东省科技发展计划项目(2014 GHY 115028)
王力勇(1968-),男,本科,高级工程师,研究方向为海洋经济生物育种与人工养殖技术,wly6812@163.com 通信作者:胡丽萍,工程师,研究方向为海洋生物遗传育种及水产品质量检测,liping.hu1985@163.com
S96
A
2095-1833(2017)04-0037-08
