磷脂酶A2受体抗体与特发性膜性肾病的研究进展
2017-08-09张雪琴
张雪琴 陆 晨
·综述·
磷脂酶A2受体抗体与特发性膜性肾病的研究进展
张雪琴 陆 晨
近年来大量研究发现人足细胞膜上表达的磷脂酶A2受体(receptor for phospholipaseA2,PLA2R)是特发性膜性肾病(idiopathic membranous nephropathy,IMN)的靶抗原[1-3]。据报道,70%的IMN患者血清中可以检测出抗PLA2R的自身抗体,且PLA2R增长幅度与患者尿蛋白水平呈正相关[4]。因此有学者提出,磷脂酶A2可评估IMN的临床疗效与预后。本文拟对此研究状况做以综述。
一、PLA2R的结构
PLA2R属于甘露糖受体(Mannose Receptor,MR)家族,1989年由Stanescu等[5]首次对其做了报道。迄今为止,共发现了两个亚型的PLA2R——M型和N型[6]。M型PLA2R是一种Ⅰ型跨膜蛋白,结构上分为细胞外段、细胞内段和跨末段。细胞外段较长,由N末端的胱氨酸富集部分、Ⅱ型纤维连接蛋白部分以及八个串联的C型外源性凝集素样部分(CTLDs)组成[7],其中CTLD5是与PLA2结合的部位[8]。Behnert等[9]将抗PLA2R血清反应阳性的IMN患者与血清反应阴性患者的PLA2R的线性结构进行了描述,结果表明两组抗原决定簇的线性结构无明显差异。但值得关注的是,随着pH值得变化,PLA2R的构象可发生伸展、弯曲等变化,进而暴露其抗原决定簇,该发现与以往基因多态性决定IMN发病这一结论相矛盾[10-11]。基于这一理论,Fresquet等[12]对与具有不同亲和力及亚型的抗PLA2R抗体发生免疫反应的结构域进行了测量,发现了每个抗原表位的构象具有一致性。那么环境因素通过什么来影响疾病的进展呢?
许多学者对PLA2R胞外结构域的三维结构进行了研究及描述。其详细结构基于CD206x的射线晶体学和FcRY的构象研究。Kao等[13]首次描述了PLA2R与自身免疫性抗体结合部位,在IMN患者中发现三个主要的蛋白结构域——CysR,FnII以及CTLD1。且当CysR或者CTLD1任何一个蛋白结构未表达,就检测不出任何PLA2R相关抗体。无独有偶,Fresquet及他的同伴在Kao的基础上,发现了另外5个抗原决定簇,即CTLD1/2和CTLD2/3域间封闭结构[12]。这些抗原决定基虽然在肽链上间断分布,但其间的二硫键使其相互作用,共同构成了PLA2R的三维空间结构(图1)。而环境因素可能是通过改变其三维立体结构从而影响疾病的发生发展。

图1 PLA2R的三维空间结构
二、抗PLA2R抗体结构及亚型
研究表明,IMN患者的血清中可检测出可特异性识别PLA2R的IgG4抗体亚型[14-15],但由于在IMN患者血清中也发现IgG1和IgG3的存在[16],所以目前为止引起IMN的aPLA2抗体亚型仍存在争议。因此,不同IgG亚型结构以及与靶抗原结合部位的亲和力也是发病机制的关键。IgG抗体目前检测到亚型主要有四种——IgG1,IgG2,IgG3,IgG4。
三、M型PLA2R及抗PLA2R抗体与IMN的关系
随着M型PLA2R及其自身免疫性抗体的发现,近年来有关PLA2R的研究逐渐增多,世界各国各地区对其血清抗体和肾组织抗原检测诊断效能的报道都存在一定差异,而激活该免疫反应的原因尚不明确。有研究发现,PLA2R的基因多态性与环境因素的干预成为该免疫反应发生并沉积在肾小球基底膜的罪魁祸首[2,17-18]。也有学者认为,PLA2R与膜性肾病自身抗体的发病可能间接相关——PLA2R或另一种与其相关的变异体影响DNA模板链上某个调控元件,如转录因子结合位点,从而产生了自身免疫性抗体导致IMN,但此机制还需进一步验证[19]。而目前已被证实的是,6号染色体上HLA-DQA1基因的单核苷酸多态性可能是靶抗原PLA2R1的自身免疫反应的扳机点[20]。而环境方面的因素至今还未得出明确的结论,也许是因为通过某些途径导致PLA2R经过一系列的构象改变,使暴露的抗原决定簇成为与细菌细胞壁上的酶同源[5,21-22]。当经过修饰的抗原决定簇暴露后,人体内的树突状细胞将其截获并联合人类白细胞抗原(human leukocyte antigen,HLA)蛋白将抗原呈递给特异性免疫细胞[23]。主要激活的细胞是Th2淋巴细胞,当Th2淋巴细胞接收到抗原时,能够产生特定的细胞因子,尤其是IL-4,IL-10,和IL-13[24-26],其中IL-4能够激活B淋巴细胞合成和分泌IgG4[27]。IgG4与树突状细胞携带的抗原表位相结合,形成的免疫复合物随着肾小球的循环变成电子致密物沉积在肾小球上皮下方,从而破坏肾小球滤过屏障。(图2)
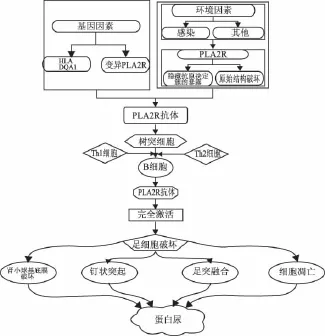
图2 膜性肾病发病机制流程图
然而在上述研究中,IgG4并不直接激补体系统。因此大量学者致力于IMN患者体内补体系统与IMN发病机制的相关性。研究发现,PLA2R上存在的甘露糖结合凝集素能被肾小球识别,但C1q却不能[28]。那么如何解释对于IMN患者病理学上补体沉积在肾小球基底膜的现象呢?学者们提出补体激活的经典途径与甘露糖结合凝集素密切相关的假设。主要观点是甘露糖结合凝集素作为蛋白胶原凝集素家族的成员,与一些特定的低聚糖如N-乙酰氨基葡萄糖、甘露糖有相同构象[29]。对于此问题众说纷纭,也有学者认为,也许是形成的免疫复合物通过抗PLA2R的IgG抗体介导的甘露糖结合凝集素途径来激活补体系统。因为抗PLA2R的IgG抗体有缺乏半乳糖的侧链,由于半乳糖的缺乏,N-乙酰氨基葡萄糖则暴露在侧链端,从而激活了甘露糖结合凝集素途径。甘露糖结合凝集素则可以激活两种丝氨酸蛋白酶(MASP1/2),这种丝氨酸蛋白酶与C2和C4功能相同,能够形成C3转化酶,在通过经典的补体途径,合成膜攻击复合物,进而引起IMN[16]。
与此同时,专家们还发现,PLA2与PLA2R相结合,可使体内免疫反应加重。PLA2通过激活cPLA2使其磷酸化后产生酶解活性,水解内质网及核膜产生花生四烯酸(arachidonic acid,AA),AA通过COX-1或COX-2途径产生前列腺素,介导炎症免疫反应。其中,激活的cPLA2使细胞膜失去稳态从而使其更容易被PLA2水解,在血管紧张素Ⅱ刺激下,足细胞中醛固酮可通过P13/AKt及P38MAPK信号通路导致足细胞nephrin蛋白表达变化及足细胞凋亡[30-31]。而肥大细胞中PLA2活了包括PKC/Raf-1/MAPK在内的信号传导途径,从而通过细胞表面受体调控AA释放,激活cPLA2后,再参与上述途径。
四、PLA2R抗体与IMN疗效及预后的研究进展
抗PLA2R抗体对IMN发病机制的影响目前已被证实。临床上对IMN的诊断依赖于肾脏穿刺活检,而对于膜性肾病治疗的疗效与预后,仍然认为肾脏病理学检查最为可靠。但因是有创检查,不为绝大多数患者所接受。故临床上常用尿蛋白、血清蛋白、尿肌酐、血清IgG、尿液IgG甚至肾脏病理等指标评估。因此有专家提出PLA2R抗体滴度对于疗效与预后的评估是否也存在一定的临床价值。近年来有学者对此做出了研究。
目前,临床上常用的临床指标对于IMN治疗缓解后的早期变化并不明显,短期内无法评估疗效。Beck等[11]提出PLA2R抗体滴度是否与体内免疫活动度有关,进而评估IMN临床疗效及判定其预后。他们通过免疫印迹免疫测定利妥昔单抗治疗前后IMN患者血清样本的PLA2R抗体,其中有71%患者体内检测到PLA2R抗体,而经过一年利妥昔单抗的治疗后有68%患者体内PLA2R抗体的滴度下降甚至消失,在这些指标有所下降的人中有59%的的患者随访后有完全或部分缓解,24个月后该概率高达88%。而在血清PLA2R抗体含量持续的患者中,经治疗后12个月和24个月完全或部分缓解的概率分别为0和33%。这一结果证实PLA2R抗体可用于评价IMN患者的疗效和预后。
还有学者针对PLA2R抗体相较于常用的临床指标如尿蛋白是否在监测疗效及预后方面更为灵敏展开了研究。研究发现IMN患者经治疗后PLA2R抗体滴度下降开始时间远比尿蛋白早几个月。研究结果显示,大概经过利妥昔单抗治疗2个月后,患者PLA2R滴度由基线值(平均值为428 U/ml)下降至其20 U/ml,而此时,研究对象尿蛋白均值仍为3.8 g/L(0.4~12.6 g/L),且大概要经数月后才逐渐下降。这一研究结果指出了PLA2R抗体评估其疗效和预后较尿蛋白更为灵敏[32]。
van den Brand等[33]认为PLA2R抗体滴度的基线水平并不能预测免疫沉积的初始反应,但抗体的状态能够预测经过治疗后最终的长期结果。他们的实验结果表明:经治疗后抗体转阴的患者有58%在5年内未复发,而抗体持续阳性的在5年内都有不同程度的复发或加重。Hoxha等[34]的一项前瞻性,开放标签,多中心的临床研究证实,高水平的 MPLA2R抗体也是IMN患者肾功能丧失进展的一个独立预测因素。
另外,南京军区总院刘志红院士团队在572例肾活检证实为IMN的患者中,用ELISA的方法检测血PLA2RAb浓度,结果得出,抗体阳性的患者较该抗体阴性的患者尿蛋白水平更高,eGFRs水平更低。与抗体阴性而抗原阳性(SAb-/GAg+)患者(n=127)相比,二者都为阳性患者蛋白尿水平更高,eGFRs水平更低。这些结果提示抗体较抗原与疾病活动性和肾功能水平降低更相关。Kaplan-Meier分析显示Ab-/Ag+患者缓解率高于Ab+/Ag+患者,24个月时累计完全缓解率分别是61.1%和35.6%。校正基线蛋白尿水平后,Ab-/Ag+患者达到完全缓解的机会仍高于Ab-/Ag+患者,危险比值HR为2.1。在52例重复肾活检的病例中,未获得缓解的患者较获得缓解的患者第一次肾活检时Ab+的比例更高。此外,Ab+的水平在未获得缓解的患者中持续较高,但是在第二次肾活检前已获得缓解的患者中明显降低。未获得缓解的患者较获得缓解的患者第一次肾活检时Ag+的比例也更高。持续的Ag(+)沉积与疾病复发有关[35]。
综上所述,PLA2R抗体是近年来发现的IMN的主要自身免疫性抗体。并且与IMN的发病机制密切相关。能够将其作为评估IMN临床疗效与预后的证据有以下几点:①它能够被肾小球足细胞表达的PLA2R识别并发生特异性的免疫反应,结合物沉积在肾小球基底膜;②血清中PLA2R抗体能够通过酶联免疫印迹法检测,成为一个简便的临床手段;③临床上用抗PLA2R抗体的免疫抑制剂治疗IMN具有明显的疗效,且经过治疗后临床症状缓解的患者,血抗PLA2R抗体滴度明显下降甚至消失;④PLA2R抗体无下降趋势的患者缓解率明显低于下降者,且复发率及肾功衰竭的风险比较后者显著增高;抗PLA2R抗体与IMN的活动度呈正相关,是一个诊断及评估疗效和预后的理想指标;⑤大量研究表明,PLA2R抗体滴度对于病情变化监测的灵敏度优于尿蛋白等目前常用于评估临床疗效及预后的常用指标[36],从而指导临床早发现、早治疗,调整治疗方案延缓肾功进展。但目前该技术并未广泛应用于临床常造成了利用这一指标的局限性,需要我们进一步克服提高。
[1] Hofstra JM,Beck LH Jr,Beck DM,et al.Anti-phospholipase A receptor antibodies correlate with clinical status in idiopathic membranous nephropathy[J].Clin J Am Soc Nephrol,2011,6(6):1286-1291.
[2] Kanigicherla D,Gummadova J,McKenzie EA,et al.Anti-PLA2R antibodies measured by ELISA predict long-term outcome in a prevalent population of patients with idiopathic membranous nephropathy[J].Kidney Int,2013,83(5):940-948.
[3] McQuarrie EP,Mackinnon B,Stewart GA,et al.Membranous nephropathy remains the commonest primary cause of nephrotic syndrome in a northern European Caucasian population[J].Nephrol Dial Transplant,2010,25(3):1009-1010.
[4] Wen J,Xie K,Zhang M,et al.HLA-DR,and not PLA2R,is expressed on the podocytes in kidney allografts in de novo membranous nephropathy[J].Medicine(Baltimore),2016,95(37):e4809.
[5] Stanescu HC,Arcos-Burgos M,Medlar A,et al.Risk HLADQA1 and PLA(2)R1 alleles in idiopathic membranous ne-phropathy[J].N Engl J Med,2011,364(7):616-626.
[6] Hoxha E,Harendza S,Zahner G,et al.An immunofluorescence test for phospholipase-A-receptor antibodies and its clinical usefulness in patients with membranous glomerulonephritis[J].Nephrol Dial Transplant,2011,26(8):2526-2532.
[7] Obrisca B,Ismail G,Jurubita R,et al.Antiphospholipase A2 Receptor Autoantibodies:A Step Forward in the Management of Primary Membranous Nephropathy[J].Biomed Res Int,2015,2015(2):1-8.
[8] Nicolas JP,Lambeau G,Lazdunski M.Identification of the binding domain for secretory phospholipases A2 on their M-type 180-kDa membrane receptor[J].J Biol Chem,1995,270(48):28869-28873.
[9] Behnert A,Fritzler MJ,Teng B,et al.An anti-phospholipase A2 receptor quantitative immunoassay and epitope analysis in membranous nephropathy reveals different antigenic domains of the receptor[J].PLoS One,2013,8(4):e61669.
[10]Coenen MJ,Hofstra JM,Debiec H,et al.Phospholipase A2 Receptor(PLA2R1)Sequence Variants in Idiopathic Membranous Nephropathy[J].J Am Soc Nephrol,2013,24(4):677-683.
[11]Beck LH Jr,Fervenza FC,Beck DM,et al.Rituximab-induced depletion of anti-PLA2R autoantibodies predicts response in membranous nephropathy[J].J Am Soc Nephrol,2011,22(8):1543-1550.
[12]Fresquet M,Jowitt TA,Gummadova J,et al.Identification of a major epitope recognized by PLA2R autoantibodies in primary membranous nephropathy[J].J Am Soc Nephrol,2015,26(2):302-313.
[13]Kao L,Lam V,Waldman M,et al.Identification of the immunodominant epitope region in phospholipase A2 receptormediating autoantibody binding in idiopathic membranous nephropathy[J].J Am Soc Nephrol,2015,26(2):291-301.
[14]Cravedi P,Abbate M,Gagliardini E,et al.Membranous Nephropathy Associated With IgG4-Related Disease[J].Am J Kidney Dis,2011,58(2):272-275.
[15]Fervenza FC,Downer G,Beck LH Jr,et al.IgG4-related tubulointerstitial nephritis with membranous nephropathy[J].Am J Kidney Dis,2011,58(2):320-324.
[16]Debiec H,Hanoy M,Francois A,et al.Recurrent membranous nephropathy in an allograft caused by IgG3κtargeting the PLA2 receptor[J].J Am Soc Nephrol,2012,23(12):1949-1954.
[17]Dhnrich C,Komorowski L,Probst C,et al.Development of a standardized ELISA for the determination of autoantibodies against human M-type phospholipase A2 receptor in primary membranous nephropathy[J].Clin Chim Acta,2013,421:213-218.
[18]Nasri H.Current concepts on anti-phospholipase A2 receptor antibody in idiopathic membranous nephropathy[J].Iran J Allergy Asthma Immunol,2014,13(2):144-146.
[19]Qin W,Beck LH Jr,Zeng C,et al.Anti-phospholipase A2 receptor antibody in membranous nephropathy[J].J Am Soc Nephrol,2011,22(6):1137-1143.
[20]Ponticelli C,Glassock RJ.Glomerular diseases:membranous nephropathy--a modern view[J].Clin J Am Soc Nephrol,2014,9(3):609-616.
[21]Beck LH Jr.Monoclonal anti-PLA2R and recurrent membranous nephropathy:another piece of the puzzle[J].J Am Soc Nephrol,2012,23(12):1911-1913.
[22]Beck LH Jr.The dominant humoral epitope in phospholipase A2 receptor-1:presentation matters when serving up a slice of π[J].J Am Soc Nephrol,2014,26(2):237-239.
[23]Cravedi P,Ruggenenti P,Remuzzi G.Circulating anti-PLA2R autoantibodies to monitor immunological activity in membranous nephropathy[J].J Am Soc Nephrol,2011,22(8):1400-1402.
[24]Hirayama K,Ebihara I,Yamamoto S,et al.Predominance of type-2 immune response in idiopathic membranous nephropathy.Cytoplasmic cytokine analysis[J].Nephron,2002,91(2):255-261.
[25]Kuroki A,Iyoda M,Shibata T,et al.Th2 cytokines increase and stimulate B cells to produce IgG4 in idiopathic membranous nephropathy[J].Kidney Int,2005,68(1):302-310.
[26]Tipping PG,Kitching AR.Glomerulonephritis,Th1 and Th2:what's new?[J].Clin Exp Immunol,2005,142(2):207-215.
[27]Imai H,Hamai K,Komatsuda A,et al.IgG subclasses in patients with membranoproliferative glomerulonephritis,membranous nephropathy,and lupus nephritis[J].Kidney Int, 1997,51(1):270-276.
[28]Takano T,Elimam H,Cybulsky AV.Complement-Mediated Cellular Injury[J].Semin Nephrol,2013,33(6):586-601.
[29]Roos A,Daha MR,van Pelt J,et al.Mannose-binding lectin and the kidney[J].Nephrol Dial Transplant,2007,22(12):3370-3377.
[30]Augert A,PayréC,de Launoit Y,et al.The M-type receptor PLA2R regulates senescence through the p53 pathway[J].EMBO Rep,2009,10(3):271-277.
[31]Beck LH Jr,Salant DJ.Membranous nephropathy:recent travels and new roads ahead[J].Kidney Int,2010,77(9):765-770.
[32]Bech AP,Hofstra JM,Brenchley PE,et al.Association of anti-PLA2R antibodies with outcomes after immunosuppressive therapy in idiopathic membranous nephropathy[J].Clin J Am Soc Nephrol,2014,9(8):1386-1392.
[33]van den Brand JA,van Dijk PR,Hofstra JM,et al.Longterm outcomes in idiopathic membranous nephropathy using a restrictive treatment strategy[J].J Am Soc Nephrol,2014,25(1):150-158.
[34]Hoxha E,Harendza S,Pinnschmidt H,et al.M-type Phospholipase A2 Receptor Autoantibodies and Renal Function in Patients with Primary Membranous Nephropathy[J].Clin J Am Soc Nephrol,2014,9(11):1883-1890.
[35]Qin HZ,Zhang MC,Le WB,et al.Combined Assessment of Phospholipase A2 Receptor Autoantibodies and Glomerular Deposits in Membranous Nephropathy[J].J Am Soc Nephrol,2016,27(10):3195-3203.
[36]Cattran DC,Kim ED,Reich H,et al.Membranous Nephropathy:Quantifying Remission Duration on Outcome[J].J Am Soc Nephrol,2017,28(3):995-1003.
2016-11-17
2017-04-16)
10.3969/j.issn.1671-2390.2017.07.015
国家自然科学基金(No.81560121)
830054 乌鲁木齐,新疆医科大学(张雪琴);830001 乌鲁木齐市,新疆维吾尔自治区人民医院肾病科(陆晨)
陆晨,E-mail:luchen706@163.com
