营养不良-炎症-动脉粥样硬化综合征对维持性血液透析患者预后的影响
2017-08-09蔡明玉
李 萍 杨 杰 蔡明玉
·论著·
营养不良-炎症-动脉粥样硬化综合征对维持性血液透析患者预后的影响
李 萍 杨 杰 蔡明玉
目的 探讨营养不良-炎症-动脉粥样硬化(malnutrition-inflammation-atherosclerosis syndrome,MIAS)综合征对维持性血液透析患者预后的影响。方法 选择2013年1月至2016年1月在第三军医大学大坪医院血液净化中心维持性血液透析3个月以上的患者256例,收集患者C反应蛋白、白蛋白、脑钠肽、血红蛋白、血钙、血磷、全段甲状旁腺素、β2-微球蛋白、Kt/V水平等。将白蛋白<35 g/L定义为营养不良,C反应蛋白≥8 mg/L定义为存在微炎症,动脉粥样硬化包括冠状动脉疾病、外周血管疾病以及脑血管疾病;根据以上标准将入选患者分成合并MIAS组(即观察组)及无MIAS组(即对照组)。比较2组患者的临床基础资料及1年、2年、3年生存率和全因死亡风险。结果 观察组71例,其中男45例,女26例,平均年龄(60.1±15.1)岁,透析时间(62.75±36.87)个月,血红蛋白(96.56±17.27)g/L;对照组185例,其中男110例,女75例,平均年龄(55.8±15.4)岁,平均透析时间(51.43±27.74)个月,Hb(106.09±18.3)g/L。与对照组比较,观察组患者年龄偏大、透析时间较长、Hb较低,均有统计学差异(P<0.05)。2组患者的1、2、3年生存率分别为:对照组99.5%、94.1%、88.1%,观察组95.8%、83.1%、80.3%。观察组患者的生存率显著低于对照组(Log rank13.419,P=0.000)。与对照组相比,观察组患者全因死亡风险为2.86(95%CI 1.59~5.17,P=0.000),经校正后仍然有统计学意义(HR2.18,95%CI 1.13~4.21,P=0.021)。结论 维持性血液透析患者存在的MIAS是患者全因死亡独立危险因素,明显影响透析患者的长期预后,是病死率增高的重要原因。
营养不良;动脉粥样硬化;维持性血液透析;预后
蛋白-能量营养不良在维持性血液透析(maintenance hemodialysis,MHD)患者中有较高的发生率,常常并发感染、心脑血管疾病等严重并发症,影响生活质量和长期生存率。早在1999年Stenvinkel等[1]提出,在慢性肾衰竭透析患者中存在营养不良-炎症-动脉粥样硬化综合征(malnutritioninflammation-atherosclerosis syndrome,MIAS),MIAS各因素间相互影响、相互促进,可影响患者的生存率。本研究主要探讨MIAS对MHD患者预后的影响。
资料与方法
一、研究资料
选择2013年1月至2016年1月在第三军医大学大坪医院血液净化中心行MHD治疗3个月以上的患者256例,其中男155例,女101例,年龄22~80岁,平均年龄(57.0±15.4)岁,平均透析时间(54.5±30.8)个月。256例MHD患者原发病分别为慢性肾小球肾炎160例,糖尿病肾病66例,高血压肾病11例,多囊肾病8例,狼疮肾炎7例,梗阻性肾病2例,痛风性肾病1例,间质性肾炎1例。入选标准:①18~80周岁;②诊断为慢性肾衰竭,规律透析(每周3次,每次4 h);③同意参加研究,签署知情同意书。排除标准:①近期有感染、创伤、手术、活动性晚期恶性肿瘤或消化道疾病、活动性肝炎等导致营养不良的因素;②有自身免疫性疾病、风湿性疾病活动。
二、方法
1.透析资料 所有患者血液透析时采用碳酸氢盐透析液(Na+140 mmol/L,HCO-332 mmol/L),血管通路为动静脉内瘘或深静脉置管,血流量范围为200~300 ml/min。透析机为瑞典金宝AK95s。透析器为旭化成REXEED系列的透析器,膜面积1.3~1.8 m2,透析液流量500 ml/min。
2.观察指标及标准 收集患者透析前C反应蛋白(C-reactive protein,CRP)、白蛋白(albumin,Alb)、脑钠肽(brain natriuretic peptide,BNP)、血红蛋白(hemoglobin,Hb)、血钙、血磷、全段甲状旁腺素(immunoreactive parathyroid hormone,iPTH)、β2-微球蛋白(β2-microglobulin,β2-MG),并计算Kt/V水平等。
将Alb<35 g/L定义为营养不良,将CRP≥8 mg/L定义为存在微炎症状态,动脉粥样硬化包括冠状动脉疾病(心肌梗塞、心绞痛、冠脉搭桥、冠脉血管介入手术)、外周血管疾病(动脉硬化性闭塞症、动脉血栓形成)以及脑血管疾病(脑梗塞、TIA、脑出血)。
3.分组 将同时存在营养不良、微炎症状态和动脉粥样硬化疾病称为MIAS[1],根据此标准将入选患者分成合并MIAS组(即观察组)及无MIAS组(即对照组)。
三、统计学处理
采用SPSS 18.0统计软件进行数据处理,正态分布的计量资料以均数±标准差表示,非正态分布数据采用中位数(四分位数)表示;计量资料组间比较采用独立样本t检验或Mann-Whitney U检验,计数资料以百分比表示,组间比较采用χ2检验;采用Kaplan-Meier法分析2组患者生存率,采用Cox比例风险模型分析MIAS对患者全因死亡的影响;P<0.05表示差异有统计学意义。
结 果
一、一般资料比较
观察组71例,其中男45例,女26例,平均年龄(60.1±15.1)岁,透析时间(62.75±36.87)个月,Hb(96.56±17.27)g/L;原发病分别为糖尿病17例,慢性肾小球肾炎43例,其他11例。对照组185例,其中男110例,女75例,平均年龄(55.8±15.4)岁,透析时间(51.43±27.74)个月,Hb(106.1± 18.3)g/L;原发病分别为糖尿病49例,慢性肾小球肾炎117例,其他19例。与对照组比较,观察组患者年龄偏大、透析时间较长、Hb较低,均有统计学差异(P<0.05)。2组BNP、血钙、血磷、iPTH、β2-MG、Kt/V均无统计学差异(P>0.05)。
二、生存率比较
2组患者的1、2、3年生存率分别为:对照组99.5%、94.1%、88.1%,观察组95.8%、83.1%、80.3%。观察组患者的生存率明显低于对照组(Log rank13.419,P=0.000)。与对照组相比,观察组患者全因死亡风险为2.86(95%CI 1.59~5.17,P=0.000),经校正后仍然有统计学意义(HR 2.18,95%CI 1.13~4.21,P=0.021)。(表1)
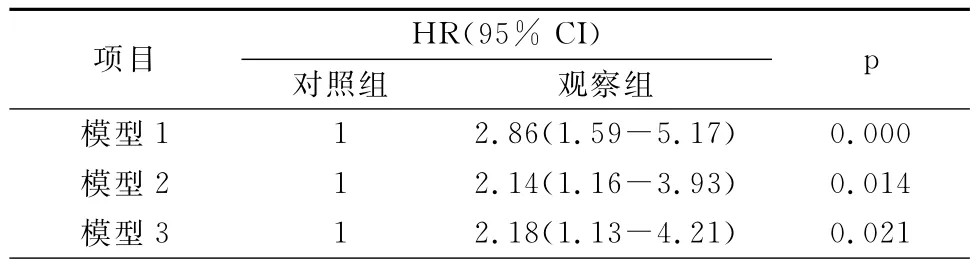
表1 MIAS全因死亡风险
讨 论
Alb水平是反映机体营养状态最经典的指标,在本研究观察组患者Alb仅为(30.96± 3.12)g/L,显著低于对照组,且与对照组相比,年龄更大、透析时间更长。MHD患者常常合并营养不良[2],其主要原因有:①使用生物相容性低的透析器,可导致机体内蛋白质的分解加速,引起营养不良;②血液透析过程中营养物质的丢失是造成血液透析患者营养不良的重要原因;③透析不充分性可引起患者营养摄入减少、厌食;④部分MHD患者可出现精神、心理疾病,出现悲观、绝望等情绪,可影响患者食物消化和吸收[3];⑤内分泌和代谢功能紊乱,包括胰岛素抵抗、对生长激素和胰岛素样生长因子敏感性降低等,高胰岛素血症等可促进蛋白质分解和蛋白质合成减少[4];⑥代谢性酸中毒可引起蛋白质和脂肪的分解代谢增加,亦可导致体内多种酶活性受抑制,使患者出现食欲不振、恶心、呕吐等;⑦MHD患者普遍存在饮食单调且搭配不合理,导致食物摄入蛋白质不足和消耗过多,其发病率达25%~76%[5];且MHD患者可伴有慢性胃肠炎等会加重营养不良;⑧尿毒症毒素中瘦素等中、大分子毒素常规血液透析清除效果差,容易在体内蓄积,引起消化道症状;⑨慢性肾衰竭患者免疫功能较差,容易合并感染,可加剧体内蛋白质的分解,引起营养不良。
慢性肾衰竭患者的微炎症状态同时与营养不良亦存在重要相关性[6]。微炎症状态的MHD患者普遍存在营养不良,以往认为能量和蛋白质摄入不足、透析过程中某些氨基酸的丢失是其的主要原因,但是最近的研究发现透析患者体内CRP和细胞因子水平可预测Alb浓度高低,炎性反应参与透析患者低蛋白血症的发生和发展。在本研究也发现CRP与Alb呈显著的相关性。目前认为微炎症状态导致营养不良的机制主要是炎症因子抑制Alb及肌肉蛋白的合成,加速骨骼肌蛋白分解代谢,以及降低食欲,使营养成分摄入减少。微炎症状态时通过释放炎性因子引起肌肉分解代谢增强,蛋白质的合成减少而致低蛋白血症。
慢性肾衰竭患者微炎症状态是一种非微生物感染引起的慢性进展性、低强度非显性炎症状态,表现为全身循环中炎性细胞因子及炎症标志物轻度持续增高,并因此导致患者各种并发症[7]。微炎症状态与微生物感染引起的全身急性炎症是不同的疾病,微炎症状态是多种因素作用的结果,炎症反应轻微而持久,抗生素治疗效果差。近年来在糖尿病、心脑血管疾病、代谢综合征、慢性肾脏疾病等慢性进展性疾病中均发现有慢性微炎症状态的存在。
慢性肾衰竭患者诱发炎症产生的因素可分为两类,一类是慢性肾衰竭患者代谢所产生的毒素及细胞因子排泄障碍,糖基化终产物及晚期氧化蛋白产物在体内积聚,与单核巨噬细胞表面特异性受体结合,分泌大量的黏附分子,并激活核因子κB(NF-κB),分泌大量炎性细胞因子如白细胞介素IL-6、IL-1及肿瘤坏死因子α(tumor necrosis factorsα,TNF-α)等,肝脏在这些炎症细胞因子的刺激下,分泌大量急性时相蛋白如CRP、淀粉样蛋白等。而慢性肾衰竭时肾脏不能将这些大分子炎性蛋白及细胞因子清除,导致血液中炎症因子蓄积[8]。Panichi等[9]发现慢性肾衰竭尚未透析患者IL-6、CRP明显增高,其增高程度与肌配清除率呈负相关,这说明尿毒症本身可引起炎症反应。另一类是MHD对微炎症状态的影响[10]:①由于透析膜的生物不相容性,血液与透析膜接触后引起补体、白细胞、单核细胞变化,细胞因子、血管活性物质的释放,导致出现相应的临床症状。研究表明铜仿膜可经旁路途径激活补体,C3a、C5a在透析患者明显增高,C3a、C5a可以促进炎症介质的释放,IL-1、TNF水平升高[11]。与铜仿膜相比,合成纤维膜可以使单核细胞释放IL-6减少[12]。②透析液的污染。细菌不能通过完整的透析膜,但其产物如脂多糖、内毒素等致热原可以通过对流或反超滤进入血液,激活单核细胞,合成大量的细胞因子,并激发免疫反应。③血管通路尤其是长期静脉留置导管处的隐匿感染及动静脉内瘘反复穿刺可激活炎症细胞,产生大量的细胞因子,从而参与微炎症状态的维持。
微炎症状态的存在对心血管系统产生不利影响。MHD患者动脉硬化性心脏病的病死率明显上升,较普通人群高10~20倍[13]。在本研究结果中也提示:观察组患者全因死亡风险是对照组的2.86倍,经不同模型校正后仍然有显著差异。现已明确动脉硬化本质上是一种炎症性疾病,机体的炎症状态与心血管疾病有关。目前研究认为微炎症状态可以通过以下几种途径导致血管损伤:CRP通过激活补体系统及与脂蛋白结合加重内皮损伤[14];血管细胞间黏附分子可增加单核巨噬细胞与内皮细胞的黏附,进而诱发动脉硬化的发生发展[15-16]。Owen等[17]长期随访123例透析患者发现,CRP高的患者整体及心血管病死率明显高于CRP低的患者,高CRP患者发生心肌梗死的危险是低CRP患者的3倍,表明炎症在心血管并发症中起重要作用。
MHD患者存在的MIAS是患者全因死亡独立危险因素,明显影响血液透析患者的长期预后,是病死率增高的重要原因。
[1] Stenvinkel P,Heimbürger O,Paultre F,et al.Strong association between malnutrition,inflammation,and atherosclerosis in chronic renal failure[J].Kidney International,1999,55(5):1899-1911.
[2] 马祖等,郑智华.维持性透析患者蛋白-能量营养不良的发病机制及治疗进展[J].中国血液净化,2002,1(2):97-100.
[3] 段丽萍,郑朝霞,吕宁,等.腹膜透析患者营养不良-炎症-心血管疾病和认知功能的关系[J].中国血液净化,2016,15(11):600-604.
[4] 陈娜,陈孟华.探讨腹膜不同转运类型对腹膜透析患者的营养状况、炎症及心血管并发症的影响[J].中国血液净化,2014,13(7):485-488.
[5] 左涛,王忠翠.维持性血液透析患者营养不良的原因及饮食护理[J].现代护理,2009,6(14):112-113.
[6] Anand N,S C C,Alam MN.The malnutrition inflammation complex syndrome-the micsing factor in the perio-chronic kidney disease interlink[J].J Clin Diagn Res,2013,7(4):763-767.
[7] Sehomig M,Eisenhardt A,Ritz E.The microinflammatory state of uremia[J].Blood Purif,2000,18(4):327-332.
[8] Kaysen GA.The microinflammatory state in uremia:causes and potential consequences[J].J Am Soc Nephrol,2001,12(7):1549-1557.
[9] Panichi V,Migliori M,De Pietro S,et al.C reactive protein in patients with chronic renal diseases[J].Ren Fail,2001,23(3-4):551-562.
[10]贾凤玉,孟建中.维持性血液透析治疗技术对MIAS的影响[J].中国血液净化,2005,4(8):453-461.
[11]Craddock PR,Fehr J,Dalmasso AP,et al.Hemodialysis leukopenia.Pulmonary vaseular leukostasis resulting from complement aetivation by dialyzer cellophane membranes[J].J Clin Invest,1977,59(5):879-888.
[12]Memoli B,Minutolo R,Bisesti V,et al.Changes of serum albumin and C-reactive protein are related to changes of interleukin-6 release by peripheral blood mononuclear cells in hemodialysis patients treated with different membranes[J].Am J Kidney Dis,2002,39(2):266-273.
[13]Sueta D,Hokimoto S,Sakamoto K,et al.Validation of the high mortality rate of Malnutrition-Inflammation-Atherosclerosis syndrome:-Community-based observational study[J].Int J Cardiol,2017,230:97-102
[14]Arici M,Walls J.End-stage renal disease,atheroselerosis,and cardiovaseular mortality:is C-reaetive protein the missing link?[J].Kidney Int,2001,59(2):407-414.
[15]Himmelfarb J,McMonagle E,Freedman S,et al.Oxidative stress is inereased in critieally ill patients with aeute renal failure[J].J Am Soc Nephrol,2004,15(9):2449-2456.
[16]Turkmen K,Tonbul HZ,Erdur FM,et al.Peri-aortic fat tissue and malnutrition-inflammation-atherosclerosis/calcification syndrome in end-stage renal disease patients[J].Int Urol Nephrol,2013,45(2013):857-867.
[17]Owen WF,Lowrie EG.C-reaetive protein as an outeome predietor for maintenance hemodialysis patients[J].Kidney Int,1998,54(2):627-636.
Effect of MIA syndrome on prognosis of maintenance hemodialysis patients
LI Ping,YANG Jie,CAI Ming-yu.
Department of Nephrology,Daping Hospital Research Institute of Surgery,the Third Military Medical University,Chongqing400016,China
Objective To study the effect of maintenance hemodialysis(MHD)patients complicated with malnutrition,inflammation and atherosclerosis(MIA)syndrome on the prognosis.Methods
The patients were recruited who have made MHD for more than three months in Hemopurification Center of our hospital between January,2013 and January,2016.If his or her serum albumin was<35 g/L,malnutrition was defined;If his or her C-reactive protein was≥8 mg/L,micro-inflammation was defined.The cerebrovascular diseases include coronary artery diseases,peripheral vascular diseases and cerebrovascular diseases.The patients were divided into two groups based on above standards:observation group and control group.The survival rate and all-cause mortality risk in one year,two years and three years were compared.Results There were 71 patients in observation group[45 males and 26 females;mean age of(60.1±15.1)years;mean hemodialysis vintage of(62.75±36.87)months;mean hemoglobin of(96.56±17.27)g/L],and there were 185 patients in control group[110 males and 75 females;mean age of(55.8±15.4)years;mean hemodialysis vintage of(51.43± 27.74)months;mean hemoglobin of(106.09±18.3)g/L].The patients were older[(60.1±15.1)vs.(55.8±15.4),P<0.05],hemodialysis vintage was longer[(62.75±36.87)vs.(51.43± 27.74),P<0.05],and hemoglobin was lower[(96.56±17.27)vs.(106.09±18.3),P<0.05]inobservation group than in control group.The one-,two-and three-year survival rate was 99.5%,94.1%and 88.1%in control group,and 95.8%,83.1%and 80.3%in observation group,respectiely.The survival rate in observation group was obviously lower than in control group(Log rank 13.419,P=0.000).As compared with control group,the all-cause mortality risk of patients in observation group was 2.86(95%CI,1.59-5.17,P=0.000),which still had statistical significance after adjustment(HR2.18,95%CI,1.13-4.21,P=0.210).Conclusions The MIA syndrome existing in MHD patients is an independent risk factor for their all-cause mortality,which significantly impacts the long-term prognosis of the HD patients,and is an important reason for the increased fatality rate.
Malnutrition;Atherosclerosis;Maintenance hemodialysis;Prognosis
2016-09-14
2017-04-15)
10.3969/j.issn.1671-2390.2017.07.007
400016 重庆,第三军医大学大坪医院野战外科研究所肾内科
