芦丁对肾脏缺血-再灌注损伤的保护作用
2017-08-08袁祖君左松王佳张炯冯胜刚
袁祖君 左松 王佳 张炯 冯胜刚
·实验研究·
芦丁对肾脏缺血-再灌注损伤的保护作用
袁祖君 左松 王佳 张炯 冯胜刚
目的探讨芦丁对肾脏缺血-再灌注损伤(ischemia-reperfusion injury,IRI)的作用及其机制。方法将30只SD大鼠随机分为假手术组(Sham组)、肾脏缺血-再灌注损伤组(IRI组)和芦丁预处理组(Rutin组),每组10只。利用血管夹夹闭左侧肾蒂,并切除右肾的方法构建大鼠IRI模型。利用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测各组血清中尿素氮(BUN)、肌酐(SCr)、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、干扰素γ(interferon-γ,IFN-γ)和白细胞介素8(interleukin-8,IL-8)的表达水平,硫代巴比妥酸(thiobarbituric acid,TBA)检测丙二醛(malondialdehyde,MDA)的含量,黄嘌呤氧化酶法检测过肾脏氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和超氧化物歧化酶(superoxide dismutase,SOD)的活性,逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)检测肾组织TNF-α、IFN-γ和IL-8的信使RNA(mRNA)表达水平,苏木精—伊红染色法(hematoxylin-eosin staining,HE)检测肾脏病理形态。结果与IRI组相比,Rutin组BUN、SCr、TNF-α、IFN-γ、IL-8和MDA的表达水平明显降低(P<0.01),而CAT、GPx和SOD的活性明显增高(P<0.05)。此外,Rutin预处理可明显减轻肾组织病理形态改变(P<0.05)。结论芦丁可通过抑制炎症和氧化应激而减轻肾脏缺血-再灌注损伤。
芦丁;肾脏缺血-再灌注损伤;炎症;氧化应激
肾脏缺血-再灌注损伤(ischemia-reperfusion injury,IRI)是因肾脏血供中断或减少引起肾脏血流和肾脏需求之间不平衡而导致的肾脏损害,重新恢复肾脏血流引起肾脏损伤反而加重的临床危象,容易诱发肾功能受损或肾衰竭,故严重威胁人类生命健康和生活质量[1-4]。芦丁(Rutin)是从中药槐米、槐角中分离的一种黄酮苷类成分,研究发现其多种生物学活性,如抗炎、抗凋亡、抗肿瘤等[5-6]。因此本实验探讨芦丁对IRI的作用及机制。
材料与方法
一、主要试剂和仪器
芦丁(Sigma,USA,经HPLC鉴定纯度超过99%)、水合氯醛(武汉谷歌)、丙二醛(malondialdehyde,MDA)购自美国Sigma,过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和超氧化物歧化酶(superoxide dismutase,SOD)试剂盒购自美国Sigma,肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、干扰素γ(interferon-γ,IFN-γ)酶联免疫吸附试验(ELISA)检测盒(Ebioscience,USA),实时定量逆转录聚合酶链反应(real time reverse transcription polymerase chain reaction,RT-PCR)试剂盒购自美国GeneCopoeia公司,RTPCR引物由擎科生物技术有限公司合成。显微镜(Olympus BX51)及成像系统(HITMAS-30)和苏木精-伊红(hematoxylin-eosin staining,HE)染色后均为南充市中心医院病理科提供。
二、实验动物分组和模型构建
1.实验动物分组 30只健康雄性SD大鼠,SPF级别,体质量220~250 g,由北京华福康实验动物中心提供。放置在SPF动物饲养室内喂养。适应性喂养1周后,状态良好。随机分为假手术组(Sham组)、肾脏缺血-再灌注损伤组(IRI组)和芦丁预处理组(Rutin组),每组10只。Rutin组术前1 h给予芦丁腹腔注射(16 mg/kg),Sham组和IRI组则给予等量生理盐水腹腔注射,IRI组和Rutin组施予肾缺血-再灌注手术。
2.肾缺血-再灌注手术方式 大鼠水合氯醛麻醉状态下,行腹部正中切口,游离组织,分离暴露肾蒂,用血管夹闭左侧肾蒂,纱布覆盖切口置于恒温水浴箱45 min,然后松开血管夹,恢复肾脏血流灌注,去除右侧肾脏,缝合腹部,术毕放回动物房。假手术与上述类似,仅开腹后不夹闭左侧肾蒂。松开血管夹后24 h处死大鼠,收集血清和肾脏标本。实验中,动物状态较好,苏醒较快,无死亡动物,术后给予正常饮食饮水。具体手术方法参考文献[7]。
三、标本收集
各组大鼠在肾脏再灌注24 h后,行腹主动脉取血,室温下3 000 r/min离心10 min后取上清液送连云港中心医院检验科检测血尿素氮(BUN)和血肌酐(SCr)。开腹取左肾,1/3肾置于多聚甲醛做石蜡切片,其余肾组织冻于-80℃冰箱。
四、肾脏病理检查
左肾蜡块4μm切片,脱蜡透明后由病理科实验室行HE染色,光镜下观察形态结构并评分。
分级评分标准:损伤<10%,病理评分为0分;损伤在10%~25%,病理评分为1分;损伤在25%~50%,病理评分为2分;损伤在50%~75%,病理评分为3分;损伤在75%~100%,病理评分为4分,具体评分标准参考文献[7]。
五、RT-PCR检测肾脏促炎症细胞因子的信使RNA水平
采用RT-PCR法检测肾脏TNF-α、IFN-γ和IL-8的信使核糖核酸(mRNA)表达水平。称取适量肾脏组织,于液氮中研磨成粉末状提取总RNA,紫外分光光度计测量浓度。引物序列见表1。采用两步法PCR反应,扩增条件95°C预变性30 s;95°C变性5 s,60°C退火延伸1 min。共40个循环,得到每个样本的循环值(threshold cycle,CT)法,用得到的各样本的CT值按公式2-ΔΔCT计算相对表达量。

表1 本实验所用基因的引物序列
六、血清促炎症细胞因子的表达水平的检测
按照ELISA试剂盒说明书操作步骤,检测血清中TNF-α、IFN-γ和IL-8的表达水平。
七、肾组织MDA含量的检测
利用硫代巴比妥酸(thiobarbituric acid,TBA)法检测肾组织MDA的含量,具体操作按照说明书。
八、肾组织氧化应激酶类活性的检测
按照试剂盒说明书利用黄嘌呤氧化镁法测定肾组织CAT、GPx、SOD活性。
九、统计学处理
采用SPSS 12.0统计软件进行统计分析,计量资料采用均数±标准差表示,两样本均数间比较采用t检验,多样本均数间比较采用单因素方差分析(one-way ANOVA),P<0.05为差异有统计学意义。
结 果
一、芦丁可以减轻肾脏IRI
与Sham组比较,IRI组SCr和BUN明显增加(P<0.01);与IRI组比较,Rutin组SCr和BUN明显降低(P<0.05),这提示芦丁可减轻肾脏IRI。(表2)

表2 芦丁对肾脏IRI的影响
二、芦丁可明显减轻肾脏病理改变
与Sham组相比,IRI组肾小管坏死、管腔充血和中性粒细胞浸润明显增加,其损伤评分为(3.5± 0.5)分,而Sham组损伤评分为(0.2±0.1)分,提示肾小管病理改变明显增加(P<0.01)。Rutin组与IRI组相比,肾小管坏死、管腔充血和中性粒细胞浸润明显减少,其损伤评分为(1.5±0.5)分,提示芦丁可明显减轻肾脏损伤(P<0.05)。本结果显示,芦丁在最佳浓度可明显减轻IRI导致的肾脏病理改变。(图1)
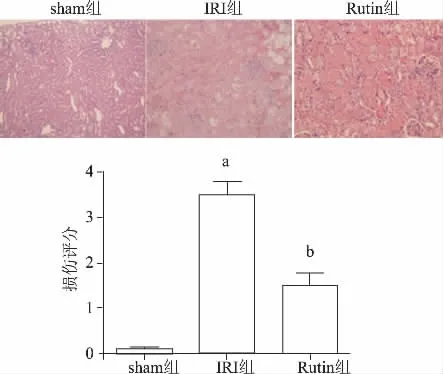
图1 HE染色检测芦丁对肾脏形态的影响
三、芦丁可降低肾脏MDA的含量
与Sham组比较,IRI组MDA表达水平明显增高(P<0.05);与IRI组比较,Rutin组MDA水平明显降低(P<0.05)。结果提示芦丁可明显减少促氧化应激酶MDA的表达。(表3)
表3 芦丁对肾脏MDA表达的影响(±s)

表3 芦丁对肾脏MDA表达的影响(±s)
注:与Sham组比较,aP<0.05;与IRI组比较,bP<0.05
组别 n MDA(nmol/mg)41 IRI组 10 14.68±3.15aRutin组(16 mg/kg) 10 7.22±1.58 Sham组 10 2.11±0.b
四、芦丁可增加肾脏氧化应激酶类的活性
与Sham组比较,IRI组CAT、GPx和SOD活性明显降低(P<0.01);与IRI组比较,Rutin组CAT、GPx和SOD的活性明显增高(P<0.05)。这提示芦丁可增加抗氧化应激酶的活性。(表4)
表4 芦丁对氧化应激酶CAT、GPx和SOD活性的影响(U/mg,±s)
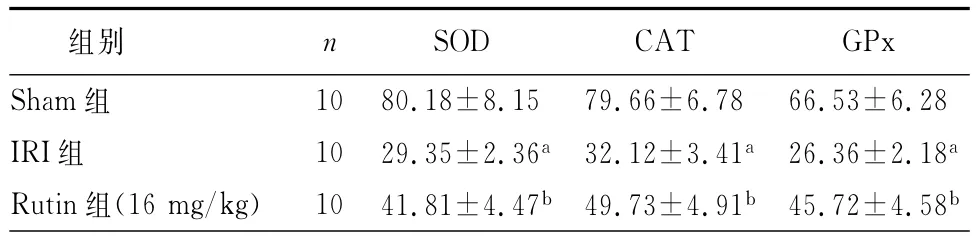
表4 芦丁对氧化应激酶CAT、GPx和SOD活性的影响(U/mg,±s)
注:与Sham组比较,aP<0.01;与IRI组比较,bP<0.05
28 IRI组 10 29.35±2.36a32.12±3.41a26.36±2.18aRutin组(16 mg/kg) 10 41.81±4.47b49.73±4.91b45.72±4.58 SOD CAT GPx Sham组 10 80.18±8.15 79.66±6.78 66.53±6.组别 n b
五、芦丁可降低肾脏促炎症细胞因子的表达
与Sham组比较,IRI组肾脏TNF-α、IFN-γ和IL-8mRNA表达明显增加(P<0.01);与IRI组比较,Rutin组肾脏TNF-α、IFN-γ和IL-8 mRNA表达明显减少(P<0.05)。这提示芦丁可抑制肾脏促炎症细胞因子的表达。(表5)
表5 芦丁对肾脏促炎症细胞因子TNF-α、IFN-γ和IL-8mRNA表达水平的影响(±s)

表5 芦丁对肾脏促炎症细胞因子TNF-α、IFN-γ和IL-8mRNA表达水平的影响(±s)
注:与Sham组比较,aP<0.01;与IRI组比较,bP<0.05
15 IRI组 10 12.00±4.15a9.50±3.12a10.50±1.75aRutin组(16 mg/kg) 10 5.50±2.11b5.12±1.12b6.50±0.75 mRNA Sham组 10 1.00±0.12 1.00±0.10 0.95±0.组别 n TNF-αmRNA IFN-γmRNA IL-8 b
六、芦丁可减少血清中促炎症细胞因子的分泌
与Sham组相比,IRI组血清中TNF-α、IFN-γ和IL-8表达水平明显增高(P<0.01);与IRI组比较,Rutin组血清TNF-α、IFN-γ和IL-8表达水平明显降低(P<0.05)。这提示芦丁可减少促炎症细胞因子的分泌。(表6)
表6 芦丁对血清中促炎症细胞因子TNF-α、IFN-γ和IL-8表达水平的影响(ng/L,±s)
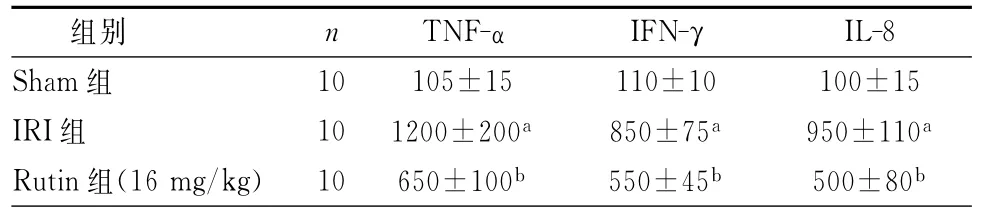
表6 芦丁对血清中促炎症细胞因子TNF-α、IFN-γ和IL-8表达水平的影响(ng/L,±s)
注:与Sham组比较,aP<0.01;与IRI组比较,bP<0.05
组别 n TNF-α IFN-γ IL-8 10 105±15 110±10 100±15 IRI组 10 1200±200a 850±75a 950±110aRutin组(16 mg/kg)10 650±100b 550±45b 500±80 Sham组b
讨 论
肾脏IRI好发于休克、心脏体外大循环和肾移植等手术,是由于肾脏血供中断,导致肾脏缺血,重新开放肾脏血供,导致肾脏损伤进一步加重的临床危象[14]。既往研究显示氧化、炎症、钙超载、中性粒细胞聚集、凋亡是其重要的发病机制[14],其中尤其值得注意的是氧化应激和炎症反应。
肾脏缺血-再灌注时,机体内自由基和炎症因子清除系统严重功能受损,导致活性氧自由基和炎症因子大量产生,广泛攻击肾脏易损区,诱发过氧化和炎症反应的“瀑布状”级联反应,诱发大量MDA以及TNF-α、IFN-γ和IL-8产生,导致肾小管坏死、管腔充血和中性粒细胞浸润,诱导肾脏病理结构改变和肾功能损伤标志物SCr和BUN的增加[89]。此外机体重要的活性氧自由基清除酶CAT、GPx和SOD,在自由基大量增加时,被严重消耗,可致使CAT、GPx和SOD活性明显下降[89]。
芦丁又名紫槲皮苷、芸香苷,是一种来源广泛的黄酮类化合物,研究发现其具有多种药理学活性[56],如抗炎,抗凋亡,抗氧化,抗肿瘤,清除体内各种活性氧自由基,保护如GPx、CAT、谷胱甘肽-S-转移酶等,并对器官IRI具有保护作用[1011]。
本结果显示,芦丁可显著增加CAT、GPx和SOD活性,减少SCr、BUN、MDA、IFN-γ和IL-8的表达以及肾脏病理形态的改变,这提示芦丁可通过抑制炎症和氧化应激而减轻IRI。
综上所述,我们推测芦丁可通过抑制炎症和氧化应激而减轻IRI。但除抑制炎症和氧化应激外,是否还有其他信号途径涉及芦丁减轻肾脏IRI,以及芦丁如何调节炎症和氧化应激,尚需进一步研究。
[1]Kalyanaraman B.Teaching the basics of redox biology to medical and graduate students:oxidants,antioxidants and disease mechanisms[J].Redox biology,2013,1(1):244-257.
[2]Kusch A,Hoff U,Bubalo G,et al.Novel signalling mechanisms and targets in renal ischaemia and reperfusion injury[J].Acta Physiol(Oxf),2013,208(1):25-40.
[3]Wang Y,He J,Pei X,et al.Systematic review and meta-analysis of mesenchymal stem/stromal cells therapy for impaired renal function in small animal models[J].Nephrology,2013,18(3):201-208.
[4]Glodowski SD,Wagener G.New insights into the mechanisms of acute kidney injury in the intensive care unit[J].J Clin Anesth,2015,27(2):175-180.
[5]Ganeshpurkar A.Saluja AK.The pharmacological potential of rutin[J].Saudi Pharm J,2017,25(2):149-164.
[6]Habtemariam S,Lentini G.The therapeutic potential of rutin for diabetes:an update[J].Mini Rev Med Chem,2015,15(7):524-528.
[7]Jia Y,Zhao J,Liu M,et al.Brazilin exerts protective effects against renal ischemia-reperfusion injury by inhibiting the NF-κB signaling pathway[J].Int J Mol Med,2016,38(1):210-216.
[8]Sarica K,Yencilek F.Prevention of shockwave induced functional and morphological alterations:an overview[J].Arch Ital Urol Androl,2008,80(1):27-33.
[9]Malle E,Buch T,Grone HJ.Myeloperoxidase in kidney disease[J].Kidney Int,2003,64(6):1956-1967.
[10]Liu Y,Gou L,Fu X,et al.Protective effect of rutin against acute gastric mucosal lesions induced by ischemia-reperfusion[J].Pharm Biol,2013,51(7):914-919.
[11]Annapurna A,Ansari MA,Manjunath PM.Partial role of multiple pathways in infarct size limiting effect of quercetin and rutin against cerebral[J].Eur Rev Med Pharmacol Sci,2013,17(4):491-500.
The protective effect of rutin on renal ischemia-reperfusion injury
YUAN Zu-jun,ZUO Song,WANG Jia,ZHANG Jiong,FENG Sheng-gang.Department of Nephrology,Nanchong Central Hospital,Nanchong637000,China
FENG Sheng-gang,E-mail:ncfsg@sina.com
ObjectiveTo investigate the effect and mechanism of rutin on renal ischemia-reperfusion injury(IRI).MethodsThirty SD rats were randomly divided into sham operation group(Sham group),renal IRI group(IRI group)and rutin pretreatment group(Rutin group)(n=10 each).The rat IRI model was constructed by clamping the left renal pedicle and removing the right kidney.The ELISA was used to detect the blood urea nitrogen(BUN),serum creatinine(SCr),tumor necrosis factor alpha(TNF-alpha)and interferon gamma(IFN-gamma)and interleukin-8(IL-8).The levels of malondialdehyde(MDA),catalase(CAT),glutathione peroxidase(GPx)and superoxide dismutase(SOD)were determined.The reverse transcriptase polymerase chain reaction was used to detect the expression of TNF-alpha,IFN-gamma and IL-8 mRNA in renal tissues.The pathologic changes of renal tissues were observed by hematoxylin-eosin staining method.ResultsAs compared with the IRI group,the levels of BUN,SCr,TNF-alpha,IFN-gamma,IL-8 and MDA in rutin group were significantly reduced(P<0.01),and the activities of CAT,GPx and SOD increased significantly(P<0.05).In addition,rutin pretreatment significantly alleviated the pathological changes in renal tissue(P<0.05).ConclusionsRutin can attenuate the renal IRI by inhibiting inflammation and oxidative stress.
Rutin;Renal ischemia-reperfusion injury;Inflammtion;Oxidative stress
2016-11-26
2017-06-05)
10.3969/j.issn.1671-2390.2017.06.011
国家自然科学基金(No.81500575)
637000 四川南充,南充市中心医院肾内科(袁祖君,左松,冯胜刚);610000 成都,四川省人民医院肾内科(王佳,张炯)
冯胜刚,E-mail:ncfsg@sina.com
