抗吡虫啉褐飞虱种群对天敌黑肩绿盲蝽抗性发展的影响
2017-08-08蒋显斌尹文兵龙丽萍黄凤宽黄所生吴碧球
凌 炎,黄 芊,蒋显斌,尹文兵,龙丽萍*,黄凤宽,黄所生,吴碧球,李 成
(1.广西农业科学院植物保护研究所/广西作物病虫害生物学重点实验室,广西 南宁 530007;2.广西农业科学院水稻研究所,广西 南宁 530007;3.广东新景象生物工程有限公司,广东 广州 510635)
抗吡虫啉褐飞虱种群对天敌黑肩绿盲蝽抗性发展的影响
凌 炎1,黄 芊2,蒋显斌2,尹文兵3,龙丽萍2*,黄凤宽1,黄所生1,吴碧球1,李 成1
(1.广西农业科学院植物保护研究所/广西作物病虫害生物学重点实验室,广西 南宁 530007;2.广西农业科学院水稻研究所,广西 南宁 530007;3.广东新景象生物工程有限公司,广东 广州 510635)
【目的】了解褐飞虱对吡虫啉产生极高水平抗性后对其主要捕食性天敌黑肩绿盲蝽抗性发展的影响,为协调化学防治与生物防治的关系提供科学依据。【方法】分别用对吡虫啉敏感的褐飞虱种群(SN种群)和极高抗种群(RN种群)连续饲养黑肩绿盲蝽25代以及用吡虫啉对黑肩绿盲蝽连续诱导25代,每隔5代分别测定黑肩绿盲蝽的敏感性和酶活性。【结果】 SNCF25种群的敏感性变化不大;RNCF25种群的LC50值是原来的1.53倍;诱导(INCF25)种群LC50值是原来的1.66倍。SNC、RNC和INC的黑肩绿盲蝽种群F5、F10、F15、F20、F25代的酯酶和谷胱甘肽转移酶活性变化与抗性倍数的变化不一致,而多功能氧化酶活性变化与抗性倍数的变化较一致。【结论】黑肩绿盲蝽对吡虫啉的抗性发展较慢,其抗性发展与酯酶和谷胱甘肽转移酶的活性变化无关,与多功能氧化酶活性的变化成正相关。
吡虫啉;褐飞虱;黑肩绿盲蝽;抗性发展
【研究意义】褐飞虱[Nilaparvatalugens(Stål)]在全世界分布广泛,是水稻生产国的主要害虫之一,具有迁飞性、暴发性和毁灭性等特点。在褐飞虱的综合防控技术体系中,化学防治一直以来是控制褐飞虱的最有效途径。由于化学农药的长期大量使用,许多国家和地区的褐飞虱均已对多种杀虫剂产生了不同程度的抗性[1-2]。2005年中国褐飞虱大发生的主要原因之一就是褐飞虱对吡虫啉产生了极高水平抗性。黑肩绿盲蝽[Cyrtorhinuslividipennis(Reuter)]是水稻产区褐飞虱、白背飞虱[Sogatellafurcifera(Horvath)]和黑尾叶蝉[Nephotettixnigropictus(Stål)]的重要捕食性天敌,主要捕食卵和低龄若虫,在褐飞虱种群自然控制中起着非常重要的作用[3]。因此,了解褐飞虱对吡虫啉产生极高水平抗性后,对其主要捕食性天敌黑肩绿盲蝽抗性发展的影响,对协调化学防治与生物防治的关系具有重要的意义。【前人研究进展】昆虫对杀虫剂产生抗性后,其生理生化指标也可能发生变化,从而影响寄主与其天敌内分泌的相互关系,最终影响到寄生昆虫对相应药剂的敏感性。李元喜研究表明寄主抗药性对菜蛾绒茧蜂有不利影响,用抗性寄主饲育的菜蛾绒茧蜂在寄生敏感寄主时仍表现一定的耐药性,有利于该蜂抗药性的发展,即寄主-寄生蜂之间在抗药性方面存在协同进化[4]。Chilcutt在研究寄生抗Bt小菜蛾的菜蛾绒茧蜂的结茧率时发现类似现象,说明寄主抗药性对寄生昆虫的不利影响在其它杀虫剂中也同样存在;从进化的角度来看,害虫和天敌是一对斗争的统一体,当害虫受杀虫剂作用而产生抗性时,天敌也会对杀虫剂产生抗性[5]。据初步统计,国内外报道了至少44 种天敌对某一种或几种杀虫剂产生了抗药性,其中18 种拟寄生昆虫,12 种植绥螨,6 种草蛉,4 种瓢虫,此外还有管巢蛛、姬螋、姬猎蝽、花蝽、瘿蚊等[6]。Mason在研究寄生斑潜蝇(Liriomyzaspp.)的贝氏潜蝇姬小蜂(Diglyphusbegini)及Baker研究寄生米象(Sitophilusozyae)的米象金小蜂(Anisopteromaluscalandrae)时,发现寄生昆虫的LC50值或抗性倍数比寄主的高[7-8]。这结果表明寄生昆虫有可能比寄主具有更高的抗性。【本研究切入点】协调化学防治与生物防治的关系一直是害虫综合治理中的重要问题。针对如何合理利用天敌和化学杀虫剂治理易对杀虫剂产生抗性的害虫已有一些研究[9-11],但有关昆虫抗药性对其天敌药剂敏感性的影响研究甚少。【拟解决的关键问题】以极高抗吡虫啉的褐飞虱种群和敏感种群为材料,研究抗吡虫啉褐飞虱种群对其主要捕食性天敌黑肩绿盲蝽抗性发展的影响,为保护和利用黑肩绿盲蝽,协调化学防治与生物防治的关系提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 供试水稻 供试水稻品种TN1来自国际水稻研究所,广西农业科学院植物保护研究所实验室自留种。将TN1水稻种子催芽,播于网室的水泥槽内,30 d左右移栽于塑料盆(φ16 cm×14 cm)内,每盆约10 根苗。
1.1.2 供试昆虫 褐飞虱抗性种群从田间采集并经测定筛选获得,对吡虫啉抗性倍数达1000倍以上;敏感种群由浙江省农业科学院植物保护与微生物研究所植保工程研究室提供,在不接触任何药剂的条件下一直用TN1水稻苗饲养繁殖而得;黑肩绿盲蝽从广西农业科学院植物保护研究所网室内饲养褐飞虱敏感种群的养虫笼内采集。抗性和敏感褐飞虱种群均用分蘖期的TN1水稻品种饲养。
将分蘖期的盆栽苗去除黄叶和小的分蘖,并用自来水小心地将稻苗清洗干净,每两盆放于一个养虫笼内,每个养虫笼内接足够数量的产卵期褐飞虱雌成虫(褐飞虱抗性种群RN和敏感种群SN分开,并做好标记),每2 d将产卵虫移到另外的养虫笼产卵,得到的产卵苗用于饲养黑肩绿盲蝽,连续饲养25代。
1.1.3 供试药剂 96.04 %吡虫啉原粉:拜耳作物科学有限公司提供。
1.2 试验方法
1.2.1 黑肩绿盲蝽对吡虫啉的敏感性测定方法 采用药膜法并加以改进[12]。即在预备试验的基础上,用丙酮将杀虫剂等比稀释成4~6个浓度。在闪烁瓶(φ2.5 cm×5.5 cm)中加入0.5 mL药液,每处理重复3次,以丙酮为对照。加好药液后闪烁瓶平放在水平桌面上滚动,使闪烁瓶内侧形成均匀的药膜。丙酮挥发后(2.5 h)每瓶接10头3龄中期黑肩绿盲蝽,瓶子横放,让试虫在药膜上爬行3 h,然后转入有孕穗期连根(用脱脂棉包住并加水保湿)稻茎(高约10 cm)的矿泉水瓶中(倒放),再接入20~30头1~2龄褐飞虱若虫作为食料。用海绵塞封住瓶口。最后将试虫置于(26±1)℃,光照16 L/8 D的光照培养箱中,3 d后检查死虫数。
1.2.2 吡虫啉抗性诱导 用上一代的LC50值处理试虫,方法与药剂敏感性测定相同,处理过的试虫用敏感褐飞虱的卵饲养。
1.2.3 酶活性测定 ①酯酶活性测定:参照Han等[13]方法,取雌虫1 头,用 0.5 mL磷酸缓冲液(0.02 mol/L,pH=7.0)匀浆,然后在 4000 r·min-1,4 ℃下离心15 min,上清液为酯酶酶液,取100 μl酯酶酶液加到酶标板孔中,然后再加入50 μl α-醋酸萘酯(2 mmol/L)和固蓝RR盐(1.5 mmol)混合液,在酶标仪上 450 nm处测OD值。用α-萘酚作标准曲线,根据所测定的OD值,在标准曲线上计算产物生成量。各处理重复40次。②谷胱甘肽转移酶活性测定:参照Kao等(1989)[14]方法,取5 头雌虫于0.4 mL磷酸缓冲液(0.1 mol/L,pH=8.0)中冰浴匀浆,10 000 r·min-1,4 ℃下离心10 min。以1,2-二氯-4-硝基苯(DCNB)作底物,3 mL反应体系中含1 mmol/L还原型谷胱苷肽(GSH)和DCNB,0.1 mol/L磷酸缓冲液(pH=8.0),0.1 mL酶液。25 ℃反应 5 min后,以磷酸缓冲液作为对照,于紫外可见分光光度计 344 nm处测定光密度值,每处理设3 次重复。③多功能氧化酶氧-脱甲基酶活性测定:参照Sang等(1984)[15]方法,取 15 头雌虫加1.5 mL磷酸缓冲液(0.1 mol/L,pH=7.8,含1 mmol/L α-苯基硫脲、α-苯基磺酰氟及EDTA,0.1 mmol/L,4-二硫苏糖醇,10 %苷油)冰浴匀浆,10 000 r·min-1,4 ℃下离心 10 min,上清液作酶液用。取 1 mL磷酸缓冲液,1 mL酶液,0.01 mL对硝基苯甲醚(0.1 mol/L,用丙酮配制),2.5 mg NADPH,定容至 25 mL。置气浴摇床中于 37 ℃摇晃反应 30 min,加入 1 mL盐酸溶液(1 mol/L)终止反应。加 5 mL氯仿萃取,取 3 mL氯仿层与 3 mL NaOH溶液(0.5 mol/L)混合后,再取NaOH层于400 nm处测定光密度值。用对硝基苯酚制作标准曲线,每处理重复3次。④可溶性蛋白含量测定:参照Bradford[11],采用考马斯亮蓝G-250法测定,以牛血清蛋白(BSA)制作标准曲线。
2 结果与分析
2.1 不同黑肩绿盲蝽种群对吡虫啉的敏感性
从表1可见,黑肩绿盲蝽CF0经褐飞虱敏感种群(SN)饲养25代后,敏感性变化不大;经褐飞虱抗性种群(RN)饲养25代后,敏感性有所下降,LC50值是原来的1.53倍;经吡虫啉抗性诱导25代后,敏感性也有所下降,LC50值是原来的1.66倍。从结果看黑肩绿盲蝽不管是经褐飞虱抗性种群饲养还是用吡虫啉诱导,抗药性上升均较慢。
2.2 不同黑肩绿盲蝽种群的酯酶活性变化
从表2可见,RNC、SNC和诱导黑肩绿盲蝽种群F5、F10、F15、F20、F25代的酯酶活性均变化不大,同种群间差异不显著,与F0代的黑肩绿盲蝽酯酶活性差异也不显著,各酯酶活性变化与抗性倍数的变化不一致。由此推测,黑肩绿盲蝽的抗性与酯酶活性变化相关性不大。
2.3 不同黑肩绿盲蝽种群的谷胱甘肽转移酶活性变化
从表3~4可见,以DCNB和CDNB为酶促反应底物时,RNC、SNC和诱导的黑肩绿盲蝽种群F5、F10、F15、F20、F25代的谷胱甘肽转移酶活性均有波动,同种群间存在差异显著性,与F0代的黑肩绿盲蝽谷胱甘肽转移酶活性差异也显著,但各谷胱甘肽转移酶活性变化与抗性倍数的变化不一致。由此推测,黑肩绿盲蝽的抗性与谷胱甘肽转移酶活性变化相关性不大。
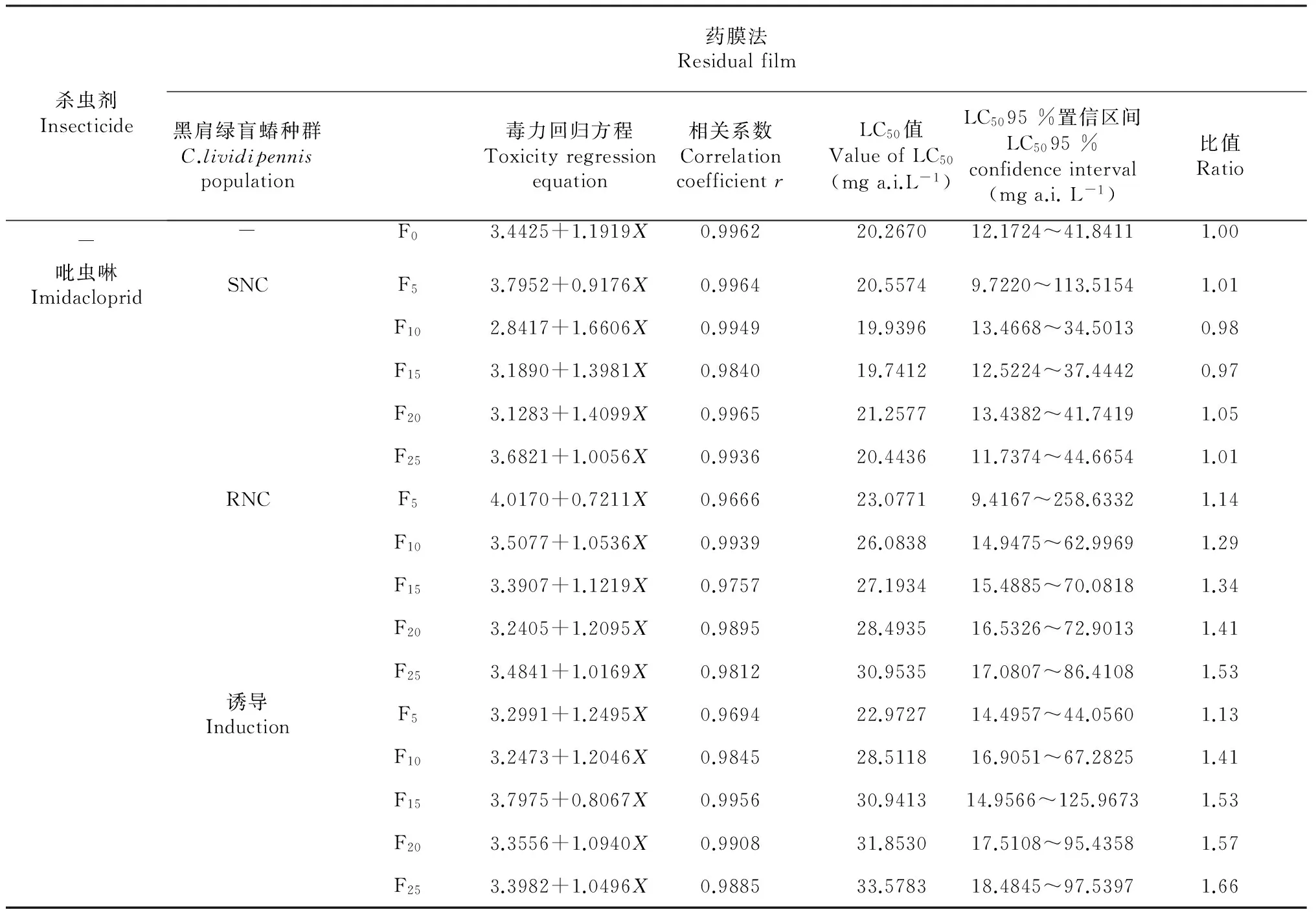
表1 不同黑肩绿盲蝽种群对吡虫啉的敏感性
注:比值=各种群的LC50值/F0的LC50值;F0、F5、F10、F15、F20、F25表示第0、5、10、15、20、25代,下同。 Note: Ratio = the LC50of the each population /the LC50of the F0;The F0,F5,F10,F15,F20,F25show gen0,gen5,gen10,gen15,gen20,gen25.The same as below.

表2 不同黑肩绿盲蝽种群的酯酶活力
注:不同字母表示0.05水平下差异显著。下同。
Note: Different letters show significance of difference at 0.05 level.The same as below.
表3 不同黑肩绿盲蝽种群谷胱甘肽转移酶活力

Table 3 The activity of GST in different C. lividipennis populations with DCNB fundus substand [△OD min-1mg-1, (mean±SE)]
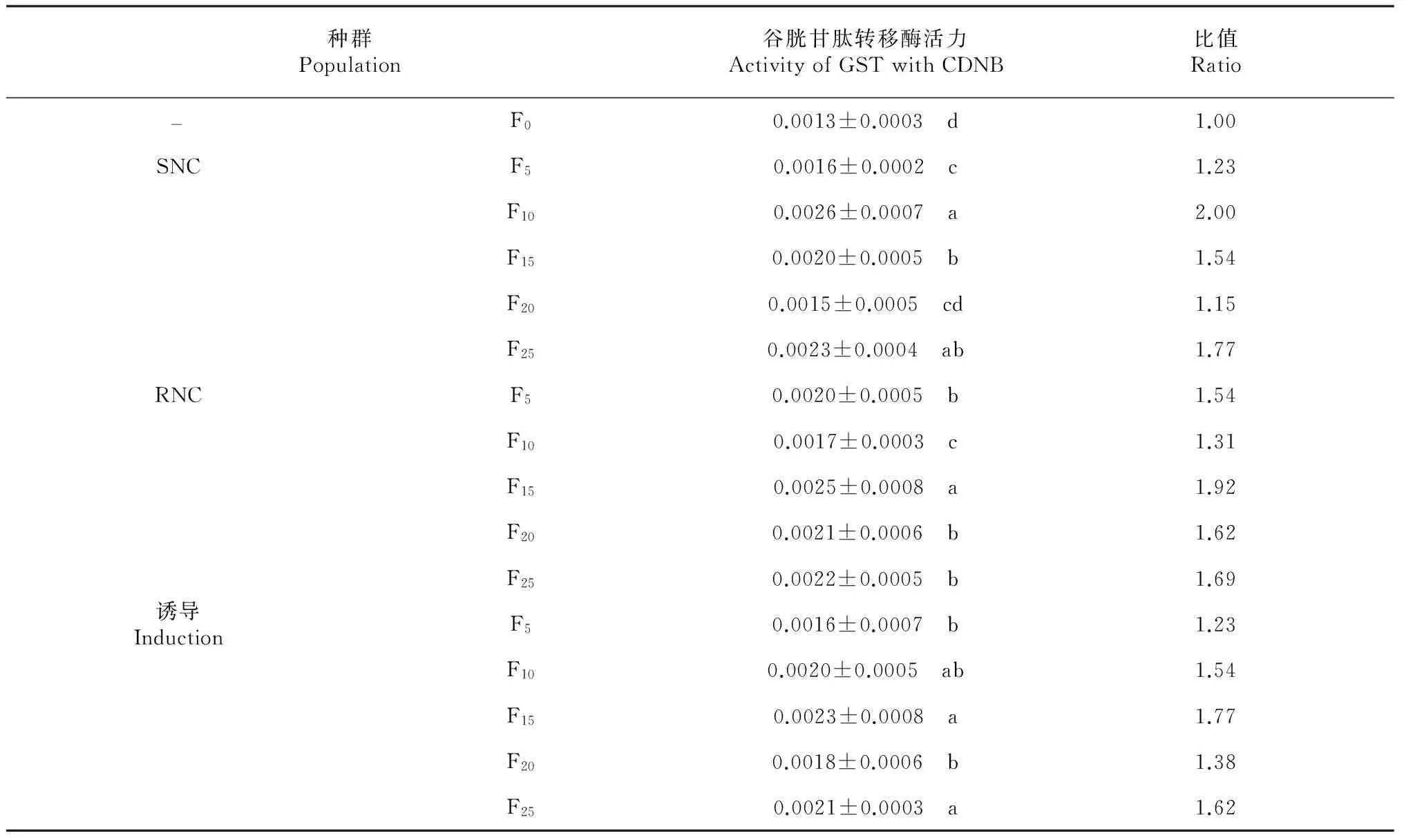
表4 不同黑肩绿盲蝽种群谷胱甘肽转移酶活力
2.4 不同黑肩绿盲蝽种群的多功能氧化酶活性变化
从表5 可见,SNC、RNC和诱导黑肩绿盲蝽种群F5、F10、F15、F20、F25代的多功能氧化酶活性均有所变化,除SNC种群外,另外2个种群同种群间差异显著性,与F0代的黑肩绿盲蝽多功能氧化酶活性差异也显著,且各多功能氧化酶活性变化与抗性倍数的变化较一致。由此推测,黑肩绿盲蝽的抗性与多功能氧化酶活性变化相关性较大。
表5 不同黑肩绿盲蝽种群多功能氧化酶活力
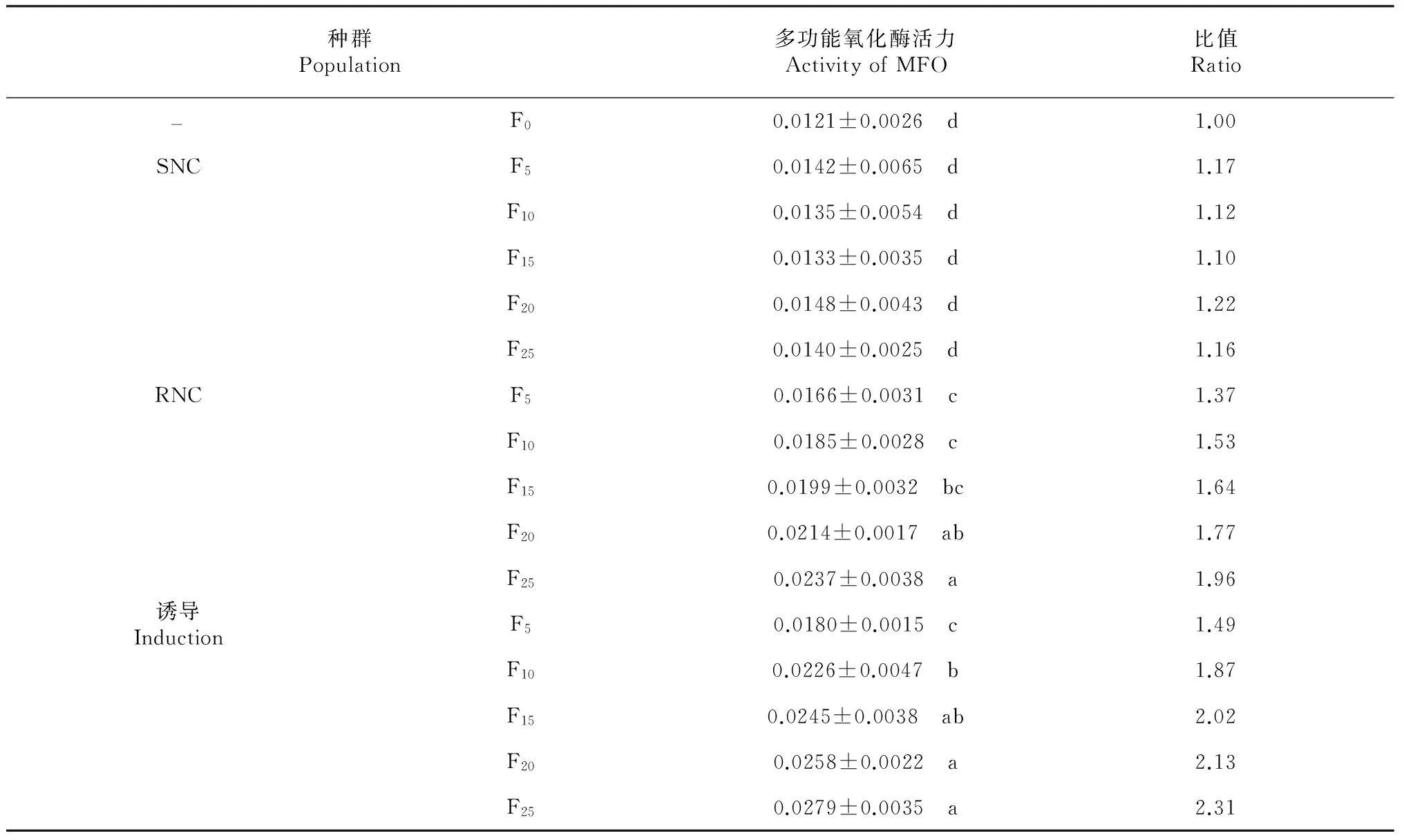
Table 5 The activity of MFO in different C. lividipennis populations [nmolmin-1mg-1, (mean±SE)]
3 讨 论
本研究发现黑肩绿盲蝽CF0无论是经抗吡虫啉褐飞虱种群(RN)饲养25代还是经吡虫啉抗性诱导25代,敏感性均变化不大,LC50值不到原来的2倍,说明黑肩绿盲蝽不管是捕食抗吡虫啉的褐飞虱还是直接用吡虫啉来诱导,抗性上升都比较慢。原因可能为:一是抗吡虫啉的褐飞虱体内所含的吡虫啉剂量较低,加上黑肩绿盲蝽自身的代谢作用,所以抗性上升较慢;二是抗性筛选时,与采用的是药膜法有一定关系,药剂只作用于虫体的表面,很少剂量直接进入虫体内有关;三是本研究采集的黑肩绿盲蝽可能不含有或很少含有对吡虫啉有抗性的基因,因此筛选的过程中较难产生抗性,以上原因有待进一步的研究。
酯酶(Es)、谷胱甘肽S-转移酶(GSTs)和多功能氧化酶(MFOs)是昆虫体内3种重要的解毒酶,在昆虫内源化合物的合成、信号传导及外源化合物和农药代谢等方面起着重要的作用,是目前昆虫对多种农药产生抗性的主要原因[16]。Es是昆虫体内一类重要的解毒酶,属水解酶,能水解酯键,主要参与有机磷类、氨基甲酸酯类和部分拟除虫菊酯类杀虫剂的解毒代谢,通过阻断作用来分解外源有毒有害物质进行解毒,或通过螯合作用与有毒物质相结合,使有毒物质无法达到作用靶标,其活性的改变与昆虫的抗性有关[14]。在抗性品系昆虫中,酯酶活性增高被认为是水解酶介导的抗性主要机理之一[17]。GSTs是催化还原型谷胱甘肽(glutathione,GSH)与各种亲电子化合物进行亲核加成反应的一类酶。GSTs 能够使亲电化合物亲水性增加,使其易于排出体外[18]。在昆虫体内,GSTs 不仅参与了多种植物次生物质的代谢[19],还参与了杀虫剂的代谢[20]。MFOs由多个组份组成, 其中细胞色素P450 是该酶系的核心部分, 在整个酶系的氧化代谢过程中起着末端氧化作用,在昆虫的生长发育、昆虫对寄主植物的适应性及对杀虫剂的抗药性中起着重要作用。潘文亮等研究发现棉蚜抗性与羧酸酯酶和谷胱甘肽S-转移酶活力升高有关[21],杨焕青等研究发现羧酸酯酶、谷胱甘肽S-转移酶和乙酰胆碱酯酶比活力的升高是引起棉蚜对吡虫啉产生抗性的主要生化原因[22]。Puinean等研究指出桃蚜和褐飞虱对吡虫啉抗性的产生主要与P450单加氧酶活性的提高有关[23-24],Shi等也认为棉蚜对吡虫啉的抗性可能是由于棉蚜P450 单加氧酶对吡虫啉解毒能力提高所致[25]。本研究发现黑肩绿盲蝽SNC、RNC和诱导种群F5、F10、F15、F20、F25代的Es和谷胱甘肽转移酶(GST)活性变化与抗性倍数的变化不一致,而MFO活性变化与抗性倍数的变化较一致,因此认为黑肩绿盲蝽对吡虫啉的抗性与ES和GST的活性变化无关,而与(MFO)活性的变化成正相关。这与刘泽文(2003)研究的褐飞虱对吡虫啉的抗性与多功能氧化酶活性的变化成正相关有相似之处。这可能与黑肩绿盲蝽的ES和GST不参与吡虫啉的解毒代谢及非靶标酶有关。另外,有关不同昆虫对同种药剂的解毒代谢差异有待进一步研究。
4 结 论
黑肩绿盲蝽对吡虫啉的抗性发展较慢,其抗性发展与ES和GST的活性变化无关,与MFO活性的变化成正相关。
[1]凌 炎,黄凤宽,龙丽萍,等. 中国和越南褐飞虱抗药性研究[J].应用昆虫学报,2011,48(5):1374-1380.
[2]Garrood W T,Zimmer C T,Gorman K J,et al. Field-evolved resistance to imidacloprid and ethiprole in populations of brown planthopperNilaparvatalugenscollected from across South and East Asia[J]. Pesticide Biochemistry and Physiology,2016,72(1):140-149.
[3]陈建明,程家安,何俊华. 温度和食物对黑肩绿盲蜻发育、存活和繁殖的影响[J]. 昆虫学报,1994,37(l):63-70.
[4]李元喜,刘树生,唐振华. 寄主抗药性对菜蛾绒茧蜂抗药性发展的影响[J]. 昆虫学报, 2002b,45(5):597-602.
[5]Chilcutt C F,Tabashnik B E. Host-mediated competition between the pathogenBacillusthuringiensisand the parasitoidCotesiaplutellaeof the diamond back moth (Lepidoptera: Plutellidae)[J]. Environmental Entomology,1997a,26(1):38-45.
[6]冯 涛,彭 宇,刘凤想,等. 昆虫天敌抗药性研究进展[J]. 昆虫天敌,2002,24(4): 180-184.
[7] Mason G A,Johnson M W. Tolerance to permethrin and fenvalerate in hymenopterous parasitoids associated withLiriomyzaspp. (Diptera:Agromyzidae)[J]. Journal of Economic Entomology,1988,81(1):123-126.
[8]Baker J E,Throne J E. Evaluation of a resistant parasitoid for biological control of weevils in insecticide treated wheat[J]. Journal of Economic Entomology,1995,88 (6):1570-1579.
[9]Havron A,Kenan G, Rosen D. Selection for pesticide resistance inAphytis. Ⅱ.A.lingnanensis,a parasite of the California red scale[J]. Entomologia Experimentalis et Applicata,1991,61:229-235.
[10]Zchori-Fein E,Roush R T, Sanderson J P. Potential for integration of biological and chemical control of greenhouse whitefly (Homoptera:Aleyrodidae)usingEncarsiaformosa(Hymenoptera:Aphelinidae)and abamectin[J]. Environmental Entomology, 1994,23 (5):1277-1282.
[11]Brodford M M. Arapidand sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72:248-254.
[12]孙定炜. 杀虫剂对褐飞虱捕食性天敌黑肩绿盲蝽的影响研究[D].南京农业大学硕士论文, 2007.
[13] Han Z J,Moores G D,Jan D,et al. Association between Biochemical Markersand Insecticide Resistance in the Cotton Aphid,Aphigossynii Glover[J]. Pesticide Biochemistry and Physiology,1998,62(3):164-171.
[14]Kao L R, Motoyama N, Dauterman W C. The purification and characterization of esterase from insecticide resistance and susceptible house flies[J]. Pesticide Biochemistry and Physiology,1989,23:228-239.
[15]Sang C,Soderlund D M. Monooxygenase activity of tobacco budworm(HeliothisvirescenesF.)larvae: tissue distribution and optimal assay conditions for the gut activity[J]. Comparative Biochemistry and Physiology,1984,79(3):407- 411.
[16]Konanz S. Characterization of mechanisms of resistance to common insecticides in noctuid pest species and resistance risk assessment for the new lepidopteran specific compound flubendiamide[D]. Stuttgart: University Hohenheim,2009.
[17]周斌芬,唐振华,高菊芳.昆虫代谢抗性的研究进展[J]. 农药,2008,47(5):313-323.
[18]Rushmore T H,Pickett C B. Glutathione S-transferases, structure,regulation,and therapeutic implications[J]. The Journal of Biological Chemistry,1993,268(16):11475-11478.
[19]Motoyama N,Dauterman W C. Glutathione Stransferases: their role in the metabolism of organophosphorus insecticides[J]. Review of Biochemistry Toxicology,1980(2):49-69.
[20]Yu S J. Consequences of induction of foreign compounds metabolizing-enzyme in insects[M] //Brattsten L B,Ahmad S. Molecular Aspects of Insect-Plant Association. New York:Plenum Press,1986.
[21]杨焕青,王开运,王红艳,等. 抗吡虫啉棉蚜种群对吡蚜酮等药剂的交互抗性及施药对其生物学特性的影响[J]. 昆虫学报,2009,52(2):175-182.
[22]潘文亮,党志红,高占林. 棉蚜抗吡虫啉品系和敏感品系主要解毒酶活性比较[J]. 昆虫学报,2003,46(6):793-796.
[23]Puinean A M,Denholm I,Millar N S,et al. Characterisation of imidacloprid resistance mechanisms in the brown planthopper,Nilaparvatalugens(Stål)(Hemiptera: Delphacidae)[J]. Pesticide Biochemistry and Physiology,2010a,97(2):129-132.
[24]Puinean A M,Foster S P,Oliphant L,et al. Amplification of a cytochrome P450 gene is associated with resistance to neonicotinoid insecticides in the aphidMyzuspersicae[J]. Plos Genetics,2010b,6:e1000999.
[25]Shi X B,Shi X G,Wang H Y,et al. Crossresistance of the imidacloprid-resistant population of Aphis gossypii Glover (Homoptera: Aphididae)to other neonicotinoid insecticides and changes in activities of related enzymes[J]. Acta Entomologica Sinica,2011,54(9):1027-1033.
(责任编辑 温国泉)
Effects of Feeding Imidacloprid ResistantNilaparvatalugenson Resistance Development ofCyrtorhinuslividipennis(Reuter)
LING Yan1,HUANG Qian2,JIANG Xian-bin2,YIN Wen-bin3,LONG Li-ping2*,HUANG Feng-kuan1,HUANG Suo-sheng1,WU Bi-qiu1,LI Cheng1
(1.Plant Protection Research Institute, Guangxi Academy of Agricultural Sciences/Guangxi Key Laboratory for Biology of Crop Diseases and Insect Pests, Guangxi Nanning 530007, China;2.Rice Research Institute, Guangxi Academy of Agricultural Sciences, Guangxi Nanning 530007, China; 3.Guangdong New Scene Bioengineering Company, Guangdong Guangzhou 510635, China)
【Objective】The influence ofNilaparvatalugensto resistance development of it's main natural predatorsCyrtorhinuslividipennisafterNilaparvatalugensproduceed highly resistant to imidacloprid was studied in order to provide scientific basis for coordinating the relationship between chemical control and biological control.【Method】Cyrtorhinuslividipenniswas fed for 25 generations byNilaparvatalugenssensitive(SN)or high level resistance(RN)to imidacloprid population, and set induced population as control (with imidacloprid, constantly for 25 generations). Then the sensitivity and enzyme activity ofCyrtorhinuslividipenniswere determined for every 5 generations.【Result】There was little change for the sensibility of SNCF25, while the LC50of RNCF25was 1.53 times higher than the original, and that of INCF25was 1.66 times higher. For the F5, F10, F15, F20, F25generations of SNC, RNC, and INC population ofCyrtorhinuslividipennis, the changes between resistance ratio and the activity of esterase or glutathione S-transferase were not concurrent, but the changes of mixed function oxidase activity were concurrent with the resistance ratio.【Conclusion】The development ofCyrtorhinuslividipennisresistance to imidacloprid was slow, which was not related to the change of esterase and glutathione transferase activity and positively correlated with the change of mixed function oxidase activity.
Imidacloprid;Nilaparvatalugens;Cyrtorhinuslividipennis;Resistance development
1001-4829(2017)6-1369-07
10.16213/j.cnki.scjas.2017.6.023
2017-03-21
国家自然科学基金项目(31560510;31360437);广西作物病虫害生物学重点实验室基金项目(16-ST-5);广西农业科学院基本科研业务专项项目(2015YT18,2016YM30,2016JZ23)
凌 炎(1980-),瑶族,女,广西平南人,硕士,副研究员,主要研究方向为农业昆虫与害虫防治,*为通讯作者:龙丽萍,E-mail:longlp@sohu.com。
S476.2
A
