萝卜细胞质雄性不育的分子鉴定及orf138/orfB基因序列差异性分析
2017-08-08李晓梅冉茂林
李晓梅,柴 靓,杨 峰,冉茂林,3 *
(1.四川省农业科学院水稻高粱研究所,四川 德阳 618000;2.四川省农业科学院作物研究所,四川 成都 610066;3.蔬菜种质与品种创新四川省重点实验室,四川 成都 610066)
萝卜细胞质雄性不育的分子鉴定及orf138/orfB基因序列差异性分析
李晓梅1,柴 靓2,杨 峰1,冉茂林1,3 *
(1.四川省农业科学院水稻高粱研究所,四川 德阳 618000;2.四川省农业科学院作物研究所,四川 成都 610066;3.蔬菜种质与品种创新四川省重点实验室,四川 成都 610066)
【目的】本研究旨在了解萝卜雄性不育细胞质的分子特征。【方法】以8份萝卜细胞质雄性不育系及其保持系、5份不育材料及6个萝卜品种为试材,利用线粒体基因orf138及orfB为分子标记,设计特异引物对材料进行扩增,并对扩增产物进行测序分析。【结果】8份萝卜细胞质雄性不育系、5份不育材料及5个萝卜品种检测到含有orf138特异片段,为Ogura胞质类型,不育系相应保持系则未检测到特异片段;对扩增产物测序发现所有Ogura胞质材料可分为2种类型,Type A和Type H;27份材料orfB特异扩增后,其产物按编码区核苷酸序列的差异可分为2个类型,Ogura胞质中序列一致,普通胞质中序列一致。【结论】由此可见,orf138与orfB基因在Ogura胞质与普遍胞质间均差异明显,可利用orf138的有无及orfB基因的核苷酸序列差异进行胞质类型鉴定。
萝卜(RaphanussativusL.);雄性不育细胞质;分子鉴定;orf138;orfB
【研究意义】萝卜(RaphanussativusL.)是一种古老的蔬菜作物,我国现今年平均种植面积约120万hm2,为我国第三大蔬菜作物。萝卜为典型的异花授粉植物,自交衰退严重,其杂种优势明显。利用细胞质雄性不育系做母本进行杂交制种是当前萝卜杂种优势利用的有效途径,具有杂种一代纯度高、制种成本低、亲本不易流失等优点[1]。细胞质雄性不育性(CMS)是由胞质基和核基因共同作用的一种母性遗传,已被证实与线粒体基因有关,线粒体基因组分子内或分子间的重组或重排,可以形成嵌合基因或新的开放阅读框(ORF)而导致CMS[2-3]。【前人研究进展】自1968年日本学者小仓发现第一个萝卜细胞质雄性不育类型(Ogura CMS)以来,现今已有77-01A、Kos、NWB及DCGMS等不同胞质类型被发现[4-8],但Ogura CMS因败育彻底,育性易于恢复,到目前为止为研究最充分、应用最广泛的不育胞质,现已通过杂交和体细胞融合等技术转育到其他十字花科作物中[9-11]。研究证明,线粒体基因orf138是导致Ogura CMS的主控因子,引起败育的原因可能是其表达产物对线粒体活性有毒性从而抑制花药绒毡层的形成[12-14]。orfB为atp8同系物,负责编码ATPase,与线粒体能量代谢有关,存在于Ogura胞质和普通胞质中,其与细胞质雄性不育的关系争议较大。Ogura CMS正是orf138插入orfB的5′端形成,因此orf138-orfB为Ogura CMS线粒体基因组中的重要结构[15-17]。诸多研究者利用orf138和orfB为分子标记进行萝卜胞质鉴定与分类,依orf138核苷酸碱基位点的差异,Ogura CMS被分为9个类型(Type A→I),依编码区及侧翼碱基的差异,orfB被分为3个类型(Type 1→3),其中Type1为Ogura CMS特有,这些发现证明了Ogura CMS具有丰富的多态性,有助于进行胞质类型鉴定及不同材料进化关系的研究[18-21]。鉴定萝卜胞质不育类型并对其进行分类,是有效进行细胞质雄性不育系选育的前提和基础,不仅可以提高种质材料的利用效率,还可以加快杂种一代选育进程,同时还将有助于研究细胞质基因与核基因互作机理[22-23]。【本研究切入点】本试验利用orf138和orfB为分子标记对8份萝卜细胞质雄性不育系,8份萝卜细胞质雄性不育保持系,5份不育材料及6个萝卜品种进行胞质鉴定,同时对PCR产物进行测序以分析其差异性。【拟解决的关键问题】旨在为加快萝卜CMS的转育奠定一定的理论基础。
1 材料与方法
1.1 供试材料
植物材料:本试验所用材料共27份,包括8份萝卜雄性不育系及其保持系、5份不育材料和6个萝卜品种,每个材料取3个单株,重复2次。不育系“沈A”由沈阳市农业科学院提供,“藏萝卜A”为甘孜州理塘县藏萝卜中发现的不育株,6个商业品种购于市场,其他材料均为四川省农业科学院水稻高粱研究所萝卜课题组的育种材料,各材料的性状及来源见表1。
试剂盒、酶:通用型植物DNA提取试剂盒,PCR扩增所用的TaqPlus、TaqPlus Buffer和Super pure dNTPs均购自天根生化科技(北京)公司(TIANGEN)。
1.2 试验方法
1.2.1 植物总DNA的提取 剪取萝卜幼嫩叶片约2 g,按照TIANGEN公司通用型植物DNA提取试剂盒产品说明提取总DNA,将提取的DNA用TE稀释至200 ng·μl-1,保存于-20 ℃,以备后续使用。
1.2.2 PCR扩增及测序 以萝卜线粒体全基因组(Ogura-type GenBank:AB694744及Normal-type GenBank:AB694743)中包含orf138及orfB(atp8)特异片段的序列为模板[17],使用Primer Premier 5.0设计3对特异性引物(表2),引物由上海生工合成。PCR反应体系为25 μl,含40 ng DNA,2.5 μl 10×TaqPlus Buffer(含Mg2+),2 μl 2.5 mM Super pure dNTPs,0.5 μl 10 μM正向引物,0.5 μl 10 μM反向引物,0. 5 μl 2.5 U/μlTaqPlus,用ddH2O补齐25 μl。PCR反应程序为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,30 次循环;最后72 ℃延伸10 min。 PCR产物于1.2 %琼脂糖凝胶上电泳检测,并切胶、回收、送交上海生工测序。序列分析在 NCBI上进行(http://www.ncbi.nlm.nih.gov),利用NCBI网站中的BLAST序列比较工具软件进行序列同源性分析(http://www.ncbi.nih.gov/BLAST),利用DNAMAN(Version 7.0)软件进行碱基及氨基酸序列多重比较分析。
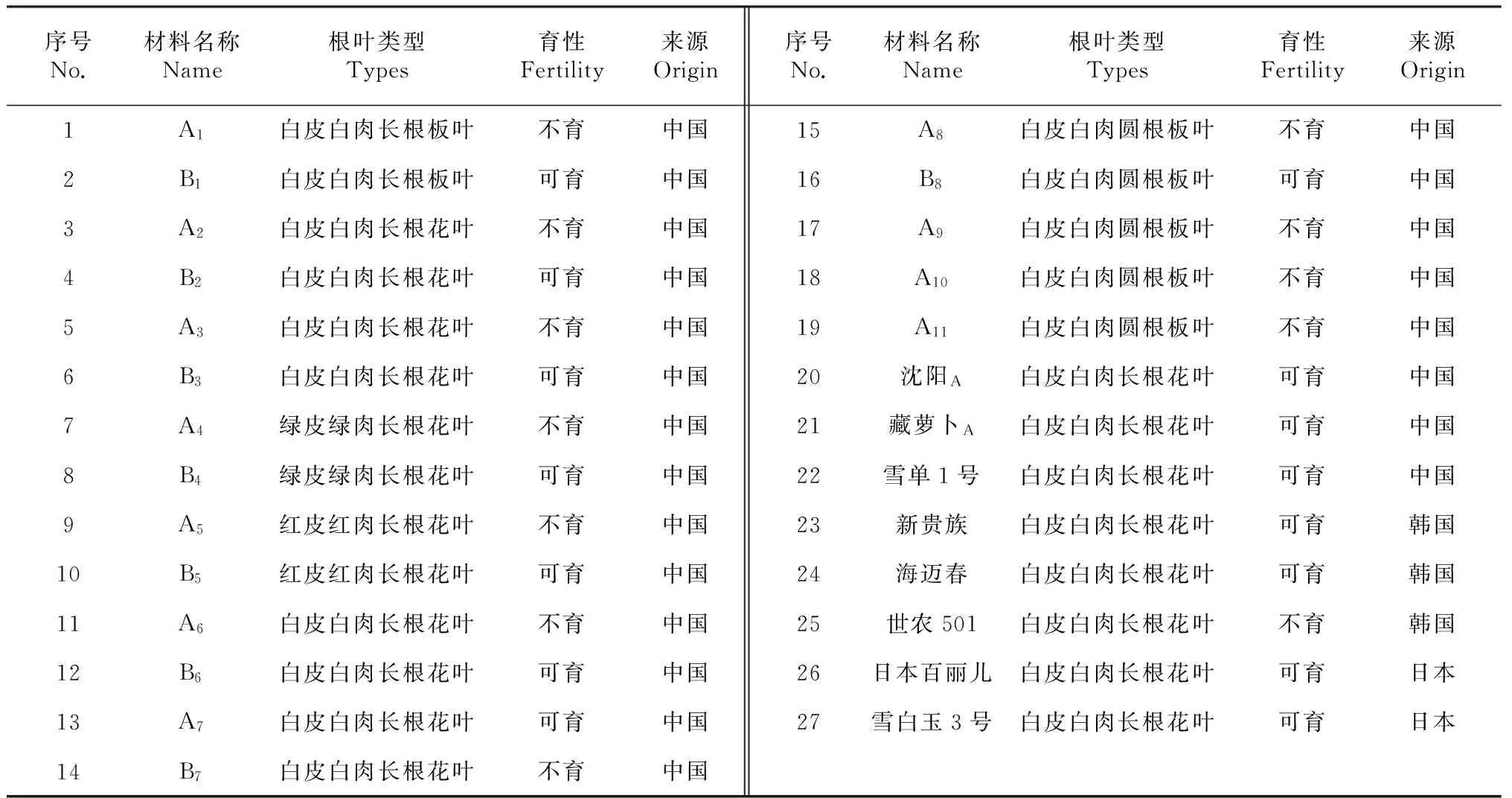
表1 试验材料
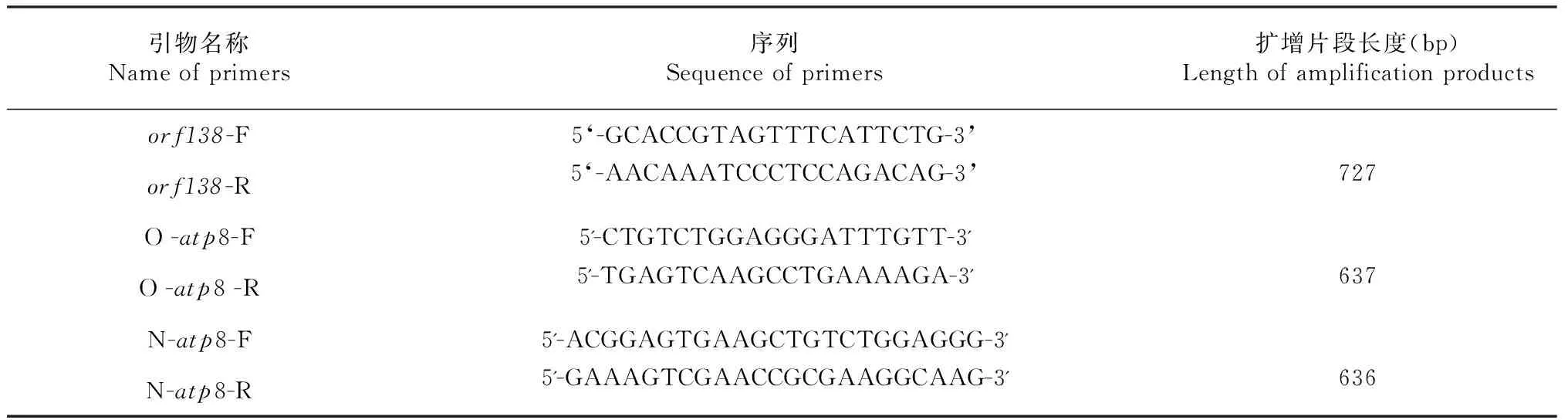
表2 特异片段扩增所用的引物序列
2 结果与分析
2.1orf138的扩增和序列比对
利用特异引物orf138-F/R对8份萝卜雄性不育系及其保持系、5份不育材料和6个萝卜品种进行PCR特异性扩增,并对扩增产物进行琼脂糖凝胶电泳。如图1所示,8份不育系、5份不育材料及5个萝卜品种有特异性条带,表明这些材料均为Ogura胞质, 5个品种表现可育,推断其为Ogura CMS与恢复系配制的杂交一代,8份保持系无特异条带,说明orf138正是引起这些不育系败育的原因,韩国品种“世农501”有微量花粉,但自交测交均不结实,说明花粉无活性,符合NWB胞质雄性不育特征,且未检测到特异性片段,其可能为NWB胞质类型配制的杂种一代。
将PCR产物回收测序,对比这18个材料的orf138编码区序列(417 bp)发现,所有材料可分为2种类型,前一类和后一类核酸序列相比,有2个碱基差异,分别是61A→C,99A→G(图2)。将这些序列在NCBI上做Blast分析发现:第一类序列与Genbank已公布的萝卜雄性不育细胞质相关基因(GenBank: DQ010330.1)核酸序列完全一致,经对比为Type A 型 Ogura CMS;而第二类序列与Genbank已公布的萝卜雄性不育细胞质相关基因(GenBank: AB055442.1)核酸序列完全一致,经对比为Type H型Ogura CMS(Yamagishi&Terachi,2001),进一步验证了Ogura CMS具有丰富的变异类型。在DNAMAN软件上进行氨基酸多重序列对比,发现orf138序列上61位点碱基的差异改变了编码区的氨基酸序列(赖氨酸→谷氨酰胺),为有义突变,但显然氨基酸的变化并没有改变雄性不育的表型性状,推测其属于中性变异。
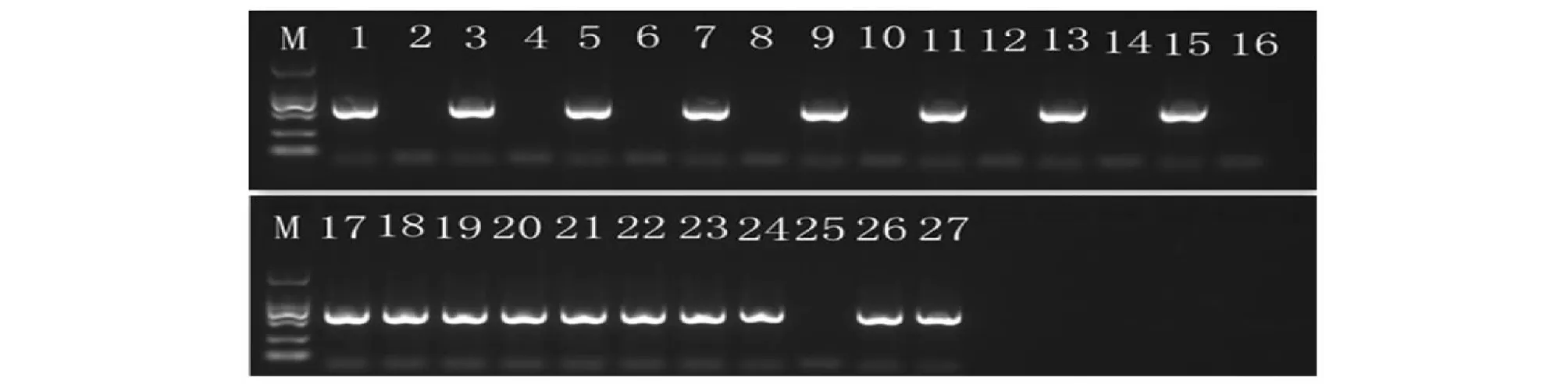
M:D2000,1~27:不同萝卜材料序号M:D2000,1-27:Number of materials图1 基于orf138基因的PCR特异性扩增产物 Fig.1 PCR products amplified from the orf138 locus of radish

图2 Ogura 胞质材料之间orf138序列差异性比较Fig.2 Nucleotide sequences analysis of orf138 locus of Ogura CMS
2.2orfB的扩增和序列比对
以N-atp8-F/R及O-atp8-F/R为特异引物,PCR扩增表明atp8存在于Ogura胞质与普通胞质中(图3),对PCR产物回收测序,并对其编码区(476 bp)进行序列分析,结果表明:所有Ogura 胞质的orfB编码区碱基序列相同,普通胞质的orfB编码区碱基序列相同,且两类序列间存在两个碱基位点的差异,即370C→ A,449C→T(图4),这与Terachi等的研究结果一致,进一步证实了Ogura胞质具有特异性的orfB序列。氨基酸多重序列对比发现,两序列在碱基位点突变处均引起了编码氨基酸的改变(370异亮氨酸→亮氨酸,449缬氨酸→丙氨酸),这些氨基酸的变化是否引起基因功能的改变尚不知晓,有待进一步研究。
3 结论与讨论
Ogura CMS是1968年小仓在日本野生萝卜群体内发现的首个萝卜胞质雄性不育材料,其不育源败育彻底,是十字花科作物迄今发现的不育性最彻底的胞质不育源之一,应用价值巨大,随后诸多学者对Ogura CMS进行了广泛研究。1991年,一个2.5 kb的片段Nco2.5被证实与Ogura CMS有关,随后进一步发现该片段包含orf138和orfB2个开放阅读框,在Ogura CMS中2个基因共转录一个1.4 kb的双顺反子mRNA,其中orf138只在Ogura CMS中转录表达,而orfB在不育与可育植株中均转录表达[12-13]。随后研究者进一步证实Ogura CMS正是orfB位点的5′插入特异orf138导致不育,orf138-orfB可能共同决定了Ogura 胞质的不育性[15],因此日本学者用107份日本野生萝卜,29份来自中国和日本的品种及7份野芥为材料,研究了萝卜在种间和种内水平上orf138编码区碱基的差异性,第一次在核苷酸水平证实了线粒体基因orf138的多态性。研究表明143份材料的orf138编码区序列共存在6个碱基位点的变异和一个39个核苷酸的缺失,依此将Ogura CMS分为9个类型(Type A→I),中国萝卜Ogura 胞质的主要类型为Type H,并且这些变异均属有义突变,引起了氨基酸序列的变化,但显然并没有引起蛋白质功能的改变[18],随后中国学者也鉴定到2个Ogura CMS的变异类型[22]。本研究用27个不同性状萝卜为试材,以orf138为特异分子标记进行鉴定,结果显示除了品种“雪单1号”(湖北省农业科学院经济作物研究所选育),所有中国来源的材料均为Type A Ogura 胞质,韩国和日本品种均为Type H Ogura 胞质,然而Zhang等则只在中国萝卜中鉴定到Type A[21]。
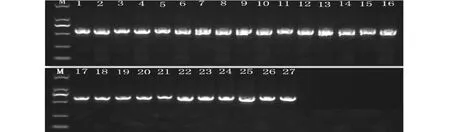
M:D2000,1~27:不同萝卜材料序号 M:D2000,1-27:The number of materials图3 基于orf B基因的PCR特异性扩增产物Fig.3 PCR products amplified from the orfB locus of radish

图4 Ogura胞质与Normal胞质orfB序列差异性比较Fig.4 Nucleotide sequences analysis of orfB between Ogura-type and Normal-type
orf138-orfB成为Ogura 线粒体基因组的重要结构,对其进行鉴定与分类具有重要的意义。
Terachi 等首次对46份萝卜材料的orfB编码区及侧翼序列进行测序分析,依序列碱基及酶切位点的差异将其分为3个类型(Type 1、Type 2、Type 3),其中Type 1只存在于Ogura胞质中,Type2、Type3存在于普通胞质中且其在编码区的序列相同,与Type 1有2个碱基位点的差异,突变引起了编码氨基酸序列的改变,Yamagishi(2004)、Zhang等(2012)的研究结果与之一致[19-21]。本文对27份材料的orfB的编码区序列进行测序发现,Type A与Type H Ogura胞质的orfB编码区碱基序列与Type 1一致,而所有普通胞质的orfB编码区碱基序列一致,与Terachi等的研究结果相同,进一步证实了Ogura胞质具有特异性的orfB序列,但其是否可作为分子标记用于鉴定Ogura胞质仍需进一步的研究。
萝卜不育胞质的鉴定和分类是利用不同遗传背景雄性不育系的前提和基础,对雄性不育系、保持系的选育具有非常重要的意义。本文鉴定到13份萝卜不育材料及5个萝卜品种均为Ogura胞质,可再结合Ogura胞质核恢复基因Rfo/rfo的酶切扩增多态性序列(CAPS)分子标记快速筛选不育源的候选保持系,从而加快育种进程[23]。同时也说明了课题组选育材料胞质类型的单一性,应加大不同胞质类型材料的引进,避免长期使用单一不育胞质带来的潜在危害。
[1]汪隆植,何启伟. 中国萝卜[M]. 北京:科学技术文献出版社,2005:310-314.
[2]Palmer J D, Herbon L A. Unicircular structure of theBrassicahirtamitochondrial genome[J]. Curr Genet, 1987(11): 565-570.
[3]Schnable P S, Wise R P. The molecular basis of cytoplasmic male sterility and fertility restoration[J]. Trends Plant Sci,1998,3(5): 175-180.
[4]Ogura H. Studies on the new male sterility in Japanese radish with special reference to the utilization of this sterility towards the practical raising of hybrid seeds[J]. Mem Fac Agric Kagoshima Univ, 1968(6): 39-78.
[5]何启伟,石惠莲,刘恩芹. 萝卜雄性不育系选育研究初报[J]. 山东农业科学,1981(1):13-16.
[6]Ikegaya Y. Frequent appearance of cytoplasmic male sterile plants in radish cultivar Kosena[J]. Jpn J Breed,1986,36(2): 106-107.
[7]Nahm S, Lee H, Lee S, et al. Development of a molecular marker specific to a novel CMS line in radish (RaphanussativusL.)[J]. Theor Appl Genet, 2005,111: 1191-1200.
[8]Lee Y, Park S, Lim C, et al. Discovery of a novel cytoplasmic male-sterility and its restorer lines in radish (RaphanussativusL.)[J]. Theor Appl Genet,2008,117: 905-913.
[9]Bannerot H, Loulidard L, Cauderon M Y. Transfer of cytoplasmic male sterility fromRaphanussativustoBrassicaoleracea[J]. Proc Eucarpia Meet Cruciferae, 1974, 25: 52-54.
[10]Pelletier G, Primard C, Vedel F, et al. Intergenetic cytoplasmic hybridization in Cruciferae by protoplast fusion[J]. Mol Gen Genet,1983,191: 244-250.
[11]Paulmann W, Röbbelen G. Effective transfer of cytoplasmic male sterility from radish (RaphanussativusL.) to rape (BrassicanapusL.)[J]. Plant Breed,1988,100: 299-309.
[12]Bonhomme S, Budar F, Férault M, et al. A 2.5 kb NcoI fragment of Ogura radish mitochondrial DNA is correlated with cytoplasmic male sterility in Brassica cybrids[J]. Curr Genet,1991,19: 121-127.
[13]Bonhomme S, Budar F, Lancelin D, et al. Sequence and transcript analysis of theNco2.5 Ogura-specific fragment correlated with cytoplasmic male sterility inBrassicacybrids[J]. Mol Gen Genet,1992,235: 340-348.
[14]Duroc Y, Gaillard C, Hiard S, et al. Biochemical and functional characterization of ORF138, a mitochondrial protein responsible for Ogura cytoplasmic male sterility inBrassiceae[J]. Biochimie, 2005, 87: 1089-1100.
[15]Krishnasamy S, Makaroff C A. Characterization of the radish mitochondrialorfBlocus: possible relationship with male sterility in Ogura radish[J]. Curr Genet,1993,24(1-2): 156-163.
[16]Gray M W, Lany B F, Cedergren R, et al. Genome structure and gene content in protest mitochondrial DNAs[J]. Nucleic Acids Res, 1998, 26: 865-878.
[17]Tanaka Y, Tsuda M, Yasumoto K, et al. A complete mitochondrial genome sequence of Ogura-type male-sterile cytoplasm and its comparative analysis with that of normal cytoplasm in radish (RaphanussativusL.)[J]. BioMed Central Genomics,2012,13: 352-362.
[18]Yamagishi H, Terachi T. Intra-and inter-specific variations in the mitochondrial geneorf138 of Ogura-type male-sterile cytoplasm fromRaphanussativusandRaphausraphanistrum[J]. Thero Appl Genet, 2001, 103: 725-732.
[19]Terachi T, Yamaguchi K, Yamagishi H. Sequence analysis on the mitochondrialorfBlocus in normal and Ogura male sterile cytoplasms from wide and cultivated radishes[J]. Curr Genet, 2001, 40: 276-281.
[20]Yamagishi H. Assessment of cytoplasmic polymorphisms by PCR-RFLP of the mitochondrialorfBregion in wide and cultivated radishes (Raphanus) [J]. Plant Breed, 2004, 123: 141-144.
[21]Zhang L, Yasumoto K, Yamgishi H. Identification of cytoplasmic male sterility in Chinese radish following PCR analysis of mitochondrial DNA[J]. Plant Mol Biol Rep,2012,30: 817-826.
[22]孙新菊. 萝卜CMS育性相关基因分离鉴定与表达特征分析[D]. 南京:南京农业大学,2012:15-16.
[23]张 丽,王庆彪,郑鹏婧. 萝卜雄性不育细胞质的鉴定与分类[J]. 华北农学报,2014,29(5):125-129.
[24]陈黎明,柳李旺,晋 萍,等. 两个萝卜雄性不育材料胞质的细胞学及分子鉴定[J]. 分子植物育种,2009,7(4):757-762.
[25]Sun X J, Liu Y, Wang L J, et al. Molecular characterization of the Rs-Rf1 gene and molecular marker-assisted development of elite radish(RaphanussativusL.) CMS lines with a functional marker for fertility restoration[J]. Mol Breeding, 2012, 30: 1727-1736.
(责任编辑 陈 虹)
Molecular Identification of Cytoplasmic Male Sterility in Radish (RaphanussativusL.) and Sequence Analysis oforf138 andorfB
LI Xiao-mei1, CHAI Liang2, YANG Feng1, RAN Mao-lin1,3*
(1.Institute of Rice and Sorghum, Sichuan Academy of Agricultural Sciences, Sichuan Deyang 618000,China; 2.Institute of Crop Research, Sichuan Academy of Agricultural Sciences, Sichuan Chengdu 610066,China; 3.Sichuan Province Key Laboratory of Vegetable Germplasm and Varieties Innovation, Sichuan Chengdu 610066, China )
【Objective】The present study was conducted to understand the molecular characteristics of male-sterile cytoplasm in radish. 【Method】Theorf138 andorfBof mitochondrial loci were used as molecular markers, and a total of eight male-sterile lines, eight maintainer lines, five male-sterile populations and six cultivars by PCR amplification were analyzed.【Result】Theorf138 gene of the eight male-sterile lines, five male-sterile populations and five cultivars by specific amplification were Ogura CMS, but their maintainer lines did not. Sequence analysis oforf138 demonstrated that the Ogura CMS could be divided into two types, type A and type H. Based on the mutations of the coding region sequences oforfB, two types oforfBwere found in total of 27 tested materials, and the sequences from Ogura and normal cytoplasm were absolutely distinguished. 【Conclusion】Thus, the genes oforf138 andorfBbetween the Ogura cytoplasm and the general cytoplasm were significantly different, and the presence oforf138 and the nucleotide sequence differences oforfBwould be used in cytoplasm type identification.
Radish (RaphanussativusL.); Cytoplasmic male sterility; Molecular identification;orf138;orfB
1001-4829(2017)6-1262-06
10.16213/j.cnki.scjas.2017.6.004
2016-07-10
四川省科学技术厅“四川省科技创新苗子工程”(2016092)
李晓梅(1984-),女,四川广安人,农学硕士,研究方向为萝卜育种及分子生物技术,E-mail: lxmwsl@126.com,*为通讯作者:冉茂林,男,农学硕士,研究方向为萝卜育种,E-mail: ran633@sohu.com。
S631.1
A
