急慢性ITP患儿外周血调节性T细胞及相关细胞因子的表达及意义
2017-08-07高凤艳郝国平
高凤艳,郝国平
(1.山西医科大学,山西 太原 030001;2.山西省儿童医院,山西 太原 030013)
急慢性ITP患儿外周血调节性T细胞及相关细胞因子的表达及意义
高凤艳1,郝国平2*
(1.山西医科大学,山西 太原 030001;2.山西省儿童医院,山西 太原 030013)
目的:检测急性原发性免疫性血小板减少症(AITP)、慢性原发性免疫性血小板减少症(CITP)患儿外周血CD4+CD25+CD127-调节性T细胞(Treg细胞)、转化生长因子(TGF-β1)、白介素-10(IL-10)的变化,探讨三者在ITP发病机制中的作用。方法:流式细胞术(FCM)分别检测35 例AITP、31 例CITP患儿及20 例健康对照儿童外周血Treg细胞百分率及血清IL-10含量,酶联免疫吸附测定(ELISA)法检测血清中TGF-β1含量,进行比较及相关性分析。结果:急性组Treg细胞百分率(4.23±0.82)%显著低于对照组的(5.05±0.90)%(P<0.01);慢性组Treg细胞百分率(3.47±0.63)%显著低于急性组的(4.23±0.82)%(P<0.01)。急性组TGF-β1水平(189.36±66.71) pg/mL低于对照组的(231.45±113.89) pg/mL(P<0.05),急性组IL-10含量(34.07±11.57) pg/mL低于对照组的(43.83±10.96) pg/mL(P<0.05)。TGF-β1水平及IL-10含量慢性组低于急性组,差异有统计学意义(P<0.01)。ITP患儿外周血Treg细胞百分率与TGF-β1含量呈正相关(r=0.75,P<0.01)。ITP患儿外周血IL-10含量与Treg细胞百分率、TGFβ1含量则无相关性。结论:ITP患儿Treg细胞减少及相关细胞因子含量降低可能与ITP的细胞免疫紊乱有关,免疫紊乱在慢性组尤其明显,这可能也是慢性患儿治疗效果不佳,呈现长病程的原因之一。
血小板减少症;调节性T细胞;转化生长因子β1;白介素10;流式细胞术
原发性免疫性血小板减少症(ITP)是一种儿童中常见的良性出血性疾病,以免疫紊乱介导的血小板减少为特征。近年越来越多学者关注细胞免疫异常在ITP发病机制中的作用。该研究检测ITP患儿外周血中CD4+CD25+CD127-调节性T细胞(Treg细胞)百分率及其相关细胞因子转化生长因子(TGF-β1)与白介素-10(IL-10)含量,进一步验证并分析Treg细胞、TGF-β1及IL-10与ITP发病的关系及可能机制。同时对ITP患儿急性者与慢性者外周血中Treg细胞百分率、TGF-β1及IL-10变化进行比较,综合分析三者在疾病不同状态的数量变化及其意义。
1 资料与方法
1.1 一般资料
选取2015年1月—2016年6月山西省儿童医院血液科住院和门诊治疗的ITP患儿66 例,均符合ITP诊断标准[1]。将初诊的未使用人免疫球蛋白及糖皮质激素治疗的ITP患儿纳入急性原发性免疫性血小板减少症(AITP)组,共35 例,男20 例,女15 例,年龄0.5~10 岁,中位年龄5.5 岁;将病程大于12 个月的ITP患儿纳入慢性原发性免疫性血小板减少症(CITP)组,共31 例,男17 例,女14 例,年龄3~12 岁,中位年龄7.5 岁,均符合CITP诊断标准[1];正常对照组来自山西省儿童医院2016年1月—3月体检中心健康体检者20 例,男7 例,女13 例,年龄3~10 岁,中位年龄6.5 岁。所有受试者均取得患儿家长的知情同意,并签署知情同意书。
排除标准:长期口服抗癫痫药所致血小板减少患儿;系统性红斑狼疮及其他自身免疫性疾病患儿;严重心肺腹及神经系统疾病患儿。
1.2 试剂和仪器
鼠抗人CD4-FITC单克隆抗体、CD25-PE单抗、CD127-APC单抗及同型对照IgG1-FITC、IgG1-PE、IgG1-APC及人血清白介素10(IL-10)均为贝克曼库尔特公司产品;酶联免疫吸附测定(ELISA)试剂TGF-β1购自博士德生物公司。流式细胞仪为贝克曼库尔特公司产品(型号:FC 500)。
1.3 试验步骤
1.3.1 外周血CD4+CD25+CD127-Treg百分率检测
取患儿治疗前EDTA抗凝血100 μL,依次加入抗CD4-FITC、抗CD25-PE的单抗各20 μL及CD127-APC单抗5 μL,对照组加入IgG1-FITC,IgG1-PE各20 μL及IgG1-APC 5 μL,分别混匀后避光孵育25~30 min,加入红细胞裂解液2 mL,室温避光孵育10 min,液体澄清透明后,1 500 r/min离心5 min,弃去上清液,再加入2 mLPBS洗涤液混匀,同法离心弃上清,细胞则悬浮于0.5 mL PBS中,混匀后上机检测。
1.3.2 外周血TGF-β1含量检测
收集外周全血2 mL(采血管为黄色,即含有分离胶和促凝剂),3 000 r/min离心5 min,取上清冻存于-70 ℃,用ELISA方法测TGF-β1含量(具体实验过程详见说明书)。
1.3.3 外周血IL-10含量检测
收集外周全血2 mL,3 000 r/min离心5 min,取上清冻存于-70 ℃,用流式细胞术测IL-10含量。(IL-10的检测是偏向于ELISA的流式细胞术)。
1.3.3.1 实验原理
流式高通量多因子检测技术(AimPlex)是依据一系列荧光强度不同的微球包被有特异性捕获抗体,与待测样本孵育后,加入检测抗体。流式细胞仪检测荧光,从而实现对蛋白抗原的检测;结合抗原标准品的标准曲线,可实现对蛋白抗原的定量检测。
1.3.3.2 标本的采集
取患儿治疗前外周全血1 mL,室温凝固30 min后,离心1 000×9 15 min,收集血清冻存于-70 ℃。
1.3.3.3 准备标准品:
取一8联管,标记1~8号,把标准品用2 000×9离心10 s,再加样品稀释液250 μL,充分混匀并冰浴5 min,8号管中加入标准品原液60 μL,1~8号管中加入样品稀释液120 μL,充分混匀,1号管中加入样品稀释液60 μL,从8号管开始依次取管液60 μL到上一管,直到2号管,则完成梯度稀释。
1.3.3.4 操作步骤
第一,取混合微球加入各孔45 μL,把孔内液体用抽滤器抽掉。第二,取标准品加入各孔45 μL,盖上封板膜,室温避光振荡60 min,把孔内液体用抽滤器抽掉。第三,取洗涤缓冲液加入各孔100 μL,浸泡约1 min后弃液,拍干,共重复3 次。第四,取生物素标记的检测抗体工作液加入各孔25 μL,盖上封板膜,室温避光振荡30 min。第五,同第三。第六,取用链霉亲和素标记的PE工作液加入各孔25 μL,盖上封板膜,室温避光振荡20 min。第七,同第三。第八,取读数缓冲液加入各孔150 μL,备用。第九,取洗涤缓冲液400 μL加入剩余微球中,充分混匀后倒入流式管,上流式细胞仪调整射门。第十,各孔内液体需充分吹吸,悬浮微球后转入流式管,上流式细胞仪测定。
1.4 统计学方法
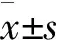
2 结 果
2.1 AITP组、CITP组、对照组Treg细胞百分率、TGF-β1、IL-10检测结果比较
AITP组Treg细胞百分率明显低于对照组,差异有统计学意义(P<0.01),TGF-β1含量低于对照组,差异有统计学意义(P<0.05),IL-10含量低于对照组,差异有统计学意义(P<0.01),CITP组Treg细胞百分率明显低于AITP组,差异有统计学意义(P<0.01),TGF-β1含量低于AITP组,差异有统计学意义(P<0.01),IL-10含量低于AITP组,差异有统计学意义(P<0.05)(见表1)。
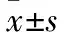
表1 三组Treg细胞百分率、TGF-β1、 IL-10检测结果比较
2.2 Treg细胞百分率、TGF-β1、IL-10三者相关性分析
ITP患儿外周血Treg细胞百分率与TGF-β1含量呈正相关(r=0.75,P<0.01);ITP患儿外周血IL-10含量与Treg细胞百分率、TGF-β1含量则无相关性。
3 讨 论
ITP是一种以血小板抗体产生为特征的自身免疫性出血性疾病,抗体也许通过网状内皮系统导致血小板的破坏[2]。Seddiki等[3]研究发现CD4+T细胞活化后高表达CD127,而真正的Treg则低表达CD127(CD4+CD25+CD127dim),所以CD127可以帮助区别Treg与活化的T细胞。王会平等[4]也认为CD4+CD25+CD127low标记可以识别理想的Treg细胞,且并不影响T细胞活性。本研究采用CD4+CD25+CD127-三标记法进行检测Treg细胞百分率,可以提高真正Treg细胞的检出率。
CD4+CD25+Treg来源于胸腺,在调节多种疾病的免疫反应中起到重要作用,如过敏性疾病、恶性肿瘤、感染、自身免疫紊乱等方面[5]。Treg的数量和功能的异常在ITP发病中起到了一定的作用[6-7]。更有学者认为Treg数量减低打破了自身耐受,Treg将成为未来ITP治疗的依据,并且可能在儿童慢性ITP的自然病程和长期结局的鉴别中成为诊断性指标[8]。研究Treg细胞在ITP患者免疫调节功能紊乱发病机制中的作用有重要意义。本研究显示急性组CD4+CD25+CD127-Treg细胞百分率较对照组明显减低,慢性组较急性组明显减低,表明Treg细胞数量减少可能与ITP的发生及疾病呈现慢性发展有关,可能与ITP患者体内存在的免疫调节功能紊乱有关,慢性ITP患儿则存在更严重的免疫紊乱。TGF-β是一种具有多种生物学功能的蛋白质,在组织损伤修复、组织细胞增殖分化、间质形成等方面起重要作用[9]。TGF-β作为机体重要的颗粒蛋白,其在免疫调节中的重要性也逐步被认识。IL-10是公认的执行免疫抑制功能的细胞因子,可被多种细胞分泌[10]。本研究显示ITP患儿外周血中Treg数量减少,TGF-β1、IL-10含量明显降低,且Treg百分率与TGF-β1含量呈正相关,Treg百分率与IL-10含量无相关性。Treg被激活后通过细胞相互接触和(或)分泌IL-10、TGF-β、IL-4等细胞因子发挥作用[11-12]。用相应抗体中和此类细胞因子则其体内免疫抑制作用降低,说明这些抑制性细胞因子可以辅助Treg细胞功能的实现。本实验结果与Meloy等[13]的结论一致。IL-10、TGF-β在Treg细胞的产生、增殖及介导免疫耐受中发挥重要作用,主要通过其可抑制抗原递呈细胞及拮抗效应T细胞的功能来实现[14-15]。Treg百分率与IL-10含量无相关性,可能与多种细胞均可分泌IL-10有关。
本研究表明Treg细胞数量减少或功能障碍及其相关细胞因子含量降低可能与ITP患者体内存在的免疫调节功能紊乱有关,而慢性组中免疫功能的改变表现更为明显,这可能也是慢性患儿治疗效果不佳呈现长病程的原因之一。
[1]中华医学会儿科学分会血液学组《中华儿科杂志》编辑委员会.儿童原发性免疫性血小板减少症诊疗建议[J].中华儿科杂志,2013,51(5):382-384.
[2]ARANDI N,MIRSHAFIEY A,JEDDI-TEHRANI M,et al.Alteration in frequency and function of CD4+CD25+FOXP3+regulatory T cells in patients with immune thrombocytopenic purpura[J].Iran J Allergy Asthma Immunol,2014,13(2):85-92.
[3]SEDDIKI N,SANTNER-NANAN B,MARTINSON J,et al.Expression of interleukin(IL)-2 and IL-7 receptors discriminates between human regulatory and αctivated T cell[J].EXP Med,2006,203(7):1693-1700.
[4]王会平,翟志敏,张爱梅,等.CD4+CD25+CD127low识别人外周血CD4+CD25+调节性T细胞的优势[J].中国免疫学杂志,2008,24(12):1059-1062.
[5]ZHANG P,LIU H Y,LIU X Y,et al.Role of treg cells in pathogensis of mouse ITP[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2016,24(3):784-787.
[6]DASGUPTA A,SAXENA R.Regulatory T cells:a review[J].Natl Med J India,2012,25(6):341-351.
[7]ZAHRAN A M,ELSAYH K I.CD4+CD25+High FoxP3+ regulatory T cells,B lymphocytes,and T lymphocytes in patients with acute ITP in assiut children Hospital[J].Clin Appl Thromb Hemost,2014,20(1):61-67.
[8]SON B R,KIM J Y.Association of CD4(+)CD25(+)FoxP3(+) regulatory T cells with natural course of childhood chronic immune thrombocytopenic purpura[J].Korean J Pediatr,2015,58(5):178-182.
[9]CHAIKUAD A,BULLOCK A N.Structural Basis of Intracellular TGF-β Signaling:receptors and Smads[J].Cold Spring Harb Perspect Bio,2016,8(11):a022 111.
[10]CASALS-PASCUAL C,KAIO,NEWTON C R,et al.Thrombocytopenia in falciparum malaria is associated with high concentrations of IL-10[J].Am J Trop Med Hyg,2006,75(3):434-436.
[11]MA L,LIANG Y,FANG M,et al.The cytokines (IFN-gamma,IL-2,IL-4,IL-10,IL-17) and Treg cytokine (TGF-beta1) levels in adults with immune thrombocytopenia[J].Pharmazie,2014,69(9):694-697.
[13]MALOY K J,SALAUN L,CAHILL R,et al.CD4+CD25+T(R) cells suppress innate immune pathology through cytokine-dependent mechanisms[J].J Exp Med,2003,197(1):111-119.
[14]HUA F,JI L,ZHAN Y,et al.Aberrant frequency of IL-10-producing B cells and its association with Treg/Th17 in adult primary immune thrombocytopenia patients[J].Biomed Res Int,2014,2014:571302.
[15]ZHANG A,FU J,NING B,et al.Tolerogenic dendritic cells generated with IL-10/TGFβ1relieve immune thrombocytopenia in mice[J].Thromb Res,2013,132(1):63-68.
ExpressionandsignificanceofregulatoryTcellsandtheirrelatedcytokinesinperipheralbloodofchildrenwithacuteandchronicprimaryimmunethrombocytopenia
GAO Fenyan1,HAO Guoping2
(1.Shanxi Medical University,Taiyuan 030001,China;2.The Children′s Hospital of Shanxi,Taiyuan 030012,China)
Objective:To detect the proportion of CD4+CD25+CD127-regulation T cell,transforming growth factor β1(TGF-β1),interleukin 10(IL-10) in children peripheral blood in acute primary immune thrombocytopenia(AITP) and chronic primary immune thrombocytopenia(CITP),and to explore their role in the pathogenesis in primary immune thrombocytopenia (ITP).Methods:The proportion of CD4+CD25+CD127-regulation T cell and the content of IL-10 were detected by flow cytometry(FCM) in peripheral blood in AITP children of 35 cases,CITP children of 31cases and healthy children of 20 cases in control group.The content of TGF-β1was analyzed by ELISA.To compare the proportion of CD4+CD25+CD127-regulation T cell and their related cytokines in the three groups and to analyze the relationships between them.Results:The proportion of CD4+CD25+CD127-regulation T cell in acute group(4.23±0.82)% was significantly lower than that in control group(5.05±0.90)%(P<0.01),the proportion of CD4+CD25+CD127-regulation T cell in chronic group (3.47±0.63)% was significantly lower than that in acute group(4.23±0.82)%(P<0.01).The amount of TGF-β1in acute group(189.36±66.71) pg/mL was significantly lower than that in control group(231.45±113.89)pg/mL(P<0.05).The amount of IL-10 in acute group (34.07±11.57) pg/mL was significantly lower than that in control group(43.83±10.96) pg/mL(P<0.05),the amount of TGF-β1and IL-10 in chronic group were significantly lower than that in acute group(P<0.01).There were psitive correlations between proportion of CD4+CD25+CD127-regulation T cell and TGF-β1in peripheral blood in ITP children(r=0.75,P<0.01).The content of IL-10 had no correlation with proportion of CD4+CD25+CD127-regulation T cell and TGF-β1in peripheral blood in ITP children.Conclution:The decrease of CD4+CD25+CD127-regulation T cell and related cytokines in peripheral blood in ITP may be connected with cellular immumune disorder of ITP,the immumune disorder in chronic group was obvious,and it may be one reason of why the children of CITP with poor therapeutic effects and long course.
Thrombopenia;regulation T cell;transforming growth factor β1;interleukin 10;flow cytometry
1671-8631(2017)07-0493-05
*本文通讯作者:郝国平
R725.5
:A
2016-11-11
(本文编辑:张荣梅)
高凤艳(1991— ),女,山西省吕梁市人,在读硕士,主要从事小儿血液科工作。
