亚麻籽饼酶法脱胶工艺条件研究
2017-08-07欧阳伶俐姚亚亚刘蓉蓉李慧静
欧阳伶俐,刘 壮,姚亚亚,刘蓉蓉,李慧静
(河北农业大学食品科技学院,河北 保定 071001)
综合利用
亚麻籽饼酶法脱胶工艺条件研究
欧阳伶俐,刘 壮,姚亚亚,刘蓉蓉,李慧静
(河北农业大学食品科技学院,河北 保定 071001)
为提高亚麻籽饼的脱胶效率,采用酶法对冷榨亚麻籽饼进行脱胶。以总糖得率及蛋白质损失率为指标,从果胶酶、纤维素酶、木聚糖酶、β-葡聚糖酶、α-淀粉酶5种酶制剂中筛选最合适的酶制剂,并通过单因素实验和响应面实验确定了酶法脱除亚麻胶的最佳工艺条件。结果表明:最佳酶制剂为果胶酶,在酶解pH 3.60、酶解温度50.42℃、酶添加量1%、酶解时间1.82 h、料液比1∶25条件下,总糖得率为14.13%,蛋白质损失率为4.22%。
亚麻籽饼;酶法脱胶;总糖得率;蛋白质损失率
亚麻籽饼是亚麻籽提油后的副产物,其中富含蛋白质、亚麻胶、木酚素、膳食纤维等物质,但一直以来亚麻籽饼都被用作动物饲料或肥料,经济效益比较低。因此,加大亚麻籽饼的综合开发利用具有重要意义。由于亚麻籽饼中的亚麻胶会使蛋白质和木酚素等物质在提取过程中容易乳化、不易离心,所以在亚麻籽饼综合开发利用前,需要对其进行脱胶。脱胶方法主要有干法和湿法两种[1]。干法需要特定的设备,如球磨机、粉碎机等,虽然工艺简单,但是脱除效果不够理想,而且对原料有一定要求。湿法的原料适应性强,对亚麻籽饼及亚麻籽均适用,其常用的浸提剂有水、酸、碱、酶、无机盐溶液等。目前,大多数报道均以水为溶剂,利用搅拌、微波、超声波、加无机盐等方法辅助提取亚麻籽或亚麻籽饼中的亚麻胶[2-6]。而有关酶法脱胶的报道较少。肖江等[7]采用果胶酶脱除亚麻籽中的亚麻胶,发现脱胶效果较好,但其仅以脱胶量为考察指标,并未对脱胶过程中蛋白质含量的变化进行研究。Wanasundara等[8]以亚麻籽为原料,比较了水浸泡处理(12 h)、0.1 mol/L NaHCO3浸泡处理(12 h)、酶处理(果胶酶和纤维素酶,3 h)3种方法的脱胶效果,结果表明NaHCO3浸泡及酶处理的脱胶效果较好,但其未对两种方法的工艺条件进行优化。
因酶具有高效性、专一性等特点,并且作用条件比较温和,故本实验采用酶法脱除冷榨亚麻籽饼中的亚麻胶,以总糖得率及蛋白质损失率为指标筛选出最合适的酶制剂,并通过单因素实验考察了酶解pH、酶解温度、酶添加量、酶解时间以及料液比对脱胶和蛋白质保留效果的影响,再通过响应面实验确定了酶法脱除亚麻胶的最佳工艺条件,旨在降低亚麻籽饼中的亚麻胶含量,并最大程度地保留其中的蛋白质,为亚麻籽饼中蛋白质和木酚素等物质的精深加工奠定一定的理论和实践基础。
1 材料与方法
1.1 实验材料
冷榨亚麻籽饼,张家口馨特植物油有限公司;果胶酶、纤维素酶,购自天津市利华酶制剂技术有限公司;木聚糖酶、β-葡聚糖酶、α-淀粉酶,购自诺维信公司;其他试剂均为分析纯。5种酶制剂的最适条件及酶活见表1。
HH-601超级恒温水浴锅,L3660D低速离心机,ZNCL-S140X140磁力搅拌器,STARTER3100型pH计,16C14型721分光光度计。
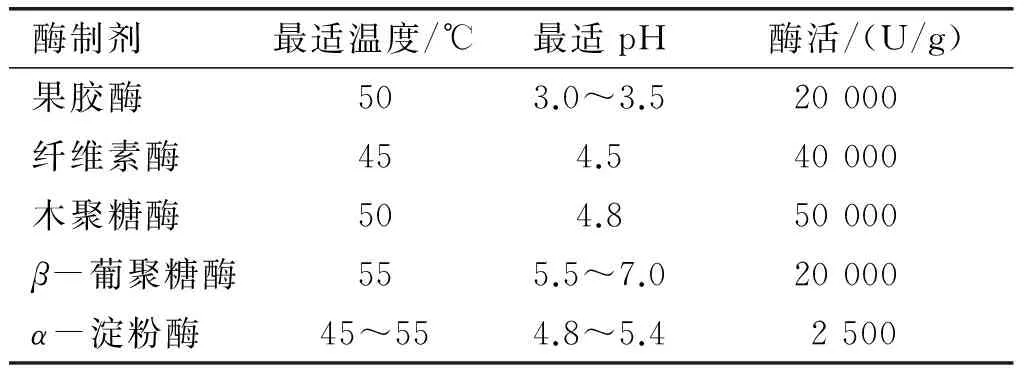
表1 5种酶制剂的最适条件及酶活
1.2 实验方法
1.2.1 亚麻籽饼酶法脱胶工艺流程
参考Wanasundara等[8]的方法,以提取液中总糖得率及蛋白质损失率为指标判断脱胶及蛋白质保留效果,总糖得率越高说明脱胶效果越好,蛋白质损失率越低说明蛋白质保留效果越好。工艺流程如下:
1.2.2 总糖得率及蛋白质损失率
总糖含量的测定:采用苯酚硫酸法[9]。将提取液稀释50倍,取1 mL稀释液于25 mL比色管中,加蒸馏水1 mL,参比管以2 mL蒸馏水代替,再加入6%苯酚1 mL,在20 s内快速加入浓硫酸5 mL,摇匀,静置10 min,25℃水浴保温10 min,在480 nm处测定吸光度。以木糖为标准品绘制的标准曲线为:y=0.010 4x+0.001 8,R2=0.999 1。
总糖得率=提取液中总糖质量/亚麻籽饼质量×100%
蛋白质含量的测定:采用考马斯亮蓝法[10]。将提取液稀释50倍,取1 mL稀释液于25 mL比色管中,参比管以1 mL 0.15 mol NaCl溶液代替,加入考马斯亮蓝染色液5 mL,摇匀,静置5 min,在595 nm处测定吸光度。以牛血清蛋白为标准品绘制的标准曲线为:y=0.004 2x+0.022 4,R2=0.990 5。固体中蛋白质含量按GB 5009.5—2010测定。
蛋白质损失率=提取液中蛋白质质量/亚麻籽饼中蛋白质质量×100%
1.2.3 数据统计方法
使用SPSS17.0软件进行方差分析(ANOVA),多组实验数据间的差异性比较采用Duncan检验,显著水平为P<0.05,采用Design Expert 8.0.6统计分析软件进行响应面分析。
2 结果与分析
2.1 单因素实验
2.1.1 酶选择
亚麻胶存在于亚麻籽种皮中,Oomah等[11]研究了12个地区109个品种的亚麻胶组成,结果表明亚麻胶主要由木糖、葡萄糖、半乳糖、鼠李糖、阿拉伯糖及岩藻糖6种单糖组成。Wanasundara等[8]将亚麻籽浸泡在300 mL煮沸的蒸馏水中,于室温下(22℃)振荡提取3 h,过滤后将滤液定容至300 mL,测定其总糖含量、戊糖含量及黏度,并通过控制料液比来获得不同亚麻胶含量的提取液。结果表明,提取液中的总糖含量、戊糖含量及黏度与料液比呈正相关,3个指标均可以间接反映提取液中亚麻胶的含量,并且当料液比为1∶100时,提取液中总糖含量约为0.5 mg/mL,即得率为5%。
精确称取2.000 g亚麻籽饼置于恒温双层夹套烧杯中,按料液比1∶25加入蒸馏水,搅拌均匀,分别加入1%的果胶酶、纤维素酶、木聚糖酶、β-葡聚糖酶、α-淀粉酶,控制搅拌速度为300 r/min,在各自最适pH及温度条件下酶解2 h,以总糖得率及蛋白质损失率为指标考察不同酶对亚麻籽饼脱胶效果的影响,结果如图1所示。
由图1可知,亚麻籽饼经果胶酶处理后其总糖得率最高,可达到14.39%,说明脱胶效果较好,且蛋白质损失率最低,仅为4.27%,说明蛋白质保留效果较好。原因可能是亚麻胶是含有少量蛋白质的多糖混合物,其中的多糖主要是酸性多糖和中性多糖,并以酸性多糖为主,酸性多糖由于分子体积小,类似于果胶物质[12]。因此,亚麻籽饼经果胶酶处理后,一方面细胞壁结构遭到破坏,另一方面果胶酶能够降解一部分亚麻胶,从而促进了亚麻胶的释放[8]。提取液中蛋白质含量较低可能是因为提取pH在等电点附近,蛋白质的溶解度较低。综上所述,选择果胶酶对亚麻籽饼进行脱胶处理。
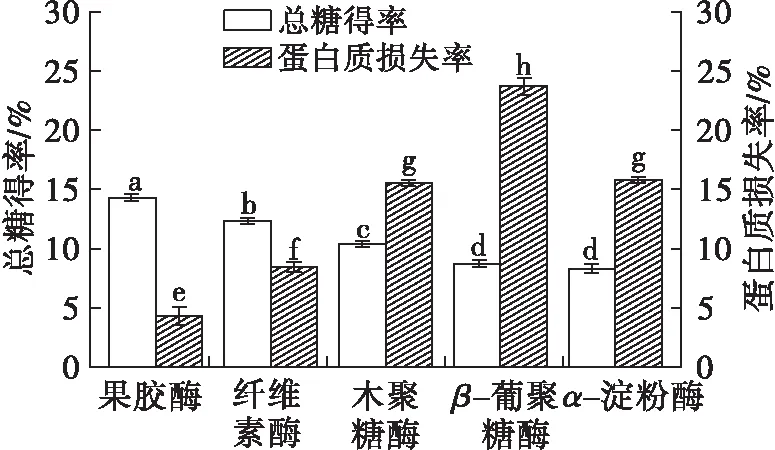
注:图中不同小写字母表示差异显著,下同。
2.1.2 酶解pH
精确称取2.000 g亚麻籽饼置于恒温双层夹套烧杯中,按料液比1∶25加入蒸馏水,搅拌均匀,控制搅拌速度为300 r/min,在果胶酶添加量1%、酶解温度50℃、酶解时间2 h条件下,以总糖得率及蛋白质损失率为指标考察不同酶解pH对亚麻籽饼脱胶效果的影响,结果如图2所示。
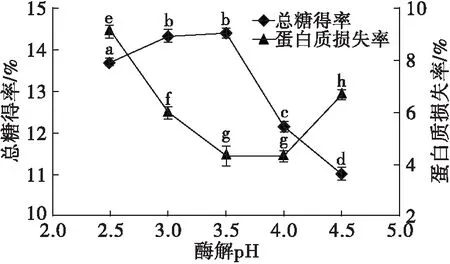
图2 酶解pH对总糖得率及蛋白质损失率的影响
由图2可知,随着酶解pH的升高总糖得率逐渐上升,当pH为3.0~3.5时,总糖得率变化不明显,当pH高于3.5时,总糖得率呈现下降趋势。这是因为果胶酶受pH的影响较大,当pH在果胶酶的最适pH范围内时酶的活性较高,催化作用强,当低于或高于最适pH时酶的活性逐渐降低[13]。蛋白质损失率受pH的影响也比较显著,当pH为3.5~4.0时蛋白质损失率较低,可能是因为该pH范围在蛋白质等电点附近,而低于或高于该pH范围,蛋白质损失率均增加。综上所述,选择酶解pH为3.5。
2.1.3 酶解温度
精确称取2.000 g亚麻籽饼置于恒温双层夹套烧杯中,按料液比1∶25加入蒸馏水,搅拌均匀,控制搅拌速度为300 r/min,在果胶酶添加量1%、酶解pH 3.5、酶解时间2 h条件下,以总糖得率及蛋白质损失率为指标考察不同酶解温度对亚麻籽饼脱胶效果的影响,结果如图3所示。
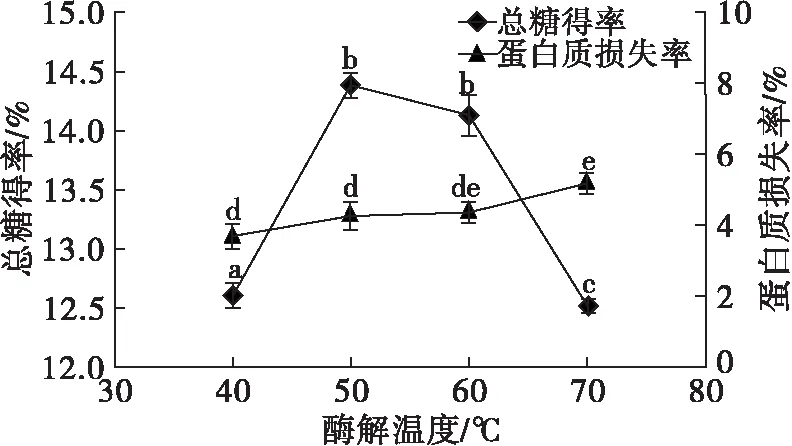
图3 酶解温度对总糖得率及蛋白质损失率的影响
由图3可知,当酶解温度为50~60℃时总糖得率较高,当低于或高于此温度范围时总糖得率均降低。这是因为温度能够影响酶促反应速率及酶的活性。随着温度的升高,酶促反应速率加快,酶活性增加,有利于亚麻籽胶的释放和降解,当温度超过酶的最适温度范围时,酶的活性逐渐降低甚至失活,酶解作用减弱[14]。酶解温度对蛋白质损失率的影响并不显著,可能与选取的pH有关。综上所述,选择酶解温度为50℃。
2.1.4 酶解时间
精确称取2.000 g亚麻籽饼置于恒温双层夹套烧杯中,按料液比1∶25加入蒸馏水,搅拌均匀,控制搅拌速度为300 r/min,在果胶酶添加量1%、酶解pH 3.5、酶解温度50℃条件下,以总糖得率及蛋白质损失率为指标考察不同酶解时间对亚麻籽饼脱胶效果的影响,结果如图4所示。

图4 酶解时间对总糖得率及蛋白质损失率的影响
由图4可知,随着酶解时间的延长总糖得率及蛋白质损失率均先增加后趋于平缓。总糖得率、蛋白质损失率在2 h时达到最大值。原因是当酶解时间太短时不足以降低亚麻胶的溶出阻力,从而不利于其释放[15]。随着酶解时间的延长,细胞壁逐渐被破坏,酶与底物作用更彻底,从而使亚麻胶的释放量及降解量均增加,当达到一定时间后,由于底物减少和抑制作用增强,亚麻胶及蛋白质的释放量均不再增加[14]。综合考虑能耗及生产周期等因素,选择酶解时间为2 h。
2.1.5 酶添加量
精确称取2.000 g亚麻籽饼置于恒温双层夹套烧杯中,按料液比1∶25加入蒸馏水,搅拌均匀,控制搅拌速度为300 r/min,在酶解pH 3.5、酶解温度50℃、酶解时间2 h条件下,以总糖得率及蛋白质损失率为指标考察不同酶添加量对亚麻籽饼脱胶效果的影响,结果如图5所示。

图5 酶添加量对总糖得率及蛋白质损失率的影响
由图5可知,随着酶添加量的增加总糖得率增加,当酶添加量为1%时达到较大值,此时继续增加酶添加量总糖得率变化不显著。可能是因为当酶添加量较小时,细胞壁破坏程度小,酶与底物反应不彻底,导致脱胶效果不佳,当酶添加量较大时,酶与底物的作用位点已达到饱和,此时继续增加酶添加量对脱胶效果影响不大。酶添加量对蛋白质损失率的影响不显著。因此,为了节约成本同时保证脱胶效率,选择酶添加量为1%。
2.1.6 料液比
精确称取2.000 g亚麻籽饼置于恒温双层夹套烧杯中,按不同的料液比加入蒸馏水,搅拌均匀,控制搅拌速度为300 r/min,在果胶酶添加量1%、酶解pH 3.5、酶解温度50℃、酶解时间2 h条件下,以总糖得率及蛋白质损失率为指标考察不同料液比对亚麻籽饼脱胶效果的影响,结果如图6所示。

图6 料液比对总糖得率及蛋白质损失率的影响
由图6可知,随着料液比的增大总糖得率及蛋白质损失率均呈先增加后趋于平缓的趋势。当料液比为1∶25时,总糖得率及蛋白质损失率达到最(较)大值,继续增大料液比对总糖得率及蛋白质损失率均无显著影响。因此,为了节约能源、提高生产效率,选择料液比为1∶25。
2.2 响应面优化实验
通过单因素实验确定了酶法脱除亚麻胶的酶制剂为果胶酶。固定酶添加量为1%、料液比为1∶25,以酶解时间(A)、酶解温度(B)、酶解pH(C)为自变量,以总糖得率(Y1)及蛋白质损失率(Y2)为响应值,采用Design Expert 8.0.6软件中的Box-Behnken设计三因素三水平响应面实验,对亚麻籽饼脱胶工艺条件进行优化。响应面因素水平见表2,响应面实验设计方案及结果见表3。
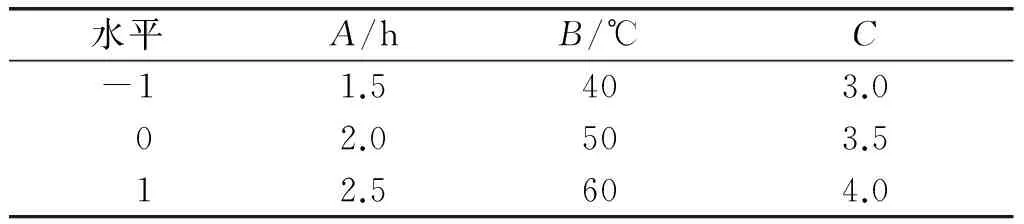
表2 响应面因素水平
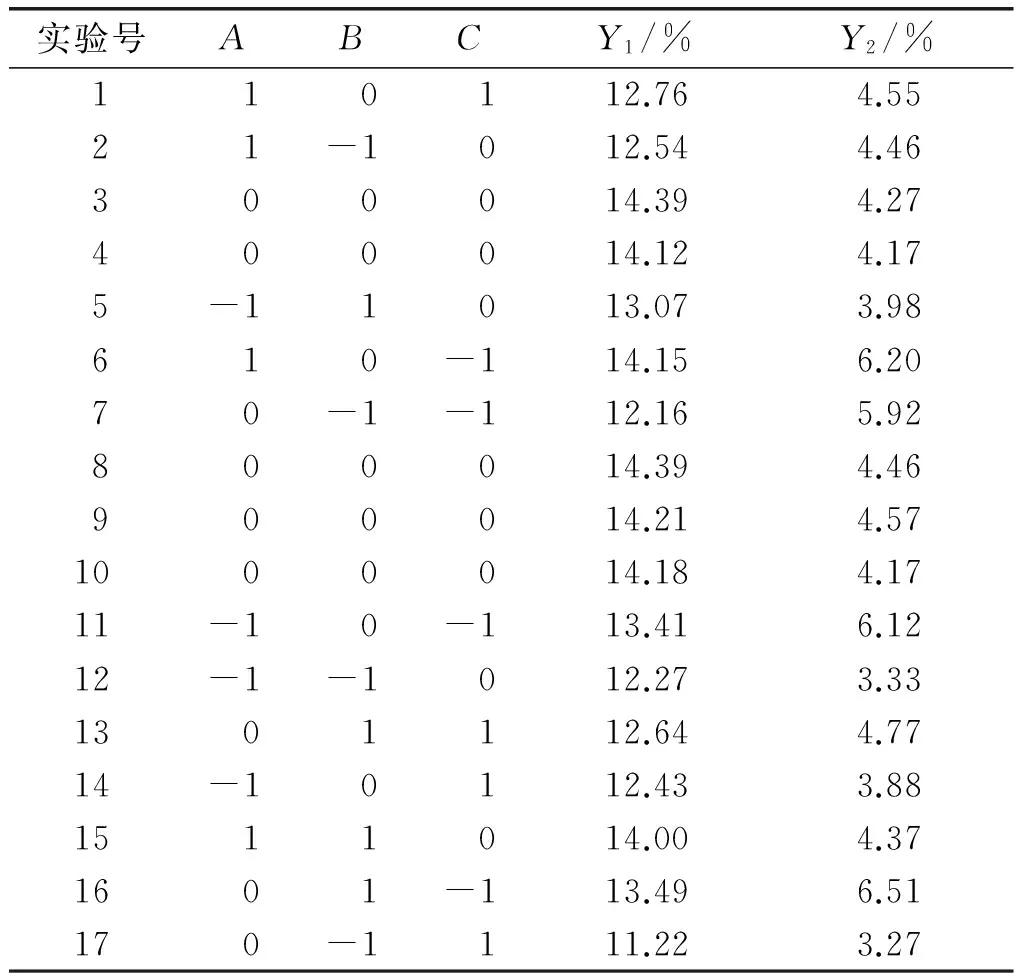
表3 响应面实验设计方案及结果
采用Design Expert 8.0.6软件对表3中的实验数据进行回归拟合。根据表4总糖得率的方差分析结果,去除不显著因子,得到关于总糖得率的回归方程为:Y1=14.26+0.28A+0.63B-0.52C-0.24A2-1.05B2-0.83C2。
由表4可以看出,该模型的F为82.94(P<0.000 1),达到了极显著水平,失拟项F为1.59(P=0.324 8>0.05),差异不显著,说明总糖得率回归模型的拟合度良好。回归模型的一次项A、B、C影响极显著;二次项A2、B2、C2影响极显著。
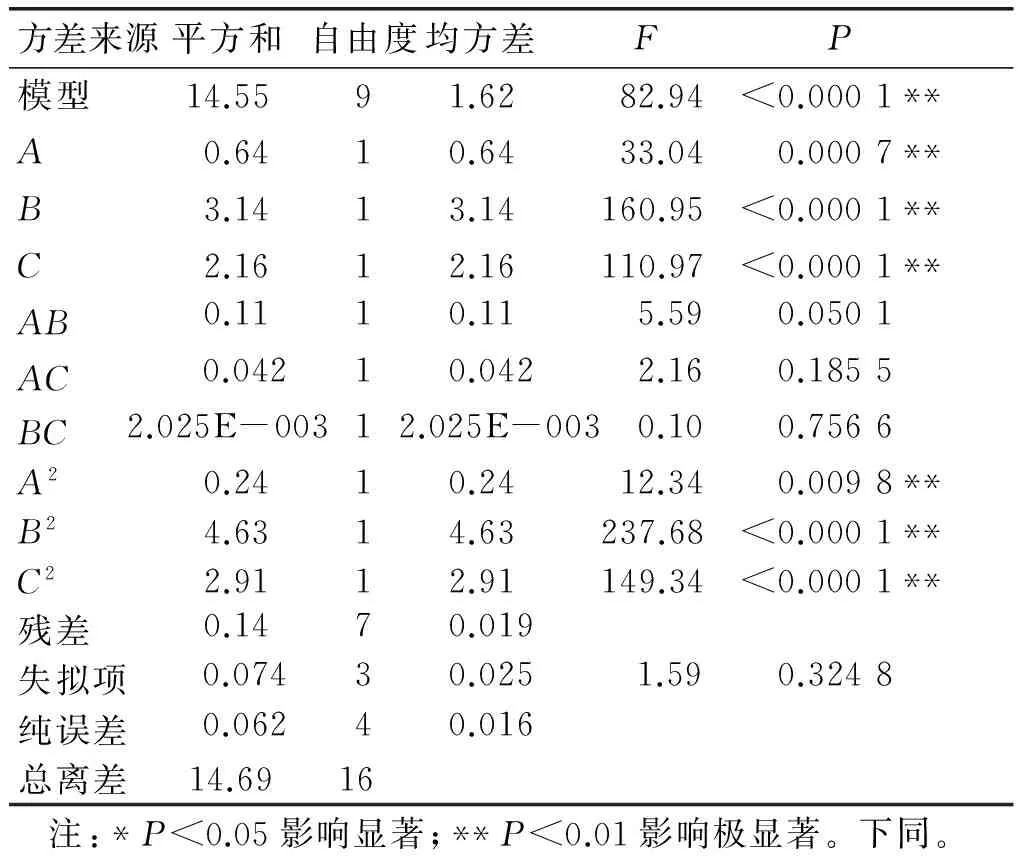
表4 总糖得率的方差分析结果
采用Design Expert 8.0.6软件对表3中的实验数据进行回归拟合。根据表5蛋白质损失率的方差分析结果,去除不显著因子,得到关于蛋白质损失率的回归方程为:Y2=4.33+0.28A+0.33B-1.04C+0.97C2。

表5 蛋白质损失率的方差分析结果
由表5可以看出,该模型的F为21.51(P=0.000 3<0.01),达到了极显著水平,失拟项F为4.10(P=0.103 0>0.05),差异不显著,说明蛋白质损失率回归模型的拟合度良好。回归模型的一次项A、B影响显著,C影响极显著;二次项C2影响极显著。
2.3 最佳实验条件的确定及验证
利用Design Expert 8.0.6统计分析软件对酶解条件进行优化,得到果胶酶脱除亚麻胶的最佳工艺条件为酶解pH 3.60、酶解温度50.42℃、酶添加量1%、酶解时间1.82 h、料液比1∶25,理论预测值为总糖得率14.03%,蛋白质损失率4.06%。为检验可靠性,在最佳条件下进行3次验证实验,结果表明总糖得率为14.13%,误差为0.74%,蛋白质损失率为4.22%,误差为3.88%,说明此模型设计合理,能够用来预测实验结果。
3 结 论
实验通过比较果胶酶、纤维素酶、木聚糖酶、β-葡聚糖酶、α-淀粉酶对冷榨亚麻籽饼脱胶效果的影响,筛选出能有效脱除亚麻胶同时最大程度保留亚麻籽蛋白的酶为果胶酶。通过单因素实验及响应面实验得到了最佳的脱胶工艺条件为:酶解pH 3.60,酶解温度50.42℃,酶添加量1%,酶解时间1.82 h,料液比1∶25。在最佳条件下总糖得率为14.13%,蛋白质损失率为4.22%。
[1] 李群,胡晓军,许光映,等.亚麻胶提取工艺研究[J].食品科技,2013,38(7):278-282.
[2] 刘蕾,潘秋月,高浩渊,等.亚麻籽胶提取工艺的研究[J].食品工业,2014,35(8):8-10.
[3] FABRE J F, LACROUX E, VALENTINA R,et al. Ultrasonication as a highly efficient method of flaxseed mucilage extraction[J]. Ind Crops Prod,2015,65:354-360.
[4] 崔宝玉,阚侃,刘喆,等.亚麻胶超声波强化提取工艺研究[J].黑龙江科学,2010,1(2):20-22.
[5] 孙姣,胡浩斌,毕阳.响应面法优化亚麻胶微波-超声波辅助提取工艺[J].中国油脂,2015,40(6):86-89.
[6] 连莹君,江紫琦,陆学茸,等. HPLC外标法测定亚麻籽油中4种环肽含量的研究[J]. 中国油脂, 2015, 40(5):90-94.
[7] 肖江,陈元涛,张炜,等.酶法脱除亚麻籽胶的工艺研究[J].食品科技,2012,37(12):151-154.
[8] WANASUNDARA P K J P D, SHAHIDI F. Removal of flaxseed mucilage by chemical and enzymatic treatments[J]. Food Chem,1997,59(1):47-55.
[9] 谢笔钧,何慧.食品分析[M].北京:科学出版社,2009:157-159.
[10] 刘志国.生物化学实验[M].武汉:华中科技大学出版社,2007:79-81.
[11] OOMAH B D, KENASCHUK E O, WUWEI C,et al. Variation in the composition of water-soluble polysaccharides in the flaxseed[J].J Agric Food Chem,1995,43(6):1484-1488.
[12] 陈海华,许时婴,王璋.亚麻籽胶化学组成和结构的研究[J].食品工业科技,2004,25(1):103-105.
[13] 李斌,于国萍.食品酶工程[M].北京:中国农业大学出版社,2010:53-56.
[14] 杨辉,闫明明.果胶酶提取大枣多糖的工艺研究[J].陕西科技大学学报,2012,30(5):62-66.
[15] 陈晶.水酶法提取亚麻籽油及其微胶囊化[D].江苏 无锡:江南大学,2007:9-12.
Enzymatic degumming process of flaxseed cake
OUYANG Lingli, LIU Zhuang, YAO Yaya, LIU Rongrong, LI Huijing
(College of Food Science and Technology, Hebei Agricultural University, Baoding 071001, Hebei, China)
In order to improve the degumming efficiency of flaxseed cake produced by cold pressing, enzyme method was adopted to degum. The optimal enzyme was selected from five enzymes with total sugar yield and protein loss rate as indicators, including pectinase, celluloses, xylanase,β-glucanase andα-amylase. The optimal degumming conditions were determined by single factor experiment and response surface methodology. The results showed that the optimal enzyme was pectinase and the optimal degumming conditions were obtained as follows: enzymolysis pH 3.60, enzymolysis temperature 50.42℃,enzyme dosage 1%,enzymolysis time 1.82 h and ratio of material to liquid 1∶25. Under these conditions, the total sugar yield and protein loss rate were 14.13% and 4.22% respectively.
flaxseed cake;enzymatic degumming; total sugar yield; protein loss rate
2016-09-23;
2016-10-14
河北省食品科学与工程学科“双一流”建设基金项目(2016SPGCA18); 新型食品加工关键技术及包装材料开发(17227117D)
欧阳伶俐(1989),女,硕士研究生,研究方向为粮油深加工与资源开发(E-mail)cereal1132@163.com。
李慧静,教授,博士(E-mail)huijingli2002@163.com。
TS229;TQ556
A
1003-7969(2017)05-0127-05
