琥珀酰化改性花生蛋白研究
2017-08-07王克琴张丽霞宋国辉黄纪念
芦 鑫,王克琴,张丽霞,宋国辉,孙 强,黄纪念
(1.河南省农业科学院 农副产品加工研究中心,郑州 450002; 2.河南省农产品生物活性物质工程技术研究中心,郑州 450002; 3.河南农业大学 食品科学技术学院,郑州 450002)
油料蛋白
琥珀酰化改性花生蛋白研究
芦 鑫1,2,王克琴3,张丽霞1,2,宋国辉1,2,孙 强1,2,黄纪念1,2
(1.河南省农业科学院 农副产品加工研究中心,郑州 450002; 2.河南省农产品生物活性物质工程技术研究中心,郑州 450002; 3.河南农业大学 食品科学技术学院,郑州 450002)
为考察琥珀酰化改性因素对花生蛋白改性效果及结构性质的影响,采用单因素试验、响应面试验分析花生蛋白质量浓度、琥珀酸酐添加量、反应温度对改性花生蛋白酰化度与产率的影响,确定最优琥珀酰化改性条件。通过红外光谱、电子显微镜、氮溶解指数评价琥珀酰化改性花生蛋白的结构性质。结果表明:花生蛋白质量浓度、琥珀酸酐添加量是显著影响因素;最佳改性条件为花生蛋白质量浓度58.5 g/L、琥珀酸酐添加量为花生蛋白质量的19.55%、反应温度49℃,在最佳条件下改性花生蛋白酰化度与产率分别为(82.82±0.59)%和(76.89±0.74)%;引入琥珀酰基改变了花生蛋白的分子结构,使蛋白质分子由折叠趋向伸展,蛋白质聚集体尺寸减小;改性花生蛋白的溶解性得到明显改善。
花生蛋白;酰化度;二级结构;氮溶解指数
花生是世界重要的油料作物之一,年产量4 600万t左右。我国是花生的生产大国,产量居世界第一,2015年花生产量为1 700万t。花生蛋白是花生的主要组分,约占20%,由于花生蛋白的氨基酸组成均衡合理,营养价值高,适合人们消费,已经成为世界第三大食用植物蛋白资源[1-2]。
虽然花生蛋白已经被广泛应用于食品领域,但同其他植物蛋白类似,花生蛋白在酸性、中性条件下溶解性差,易产生沉淀,影响产品品质,限制其使用范围[3-5]。研究表明:酰化改性可以有效提高蛋白质分散性与溶解性[6-7]。Beuchat[8]通过琥珀酰化改性花生蛋白粉,提高其在pH 6~7的溶解性、持水力、乳化性;Monteiro等[9]发现花生蛋白的主要成分花生球蛋白、伴花生球蛋白Ⅰ和伴花生球蛋白Ⅱ都可以采用琥珀酰化改性,将其等电点降低到4以下,改善其溶解性和分散性。
目前国外开展了琥珀酰化改性花生蛋白的研究工作,但国内该领域研究仍处于起步阶段。本文以改性花生蛋白酰化度和产率为评价指标,考察花生蛋白质量浓度、琥珀酸酐添加量、反应温度对花生蛋白琥珀酰化改性的影响,建立最佳的琥珀酰化改性工艺,并对比改性前后蛋白质的功能性质与结构的差异,为琥珀酰化改性花生蛋白的后续研究提供参考。
1 材料与方法
1.1 试验材料
花生蛋白粉: 实验室自制,具体条件见文献[10]。丁二酸酐(琥珀酸酐),上海阿拉丁试剂有限公司;茚三酮,瑞金特化学有限公司;其他试剂均为分析纯,国药集团化学试剂有限公司。
K-05全自动凯氏定氮仪,UV-6300型分光光度计,IS5型傅里叶红外分析仪,LyovacGT1冷冻干燥机,DL-5-B 离心机,XS205电子天平,DF-101S集热式磁力搅拌器。
1.2 试验方法
1.2.1 琥珀酰化改性花生蛋白
配制一定质量浓度的花生蛋白溶液,在一定温度下,逐步加入琥珀酸酐,搅拌反应1 h,整个过程中使用3 mol/L NaOH溶液维持反应体系pH在8.0~8.5之间。反应结束后,用3 mol/L盐酸中和,以5 000 r/min 离心15 min,收集上清液,采用截留相对分子质量为3 500 Da透析袋透析12 h,冷冻干燥获得改性花生蛋白。
1.2.2 改性花生蛋白酰化度的测定
参考刘金阳等[11]的方法。取0.4 mL 1.2.1中离心上清液,加入0.4 mL蒸馏水,随后加入0.1 mol/L、pH 8.0的磷酸盐缓冲液及茚三酮溶液各0.2 mL,混合均匀后100℃水浴加热15 min,反应结束后,迅速冷却至室温并加蒸馏水定容至5 mL,静置15 min 后,以蒸馏水作为空白,测定在570 nm 处的吸光度Am。取相同质量浓度的花生蛋白溶液0.4 mL,按照上述步骤处理,测定吸光度A0。按照下式计算酰化度:
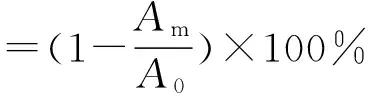
1.2.3 改性花生蛋白产率的计算
分别采用凯氏定氮法(GB 5009.5—2010,系数为5.46)测定花生蛋白与改性花生蛋白的蛋白质含量C0和Cm,采用下式计算改性花生蛋白产率:
式中:M0和Mm分别为改性前后花生蛋白的质量。
1.2.4 花生蛋白的红外光谱分析
将干燥的花生蛋白与琥珀酰化改性花生蛋白分别与溴化钾按1∶100的比例充分研磨,用粉末压片机以15 MPa压制30 s,将压片转移到红外分析仪中扫描。扫描范围为4 000~400 cm-1,采样64次,以空气为背景,样品扫描前扣除背景。采用Origin 8.5计算蛋白质二级结构中ɑ-螺旋、β-折叠、β-转角、无规则卷曲所占的比例[12]。
1.2.5 花生蛋白的微观结构分析
花生蛋白与琥珀酰化改性花生蛋白干燥后,用离子喷溅仪进行真空喷金,随后在15 kV的加速电压下,电子显微镜拍摄,照片分辨率600 DPI[13]。
1.2.6 花生蛋白氮溶解指数的测定
分别称取1 g样品,溶于50 mL纯水中,调节pH 4、6、8缓慢搅拌30 min后,在4 000 r/min离心30 min,取上清液5 mL。凯氏定氮法测定上清液中可溶性氮质量Ms与样品总氮质量Mt,然后按下式计算氮溶解指数(NSI)[14]:
1.2.7 数据处理
采用软件SAS 9.2进行Box-Behnken设计的响应面分析,以Duncan算法进行单因素方差分析。图中同一曲线上带有相同小写字母的样品间在0.05水平上无显著差异。
2 结果与分析
2.1 花生蛋白琥珀酰化改性单因素试验
2.1.1 花生蛋白质量浓度对花生蛋白琥珀酰化改性的影响
分别配制质量浓度为30、60、90、120、150、180 g/L的花生蛋白溶液,琥珀酸酐添加量为花生蛋白质量的10%,在温度30℃、pH 8.0~8.5下反应1 h后,离心,取上清液测定酰化度与产率,结果见图1。
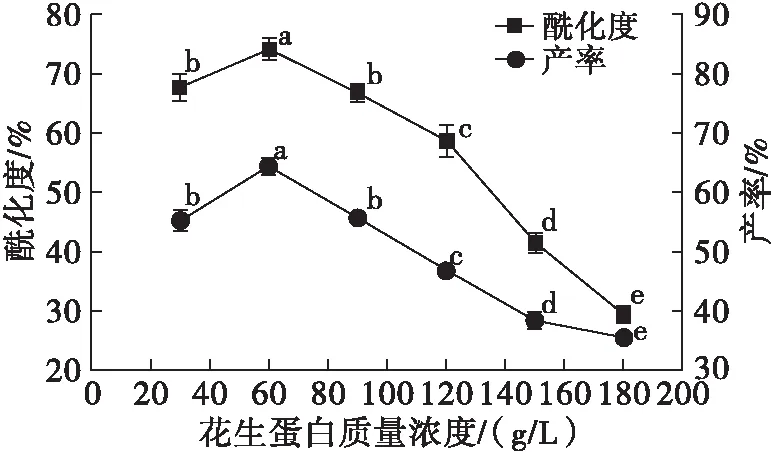
图1 花生蛋白质量浓度对花生蛋白琥珀酰化
由图1可知,随着花生蛋白质量浓度的增加,酰化度呈现先小幅上升后显著下降的趋势,这是由于当花生蛋白质量浓度增加时,单位体积溶液中可参与反应的蛋白质分子数目增加,与琥珀酸酐碰撞概率增加,加快了反应速度。当花生蛋白分子持续增加时,由于琥珀酸酐的浓度一定,使得两种分子碰撞概率减少,蛋白质之间相互碰撞概率提高,导致酰化度降低。以上结果与李磊等[15]对琥珀酰化改性大豆蛋白的结果一致。
由图1可知,改性花生蛋白产率随着花生蛋白质量浓度的增加呈现先小幅上升后显著下降降趋势,这是因为随着酰化度降低,琥珀酰化改性效果降低,对其溶解性的改善作用减弱,导致中性条件下,溶解在上清液中的蛋白质减少,导致产率降低。综合酰化度与产率,花生蛋白质量浓度以60 g/L为宜。
2.1.2 琥珀酸酐添加量对花生蛋白琥珀酰化改性的影响
配制质量浓度为60 g/L花生蛋白溶液,分别添加花生蛋白质量的5%、10%、15%、20%、25%、30%的琥珀酸酐,在温度30℃、pH 8.0~8.5下反应1 h后,离心,取上清液测定酰化度与产率,结果见图2。
由图2可知,随着琥珀酸酐添加量从5%增加到10%,改性花生蛋白酰化度显著增加,琥珀酸酐添加量继续增加到25%的过程中,改性花生蛋白酰化度虽然持续增加,但增加幅度减弱,当琥珀酸酐添加量增加到30%,酰化度反而下降。产生以上变化的原因是:琥珀酸酐添加量增加提高了与蛋白质分子的碰撞概率,从而提高酰化度;当琥珀酸酐添加量过高时,部分琥珀酸酐与水反应,导致未能有效提高酰化度[7]。
由图2可知,改性花生蛋白产率随着琥珀酸酐添加量的增加而增加,但是当琥珀酸酐添加量从25%增加到30%时,改性花生蛋白产率下降,这是受酰化度下降,蛋白质溶解性削弱,降低改性花生蛋白产率。考虑生产成本与污水处理,琥珀酸酐添加量以15%为宜。此时,改性花生蛋白酰化度与产率分别为 (76.24±0.64)%和(69.22±0.60)%。
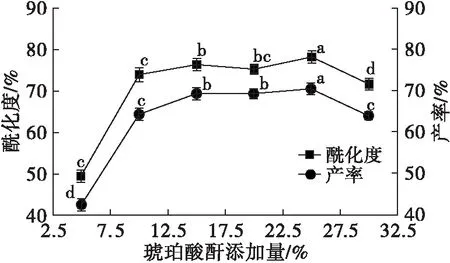
图2 琥珀酸酐添加量对花生蛋白琥珀酰化
2.1.3 反应温度对花生蛋白琥珀酰化改性的影响
配制质量浓度为60 g/L的花生蛋白溶液,琥珀酸酐添加量为花生蛋白质量的15%,分别在25、30、35、40、45、50、55、60℃下,pH 8.0~8.5反应1 h后,离心,取上清液测定酰化度与产率,结果见图3。
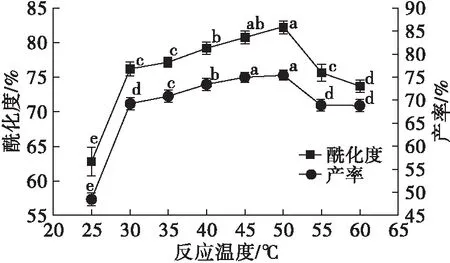
图3 反应温度对花生蛋白琥珀酰化改性效果的影响
反应温度是影响琥珀酰化改性的重要因素,低反应温度会导致分子运动速度减慢,从而降低蛋白质分子与琥珀酸酐的碰撞概率,降低反应速度,并且蛋白质分子在较低温度下,分子结构未充分伸展,不利于活性中心暴露,也会降低花生蛋白改性效率;高反应温度虽然可以加速分子运动速度,提高蛋白质分子与琥珀酸酐碰撞概率,加速改性反应,但高反应温度也会加快琥珀酸酐与水产生羧酸的副反应速度,同时蛋白质在高温时会发生聚集、变性,这都会导致体系内参与改性反应的底物浓度的降低,进而影响改性效果。
由图3可知,反应温度对花生蛋白改性的影响符合上述规律,当反应温度从25℃升高到50℃时,酰化度显著增加,但继续升高反应温度后,酰化度反而下降。与酰化度变化趋势相似,随着反应温度升高,琥珀酰化改性花生蛋白产率呈现先上升后下降的趋势。这是由于琥珀酰化改性花生蛋白的溶解性与酰化度密切相关,高酰化度的改性花生蛋白具有良好的溶解性,从而增加中性条件下上清液中蛋白质浓度,最终提高琥珀酰化改性花生蛋白产率。结合酰化度与产率,反应温度采用50℃为宜,在此条件下,改性花生蛋白的酰化度与产率分别为(82.20±0.56)%和(75.59±0.66)%。
2.2 花生蛋白琥珀酰化改性响应面试验
在上述单因素试验的基础上为了分析单因素间的交互作用,以获得最佳的花生蛋白改性条件,采用响应面试验优化,具体试验设计与结果见表1,方差分析见表2、表3。
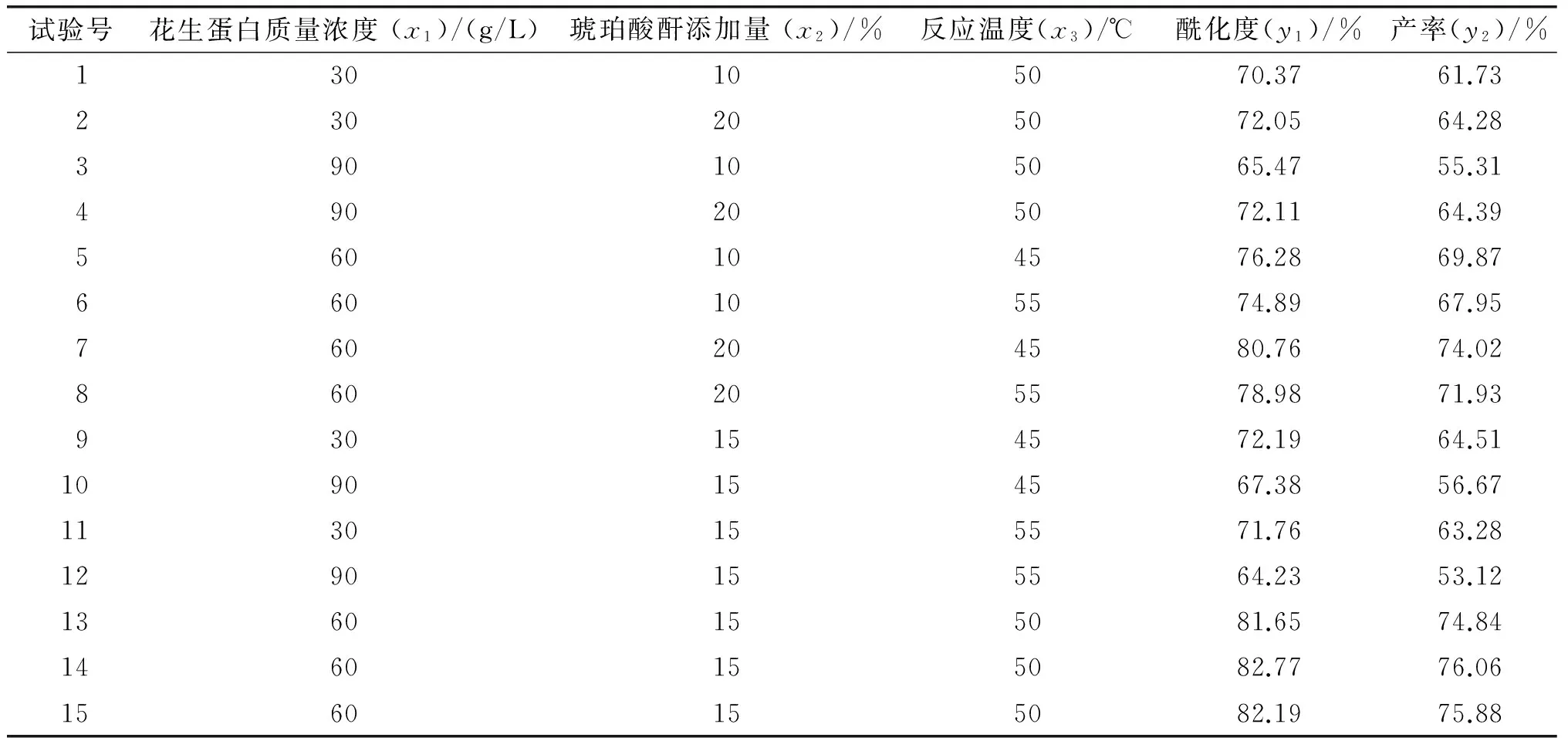
表1 花生蛋白琥珀酰化改性的响应面试验设计与结果
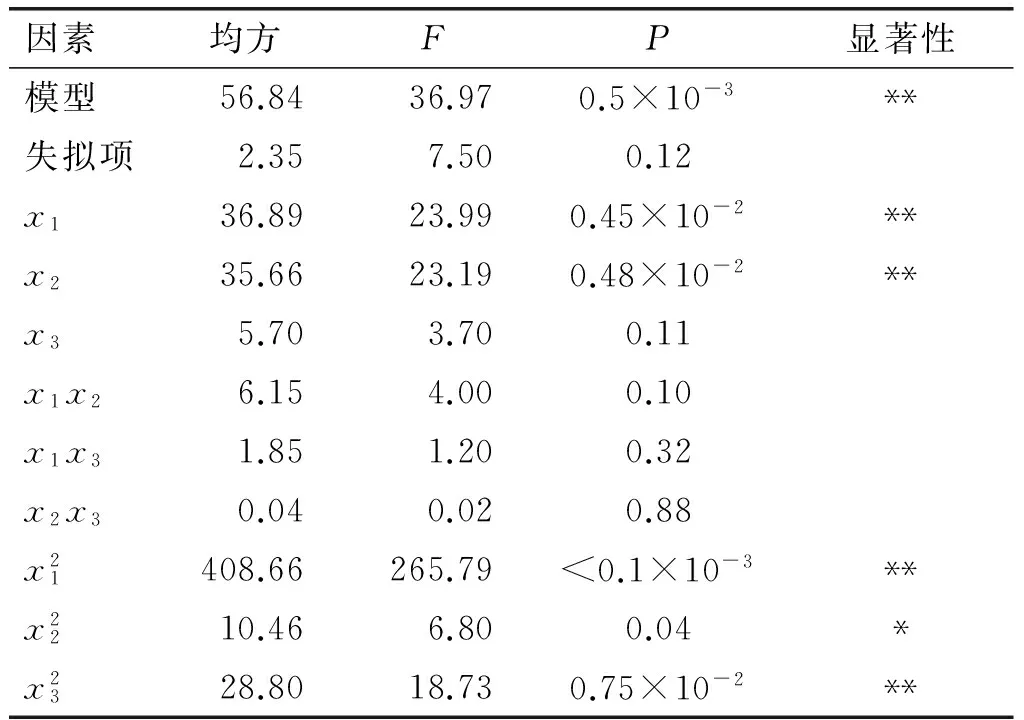
表2 琥珀酰化改性条件对酰化度影响方差分析
注:显著水平P为0.05,用*表示;高度显著水平P为0.01,用**表示。下同。
由表2可知,在响应面考察的因素变化范围中,花生蛋白质量浓度和琥珀酸酐添加量是高度显著因素(P<0.01),且花生蛋白质量浓度的影响大于琥珀酸酐添加量,而反应温度是不显著影响因素(P>0.05);同时,因素间的交互作用不显著。

表3 琥珀酰化改性条件对产率影响方差分析
分析影响因素的显著性发现,花生蛋白质量浓度是高度显著因素(P<0.01),琥珀酸酐添加量是显著因素(P<0.05),而反应温度是不显著影响因素(P>0.05),因素间的交互作用不显著。
由SAS预测,当花生蛋白质量浓度58.2 g/L、琥珀酸酐添加量为花生蛋白质量的18.04%、反应温度49.23℃时,获得最高酰化度,即(82.98±0.67)%;当花生蛋白质量浓度58.3 g/L、琥珀酸酐添加量为花生蛋白质量的19.55%、反应温度49.17℃时,获得最高产率,即(76.89±1.17)%。为获得最高的产率,并结合实际生产条件,将花生蛋白琥珀酰化改性的最佳条件调整为:花生蛋白质量浓度58.5 g/L,琥珀酸酐添加量为花生蛋白质量的19.55%,反应温度49℃。在最佳条件下改性花生蛋白酰化度与产率分别为(82.82±0.59)%和(76.89±0.74)%。
2.3 琥珀酰化改性花生蛋白的性质
2.3.1 改性花生蛋白的红外光谱
为分析琥珀酰化改性对花生蛋白结构的影响,采用红外光谱分析琥珀酰化改性花生蛋白与未改性花生蛋白的差异,结果见图4。

图4 花生蛋白与琥珀酰化改性花生蛋白的红外光谱图

为分析改性对花生蛋白二级结构的影响,采用Origin 8.5中峰型拟合工具分析1 600~1 700 cm-1的透光率,计算花生蛋白二级结构组成,结果见表4。

表4 花生蛋白和琥珀酰化改性花生蛋白的二级结构组成 %
由表4可知,通过琥珀酰化改性可以减少花生蛋白中β-折叠与β-转角结构,增加α-螺旋与无规则卷曲,原因可能是由于带负电的琥珀酰基取代带正电的铵离子,从而使蛋白质分子内带负电的羰基与带正电的氨基间的引力变为斥力,导致蛋白质分子从原有的折叠弯曲结构变为伸展状态。
2.3.2 改性花生蛋白的微观结构
为考察改性对花生蛋白微观形态的影响,采用扫描电镜观察花生蛋白与琥珀酰化改性花生蛋白的微观结构,结果见图5。

图5 花生蛋白(a)与琥珀酰化改性花生蛋白(b)电子显微镜图(×5 000)
由图5可知,花生蛋白聚集成球状或团状,其表面光滑;而琥珀酰化改性花生蛋白呈现片状,且聚集物尺寸要小于普通花生蛋白形成的聚集物。两种蛋白质微观形态的差异可能是由于蛋白质分子结构发生变化,引发蛋白质微观聚集形态产生差别。
2.3.3 改性花生蛋白的氮溶解指数
为评价琥珀酰化改性对花生蛋白溶解性提高效果,测试不同pH条件下,花生蛋白与琥珀酰化改性花生蛋白的NSI,结果见表5。

表5 花生蛋白与琥珀酰化改性花生蛋白的氮溶解指数
由表5可知,在pH 4、6、8下,琥珀酰化改性花生蛋白的NSI明显高于花生蛋白的,这表明琥珀酰化改性可以提高花生蛋白的溶解性,以上结果与琥珀酰化改性提高米糠蛋白、大豆蛋白溶解性的结果一致[17-18]。因为琥珀酰化减弱了由于蛋白质分子中氨基和羰基之间的引力使蛋白质分子集聚的程度,这有利于蛋白质分子与水分子发生水合,促进在水中分散、溶解。蛋白质中净负电荷的增加推动蛋白质等电点向低pH移动,从而改善在酸性条件下的溶解性。
3 结 论
以改性花生蛋白酰化度与产率为评价指标,通过单因素试验、响应面优化试验考察花生蛋白质量浓度、琥珀酸酐添加量、反应温度对琥珀酰化改性花生蛋白的影响,并建立最佳改性工艺条件。另外,采用红外光谱、电子显微镜与氮溶解指数分析改性前后花生蛋白结构性质差异。结果表明:花生蛋白琥珀酰化改性的最佳条件为花生蛋白质量浓度58.5 g/L、琥珀酸酐添加量为花生蛋白质量的19.55%、反应温度49℃,在最佳条件下改性花生蛋白酰化度与产率分别为(82.82±0.59)%和(76.89±0.74)%。通过琥珀酰化改性,花生蛋白结构与形态发生变化,分子结构由折叠趋向伸展,蛋白质聚集物尺寸减小;花生蛋白的溶解性提高,尤其在酸性条件下,溶解性改善明显。
[1] 吴海文, 王强, 周素梅. 花生蛋白及其功能性研究进展[J]. 中国油脂, 2007, 32(9): 7-11.
[2] 刘大川, 廖晓龙, 王祖奎, 等. 花生分离蛋白制备工艺研究[J]. 中国油脂, 2010, 35(10): 21-24.
[3] 张雪春, 王振兴, 涂宗财, 等. 酶-微射流复合改性花生蛋白及其在微胶囊粉末油脂中的应用研究[J]. 中国油脂,2014,39(11): 32-35.
[4] 李萌萌,卞科, 陶平平, 等. 微波改性花生蛋白标签胶的研究[J]. 中国油脂, 2012, 37(1): 60-64.
[5] 潘秋琴, 沈蓓英, 程霜. 花生蛋白质的磷酸化改性[J]. 中国油脂, 1997, 22(1): 25-27.
[6] 董新红, 赵谋明, 蒋跃明. 花生蛋白改性的研究进展[J]. 中国粮油学报, 2011, 26(12): 109-117.
[7] 刘智宇. 植物蛋白的酰化改性及其应用综述[J]. 粮油食品科技, 1996(3): 14-16.
[8] BEUCHAT L R. Functional and electrophoretic characteristics of succinylated peanut flour protein[J].J Agric Food Chem, 1977, 25(2): 258-261.
[9] MONTEIRO P V, PRAKASH V. Alteration of functional properties of peanut (ArachishypogaeaL.) protein fractions by chemical and enzymatic modifications[J]. J Food Sci Technol, 1996, 33(1): 19-26.
[10] 芦鑫, 朱巧梅, 孙强, 等. 高温压榨花生饼粕酶法制备抗氧化肽的研究[J].中国粮油学报, 2013, 28(3): 99-104.
[11] 刘金阳, 赵城彬, 陈旸, 等. 琥珀酰化燕麦分离蛋白制备条件的优化及其结构分析[J]. 食品工业科技,2016, 37(4): 294-298.
[12] HE S D, SHI J, WALIDA E, et al. Reverse micellar extraction of lectin from black turtle bean (Phaseolusvulgaris): optimisation of extraction conditions by response surface methodology[J]. Food Chem, 2015, 166(1): 93-100.
[13] LU X, LU Z H, YIN L J, et al. Effect of preheating temperature and calcium ions on the properties of cold-set soybean protein gel[J]. Food Res Int, 2010, 43(6): 1673-1683.
[14] 黄行健, 高丽, 章肇敏, 等. 商用大豆分离蛋白乳化活性的优化[J]. 食品工业科技,2013, 34(23): 156-159.
[15] 李磊, 迟玉杰, 王喜波. 琥珀酰化提高大豆分离蛋白乳化性的研究[J]. 中国粮油学报,2012, 25(9): 17-22.
[16] 姜绍通, 唐文婷, 潘丽军. 小麦面筋蛋白琥珀酰化修饰研究[J]. 食品科学, 2005, 26(12): 40-44.
[17] 翟爱华, 马国飞, 李丹. 琥珀酰化改性对米糠蛋白功能性质的影响[J]. 食品研究与开发, 2014, 35(19): 1-6.
[18] 王月, 张东杰. 琥珀酰化改性高溶解度大豆分离蛋白的工艺优化[J]. 食品与机械, 2011, 27(3): 119-122.
Modification of peanut protein by succinylation
LU Xin1,2, WANG Keqin3, ZHANG Lixia1,2, SONG Guohui1,2,SUN Qiang1,2, HUANG Jinian1,2
(1.Research Center of Agricultural and Sideline Products Processing, Henan Academy of Agricultural Sciences,Zhengzhou 450002, China; 2.Henan Engineering Research Center of Bioactive Substances in Agricultural Products, Zhengzhou 450002, China; 3. College of Food Science and Technology,Henan Agricultural University, Zhengzhou 450002, China)
In order to investigate the impacts of succinylation modification factors on modification effect and structure of peanut protein, the effects of mass concentration of peanut protein, dosage of succinic anhydride and reaction temperature on acylation degree and yield of the modified peanut protein were analyzed by single factor experiment and response surface methodology, and the optimal conditions of modification by succinylation were determined. The structural properties of modified peanut protein by succinylation were evaluated by infrared spectra, electronic microscope and nitrogen solubility index. The results showed that the mass concentration of peanut protein and dosage of succinic anhydride were significant factors. The optimal modification conditions were obtained as follows: mass concentration of peanut protein 58.5 g/L, dosage of succinic anhydride 19.55% of peanut protein mass and reaction temperature 49℃. Under these conditions, the acylation degree and yield of the modified peanut protein reached (82.82±0.59)%and (76.89±0.74)% respectively. Because of the introduction of succinyl group, the molecular structure of peanut protein changed, so that the fold state inclined to extension and the size of protein aggregate shrank. The solubility of modified peanut protein was also improved notably.
peanut protein; acylation degree; secondary structure; nitrogen solubility index
2016-09-25;
2017-01-21
河南省科技开放合作项目(152106000053)
芦 鑫(1981),男,助理研究员,博士,研究方向为油脂加工(E-mail)xinlu1981@foxmail.com。
黄纪念,研究员,博士(E-mail)hjinian@sina.com。
TS229;TQ936.2
A
1003-7969(2017)05-0034-06
