血必净通过Rho激酶信号通路对脓毒症急性肾损伤后肾小管细胞的影响研究
2017-08-07孙雪东严一核褚韦韦张亦婷应利君
孙雪东,严一核,褚韦韦,张亦婷,应利君
·论著·
血必净通过Rho激酶信号通路对脓毒症急性肾损伤后肾小管细胞的影响研究
孙雪东*,严一核,褚韦韦,张亦婷,应利君
目的 探讨早期应用血必净通过Rho激酶信号通路对脓毒症急性肾损伤后肾小管细胞凋亡的保护作用。方法 2014年8月—2015年6月,54只雄性SD大鼠采用随机数字表法分为假手术组、脓毒症组、血必净组,每组18只。脓毒症组和血必净组以盲肠结扎穿孔(CLP)法制造脓毒症模型,脓毒症组大鼠CLP后0.5 h尾静脉注射0.9%氯化钠溶液4 ml/kg;血必净组大鼠CLP后0.5 h尾静脉注射血必净注射液4 ml/kg。造模后6、24 h每组分别选取9只大鼠采用激光多普勒血流仪测定血流灌注(BPU)情况,采用全自动生化仪检测血肌酐、尿素氮、肌酐清除率(CrCl),病理组织学检测评定肾小管损伤评分,采用原位末端标记(TUNEL)法计算凋亡指数(AI),Western blotting法检测Rho相关卷曲螺旋形成蛋白激酶1(ROCK-1)、肌球蛋白磷酸酶靶亚基1(MYPT-1)、含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3)的表达水平。结果 3组大鼠造模后6 h BPU及造模后24 h BPU、血肌酐、尿素氮、CrCl比较,差异均有统计学意义(P<0.05);其中造模后6 h,脓毒症组大鼠BPU较假手术组升高,血必净组大鼠BPU较假手术组升高、较脓毒症组降低(P<0.05);造模后24 h,脓毒症组大鼠BPU较假手术组降低,脓毒症组大鼠血肌酐、尿素氮、CrCl较假手术组升高,血必净组大鼠尿素氮、CrCl较假手术组升高,血必净组大鼠BPU较脓毒症组升高,血必净组大鼠血肌酐、尿素氮、CrCl较脓毒症组降低(P<0.05)。造模后6 h,3组肾小管损伤评分、AI比较,差异无统计学意义(P>0.05);造模后24 h,3组肾小管损伤评分、AI比较,差异有统计学意义(P<0.05);其中脓毒症组肾小管损伤评分、AI较假手术组升高,血必净组肾小管损伤评分、AI较假手术组升高,血必净组肾小管损伤评分、AI较脓毒症组降低(P<0.05)。造模后6、24 h,3组ROCK-1、MYPT-1和Caspase-3表达水平比较,差异均有统计学意义(P<0.05);其中造模后6 h,脓毒症组和血必净组ROCK-1、MYPT-1和Caspase-3表达水平较假手术组升高(P<0.05);造模后24 h,脓毒症组ROCK-1、MYPT-1和Caspase-3表达水平较假手术组升高,血必净组ROCK-1、MYPT-1表达水平较假手术组升高,血必净组ROCK-1、MYPT-1和Caspase-3表达水平较脓毒症组降低(P<0.05)。结论 早期应用血必净可以通过Rho激酶信号通路减少肾小管细胞在脓毒症进程中的凋亡,改善病理学改变,减轻脓毒症导致的急性肾损伤。
急性肾损伤;脓毒症;Rho相关激酶类;细胞凋亡
孙雪东,严一核,褚韦韦,等.血必净通过Rho激酶信号通路对脓毒症急性肾损伤后肾小管细胞的影响研究[J].中国全科医学,2017,20(23):2868-2874.[www.chinagp.net]
SUN X D,YAN Y H,CHU W W,et al.Effects of Xuebijing on tubular apoptosis via Rho-kinase signaling pathway in sepsis-induced acute kidney injure rats[J].Chinese General Practice,2017,20(23):2868-2874.
本研究背景:
脓毒症是重症患者中发生急性肾损伤(AKI)最常见的原因,一旦发生多器官功能衰竭,其病死率极大增加。既往观点认为肾组织缺血及肾前性灌注不足在脓毒症AKI(SI-AKI)中起主导作用,治疗方面也多只注重扩容及增强心输出量以增加肾灌注。但最新早期脓毒症研究发现肾组织灌注并没有减少,即使在脓毒性休克的过程中,肾皮质及髓质的血流量仍能维持。而细胞凋亡通路的激活被认为是导致早期SI-AKI的重要原因,Rho激酶被认为是细胞内信号传递的分子启动因子。本研究在脓毒症模型早期予以中药血必净进行干预,观察SI-AKI的病理学改变、肾小管细胞凋亡的变化以及在Rho激酶信号通路上相关蛋白的表达,结果对临床具有一定的指导意义。
尽管重症医学飞速发展,脓毒症和脓毒性休克仍然是ICU的主要死因,严重脓毒症常引起多脏器功能不全,其病死率高达25%~80%[1]。由于细胞通路产生大量炎性因子的瀑布样作用,因此传统的治疗方法常疗效甚微。近来,细胞凋亡通路的激活被认为是导致早期急性脓毒性肾损伤的重要原因,Rho被认为是细胞内信号传递的分子启动因子[2]。Rho的许多功能分子已经被识别,Rho激酶的下游蛋白ROCK能够磷酸化多种底物,包括磷酸化肌球蛋白轻链(MLC),介导肌动蛋白纤维的形成和各种细胞的表面黏附,Rho激酶信号通路参与细胞的凋亡[3-4]。血必净注射液利用中药多成分、多途径和多靶点的优势,采取“菌、毒、炎”并治的方法广泛应用于临床的多脏器功能不全的保护,但对肾脏的保护机制仍未完全阐明[3]。本研究从细胞凋亡的角度出发,研究血必净在Rho激酶信号通路上对脓毒症急性肾损伤(SI-AKI)的保护作用,并探讨其可能的机制。
1 材料与方法
1.1 实验动物 2014年8月—2015年6月,选取SPF级16~18周龄SD雄性大鼠54只,体质量(200±20)g,由浙江大学医学院实验动物中心提供和饲养,合格证号:SYXK(浙)2010-0126。实验造模前在室温20 ℃、相对湿度45%~70%的环境下,维持12 h/d光照,昼夜循环,自由进食、水;基础饲料适应性喂养1周。本实验通过医院伦理委员会论证。
1.2 动物模型的制作和分组 参照文献[5]以盲肠结扎穿孔(CLP)法制造脓毒症模型。CLP后0.5 h大鼠精神软弱,活动减少,毛色杂乱无光泽,呼吸稍促,喜饮水,解稀便作为动物模型成功的判定标准。采用随机数字表法将大鼠分为假手术组、脓毒症组、血必净组,每组18只。假手术组麻醉后开腹翻动肠道,随即关腹,术后0.5 h尾静脉注射0.9%氯化钠溶液4 ml/kg;脓毒症组大鼠CLP后0.5 h尾静脉注射0.9%氯化钠溶液4 ml/kg;血必净组大鼠CLP后0.5 h尾静脉注射血必净注射液(天津红日药业股份有限公司,10 ml/支,批准文号:国药准字Z2004003)4 ml/kg。所有大鼠在术后常规予以尾静脉注射30 ml/kg 0.9%氯化钠溶液进行液体复苏。
1.3 标本的留取和指标检测
1.3.1 生化指标的检测 造模后6、24 h每组分别随机选取9只大鼠采用戊巴比妥(50 mg/kg)进行腹腔注射麻醉,破腹暴露肾脏,采用激光多普勒血流仪(ML191,ADI-澳大利亚)测定肾脏血流,记录血流灌注(blood perfusion unit,BPU)情况,并采集腹主动脉血,留取肾脏标本。采用全自动生化仪(日立7600,日本)检测血肌酐(μmol/L)、尿素氮(mmol/L),肌酐清除率(CrCl)=U·V/P,U代表尿肌酐(μmol/L),V代表每分钟尿量(ml/min),P代表血肌酐(μmol/L);CrCl予以体质量矫正,用ml·min-1·100 g-1表示。
1.3.2 病理组织学检测 肾脏组织采用10%甲醛溶液固定、脱水、石蜡包埋、切片和苏木素-伊红(HE)染色。在光镜利用盲法的原则观察病理结果,评定肾小管损伤评分,作半定量分析。肾损伤定义为:肾小管退化、空泡变性,管型形成,小管坏死和炎症浸润。评分标准:0分,正常组织;1分,单细胞、点灶性坏死;2分,肾小管受损面积<25%;3分,肾小管受损面积25%~50%;4分,肾小管受损面积>50%。
1.3.3 原位末端标记(TUNEL)法测定肾脏凋亡细胞 采用原位细胞死亡检测试剂盒(Roche,德国)并按试剂盒说明书进行操作,检测凋亡的DNA碎片:对石蜡切片脱蜡、脱水,用蛋白酶K孵育,微波修复抗原,滴加TUNEL反应液,滴加辣根过氧化物酶标抗荧光素抗体工作液,用DAB显色剂呈色;最后脱水、透明、封固。在光镜下观察凋亡细胞,被苏木素染色的细胞核呈棕黄色,即为TUNEL阳性细胞。每视野内TUNEL阳性细胞占总细胞核数的百分比即为凋亡指数(apoptotic index,AI)。采用Image-Pro Plus-6.0软件对图像的AI进行盲法分析。
1.3.4 Western blotting法检测Rho相关卷曲螺旋形成蛋白激酶1(ROCK-1)、肌球蛋白磷酸酶靶亚基1(MYPT-1)、含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3)表达 取新鲜肾脏髓质40 mg在400 μl的RIPA裂解液〔50 mmol/L三(羟甲基)氨基甲烷(Tris-HCl) pH 7.4,150 mmol/L氯化钠(NaCl),1 mmol/L苯甲基磺酰氟(PMSF),1%乙基苯基聚乙二醇(NP-40)〕中进行匀浆,然后在4 ℃下进行12 000 r/min离心15 min(离心半径6 cm)×2,除去未破裂的细胞、细胞核和线粒体。细胞上清液转移到新的试管,测定总蛋白浓度。所有细胞上清液调整到相同的蛋白浓度,并在十二烷基硫酸钠(SDS)缓冲液65 ℃中加温15 min,-20 ℃保存备用。最后进行SDS-聚丙烯酰胺凝胶(PAGE)电泳,转膜,用一抗ROCK-1(1∶1 000,Abcam,UK)、磷酸化MYPT-1(p-MYPT-1)(1∶1 000,Abcam,UK)、总MYPT-1(total-MYPT-1)(1∶500,Abcam,UK)、Caspase-3(1∶800,Cell Signal,USA)、β-actin(1∶2 000,Santa Cruz,USA)孵育过夜,最后用二抗孵育2 h,ECL化学发光试剂显色,JY-Clear ECL型化学发光凝胶成像分析系统进行成像。ROCK-1、Caspase-3的表达用各自蛋白的表达与内参β-actin比值表示,MYPT-1的表达用p-MYPT-1/total-MYPT-1比值表示。
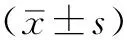
2 结果
2.1 3组大鼠造模后6、24 h BPU和血生化指标比较 3组大鼠造模后6 h BPU及造模后24 h BPU、血肌酐、尿素氮、CrCl比较,差异均有统计学意义(P<0.05);其中造模后6 h,脓毒症组大鼠BPU较假手术组升高,血必净组大鼠BPU较假手术组升高、较脓毒症组降低,差异均有统计学意义(P<0.05);造模后24 h,脓毒症组大鼠BPU较假手术组降低,脓毒症组大鼠血肌酐、尿素氮、CrCl较假手术组升高,血必净组大鼠尿素氮、CrCl较假手术组升高,血必净组大鼠BPU较脓毒症组升高,血必净组大鼠血肌酐、尿素氮、CrCl较脓毒症组降低,差异均有统计学意义(P<0.05,见表1)。
2.2 肾脏组织病理改变和肾小管损伤评分 造模后6 h各组肾脏病理组织改变不明显。造模后24 h假手术组肾脏组织病理正常,脓毒症组在肾髓质可以看到明显的肾小管退化、空泡变、坏死和透明管型并伴有单核细胞浸润;血必净组较脓毒症组肾小管坏死数量和单核细胞浸润情况明显改善(见图1,本文彩图见本刊官网www.chinagp.net电子期刊相应文章)。造模后6 h,3组肾小管损伤评分比较,差异无统计学意义(P>0.05);造模后24 h,3组肾小管损伤评分比较,差异有统计学意义(P<0.05);其中脓毒症组肾小管损伤评分较假手术组升高,血必净组肾小管损伤评分较假手术组升高、较脓毒症组降低,差异均有统计学意义(P<0.05,见表2)。
2.3 TUNEL法检测肾脏凋亡细胞 TUNEL法免疫染色显示棕黄色为凋亡细胞,提示脓毒症导致肾小管细胞的凋亡。造模后6 h各组肾小管凋亡细胞不明显。造模后24 h假手术组肾小管凋亡细胞不明显,脓毒症组见大量TUNEL阳性细胞,血必净组中凋亡细胞数量有所减少(见图2)。造模后6 h,3组AI比较,差异无统计学意义(P>0.05);造模后24 h,3组AI比较,差异有统计学意义(P<0.05);其中脓毒症组AI较假手术组升高,血必净组AI较假手术组升高、较脓毒症组降低,差异均有统计学意义(P<0.05,见表2)。
2.4 3组大鼠造模后6、24 h ROCK-1、MYPT-1和Caspase-3表达水平比较 造模后6、24 h,3组ROCK-1、MYPT-1和Caspase-3表达水平比较,差异均有统计学意义(P<0.05);其中造模后6 h,脓毒症组和血必净组ROCK-1、MYPT-1和Caspase-3表达水平较假手术组升高,差异均有统计学意义(P<0.05);造模后24 h,脓毒症组ROCK-1、MYPT-1和Caspase-3表达水平较假手术组升高,血必净组ROCK-1、MYPT-1表达水平较假手术组和脓毒症组升高,血必净组Caspase-3表达水平较脓毒症组降低,差异均有统计学意义(P<0.05,见表3、图3)。
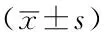
Table 2 Comparison of renal tubular injury score and AI among 3 groups 6,24 h after modeling

组别只数肾小管损伤评分(分)AI(%)6h24h6h24h假手术组90.40±0.040.39±0.035.40±1.015.60±1.07脓毒症组90.48±0.042.80±0.83a4.09±1.0228.00±5.78a血必净组90.44±0.021.60±0.54ab5.60±0.9818.20±6.87abF值0.31018.7410.352103.410P值0.8100.0010.101<0.001
注:AI=凋亡指数;与假手术组比较,aP<0.05;与脓毒症组比较,bP<0.05
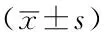
表1 3组大鼠造模后6、24 h BPU和血生化指标比较
注:BPU=血流灌注,CrCl=肌酐清除率;与假手术组比较,aP<0.05;与脓毒症组比较,bP<0.05
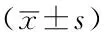
表3 3组大鼠造模后6、24 h ROCK-1、MYPT-1和Caspase-3表达水平比较
注:ROCK-1=Rho相关卷曲螺旋形成蛋白激酶1,MYPT-1=肌球蛋白磷酸酶靶亚基1,Caspase-3=含半胱氨酸的天冬氨酸蛋白水解酶3;与假手术组比较,aP<0.05;与脓毒症组比较,bP<0.05
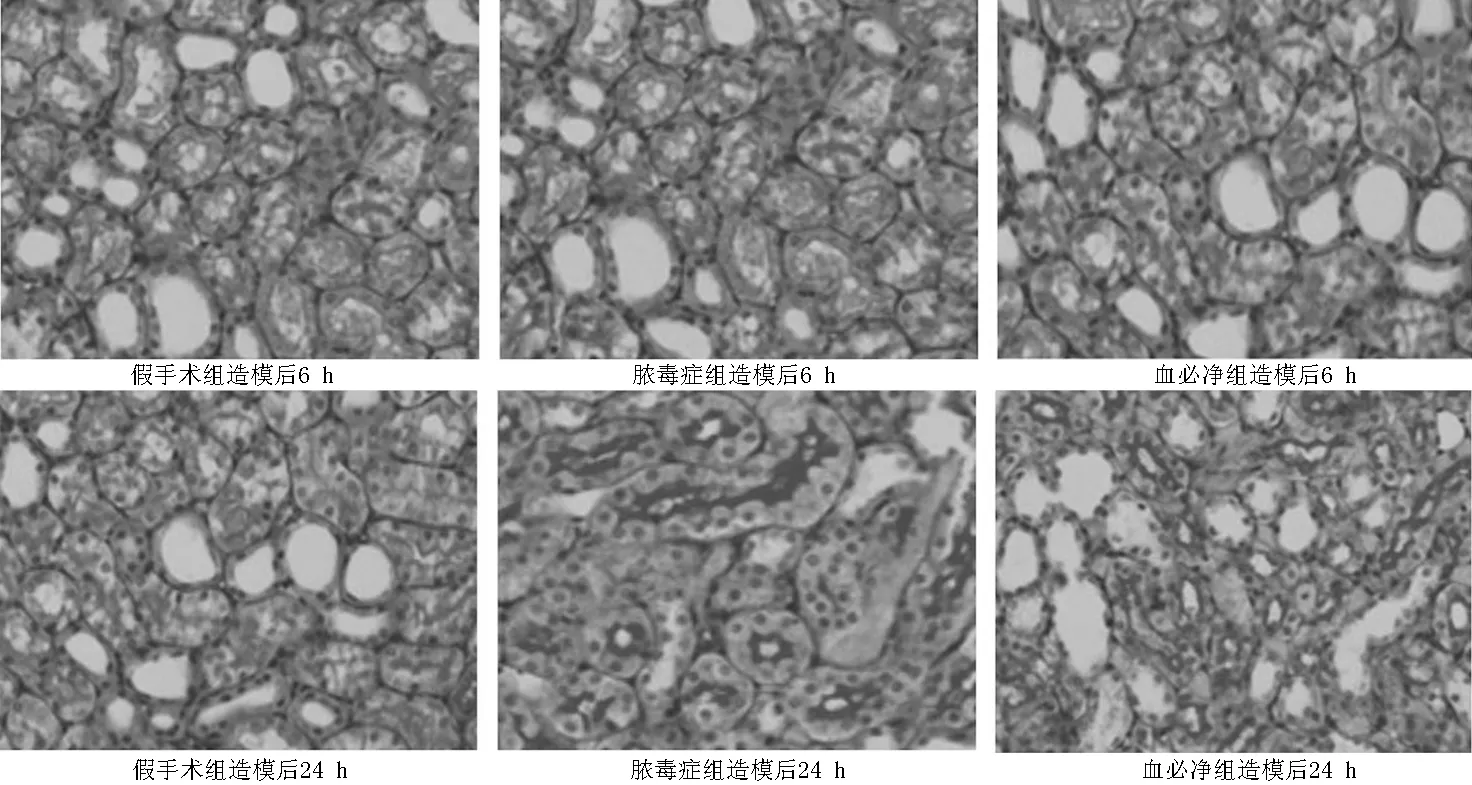
图1 造模后6、24 h各组大鼠肾脏病理学改变(HE染色,×400)
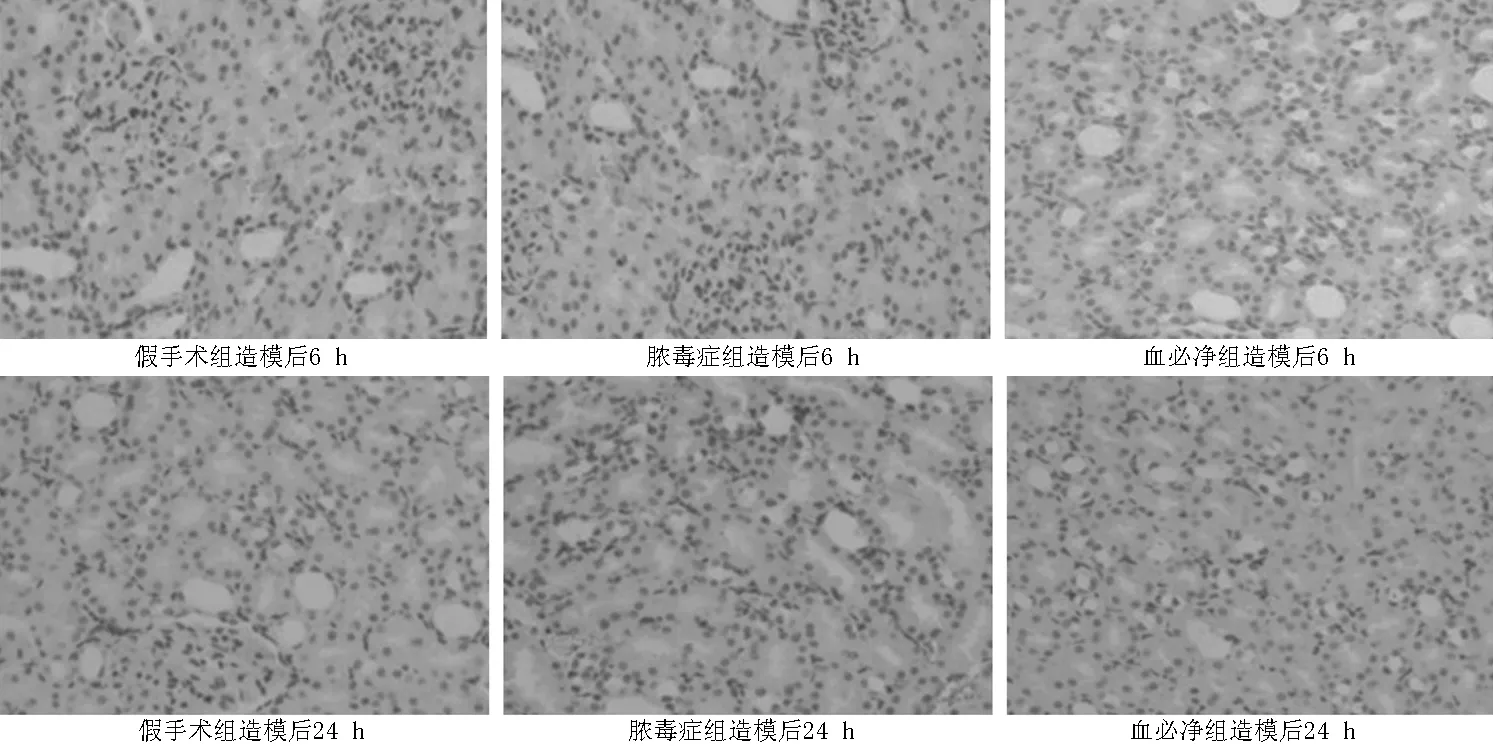
图2 造模后6、24 h各组大鼠TUNEL法检测肾脏凋亡细胞改变(TUNEL染色,×400)
3 讨论
脓毒症是感染后导致的全身炎症反应综合征,病情进一步发展成严重脓毒症可导致多器官功能障碍,包括SI-AKI,SI-AKI使患者病死率成倍增加甚至高达75%[2]。尽管抗生素不断升级、治疗手段不断改善,包括肾脏替代治疗(CRRT)的开展,不但极大增加医疗成本,而且没有明显减少脓毒症的病死率,细胞凋亡通路的激活被认为是导致SI-AKI的重要原因[6]。本研究从中药血必净入手,从Rho激酶信号通路探讨血必净对SI-AKI肾小管细胞凋亡的保护作用。
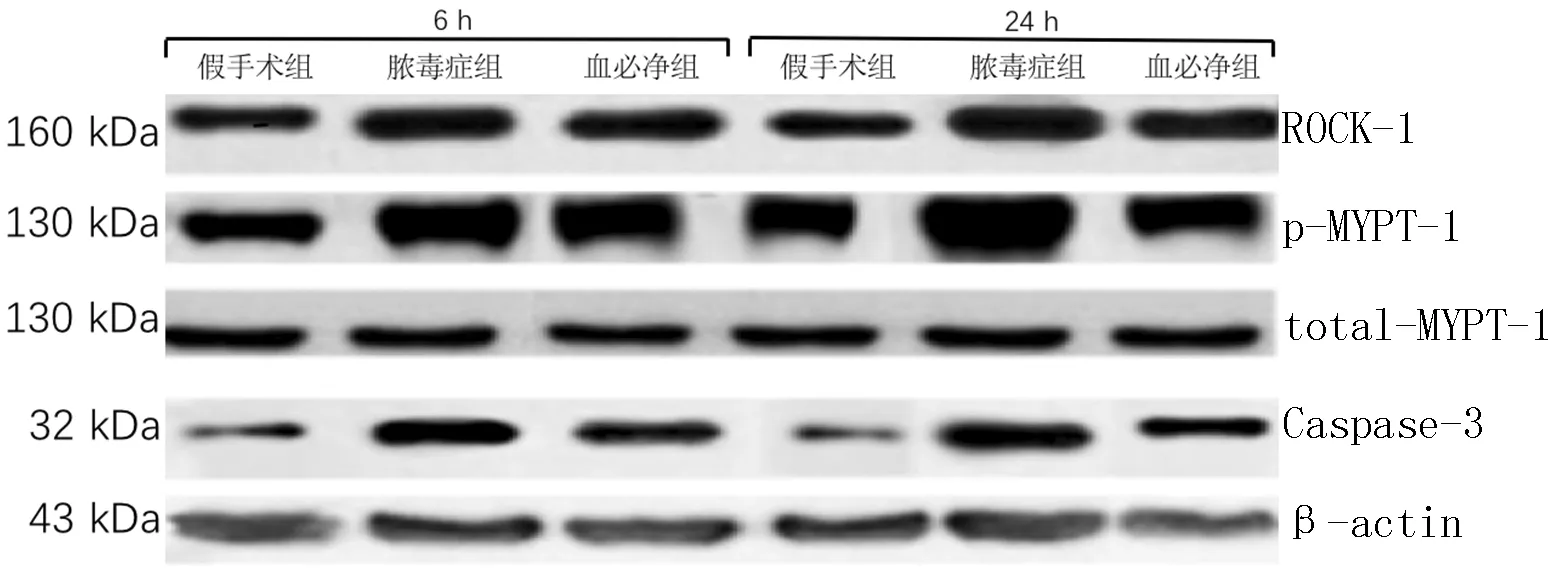
注:ROCK-1=Rho相关卷曲螺旋形成蛋白激酶1,p-MYPT-1=磷酸化肌球蛋白磷酸酶靶亚基1,total-MYPT-1=总肌球蛋白磷酸酶靶亚基1,Caspase-3=含半胱氨酸的天冬氨酸蛋白水解酶3
图3 Western blotting法检测3组大鼠造模后6、24 h ROCK-1、MYPT-1、Caspase-3表达
Figure 3 The expression of ROCK-1,MYPT-1 and Caspase-3 by Western blotting in 3 groups 6,24 h after modeling
本研究中脓毒症造模成功后,脓毒症组的血流早期流速增快,随着时间推移脓毒症进一步发展,血流速度减慢、瘀滞,这符合脓毒症临床的发展,脓毒症早期血流动力学的改变是高排低阻,进一步出现血流动力学障碍[7];而在血必净组早期也是血流增加,随着血必净疗效的逐步显现,肾脏血流并没有出现进一步的下降。目前文献也报道:早期导致SI-AKI进展不是血流减少,因此传统的治疗方法常疗效甚微[2-3]。
ROCK-1和ROCK-2是丝氨酸/苏氨酸相关的异构体,被认为是Rho蛋白的效应蛋白,能调控肌动蛋白骨架,是细胞内信号传递的启动因子,在细胞凋亡的终末阶段也发挥重要作用[8-9]。ROCK广泛存在于哺乳动物内,包括ROCK-1和ROCK-2;ROCK-1主要存在于肝、肾、睾丸等非神经组织,而ROCK-2主要存在于中枢神经和骨骼肌中。ROCK通过直接磷酸化MLC上Ser19或抑制肌球蛋白轻链磷酸化酶(myosin light chain phosphase,MLCP)来磷酸化MLC从而实现细胞调节功能[10-11]。MLCP是Rho激酶作用的底物之一,含有3个亚基,其中MYPT-1是目前研究ROCK功能最有效的手段之一,通过抑制MYPT-1在Thr696和Thr853的磷酸化,使得MLC磷酸化增加。MLC磷酸化后被诱导与肌动蛋白相互结合,激活肌动蛋白ATP酶,促使细胞骨架肌纤维和肌动球蛋白应力纤维的收缩,导致细胞骨架的改变,膜通透性改变;同时由于细胞因子的活化和炎性因子趋化的协同作用,最终导致不可逆性改变的细胞肿胀、坏死和凋亡[12]。同时,Caspase-3是细胞凋亡过程中最主要的终末剪切酶,在细胞凋亡阶段体内Caspase-3可以剪切ROCK-1的C端区域,使ROCK-1发生构象性改变,导致ROCK-1处于持续性活化状态,而ROCK-2不会发生这样现象[13]。国内学者在甘油致急性肾损伤的动物研究中观察到Caspase-3水平上升与Rho激酶底物增加密切相关[14],本研究结果与其相似。本研究结果显示,脓毒症发生后MYPT-1磷酸化增加、Caspase-3表达不断增强,导致ROCK-1的持续激活状态,从而产生一系列的病理性损害;血必净可以减少MYPT-1的磷酸化,阻止ROCK-1在脓毒症中的过度表达,同时血必净可以使Caspase-3表达降低。从生化和组织学上来看:在脓毒症早期应用血必净能明显改善肾功能的恶化,减轻肾脏组织学的形态学改变,从TUNEL免疫染色来看能够明显减少肾小管细胞的凋亡。这些证据表明血必净能够通过Rho激酶信号通路抗肾小管细胞的凋亡。
血必净是在“菌、毒、炎”并治的理论指导下研制而成的水性溶液,能抑制多种细胞炎性因子;主要成分有川芎、赤芍、丹参、红花等,具有行气活血、清热凉血、解毒止痛的功效,能扩张外周微血管,改善组织灌注与微循环,能抑制过度的炎性递质释放。单味中药常疗效甚微,而成药内各味中药之间可以产生协调效应,并对多个靶器官起作用[15-17]。因此本研究认为Rho激酶信号通路与SI-AKI密切相关,早期应用血必净可以改善SI-AKI的病理学改变,减少肾小管细胞在脓毒症进程中的凋亡。由于中药的多成分性和多靶点性,有效化学成分的研究和提纯仍然有待进一步的研究。
作者贡献:孙雪东进行文章的构思与设计、结果的分析与解释、撰写论文;严一核进行研究的实施与可行性分析;褚韦韦进行数据收集和整理;张亦婷进行统计学处理;应利君进行论文的修订、负责文章的质量控制及审校;孙雪东、应利君对文章整体负责,监督管理。
本文无利益冲突。
[1]LANGENBERG C,BAGSHAW S M,MAY C N,et al.The histopathology of septic acute kidney injury:a systematic review[J].Crit Care,2008,12(2):R38.DOI:10.1186/cc6823.
[2]WAN L,BAGSHAW S M,LANGENBERG C,et al.Pathophysiology of septic acute kidney injury:what do we really know?[J].Crit Care Med,2008,36(4 Suppl):S198-203.DOI:10.1097/CCM.0b013e318168ccd5.
[3]孙骅,陈荣华.小G蛋白Rho/Rock信号转导通路与疾病[J].国外医学(儿科学分册),2004,31(3):162-164.DOI:10.3760/cma.j.issn.1673-4408.2004.03.020. SUN H,CHEN R H.Rho/Rock mediated pathway:signal transduction and pathophysiology[J].Foreign Medical Science (Section of Pediatrics),2004,31(3):162-164.DOI:10.3760/cma.j.issn.1673-4408.2004.03.020.
[4]HOLTHOFF J H,WANG Z,SEELY K A,et al.Resveratrol improves renal microcirculation,protects the tubular epithelium,and prolongs survival in a mouse model of sepsis-induced acute kidney injury[J].Kidney Int,2012,81(4):370-378.DOI:10.1038/ki.2011.347.
[5]RITTIRSCH D,HUBER-LANG M S,FLIERL M A,et al.Immunodesign of experimental sepsis by cecal ligation and puncture[J].Nat Protoc,2009,4(1):31-36.DOI:10.1038/nprot.2008.214.
[6]SALMON-GANDONNIRE C,BENZ-DE BRETAGNE I,MERCIER E,et al.Iohexol clearance in unstable critically ill patients:a tool to assess glomerular filtration rate[J].Clin Chem Lab Med,2016,54(11):1777-1786.DOI:10.1515/cclm-2015-1202.
[7]DEWITTE A,COQUIN J,MEYSSIGNAC B,et al.Doppler resistive index to reflect regulation of renal vascular tone during sepsis and acute kidney injury[J].Crit Care,2012,16(5):R165-177.DOI:10.1186/cc11517.
[8]YAO W,HU Q,MA Y,et al.Human adipose-derived mesenchymal stem cells repair cisplatin-induced acute kidney injury through anti-apoptotic pathways[J].Exp Ther Med,2015,10(2):468-476.DOI:10.3892/etm.2015.2505.
[9]CHEN L W,CHEN W,HU Z Q,et al.Protective Effects of Growth Arrest-Specific Protein 6 (Gas6) on sepsis-induced acute kidney injury[J].Inflammation,2016,39(2):575-582.DOI:10.1007/s10753-015-0282-2.
[10]BESSHO M,AKI T,FUNAKOSHI T,et al.Rho-kinase inhibitor Y-27632 attenuates arsenic trioxide toxicity in H9c2 cardiomyoblastoma cells[J].Cardiovasc Toxicol,2013,13(3):267-277.DOI:10.1007/s12012-013-9206-2.
[11]NORITAKE K,AKI T,FUNAKOSHI T,et al.Critical roles of Rho-associated kinase in membrane blebbing and mitochondrial pathway of apoptosis caused by 1-butanol[J].Toxicol in Vitro,2012,26(6):849-855.DOI:10.1016/j.tiv.2012.04.027.
[12]KENTRUP D,REUTER S,SCHNÖCKEL U,et al.Hydroxyfasudil-mediated inhibition of ROCK1 and ROCK2 improves kidney function in rat renal acute ischemia-reperfusion injury[J].PLoS One,2011,6(10):e26419.DOI:10.1371/journal.pone.0026419.
[13]GABET A S,COULON S,FRICOT A,et al.Caspase-activated ROCK-1 allows erythroblast terminal maturation independently of cytokine-induced Rho signaling[J].Cell Death Differ,2011,18(4):678-689.DOI:10.1038/cdd.2010.140.
[14]王远大,洪权,吕杨,等.内质网应激途径诱导肾小管上皮细胞凋亡在横纹肌溶解肾损伤过程中的作用[J].解放军医学杂志,2015,40(3):194-199.DOI:10.11855/j.issn.0577-7402.2015.03.05. WANG Y D,HONG Q,LYU Y,et al.Role of endoplasmic reticulum stress-induced apoptosis of renal tubular epithelial cells in rhabdomyolysis-associated acute kidney injury[J].Medical Journal of Chinese People′s Liberation Army,2015,40(3):194-199.DOI:10.11855/j.issn.0577-7402.2015.03.05.
[15]黎宝红,吴子廷,董嘉怡.血必净联合常规机械通气治疗重症肺炎的疗效[J].海南医学院学报,2015,21(12):1617-1620.DOI:10.13210/j.cnki.jhmu.20150713.002. LI B H,WU Z T,DONG J Y.Efficacy evaluation of Xuebijing combining with conventional mechanical ventilation on severe pneumonia[J].Journal of Hainan Medical University,2015,21(12):1617-1620. DOI:10.13210/j.cnki.jhmu.20150713.002.
[16]蔡春梅,吴振瀛,段长民.血必净在急性放射性肺炎中的临床应用及疗效观察[J].实用心脑肺血管病杂志,2012,20(7):1176.DOI:10.3969/j.issn.1008-5971.2012.07.051. CAI C M,WU Z Y,DUAN C M.Clinical application and effect of Xuebijing on acute radiation pneumonitis[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2012,20(7):1176.DOI:10.3969/j.issn.1008-5971.2012.07.051.
[17]丁国娟,吕铁.血必净注射液联合参附注射液治疗脓毒症效果探讨[J].中国全科医学,2015,18(11):1300-1303.DOI: 10.3969/j.issn.1007-9572.2015.11.017. DING G J,LYU T.Injection of xuebijing with shenfu for sepsis[J].Chinese General Practice,2015,18(11):1300-1303.DOI: 10.3969/j.issn.1007-9572.2015.11.017.
(本文编辑:陈素芳)
Effects of Xuebijing on Tubular Apoptosis via Rho-kinase Signaling Pathway in Sepsis-induced Acute Kidney Injure Rats
SUNXue-dong*,YANYi-he,CHUWei-wei,ZHANGYi-ting,YINGLi-jun
CriticalCareMedicine,ShaoxingPeople′sHospital,ShaoxingHospitalofZhejiangUniversity,Shaoxing312000,China
*Correspondingauthor:SUNXue-dong,Associatechiefphysician;E-mail:drsxd@tom.com
Objective To investigate the protective effect of early application of Xuebijing on apoptosis of renal tubular cells after septic acute kidney injure(SI-AKI) by Rho-kinase signaling pathway.Methods From August 2014 to June 2015,54 male SD rats were divided into three groups by random number table:sham operation group,sepsis group,Xuebijing group,18 rats in each group.The sepsis model of the sepsis group and the Xuebijing group was established by cecal ligation and puncture (CLP) method.The rats in the sepsis group were injected with 0.9% sodium chloride solution at a dose of 4 ml/kg via tail vein 0.5 h after CLP.The rats in the Xuebijing group were injected with Xuebijing injection at a dose of 4 ml/kg via tail vein 0.5 h after CLP.Nine rats in each group were selected 6,24 h after modeling.Blood perfusion unit(BPU) was determined using laser Doppler flowmetry.Serum creatinine,urea nitrogen,creatinine clearance (CrCl) were measured by automatic biochemical analyzer.Histopathological examination was used to assess renal tubular injury score.The apoptotic indices (AI) were calculated by TdT-mediated dUTP nick end labeling (TUNEL).The expression levels of Rho associated coiled coil forming protein kinase 1 (ROCK-1),myosin phosphatase target subunit 1 (MYPT-1),Cysteine containing aspartic acid proteolytic enzyme 3 (Caspase-3) were detected by Western blotting.Results The BPU 6 h after modeling and the BPU,serum creatinine,urea nitrogen,CrCl 24 h after modeling of rats among 3 groups were compared,the differences were statistically significant (P<0.05).Among them,6 h after modeling,BPU in sepsis group was higher than that in sham operation group,and BPU in Xuebijing group was higher than that in sham operation group and lower than that in sepsis group (P<0.05).24 h after modeling,BPU in sepsis group was lower than that in sham operation group,serum creatinine,urea nitrogen and CrCl in sepsis group were higher than those in sham operation group,urea nitrogen and CrCl in Xuebijing group were higher than those in sham operation group,BPU in Xuebijing group was higher than that in sepsis group and the serum creatinine,urea nitrogen and CrCl in Xuebijing group were lower than those in sepsis group(P<0.05).6 h after modeling,renal tubular injury score and AI among 3 groups were compared,the differences were not statistically significant (P>0.05).Renal tubular injury score and AI among 3 groups were compared,the differences were statistically significant (P<0.05).24 h after modeling,renal tubular injury score and AI in sepsis group were higher than those in sham operation group,renal tubular injury score and AI in Xuebijing group were higher than those in sham operation group,and renal tubular injury score and AI in Xuebijing group were lower than those in sepsis group(P<0.05).6,24 h after modeling,the expression levels of ROCK-1,MYPT-1 and Caspase-3 among 3 groups were compared,the differences were statistically significant (P<0.05).6 h after modeling,the expression levels of ROCK-1,MYPT-1 and Caspase-3 in sepsis group and Xuebijing group were higher than those in sham operation group (P<0.05).24 h after modeling,the expression levels of ROCK-1,MYPT-1 and Caspase-3 in sepsis group were higher than those in the sham operation group,the expression levels of ROCK-1 and MYPT-1 in Xuebijing group were higher than those in the sham operation group,the expression levels of ROCK-1,MYPT-1 and Caspase-3 in Xuebijing group were lower than those in sepsis group (P<0.05).Conclusion Early application of Xuebijing can reduce the apoptosis of renal tubular cells in sepsis by Rho-kinase signaling pathway,improve pathological changes,reduce acute kidney injury caused by sepsis.
Acute kidney injury;Sepsis;Rho-associated kinases;Apoptosis
浙江省绍兴市科技计划项目(2014B70066)
R 692
A
10.3969/j.issn.1007-9572.2017.05.y09
2016-12-20;
2017-05-11)
312000浙江省绍兴市人民医院 浙江大学绍兴医院重症医学科
*通信作者:孙雪东,副主任医师;E-mail:drsxd@tom.com
