黄芩素诱导乳腺癌细胞自噬*
2017-08-07蔡兆伟蔡月琴褚燕青陈民利
凌 云, 屠 珏, 蔡兆伟, 蔡月琴, 褚燕青, 陈民利
(浙江中医药大学 1动物实验研究中心, 2比较医学研究所, 浙江 杭州 310053)
黄芩素诱导乳腺癌细胞自噬*
凌 云1, 2△, 屠 珏1, 2, 蔡兆伟1, 2, 蔡月琴1, 2, 褚燕青1, 陈民利1, 2
(浙江中医药大学1动物实验研究中心,2比较医学研究所, 浙江 杭州 310053)
目的: 考察黄芩素诱导乳腺癌细胞的自噬作用,并初步探讨其机制。方法: 采用MTT实验考察黄芩素对乳腺癌MCF-7细胞和4T1细胞活力的影响,确定给药剂量。Western blot检测黄芩素(25、50和100 μmol/L)及联合自噬抑制剂3-MA作用下,MCF-7细胞和4T1细胞中自噬特征蛋白LC3-II和LC3-I的表达水平,流式细胞术Annexin V/PI双染法观察3-MA对黄芩素诱导MCF-7细胞和4T1细胞凋亡的影响,确认黄芩素诱导自噬的作用。通过Western blot考察自噬信号通路相关蛋白p-mTOR、mTOR、p-AKT和AKT的蛋白水平,结合AKT-mTOR激活剂EGF明确AKT-mTOR通路在黄芩素诱导乳腺癌自噬中的作用。结果: 50 μmol/L及其以上剂量的黄芩素可显著抑制乳腺癌MCF-7细胞和4T1细胞的活力,其作用具有显著的时效和量效性。Western blot结果表明,50和100 μmol/L黄芩素作用下MCF-7细胞和4T1细胞的LC3-II/LC3-I比例显著增强,3-MA加入后又明显降低。流式细胞术结果显示,相比黄芩素单用组,联合自噬抑制剂可促进MCF-7细胞的坏死和凋亡。通路蛋白研究表明mTOR和AKT总量不变,其活化蛋白水平在黄芩素作用下显著降低,而加入EGF后又再次增加。结论: 黄芩素可通过抑制AKT-mTOR通路诱导乳腺癌MCF-7细胞和4T1细胞自噬。
黄芩素; 乳腺癌细胞; 自噬; AKT-mTOR信号通路
乳腺癌是一种在女性中发病率较高的癌症,2015年公布的中国肿瘤临床数据显示,其发生率占了所有女性肿瘤的15%,居于首位,且呈现逐年上升和年轻化的趋势[1]。因此,针对乳腺癌的研究一直是抗肿瘤研究的重点。
黄芩素(baicalein)是从唇形科植物黄芩根部提取的一种黄酮类单体,其具有抗炎、抗氧化、抗菌和抗肿瘤等多种生物学活性。研究表明,黄芩素在包括乳腺癌、胃癌、肝癌和非小细胞肺癌等多种肿瘤中均具有抗肿瘤活性[2-5]。其抗肿瘤作用主要包括抑制肿瘤细胞增殖、促进凋亡、抑制其侵袭转移等[2-6]。自噬是近年来开始被广泛关注和研究的一种不同于凋亡的新的细胞降解途径。目前已经有不少黄酮类化合物诱导自噬抗肿瘤的作用机制被揭示[7-8],然而黄芩素是否诱导乳腺癌自噬,目前少有报道。因此,本研究采用乳腺癌MCF-7细胞和4T1细胞作为工具,研究黄芩素与乳腺癌细胞自噬的关系。
材 料 和 方 法
1 材料
1.1 细胞株 人乳腺癌MCF-7细胞株和小鼠乳腺癌4T1细胞株均购自中科院上海生物所细胞库。
1.2 主要试剂和药物 黄芩素(含量98%)购自于上海中药标准化研究中心,临用前DMSO溶解配制0.1 mol/L母液待用。细胞培养基RPMI-1640为Gibco产品;新生牛血清购自于杭州四季青生物工程公司;Annexin V/PI双染凋亡检测试剂盒购自南京凯基公司;MTT粉末和3-甲基腺嘌呤(3-methyladenine,3-MA)购自Sigma;抗LC3抗体购自Cell Signaling,其它 I 抗均购自Santa Cruz;II 抗为LI-COR产品。表皮生长因子(epidermal growth factor,EGF)购买自PeproTech。
2 方法
2.1 细胞培养 将贴壁的MCF-7细胞和4T1细胞培养于含10%新生牛血清和1×105U/L青、链霉素的RPMI-1640培养基的培养瓶中,并置于37 ℃培养箱中培养(5% CO2,相对湿度饱和),每2~3 d传代1次。
2.2 MTT检测乳腺癌细胞活力 收集对数期细胞,调整细胞悬液浓度,将MCF-7细胞和4T1细胞以1×108/L密度接种于96孔板中,每孔100 μL,5% CO2、37 ℃培养箱孵育24 h,至细胞单层铺满孔底(96孔平底板)。吸去培养基,分别加入6.25、12.5、25、50、100、200和400 μmol/L的黄芩素,每个浓度设置6~8个复孔,5% CO2、37 ℃培养箱中分别孵育24 h,48 h和72 h,倒置显微镜下观察细胞形态并拍照。每孔加入20 μL的MTT溶液(5 g/L),继续培养4 h。4 h后,小心吸去孔内培养液,每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的吸光度。
2.3 流式细胞术检测凋亡 将MCF-7细胞和4T1细胞分别以2×108/L密度接种于6孔板中,每孔1 mL。5% CO2、37 ℃培养箱中继续孵育24 h至细胞密度约70%~80%。去除培养基,加入含25、50和100 μmol/L的黄芩素的培养基继续培养48 h后,抑制剂组加入10 mmol/L 的3-MA继续作用2 h,消化收集细胞,PBS清洗1次,加入0.5 mL的buffer重悬细胞,分别加入5 μL的Annexin V和碘化丙啶(propidium iodide,PI)两种荧光染料避光孵育15 min,上机检测。
2.4 Western blot检测细胞自噬相关蛋白LC3的表达 将2×108/L的MCF-7细胞和4T1细胞接种于6孔板中(每孔1 mL),待细胞生长至60%~70%,去除培养基,正常组给予正常培养基,给药组分别给予黄芩素25、50和100 μmol/L,黄芩素加3-MA(10 mmol/L)以及黄芩素加EGF(1 μg/L)48 h,其中3-MA在收细胞前2 h加入,EGF在黄芩素作用48 h后给予,并继续孵育6 h,消化收集细胞,800×g离心,5 min。去上清后加入事先配好的细胞裂解液,4 ℃裂解30 min后,12 000 r/min离心15 min。将上清转移到新管中加入loading buffer,混匀后沸水浴变性,-20 ℃保存。
将蛋白样品加入配制好的SDS聚丙烯凝胶泳道中,电泳2~3 h后,取凝胶并将其切成固定大小,通过蛋白转印系统将凝胶上的蛋白转印到硝酸纤维素膜上后,将膜置于5%脱脂牛奶封闭2 h。PBS洗去封闭液,加入含一定浓度 I 抗的PBST缓冲液中4 ℃孵育过夜。第2天将膜用PBST洗 10 min×3次,避光室温用含 II 抗的PBST缓冲液继续孵育2 h,避光洗去 II 抗,采用Odyssey近红外扫描仪,Odyssey软件分析其表达。
2.5 Western blot检测相关信号通路蛋白的表达 将2×108/L的MCF-7细胞和4T1细胞接种于6孔板中,待细胞生长至60%~70%,去除培养基,正常组给予正常培养基,给药组分别给予黄芩素50和100 μmol/L,黄芩素加EGF (1 μg/L),共同孵育48 h。其中EGF在黄芩素作用48 h后给予,并继续孵育6 h,收集细胞。蛋白提取及检测步骤同2.4。
3 统计学处理
数据使用SPSS 19.0软件统计分析。计量资料均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,组间两两比较采用Tukey法。以P<0.05为差异有统计学意义。
结 果
1 黄芩素对乳腺癌细胞活力的抑制作用
浓度为6.25、12.5、25、50、100、200和400 μmol/L的黄芩素对乳腺癌MCF-7细胞和4T1细胞分别作用24 h、48 h和72 h,从图1A中可知,随着黄芩素浓度的提高和作用时间的延长,其对MCF-7细胞和4T1细胞的活力抑制逐渐增强,表现为剂量和时间的依赖性。同时,图1B镜下细胞观察表明,50和100 μmol/L黄芩素作用48 h后坏死细胞增多,贴壁细胞内空泡显著增加。根据该结果,我们选择25、50和100 μmol/L作为后续实验的研究浓度。

Figure 1.Inhibitory effect of baicalein on breast cancer cells. A: inhibition rates of both MCF-7 and 4T1 cells treated with 6.25, 12.5, 25, 50, 100, 200 and 400 μmol/L baicalein for 24, 48 and 72 h detected by MTT assay. Mean±SD.n=6. B: morphological changes of both MCF-7 and 4T1 cells treated with 25, 50 and 100 μmol/L baicalein for 48 h (×200).
图1 黄芩素对乳腺癌细胞的抑制作用。
2 黄芩素诱导乳腺癌细胞自噬和凋亡的关系
基于黄芩素可诱导细胞凋亡的作用,我们考察了黄芩素诱导2种乳腺癌细胞自噬和凋亡的关系。图2是黄芩素作用下,MCF-7细胞和4T1细胞流式细胞术双染的实验结果。50和100 μmol/L黄芩素可显著诱导2种细胞凋亡,但总体程度不高(10%~20%)。当给予自噬抑制剂3-MA后,MCF-7细胞和4T1细胞的凋亡和坏死程度均显著提高,提示部分原本诱导自噬的细胞可能通过凋亡和坏死的方式发生自我降解。

Figure 2.Effects of baicalein on apoptosis and necrosis of breast cancer cells. Mean±SD.n= 3.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vs50 μmol/L baicalein group;△P<0.05vs100 μmol/L baicalein group.
图2 黄芩素对乳腺癌细胞凋亡和坏死的影响
3 黄芩素对乳腺癌细胞中LC3表达的影响
为了进一步确认黄芩素对乳腺癌细胞自噬的影响,我们通过Western blot检测LC3的表达发现,50和100 μmol/L黄芩素作用下,LC3-II的蛋白水平显著增高,LC3-Ⅱ/LC3-Ⅰ比值也明显增大(P<0.01)。而加入抑制剂3-MA后,与黄芩素单用组相比,联合自噬抑制剂组的自噬程度显著降低(P<0.01),见图3。
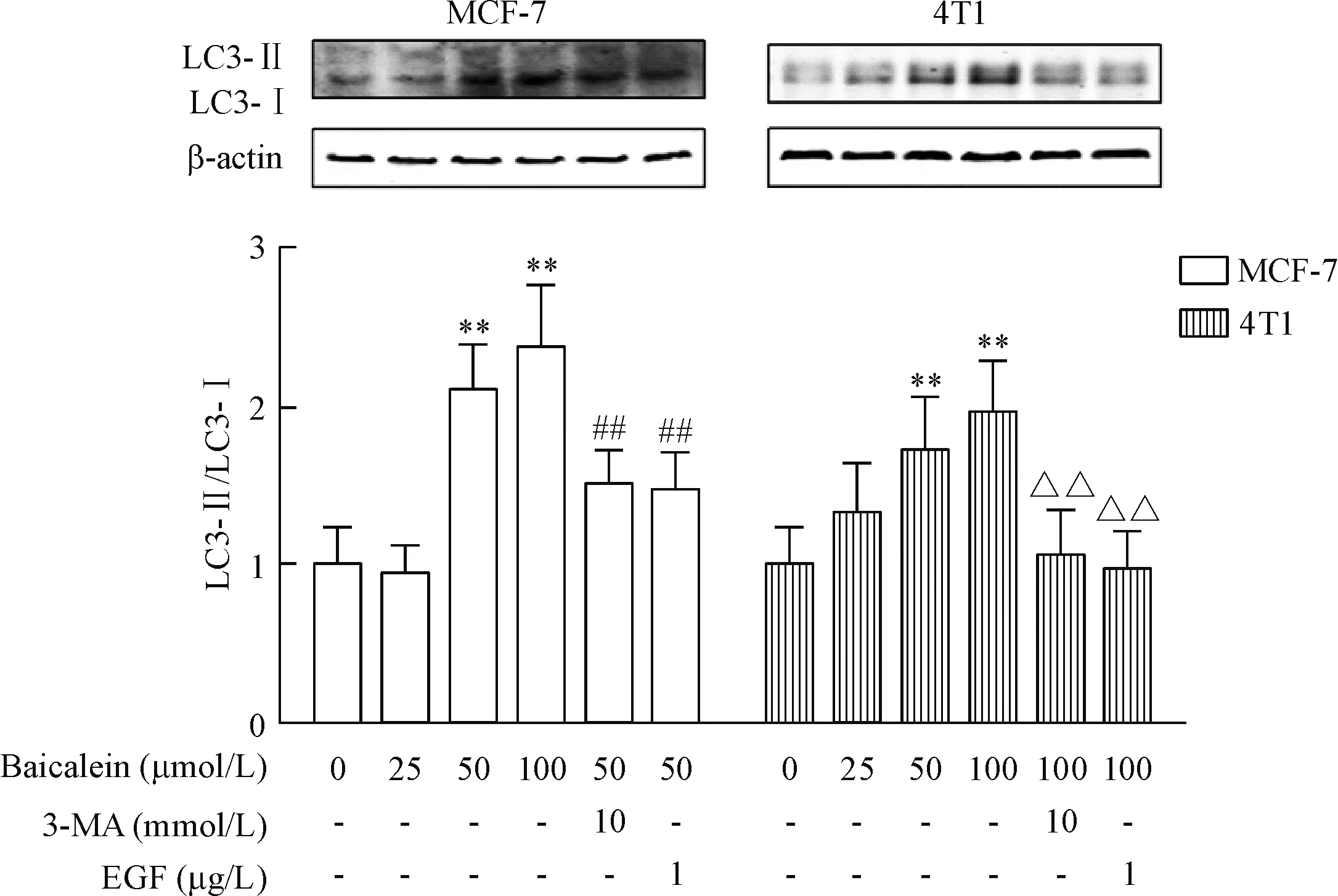
Figure 3.Effects of baicalein on the expression of LC3 protein in breast cancer cells. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vs50 μmol/L baicalein group;△△P<0.01vs100 μmol/L baicalein group.
图3 黄芩素对乳腺癌细胞LC3蛋白表达的影响
4 黄芩素诱导乳腺癌细胞自噬的相关通路蛋白的表达
从图4可见,MCF-7细胞和4T1细胞在50和100 μmol/L黄芩素作用下,p-mTOR和p-AKT的蛋白水平显著降低(P<0.01)。为了进一步确认黄芩素诱导乳腺癌自噬与AKT-mTOR信号通路的关系,我们采用AKT-mTOR信号通路激活剂EGF[9],结果表明,50 μmol/L黄芩素组中,EGF加入后细胞内p-mTOR和p-AKT再次被活化(P<0.01),同时LC3-II/LC3-I比值相比50 μmol/L黄芩素组有明显降低(P<0.01)。而黄芩素对mTOR和AKT的总蛋白水平无明显影响。
讨 论
自噬是一种保守的细胞自我降解方式,是通过溶酶体吞噬自身胞质或细胞器达到细胞内营养和能量再利用的过程。基础水平的自噬是维持细胞稳态所必需的,参与发育、免疫和抗衰老等多种生理过程。当外界因素,如缺氧、饥饿、药物作用等条件下,细胞内自噬调控基因会启动,将待降解胞质或受损的细胞器包装形成自噬体,并且通过与溶酶体融合,将其降解利用,客观上保护细胞的存活。然而,当外界环境进一步恶化,细胞将启动程序性死亡过程。因此,自噬对细胞的调控具有双重性,是不同于凋亡的一种新的调控机制[10]。
微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)是在哺乳动物中发现的酵母自噬相关基因atg8的同源体,在正常细胞中低表达。LC3有2种活化的亚型: LC3-I和LC3-II。当发生自噬时,细胞内LC3前体(pro-LC3)通过转化为LC3-I并进一步水解为LC3-II被招募至自噬体膜上,因此检测LC3-II的含量可反映细胞内自噬的水平,LC3-II/LC3-I比值升高被认为是自噬体形成的标志[11]。我们发现,在黄芩素作用下乳腺癌MCF-7和4T1细胞内LC3-II/LC3-I比值均显著增加,表明黄芩素作用后MCF-7细胞和4T1细胞内自噬体显著增加。3-MA是一种常用的自噬抑制剂,可选择性抑制自噬相关蛋白Vps34和PI3Kγ[12],阻断PI3Kγ参与介导的自噬途径。我们发现3-MA作用下,3-MA联合黄芩素组较单用黄芩素组,其细胞内蛋白表达水平的LC3-II/LC3-I比值显著降低,而流式凋亡和坏死增加,表明黄芩素可诱导MCF-7细胞和4T1细胞自噬,同时提示,其作用途径有PI3Kγ参与。
目前在中药中,许多黄酮类提取物和单体均已被证明能够诱导肿瘤细胞自噬进而死亡,从而发挥抗肿瘤作用[7-8],黄芩素作为一种黄酮类中药单体,其诱导自噬作用近年来已经得到体内外实验证实。有研究发现,在大鼠体内,黄芩素通过血红素加氧酶1诱导正常肝细胞自噬,降低肝脏缺血和再灌注损伤[13]。在肝癌细胞中,分别有研究表明,黄芩素可通过内质网应激和AKT/mTOR通路,诱导细胞自噬[14-15]。Aryal等[16]发现,黄芩素可通过 AMPK/ULK1/mTOR通路诱导前列腺癌自噬。此外,在卵巢癌中,黄芩素可通过抑制ERK和AKT诱导肿瘤细胞自噬[17]。因此,黄芩素在多种细胞,尤其是肿瘤细胞中诱导自噬作用是较为明确的,并且可能与AKT和mTOR相关。

Figure 4.Effects of baicalein on the protein levels of p-mTOR, mTOR, p-AKT and AKT in breast cancer cells. A: MCF-7 cells; B: 4T1 cells. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vs50 μmol/L baicalein group;△△P<0.01vs100 μmol/L baicalein group.
图4 黄芩素对乳腺癌细胞中p-mTOR、mTOR、p-AKT和AKT蛋白水平的影响
目前已经发现的调控自噬的上游相关信号通路有多条,包括mTOR、PI3K/AKT、ROS和NF-κB信号通路等。其中被广泛认可的最主要的一条是mTOR信号通路,其作用核心蛋白mTOR的活化是决定自噬体形成和成熟的关键蛋白[18]。mTOR是目前自噬调控最主要的信号通路蛋白之一,而AKT是其上游重要的调控分子,因此,我们考察了这2个蛋白及其活化形式的变化,发现黄芩素可显著抑制MCF-7和4T1细胞内mTOR的活化。PI3K/AKT信号通路是mTOR上游与细胞增殖,存活和凋亡相关的信号通路,是调控自噬相关mTOR的主要上游信号通路之一[19-20]。我们发现黄芩素能够抑制AKT的活化而对总的AKT影响不大。因此,我们推测PI3K/AKT信号通路可能介导了黄芩素对mTOR表达的抑制。进一步的,我们通过生长因子EGF重新激活AKT/mTOR通路,LC3-II/LC3-I比值显著降低。
综上所述,本实验通过自噬标志物和自噬抑制剂,研究黄芩素对乳腺癌MCF-7细胞和4T1细胞自噬的影响,发现一定剂量的黄芩素可诱导乳腺癌细胞自噬,并且该作用可能通过抑制细胞存活的PI3K/AKT通路,进而影响mTOR通路的活化发挥作用。该实验结果为黄芩素在乳腺癌方面的临床应用提供了一定的实验基础。
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2):115-132.
[2] Lee JH, Li YC, Ip SW, et al. The role of Ca2+in baicalein-induced apoptosis in human breast MDA-MB-231 cancer cells through mitochondria- and caspase-3-depen-dent pathway[J]. Anticancer Res, 2008, 28(3A):1701-1711.
[3] Mu J, Liu T, Jiang L, et al. The traditional Chinese medicine baicalein potently inhibits gastric cancer cells[J]. J Cancer, 2016, 7(4):453-461.
[4] Zheng YH, Yin LH, Grahn TH, et al. Anticancer effects of baicalein on hepatocellular carcinoma cells[J]. Phytother Res, 2014, 28(9):1342-1348.
[5] Cathcart MC, Useckaite Z, Drakeford C, et al. Anti-can-cer effects of baicalein in non-small cell lung cancerin-vitroandin-vivo[J]. BMC Cancer, 2016, 16:707.
[6] 孙吉凤, 刘诗音, 宋英明. 黄芩素抗肿瘤作用机制的研究进展[J]. 中国当代医药, 2015, 22(14): 24-26, 31.
[7] 王 威, 陈景红, 王新宁, 等. 葡萄籽原花青素诱导人肝癌HepG2细胞凋亡及自噬性死亡[J]. 暨南大学学报: 自然科学与医学版, 2011, 32(2):181-187.
[8] 朱茉莉, 华文敏, 梁中琴. 槲皮素诱导MCF-7细胞死亡机制中自噬与凋亡的相关性[J]. 中国药学杂志, 2010, 45(6):434-439.
[9] Li Y, Zhang L, Li K, et al. ZNF32 inhibits autophagy through the mTOR pathway and protects MCF-7 cells from stimulus-induced cell death[J]. Sci Rep, 2015, 5: 9288.
[10]Ouyang L, Shi Z, Zhao S, et al. Programmed cell death pathways in cancer: a review of apoptosis, autophagy and programmed necrosis[J]. Cell Prolif, 2012, 45(6): 487-498.
[11]Romao S, Münz C. LC3-associated phagocytosis[J]. Autophagy, 2014, 10(3):526-528.
[12]An HK, Kim KS, Lee JW, et al. Mimulone-induced autophagy through p53-mediated AMPK/mTOR pathway increases caspase-mediated apoptotic cell death in A549 human lung cancer cells[J]. PLoS One, 2014, 9(12): e114607.
[13]Liu A, Huang L, Guo E,et al. Baicalein pretreatment reduces liver ischemia/reperfusion injury via induction of autophagy in rats[J]. Sci Rep, 2016, 6:25042.
[14]Wang Z, Jiang C, Chen W, et al. Baicalein induces apoptosis and autophagy via endoplasmic reticulum stress in hepatocellular carcinoma cells[J]. Biomed Res Int, 2014, 2014:732516.
[15]Wang Y, Li T, Tang Z,et al. Baicalein triggers autophagy and inhibits the protein kinase B/mammalian target of rapamycin pathway in hepatocellular carcinoma HepG2 cells[J]. Phytother Res, 2015, 29(5):674-679.
[16]Aryal P, Kim K, Park P, et al. Baicalein induces auto-phagic cell death through AMPK/ULK1 activation and downregulation of mTORC1 complex components in human cancer cells[J]. FEBS J, 2014, 281(20):4644-4658.
[17]Wang Y, Xu Y, Tang Z, et al. Baicalein induces beclin 1 and extracellular signal-regulated kinase-dependent autophagy in ovarian cancer cells[J]. Am J Chin Med, 2017, 45(1):123-136.
[18]陈松峰, 邵增务. 自噬相关信号转导通路研究进展[J]. 国际骨科学杂志, 2013, 34(4): 269-271,280.
[19]Sun H, Wang Z, Yakisich JS. Natural products targeting autophagy via the PI3K/Akt/mTOR pathway as anticancer agents[J]. Anticancer Agents Med Chem, 2013, 13(7): 1048-1056.
[20]Strozyk E, Kulms D. The role of AKT/mTOR pathway in stress response to UV-irradiation: implication in skin carcinogenesis by regulation of apoptosis, autophagy and senescence[J]. Int J Mol Sci, 2013, 14(8):15260-15285.
(责任编辑: 陈妙玲, 罗 森)
Baicalein induces autophagy in breast cancer cells
LING Yun1, 2, TU Jue1, 2, CAI Zhao-wei1, 2, CAI Yue-qin1, 2, CHU Yan-qing1, CHEN Min-li1, 2
(1AnimalExperimentalResearchCenter,2InstituteofComparativeMedicine,ZhejiangChineseMedicineUniversity,Hangzhou310053,China.E-mail: 18465129@qq.com)
AIM: To investigate the autophagy of breast cancer cells induced by baicalein and to explore its mechanism. METHODS: The effects of baicalein on the viability of MCF-7 cells and 4T1 cells were investigated by MTT assay, and the dosage of the drug was determined. The expression levels of microtubule-associated protein 1 light chain 3-II (LC3-II) and LC3-I in the MCF-7 cells and 4T1 cells treated with baicalein at doses of 25, 50 and 100 μmol/L, or combined with autophagy inhibitor 3-methyladenine (3-MA) were determined by Western blot. In order to confirm the role of baicalein in autophagy, the effect of 3-MA on the apoptosis of both MCF-7 cells and 4T1 cells induced by baicalein was analyzed by flow cytometry. The protein levels of p-mTOR, mTOR, p-AKT and AKT were examined by Western blot and the role of AKT-mTOR pathway in the induction of autophagy in breast cancer induced by baicalein was determined by the combination of activators. RESULTS: Baicalein at 50 μmol/L and above doses significantly inhibited the viability of breast cancer cells in a dose- and time-dependent manner. The expression of LC3-II/LC3-I in both MCF-7 cells and 4T1 cells was significantly enhanced after the action of baicalein, and the ratio of LC3-II/LC3-I was significantly decreased after 3-MA addition. The results of flow cytometry showed that, compared with baicalein group, the combination of baicalein and 3-MA promoted the levels of necrosis and apoptosis. Moreover, the protein levels of p-mTOR and p-AKT were significantly decreased and were rescued by EGF, while their total protein levels were not changed.CONCLUSION: Baicalein induces autophagy through AKT-mTOR pathway both in MCF-7 cells and 4T1 cells.
Baicalein; Breast cancer; Autophagy; ATK-mTOR signal pathway
1000- 4718(2017)07- 1171- 06
2016- 10- 18
2017- 05- 09
浙江省自然科学基金(No. LQ13H280004);浙江中医药大学校级科技创新团队(No. XTD201301)
R979.19; R730.23
A
10.3969/j.issn.1000- 4718.2017.07.003
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0571-86613662; E-mail: 18465129@qq.com
