MicroRNA-483-3p对人神经胶质瘤细胞的作用*
2017-08-07刘康栋
赵 克, 刘康栋
(郑州大学附属肿瘤医院神经外科, 河南 郑州 450008)
MicroRNA-483-3p对人神经胶质瘤细胞的作用*
赵 克, 刘康栋△
(郑州大学附属肿瘤医院神经外科, 河南 郑州 450008)
目的: 探讨microRNA (miRNA)-483-3p对人神经胶质瘤细胞A172生长和迁移能力的影响及潜在作用机制。方法: 实时荧光定量聚合酶链式反应(RT-qPCR)检测人肾胚细胞系HEK-293和不同神经胶质瘤细胞株(A172、U251和SHG44)中miRNA-483-3p的表达水平。转染miRNA-483-3p抑制序列(miRNA-483-3p inhibitor)下调A172细胞中miRNA-483-3p的表达,采用CCK-8法和流式细胞术检测细胞活力和周期分布;Transwell实验检测细胞的迁移;Western blot检测周期相关调控因子及上皮-间充质转化相关蛋白的水平。双萤光素酶报告基因分析法预测及验证其可能的靶基因。结果: miRNA-483-3p在各型神经胶质瘤细胞中高表达。沉默miRNA-483-3p后,A172细胞的活力下降并呈现出明显的周期阻滞,且细胞迁移率也显著降低。同时细胞中cyclin D1、周期蛋白依赖性激酶4、磷酸化视网膜母细胞瘤蛋白、N-cadherin及vimentin的蛋白表达水平均显著降低,E-cadherin和β-catenin的蛋白表达水平显著升高。双萤光素酶报告基因分析显示Smad4是miRNA-483-3p的可能作用靶点,A172细胞共转染miRNA-483-3p inhibitor和Smad4 siRNA可部分逆转miRNA-483-3p介导的细胞增殖及迁移抑制。结论: 沉默miRNA-483-3p可通过靶向Smad4抑制神经胶质瘤细胞株A172的生长及迁移。
MicroRNA-483-3p; 神经胶质瘤; 细胞活力; 细胞迁移; Smad4
神经胶质瘤是中枢神经系统的常见恶性肿瘤,也是颅脑肿瘤死亡的主要原因之一,且复发率高,预后差,严重危害着人们的身体健康[1-2]。肿瘤细胞的恶性生物学特性则是导致胶质瘤治疗困难的根本原因,其中基因遗传学的改变,对深入研究胶质瘤发病机制与其恶性表型关系具有重要的意义,特别是对基因具有调控能力的微小RNA(microRNA,mi-RNA)。在神经胶质瘤中同样可检测到一些表达及功能异常的microRNA,且这些异常表达的microRNA 亦被证明参与调控胶质瘤细胞的生物学行为[3-4]。
miRNA-483-3p是miRNA-483大家族的一种,位于常染色体11p15.5,IGF2基因的内含子区域,广泛参与调控多种肿瘤的发生发展过程[5]。研究显示,miRNA-483-3p可发挥癌基因作用,如在食管鳞状细胞癌、直肠癌及胰腺癌中可检测到miRNA-483-3p的高表达[6-8]。Wang等[9]的研究发现,在神经胶质瘤细胞中miRNA-483家族的另一员miRNA-483-5p可抑制细胞的增殖,但关于miRNA-483-3p与神经胶质瘤细胞相关生物学行为的研究还很少。基于以上科研背景及本实验室前期的研究工作,本研究旨在阐明miRNA-483-3p对神经胶质瘤细胞系A172生长和迁移的影响,并通过生物信息学分析方法预测及验证其可能的靶基因。
材 料 和 方 法
1 材料与试剂
人神经胶质瘤细胞系SHG44、U251、A172及人肾胚细胞系HEK-293均购于中科院;四季青胎牛血清(fetal bovine serum,FBS)、DMEM培养基及Opti-NEM培养基均购于浙江天杭生物科技股份有限公司;Lipofectamine 2000及相关转染试剂购于Invitrogen; 抗cyclin D1、周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)4、视网膜母细胞瘤蛋白(retinoblastoma protein,Rb)、p-Rb、E-cadherin、β-catenin、N-cadherin、vimentin、Smad4及GAPDH抗体购于江苏碧云天生物技术研究所;CCK-8细胞活力分析试剂盒购于广州赖德生物技术有限公司;细胞周期检测试剂盒购于南京凯基公司;miRNA-483-3p抑制序列(miRNA-483-3p inhibitor,483-i)、SYBR Green I real-time PCR 试剂盒、野生型及突变型Smad4基因3’UTR-萤光素酶表达载体(WT-3’UTR和MUT-3’UTR)的构建和测序由上海吉玛制药技术有限公司提供。
2 方法
2.1 细胞培养、转染和分组 实验用所有神经胶质瘤细胞株(SHG44、U251和A172)及人肾胚细胞系HEK-293选用含10% FBS的DMEM培养基培养于37 ℃、5% CO2的培养箱中。每2 d换液,3~5 d消化传代。细胞转染按说明书要求进行,取对数生长期的细胞接种于6孔板中,待细胞融合至60%,更换为不含血清的培养基同步化12 h,随后转入质粒。取483-i或miRNA阴性对照序列(negative control,NC)加入Opti-MEM培养基中室温孵育5 min;同时另取Lipofectamine 2000加入Opti-MEM培养基中室温孵育5 min,将两者混合后室温静置20 min。然后将混合物加入到相应组别的细胞中,置于培养箱中孵育6 h,更换为正常培养基继续培养48 h。组别设置为空白对照(control,Ctrl)组、NC组和483-i转染组。提取蛋白测定转染效率并进行后续实验分析。
2.2 CCK-8法测定细胞活力 将细胞接种于96孔板中(每孔1×104个),经过相应处理后继续培养,在结束培养前2 h向每孔中加入CCK-8试剂并在培养箱中继续培养2 h。用酶标仪测定各孔450 nm处吸光度(A)。每组设置3个复孔取均值,另设单孔只加入培养基作为空白对照。细胞活力(%)=(A检测时间点-A0 h)/(A0 h-A空白对照)×100% 。
2.3 流式细胞术检测细胞周期 收集各组细胞,加冰PBS漂洗2次后离心;加70%冰乙醇于4 ℃下避光固定过夜,1 000×g离心洗去固定液。依据试剂盒说明,先后加入RNase及碘化丙啶(PI)染色液在相应的条件下孵育,最后用流式细胞仪检测Ex=488 nm处的荧光强度。
2.4 Transwell实验检测细胞迁移 收集各组细胞,加培养基重悬细胞并调整细胞密度至2×108/L。将细胞接种于Transwell小室的上室中,并在下室中加入完全培养基,置于细胞培养箱中孵育6 h。取出后,PBS冲洗并擦除上室表面的细胞。加90%乙醇固定Transwell小室内的细胞,后加0.1%结晶紫染液,PBS再次漂洗后置于倒置显微镜下观察并计数染色细胞的个数(每组细胞计数3个视野取均值)。
2.5 萤光素酶报告基因检测 靶基因预测数据库TargetScan、miRanda和PicTar预测miRNA-483-3p的靶基因,结合文献研究、基因序列及功能挑选预测值较高的靶点(即Smad4)进行验证。构建野生型及突变型Smad4基因3’UTR-萤光素酶表达载体(WT-3’ UTR和MUT-3’ UTR),并将其和/或miRNA-483-3p inhibitor 转入细胞中,通过检测萤光素酶的活性来验证Smad4是否为miRNA-483-3p的直接作用靶点。接种细胞于24孔板中,待细胞生长至60%融合,用Lipofectamine 2000将psiCHECK-2空载体、WT-3’ UTR和MUT-3’ UTR质粒转染到细胞内,同时转入483-i或NC。然后依据说明书要求,使用萤光素酶报告基因检测仪进行Dual-Luciferase Reporter Assay 测定。实验结果以萤火虫萤光素酶活性与海肾萤光素酶活性的比值来进行统计学分析。
2.6 Western blot测定蛋白水平 RIPA裂解提取细胞蛋白,采用BCA试剂盒定量后进行SDS-PAGE。调整上样蛋白的总量至60 μg,并按照1∶4的体积比加入蛋白上样缓冲液,100 ℃变性后上样进行电泳。待蓝色loading buffer跑出凝胶后将蛋白电转至PVDF膜上。用5%脱脂牛奶室温封闭90 min,按说明书要求加入相应比例的 I 抗4 ℃孵育过夜,TBST洗涤5 min×3次;加入相应的 II 抗室温孵育2 h,TBST洗涤10 min×3次,暗室中显影、定影,冲洗胶片后进行蛋白的半定量灰度分析。
2.7 RT-qPCR实验 依据Trizol说明书提取各组细胞中的总RNA,测定RNA样品的A280并定量。取2 μg总RNA以逆转录酶催化合成cDNA,调整至终体积20 μL;而后采用SYBR Green I real-time PCR的方法检测mRNA的相对表达。PCR反应条件为: 95 ℃ 5 s; 95 ℃ 10 s, 60 ℃ 35 s,共40个循环。采用2-ΔΔCt法分析mRNA的相对表达量。具体引物序列见表1。
3 统计学处理
所有数据录入SPSS 17.0软件进行统计学分析。实验结果以均数±标准差(mean±SD)表示。两组计量资料的组间差异采用t检验,多组计量资料行单因素方差分析,同时采用Bonferroni校正的t检验进行均数组间的两两比较,计数资料的比较采用2检验,以P<0.05为差异有统计学意义。

表1 引物名称和序列
F: forward; R: reverse.
结 果
1 miRNA-483-3p在神经胶质瘤细胞系中高表达
相较于人肾胚细胞系HEK-293,神经胶质瘤细胞系SHG44、U251和A172中miRNA-483-3p的表达水平显著升高,见图1A。
2 沉默miRNA-483-3p抑制细胞生长
通过脂质体将miRNA-483-3p inhibitor转染至A172细胞中,采用RT-qPCR检测miRNA-483-3p表达水平的变化。结果显示转染了miRNA-483-3p inhibitor后,A172细胞中的miRNA-483-3p表达水平显著降低(P<0.05),见图1B。
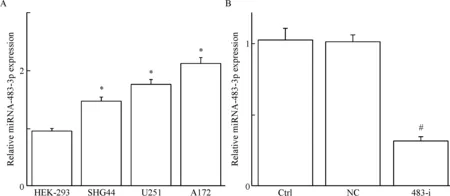
Figure 1.The expression of miRNA-483-3p in different human glioma cells (A) and the expression of miRNA-483-3p in the A172 cells after transfected with miRNA-483-3p inhibitor (B). Mean±SD.n=6.*P<0.05vsHEK-293 cells;#P<0.05vscontrol (Ctrl) group.
图1 miRNA-483-3p在不同神经胶质瘤细胞中表达和A172细胞转染miRNA-483-3p inhibitor后miRNA-483-3p的表达
采用CCK-8法,在转染miRNA-483-3p inhibitor后,分别于24 h、48 h和72 h时检测细胞活力变化(表2)。结果显示沉默miRNA-483-3p后,A172细胞的活力显著低于空白对照组(P<0.05)。
进一步采用流式细胞术检测了A172细胞周期分布,沉默miRNA-483-3p后,G0/G1期的细胞所占百分比增加至85.42%±4.41%(P<0.05),S期细胞所占百分比减少至9.64%±2.15%(P<0.05),说明沉默miRNA-483-3p可抑制A172细胞周期由G0/G1期向S期转化,见图2A。
表2 miRNA-483-3p对A172细胞活力的影响
Table 2.The effect of miRNA-483-3p on the viability of the A172 cells (%.Mean±SD.n=6)

Group0h24h48h72hCtrl012.42±1.0958.49±4.1296.22±7.32NC011.37±0.9759.21±4.2698.07±8.11483-i06.43±0.2721.08±1.17*42.83±3.34*
*P<0.05vscontrol (Ctrl) group.
3 沉默miRNA-483-3p抑制细胞迁移
采用Transwell法检测A172中沉默miRNA-483-3p对细胞迁移的影响,结果显示,转染miRNA-483-3p inhibitor后,细胞的迁移率降低至62.34%±4.21%,表明沉默miRNA-483-3p可明显抑制神经胶质瘤细胞A172的迁移,见图2B。
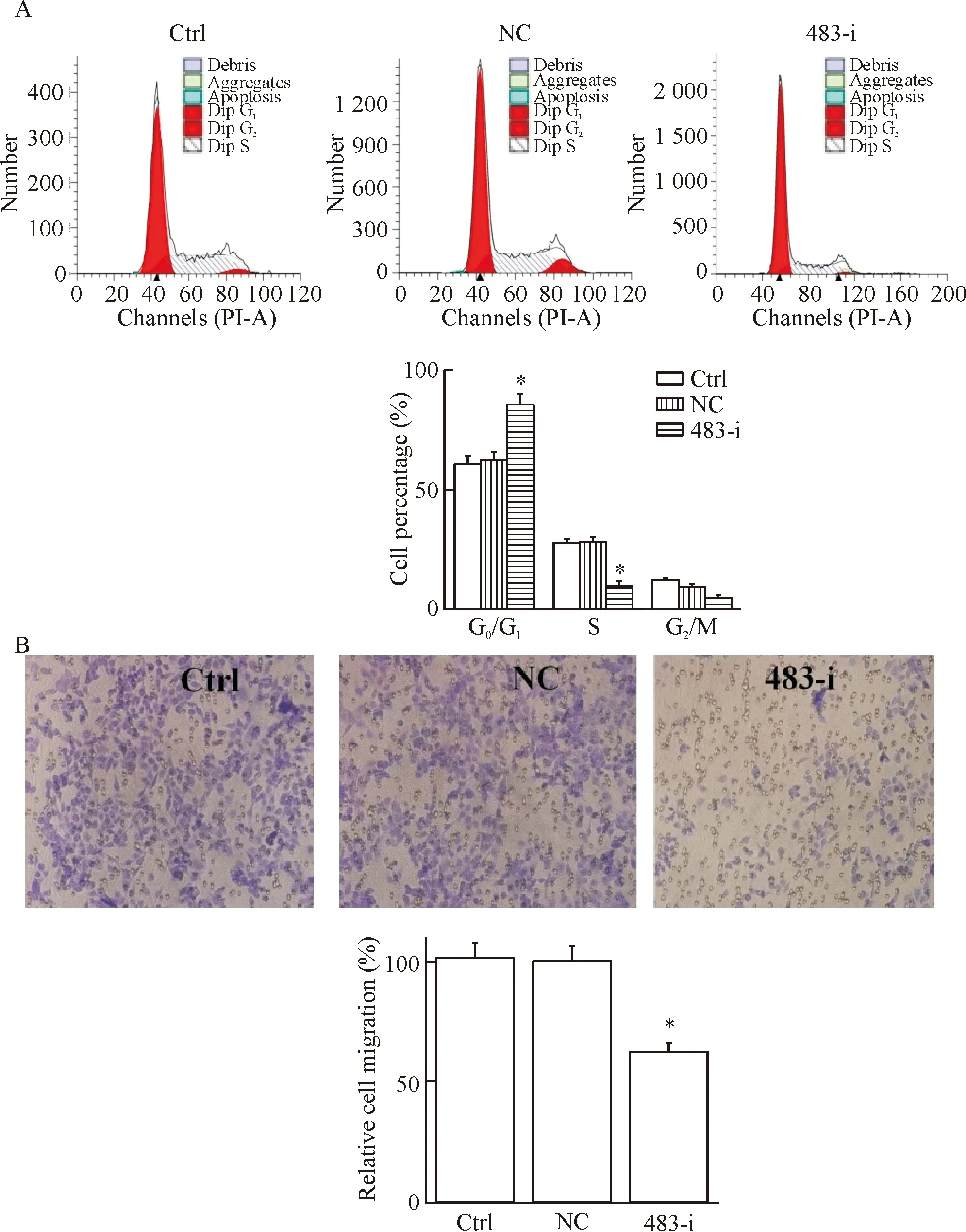
Figure 2.The effect ofmiRNA-483-3pdown-regulation on the cell cycle distribution (A) and the migration ability (B) in the A172 cells. Ctrl: control. Mean±SD.n=6.*P<0.05vsNC group.
图2 沉默miRNA-483-3p对细胞周期及细胞迁移的影响
4 沉默miRNA-483-3p对周期相关分子蛋白水平及上皮-间充质转化(epithelial-mesenchymal transition,EMT)进程的影响
如图3所示,相对于NC组细胞,沉默miRNA-483-3p后周期相关蛋白cyclin D1、CDK4和p-Rb 的蛋白水平均显著降低;且沉默miRNA-483-3p后E-cadherin和β-catenin的表达明显升高,而 N-cadherin和vimentin的表达明显降低,提示沉默miRNA-483-3p所致的细胞活力及迁移抑制作用可能是与周期相关因子及EMT进程有关。
5 miRNA-483-3p靶基因的预测及验证
为了寻找miRNA-483-3p调控神经胶质瘤细胞增殖及迁移作用的靶基因,我们通过生物信息学的方法,检索了网络数据库TargetScan、miRanda和PicTar,并结合文献检索,分析相关基因的结构及功能后得到预测值较高的靶点Smad4。A172细胞中转入miRNA-483-3p inhibitor之后,Smad4的mRNA和蛋白表达水平均明显升高,见图4A。这一结果说明,在A172细胞中,沉默miRNA-483-3p可上调Smad4的表达。

Figure 3.The effects ofmiRNA-483-3pdown-regulation on the protein levels of related molecules. A: the cell cycle-related molecules; B: the cell EMT process-related proteins. Ctrl: control. Mean±SD.n=6.*P<0.05vsNC group.
图3 沉默miRNA-483-3p对相关因子蛋白水平的影响
进一步在A172细胞中进行的萤光素酶报告基因检测,序列信息如图4B所示。转入空载体的psiCHECK-2组,同时转入miRNA-483-3p inhibitor或miRNA-NC对萤光素酶的活性并没有显著的影响;转入野生型Smad4基因表达载体(WT-3’ UTR)之后,再转入miRNA-483-3p inhibitor会抑制萤光素酶的活性(P<0.05);而转入突变型Smad4基因表达载体(MUT-3’ UTR)之后,再转入miRNA-483-3p inhibitor对萤光素酶活性的无明显抑制作用,见图4C。这一结果表明miRNA-483-3p可通过直接作用于Smad4基因上3’UTR的识别位点来抑制Smad4的表达,即Smad4是miRNA-483-3p的靶基因。
6 沉默Smad4部分逆转miRNA-483-3p的作用
为了进一步证明miRNA-483-3p是通过上调Smad4的表达来调控A172细胞的增殖及迁移,我们在A172细胞中同时转入miRNA-483-3p inhibitor 和Smad4 siRNA,检测其是否可逆转miRNA-483-3p的作用。结果显示同时转入miRNA-483-3p inhibitor 和Smad4 siRNA后,Smad4的表达明显低于对照组(图5A)。CCK-8实验结果显示48 h时细胞活力明显升高(图5B),而细胞迁移率则由对照组的(63.21±4.32)%升高至(83.58±5.14)%(图5C)。以上结果表明,沉默Smad4可以部分逆转miRNA-483-3p对细胞活力及迁移能力的抑制作用。
讨 论
研究提示,miRNA-483-3p在多种肿瘤中高表达,可发挥癌基因样作用。本研究在SHG44、U251、A172等几株神经胶质瘤细胞系中检测到miRNA-483-3p的高表达,与既往的研究一致。我们通过转染miRNA-483-3p inhibitor 沉默A172细胞中miRNA-483-3p,分析了其对神经胶质瘤细胞A172生长及迁移的影响。

Figure 4.Smad4 was a direct target of miRNA-483-3p. A: down-regulation ofmiRNA-483-3ppromoted Smad4 expression; B: mi-RNA-483-3p seed sequence and its complementary binding site in Smad4 3’UTR; C: the relative luciference activity in transfected A172 cells. Ctrl: control. Mean±SD.n=6.*P<0.05vsNC group;#P<0.05vspsiCHECK-2.
图4 Smad4是miRNA-483-3p的直接作用靶点
CCK-8细胞活力检测和周期检测的结果显示,沉默miRNA-483-3p可致A172细胞活力降低并出现周期阻滞。表明沉默miRNA-483-3p可抑制A172细胞生长。进一步采用Transwell检测细胞的迁移情况,发现沉默miRNA-483-3p可抑制A172细胞迁移,提示在神经胶质瘤细胞A172中,沉默miRNA-483-3p可通过抑制癌细胞生长及迁移,抑制神经胶质瘤的进展。
关于miRNA-483-3p影响神经胶质瘤细胞A172生长和迁移的机制目前并没有系统的研究。本实验中我们发现沉默miRNA-483-3p后,A172细胞中周期相关因子cyclin D1和CDK4的表达明显降低,Rb的磷酸化水平也显著降低。Cyclin可与CDK结合形成复合物,促进Rb的磷酸化,并促进细胞通过G1/S调控点进入S期进行DNA复制。这是多种miRNA调控肿瘤细胞增殖的关键机制[10-12]。我们的结果显示,沉默miRNA-483-3p可通过调控周期相关因子的表达,致明显的G1/S细胞周期阻滞,进而抑制细胞活力。细胞的EMT进程在肿瘤的侵袭迁移中发挥着关键的作用[13-14],我们的结果显示,沉默miRNA-483-3p可显著上调上皮细胞标志物E-cadherin及β-catenin的表达而下调间充质细胞标志物N-cadherin和vimentin的表达。结果说明沉默miRNA-483-3p可抑制A172细胞的EMT进程,进而抑制细胞的迁移。

Figure 5.Down-regulation ofSmad4 partially reversed the effect of miRNA-483-3p. A: the expression of Smad4; B: the cell viability; C: the cell migration. Ctrl: control; siRNA:Smad4 siRNA. Mean±SD.n=6.*P<0.05vs483-i+NC group.
图5 沉默Smad4可部分逆转miRNA-483-3p的作用
miRNA的调控作用大多是通过影响靶基因的表达来实现的,且一个miRNA可以有多个靶基因,一个基因也可能是多个miRNA的共同靶点。生物信息学分析显示Smad4是miRNA-483-3p的靶基因,在A172细胞中同时转入miRNA-483-3p inhibitor 和Smad4 siRNA,可逆转miRNA-483-3p对A172细胞活力和迁移的影响。既往的研究显示,Smad4是一种重要的抑癌基因,研究显示过表达Smad4 可通过周期阻滞抑制胶质瘤细胞增殖[15],且Smad4还可抑制癌细胞迁移[16],其调控作用不仅涉及多种复杂信号,同时也是多种miRNA 作用的靶基因[17-18]。在胰腺癌中的研究显示miRNA-483-3p可抑制Smad4的表达[19]。本实验中miRNA-483-3p沉默可靶向Smad4调控A172的生物学特性,但是这一作用是否涉及其他信号通路以及两者之间的具体作用机制还需进一步深入的研究。
综上所述,miRNA-483-3p在神经胶质瘤细胞中高表达;且在A172细胞中,沉默miRNA-483-3p可通过调控Smad4基因的表达,抑制神经胶质瘤细胞株A172的生长及迁移。
[1] Vargo M, Henriksson R, Salander P. Rehabilitation of patients with glioma[J]. Handb Clin Neurol, 2016, 134:287-304.
[2] Zeng T, Cui D, Gao L.Glioma: an overview of current classifications, characteristics, molecular biology and target therapies[J]. Front Biosci (Landmark Ed), 2015, 20:1104-1115.
[3] 郑国沛, 贾小婷, 彭 聪, 等. miR-205通过靶向调控TBX18抑制神经胶质瘤细胞的侵袭能力[J]. 中国病理生理杂志, 2015, 31(7):1219-1224.
[4] Wang BC, Ma J. Role of microRNAs in malignant glioma[J]. Chin Med J (Engl), 2015, 128(9):1238-1244.
[5] Qi Y, Ma N, Yan F, et al. The expression of intronic miRNAs, miR-483 and miR-483*, and their host gene,Igf2, in murine osteoarthritis cartilage[J]. Int J Biol Macromol, 2013, 61:43-49.
[6] Ma J, Hong L, Xu G, et al. miR-483-3p plays an oncogenic role in esophageal squamous cell carcinoma by targeting tumor suppressor EI24[J]. Cell Biol Int, 2016, 40(4):448-455.
[7] Cui H, Liu Y, Jiang J, et al. IGF2-derived miR-483 mediated oncofunction by suppressing DLC-1 and associated with colorectal cancer[J]. Oncotarget, 2016, 7(30):48456-48466.
[8] Abue M, Yokoyama M, Shibuya R, et al. Circulating miR-483-3p and miR-21 is highly expressed in plasma of pancreatic cancer[J]. Int J Oncol, 2015, 46(2):539-547.
[9] Wang L, Shi M, Hou S, et al. MiR-483-5p suppresses the proliferation of glioma cells via directly targeting ERK1[J]. FEBS Lett, 2012, 586(9):1312-1317.
[10]Xiao H, Xiao W, Cao J, et al. miR-206 functions as a novel cell cycle regulator and tumor suppressor in clear-cell renal cellcarcinoma[J]. Cancer Lett, 2016, 374(1):107-116.
[11]Xu G, Ji C, Song G, et al. Obesity-associated microRNA-26b regulates the proliferation of human preadipocytes via arrest of the G1/S transition[J]. Mol Med Rep, 2015, 12(3):3648-3654.
[12]Li D, Li DQ, Liu D, et al. MiR-613 induces cell cycle arrest by targeting CDK4 in non-small cell lung cancer[J]. Cell Oncol (Dordr), 2016, 39(2):139-147.
[13]Ding XM. MicroRNAs: regulators of cancer metastasis and epithelial-mesenchymal transition (EMT)[J]. Chin J Cancer, 2014, 33(3):140-147.
[14]Song Q, Xu Y, Yang C, et al. miR-483-5p promotes invasion and metastasis of lung adenocarcinoma by targeting RhoGDI1 and ALCAM[J]. Cancer Res, 2014, 74(11):3031-3042.
[15]Yang Z, Zhong L, Zhong S, et al. Adenovirus encoding Smad4 suppresses glioma cell proliferation and increases apoptosis through cell cycle arrest at G1phase[J]. Int Immunopharmacol, 2015, 25(1):169-173.
[16]Zhang X, Cao J, Pei Y, et al. Smad4 inhibits cell migration via suppression of JNK activity in human pancreatic carcinoma PANC-1 cells[J]. Oncol Lett, 2016, 11(5):3465-3470.
[17]Chaikuad A, Bullock AN. Structural basis of intracellular TGF-β signaling: receptors and Smads[J]. Cold Spring Harb Perspect Biol, 2016, 8(11): a022111.
[18]Rachagani S, Macha MA, Heimann N, et al. Clinical implications of miRNAs in the pathogenesis, diagnosis and therapy of pancreatic cancer[J]. Adv Drug Deliv Rev, 2015, 81:16-33.
[19]Hao J, Zhang S, Zhou Y, et al. MicroRNA 483-3p suppresses the expression of DPC4/Smad4 in pancreatic can-cer[J]. FEBS Lett, 2011, 585(1):207-213.
(责任编辑: 陈妙玲, 罗 森)
Effects of microRNA-483-3p on human glioma cells
ZHAO Ke, LIU Kang-dong
(DepartmentofNeurosurgery,HenanCancerHospital,ZhengzhouUniversity,Zhengzhou450008,China.E-mail:kdliu@zzu.edu.cn)
AIM: To investigate the effects of microRNA (miRNA)-483-3p on the growth and migration of human glioma cell line A172 and its potential mechanisms. METHODS: The abundance of miRNA-483-3p in human embryonic kidney 293 cells and different human glioma cell lines (A172, U251 and SHG44) was measured by RT-qPCR. After down-regulation of miRNA-483-3p by transfection of inhibitor in the A172 cells, the cell viability, cell cycle distribution and cell migration were detected by CCK-8 assay, flow cytometry and Transwell assay, respectively. Furthermore, the protein levels of cell cycle-related molecules and epithelial-mesenchymal transition markers were measured by Western blot. Luciferase reporter assay was used to predict and verify the target gene of miRNA-483-3p. RESULTS: miRNA-483-3p was highly expressed in human glioma cells. Knockdown ofmiRNA-483-3pinhibited A172 cell viability, arrested cell cycle and decreased cell migration rate. Furthermore, the protein levels of cyclin D1, cyclin-dependent kinase 4, phoshorylated retinoblastoma protein, N-cadherin and vimentin were significantly decreased after knockdown ofmiRNA-483-3p, accompanied with the up-regulation of E-cadherin and β-catenin protein expression. Luciferase reporter assay demonstrated thatSmad4 was a potential target gene of miRNA-483-3p. Down-regulation ofSmad4 in the A172 cells transfected with miRNA-483-3p inhibitor partially reversed the effect of miRNA-483-3p on cell viability and migration. CONCLUSION: Knockdown ofmiRNA-483-3prestrains the growth and migration of A172 cells by targetingSmad4.
MicroRNA-483-3p; Glioma; Cell viability; Cell migration; Smad4
1000- 4718(2017)07- 1163- 08
2017- 01- 20
2017- 05- 12
国家自然科学基金资助项目(No. 81372269)
R739.41; R730.23
A
10.3969/j.issn.1000- 4718.2017.07.002
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0371-65587307; E-mail: kdliu@zzu.edu.cn
