拮抗旱柳枯萎病菌YQT13菌株发酵条件和抑菌稳定性1)
2017-08-01朱丹璐刘忠玄刘雪峰刘朝霞王斌
朱丹璐 刘忠玄 刘雪峰 刘朝霞 王斌
(东北林业大学,哈尔滨,150040) (内蒙古鄂尔多斯市森防站)
拮抗旱柳枯萎病菌YQT13菌株发酵条件和抑菌稳定性1)
朱丹璐 刘忠玄 刘雪峰 刘朝霞 王斌
(东北林业大学,哈尔滨,150040) (内蒙古鄂尔多斯市森防站)
从鄂尔多斯伊金霍洛旗旱柳枯萎病疫区采集的土样中分离获得对该病原菌(成团泛氏菌Pantoeaagglomerans)生长有抑制作用的菌株YQT13(米根霉Rhizopusoryzae)。通过平板打孔对峙方法对该菌株进行最佳培养基筛选、最适培养条件优化及发酵液稳定性研究。结果表明:最佳培养条件为葡萄糖40 g·L-1、蛋白胨10 g·L-1、初始pH值6.2、摇培速度160 r·min-1、培养温度35 ℃,其发酵原液抑菌直径(14.2±0.3)mm。浓缩作用能有效提高发酵液抑菌效果,发酵液于121 ℃灭菌30 min或-80~0 ℃保存20 d抑菌活性几乎不变,但光稳定性较差;pH值3.0保存24 h抑菌活性不变,随着pH值增大抑菌直径减小,pH≥10.0保存24 h会完全失活。
生防菌;发酵条件;旱柳枯萎病;成团泛氏菌;根霉菌
Biocontrol bacteria; Fermentation conditions;Salixmatsudanawilt disease;Pantoeaagglomerans;Rhizopus
旱柳是鄂尔多斯地区最主要的造林乔木,在沙漠治理和城市绿化中有极其重要地位[1-2]。2012年以来,旱柳枯萎病大面积暴发严重威胁树木健康,发病植株新叶提前枯萎、凋落,且感病枝干横截面边材位置有褐色的环状坏死病斑,伴有臭味液体流出,整株将在1~3 a完全枯死[3]。
在国外,1924年荷兰学者Day[4]首次发现由Erwiniasalicis引起板球拍柳水印病;1931年Lindeijer[5]报道白柳水印病和Day描述的症状相似。英国、荷兰、比利时、澳大利亚、美国、日本都有柳树水印病的报道,防治上均采取销毁感病株、植物检疫、抗病育种、化学防治等方法,但防治效果并不理想[6-11]。国内仅有金九辰[12]对西宁地区的柳树枯萎病有过研究,病原与国外报道一致,但未提出良好的防治方法。
霉菌在自然界分布较广,用途广泛,工农业生产中常用的糖化菌、产酸菌和生防菌多为霉菌[13-14]。在森林病虫害防治方面,木霉菌是理想的广谱性生防菌,对土传或气传的真菌和细菌性病害均有较好防治效果[15-16],而利用黑根霉和木霉协同作用防治引起多种枯萎病的病原尖孢镰刀菌(Fusariumoxysporum)效果更显著[17];笔者通过分离获得米根霉(Rhizopusoryzae)对旱柳枯萎病病原有较好的抑菌作用,笔者对其抑菌培养条件和抑菌物稳定性进行研究,为下一步生产应用提供依据。
1 材料与方法
供试菌种:旱柳枯萎病病原菌(成团泛氏菌Pantoeaagglomerans)[3]。生防菌YQT13(米根霉RhizopusoryzaeWent et Pr. Geerl.)从内蒙古鄂尔多斯伊金霍洛旗旱柳枯萎病疫区土壤中分离获得。二者均保存于东北林业大学病理实验室。
发酵培养基的优选:选用PDA、1/2PDA、1/5PDA、MMN、Martin、沙保弱、沙氏葡萄糖、察氏共8种培养基对YQT13菌株进行液体发酵培养。平板打孔对峙法测量抑菌直径以评价抑菌效果,依据菌丝干质量评价真菌的生长量,菌丝干质量=摇培菌丝干质量-接入菌丝干质量;用抑菌直径评价抑菌效果,抑菌直径=实测抑菌直径-打孔直径(14 mm)。菌丝干质量测定,150 mL三角瓶中加入以上液体培养基60 mL,各重复3组,灭菌,接入经PDA充分活化的10 mm生防菌饼2个,160 r·min-1、25 ℃摇培3 d,用纱布过滤菌丝烘干至恒质量测量其干质量。抑菌直径测定,90 mm平板加入20 mL PDA,凝固后用三角推涂布200 μL细菌原液,均匀打孔4个,孔径14 mm,滴加300 μL经0.22 μm微孔滤膜过滤的发酵液,25 ℃培养36 h测其抑菌直径。
碳、氮形态对YQT13发酵液抑菌效果的影响:将筛选出的最佳的培养基中氮形态分别替换为NaNO3、蛋白胨、酵母膏、(NH4)2·SO4、NH4Cl和无氮;再将碳形态分别替换为蔗糖、葡萄糖、果糖、麦芽糖、乳糖和无糖进行单因素试验。经换算使各成分加入的碳或者氮元素含量一致,重复3组,测量菌丝干质量和抑菌直径。
摇培转速对YQT13发酵液抑菌效果的影响:从碳、氮形态对YQT13发酵液抑菌效果影响的试验中筛选的最佳碳氮形态刚好为沙氏葡萄糖培养基标准配方(葡萄糖40 g,蛋白胨10 g,蒸馏水1 L,pH值5.8)。将YQT13接入到沙氏葡萄糖培养基中,分别设置静止、80、160、200于25 ℃摇培3 d,测量菌丝干质量和抑菌直径。
培养温度对YQT13发酵液抑菌效果的影响:在测得的最佳摇培速度下,将拮抗菌YQT13接入到沙氏葡萄糖培养基中,分别在15、25、35、45 ℃下,160 r·min-1进行液体摇培,培养3 d,测量菌丝干质量和抑菌直径。
pH值对YQT13发酵液抑菌效果的影响:预试验表明,用HCl和NaOH配制成不同pH值的无菌水溶液对细菌生长无抑制作用。所以,在测得的最佳培养温度下,用1 mol·L-1的HCl和NaOH调节沙氏葡萄糖培养基pH值至5.0、6.0、7.0、8.0、9.0,接入YQT13,35 ℃,160 r·min-1,摇培3 d,测量菌丝干质量和抑菌直径。
正交试验:以单因素试验结果,选取碳形态、氮形态、培养温度、转速和pH值5因素设计4水平(表1)正交试验L16(45),液体摇培3 d后测定抑菌直径。
YQT13发酵液活性物质稳定性的测定:发酵液活性物质光稳定性、热稳定性和pH稳定性的研究对于生产实践至关重要。将通过0.22 μm水性滤膜真空抽滤的无菌发酵液进行55 ℃的2倍真空旋转浓缩,将原液和浓缩液进行打孔对峙试验,以2倍浓缩液进行稳定性测定。热稳定性测定,在黑暗条件下保存于-80、-20、0、25、60、121 ℃(30 min),过程中应避免液体蒸发丢失,除了121 ℃外,其他温度下每5 d测定抑菌效果。光稳定性测定,将YQT13浓缩发酵液于25 ℃下分别放置在全光照、12 h交替光照和黑暗条件下,每5 d测量抑菌效果。pH稳定性测定,首先测定YQT13发酵液的pH值,再用1 mol·L-1的NaOH和HCl溶液调节浓缩液至pH为3.0、6.0、8.0、10.0、12.0,25 ℃避光放置0、6、12、24 h后测量抑菌效果。

表1 YQT13优化培养正交试验
2 结果与分析
2.1 单因素试验
2.1.1 拮抗菌发酵培养基筛选
由表2可见,沙氏葡萄糖培养基中YQT13的发酵液抑菌效果最好,原液抑菌直径为(12.4±0.2)mm;MMN菌丝干质量达8.568 3 g·L-1,但抑菌直径仅为(6.3±0.3)mm;Martin培养基中菌丝干质量达6.456 7 g·L-1,但无抑菌效果,说明抑菌效果和菌丝量不成正比关系。沙氏葡萄糖培养基的菌丝干质量和抑菌直径均大于PDA,所以选择前者为最佳培养基。

表2 YQT13最适培养基筛选
注:表中抑菌直径为平均值±标准差。
2.1.2 碳、氮形态对YQT13发酵液抑菌效果的影响
以葡萄糖和蛋白胨分别为碳氮形态时,发酵液对病原菌的抑制效果最好,原液抑菌直径为(12.5±0.6)mm(表3)。该拮抗菌不能在无氮、无机氮和氨态环境生长。YQT13菌株无碳源时菌丝能生长,而无氮源时,菌丝不能生长;单糖、双糖和多糖均能被利用。
2.1.3 转速、温度和pH值对YQT13发酵液抑菌效果的影响
摇培速度对菌丝干量和发酵液抑菌效果的影响十分显著。静止培养有少许菌丝产生,但发酵液无抑菌效果;80 r·min-1培养时,菌丝干量较小,发酵液抑菌效果不明显。160、200 r·min-1培养,菌丝生长旺盛,但抑菌效果差异不大(表4)。因此,从摇培成本以及对设备保护角度考虑,选择160 r·min-1培养更佳。
15 ℃或45 ℃都会减缓YQT13菌株的生长,且发酵液抑菌效果下降;25 ℃和35 ℃摇培YQT13菌株生长良好,且抑菌效果较好,相比之下35 ℃时菌丝生长更旺盛,抑菌更强,为(13.3±0.1)mm。所以,35 ℃培养更佳。
pH值6.0的培养基发酵液抑菌效果最佳,抑菌直径为(13.1±0.1)mm。过酸或过碱都不利于YQT13生长并产生抑菌物质。
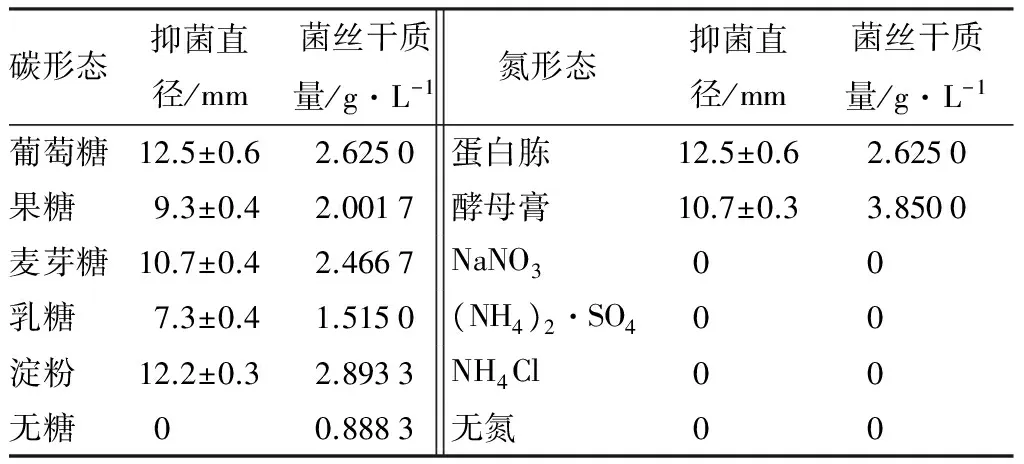
表3 不同碳、氮形态的YQT13发酵液抑菌效果
注:表中抑菌直径为平均值±标准差。
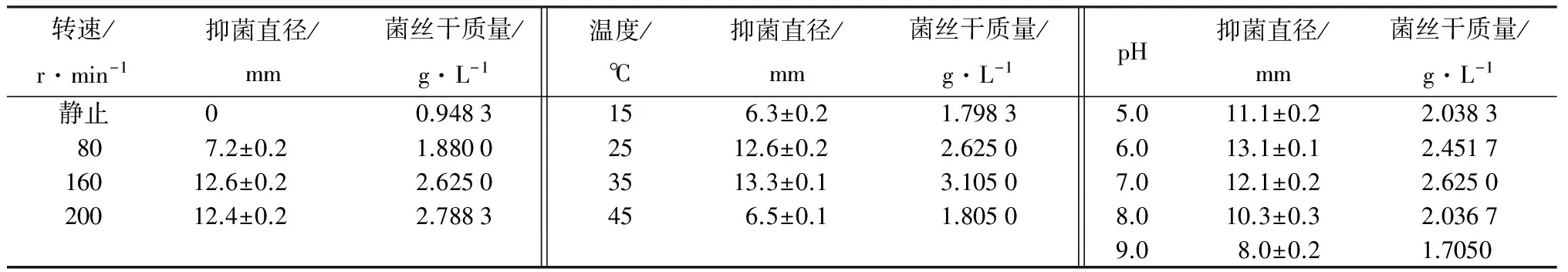
表4 不同转速、温度和pH值YQT13发酵液抑菌效果
注:表中抑菌直径为平均值±标准差。
2.2 正交试验
16组试验获得的抑菌直径分别为(10.1±0.2)、(10.8±0.4)、(12.1±0.3)、(11.4±0.3)、(11.5±0.1)、(11.8±0.2)、(12.4±0.2)、(12.3±0.2)、(11.8±0.3)、(11.9±0.4)、(12.9±0.1)、(13.1±0.3)、(12.0±0.3)、(11.7±0.4)、(11.7±0.1)、(12.2±0.2)mm。极差结果表明:各因素对试验结果的影响作用由大到小依次为葡萄糖、蛋白胨、初始pH值、温度、转速(表5)。最佳抑菌培养条件为葡萄糖40 g·L-1、蛋白胨10 g·L-1、初始pH值6.2、摇培速度160 r·min-1、培养温度35 ℃,经验证其原液抑菌直径为(14.2±0.3)mm。

表5 YQT13培养条件优化正交试验结果 mm
2.3 发酵液抑菌活性物质稳定性
2.3.1 热稳定性
2倍发酵浓缩液抑菌直径为(15.7±0.2)mm,原液的抑菌直径为(14.2±0.3)mm(图1)。可见,真空浓缩能提升发酵液抑菌效果。发酵液在-80 ℃保存20 d其抑菌效果无明显变化;在-20、0、25 ℃条件下保存20 d,抑菌直径缓慢减小(图2);而60 ℃保存20 d,发酵液抑菌直径快速下降至(6.6±0.2)mm;而121 ℃灭菌30 min,抑菌效果无明显变化,仍然大于15.0 mm。即:活性物质在-80~121 ℃较稳定,但随着保存时间的延长,抑菌效果有所下降,且高温加快其失效。

A.原液抑菌;B.2倍浓缩液抑菌

图2 温度对YQT13抑菌物质稳定性的影响
2.3.2 光稳定性
25 ℃下3种光照条件保存20 d,发酵液抑菌效果有显著差异。全光照和避光保存20 d时,抑菌直径相差4.4 mm,半光照下抑菌效果介于二者之间(图3)。说明光照不利于YQT13发酵液发挥抑菌作用和储存。
2.3.3 pH稳定性
沙氏葡萄糖培养基的YQT13发酵原液pH值为2.71~2.94。调节YQT13发酵液pH值进行pH稳定性测定(图4),pH值为3.0保存24 h,抑菌效果无变化;当pH值为6.0和8.0时,前12 h内抑菌直径明显下降,12 h后趋于平稳不再下降;而调节发酵液至pH值为10.0或12.0时,其抑菌效果快速下降,且24 h内完全失去抑菌活性。说明酸性条件有利于抑菌化合物的保存及发挥抑菌效果。

图4 pH值对YQT13抑菌物质稳定性的影响
3 结论与讨论
以抑菌直径为评判标准,单因素试验筛选出沙氏葡萄糖培养基为最佳培养基,葡萄糖和蛋白胨为最佳的碳氮源,摇培速度、培养温度和初始pH值明显影响YQT13菌丝生长及产生抑菌物质。通过正交试验筛选得出最佳抑菌培养条件为:葡萄糖40 g·L-1、蛋白胨10 g·L-1、初始pH值6.2、摇培速度160 r·min-1、培养温度35 ℃,其发酵液具有最佳的抑菌效果,发酵原液抑菌直径为(14.2±0.3)mm,2倍浓缩液抑菌直径为(15.7±0.2)mm,即浓缩作用能有效提高抑菌效果。长时间(大于20 d)光照或高温(大于20 ℃)处理都会加速活性物质的降解,pH值8.0~12.0环境中显著加快活性物质降解,并在24 h内失去抑菌活性。所以抑菌活性物质在低温(20
℃以下)、避光、酸性(pH值2.7~3.0)环境中能发挥更佳的抑菌效果也更便于储存。
培养基筛选中,Martin培养基培育出大量的菌丝但是发酵液完全没有抑菌效果;MMN培养基培养出的菌丝量最多,但是发酵液的抑菌效果不如沙氏葡萄糖培养基明显,可能是由于培养基中的某些物质限制了抑菌物质的生产或者是有效抑菌成分被降解。而Martin培养基中含有多种离子化合物可能是无抑菌效果的主要因素;察氏培养基中菌丝不生长,也可能与其中大量的离子化合物有关。YQT13菌株发酵液严重偏酸(pH值2.71~2.94),这种酸性物质可能是抑菌的活性成分,而这些酸的大量积累也抑制了YQT13菌丝繁殖;碱性环境明显降低抑菌效果甚至完全失活,也从侧面说明酸可能是抑菌物质。鄂尔多斯地区属于严重的盐碱地,部分地区地表可见白色盐碱物,土壤平均pH值为8.0,而碱性环境不利于抑菌物质发挥作用,所以探究出在盐碱地环境施药方法是下一步研究工作重点。
[1] 何维明,董鸣.毛乌素沙地旱柳生长和生理特征对遮荫的反应[J].应用生态学报,2003,14(2):175-178.
[2] 吴统贵,周和锋,吴明.旱柳光合作用动态及其与环境因子的关系[J].生态学杂志,2008,27(12):2056-2061.
[3] 晁开瑞.柳树枯萎病病原菌及其致病毒素和潜在风险性的研究[D].哈尔滨:东北林业大学,2016.
[4] DAY W R. The watermark disease of the cricket bat Willow (Salixcaerulea)[J]. Oxford Forestry Memoirs,1924(3):30.
[5] LINDEIJER E J. Een bacterie-ziekte van de wilg[J]. Tijdschrift Over Plantenziekten,1931,37(3):63-67.
[6] TURNER J G, DAVIS J M L, GUVEN K. Watermark disease of tree willows[J]. Proceedings of the Royal Society of Edinburgh. Section B. Biological Sciences,1992,98:105-117.
[7] DOWSON W J.Bacteriumsalicisday, the cause of the watermark disease of the cricket-bat willow[J]. Annals of Applied Biology,1937,24(3):528-544.
[8] METCALFE G. The watermark disease of willows. Ⅰ. Host-parasite relationships[J]. New Phytologist,1940,39(3):322-332.
[9] MAES M, HUVENNE H, MESSENS E.Brenneriasalicis, the bacterium causing watermark disease in willow, resides as an endophyte in wood[J]. Environ Microbiol,2009,11(6):1453-1462.
[10] SAKAMOTO Y, SANO Y. Inhibition of water conductivity caused by watermark disease inSalixsachalinensis[J]. Iawa Journal,2000,21(1):49-60.
[11] SAKAMOTO Y, TAKIKAWA Y, SASAKI K. Occurrence of watermark disease of willows in Japan[J]. Plant Pathology,1999,48(5):613-619.
[12] 金九辰,刘瑞,王清萍.西宁地区柳树细菌性枯萎病的研究[J].中国森林病虫,2001,20(1):5-7.
[13] SCHIPPER M A A. Revision of the genusRhizopus[J]. Stud Mycol,1984,25:1-34.
[14] 孔维锐,郭福宗,周胜.产糖化酶根霉菌的分离及其酶学性质研究[J].酿造科技,2012(9):32-35.
[15] 姚彦坡.防治马铃薯晚疫病和辣椒疫病木霉菌的筛选及生防机制研究[D].北京:中国农业大学,2015.
[16] BHUYAN S A. Antagonistic effect ofT.viride,T.harzianumandAaperigillusterreusonRhizoctoniasolanicausing sheath blight of rice[J]. Agricultural Science Society of North East India,1994,7(1):125-128.
[17] 樊恒达.拟康氏木霉和黑根霉对枯萎病的协同防治作用[D].济南:山东大学,2015.
朱丹璐,女,1991年11月生,东北林业大学林学院,硕士研究生。E-mail:913695404@qq.com。
刘雪峰,东北林业大学林学院,研究员。E-mail:757489401@qq.com。
2016年12月13日。
S763.1
Fermentation Conditions and Antibacterial Stability ofSalixmatsudanaWilt Disease Antagonistic Fungi YQT13//Zhu Danlu Liu Zhongxuan, Liu Xuefeng(Northeast Forestry University, Harbin 150040, P. R. China); Liu Zhaoxia, Wang Bin(Forest Protection Station, Erdos City in Inner Mongolia Autonomous Region)//Journal of Northeast Forestry University,2017,45(7):94-97.
1)事业单位委托科技项目(2015-170)。
责任编辑:程 红。
The strain YQT13 (Rhizopusoryzae), which inhibits the growth of pathogens (Pantoeaagglomerans), was isolated from the soil samples collected from the Ejin Horo Banner. The optimum culture medium was screened by plate perforation confinement, the optimum culture condition was optimized and the stability of fermentation broth was studied. The glucose of 40 g·L-1, peptone of 10 g·L-1, pH of 6.2, 160 r·min-1and culture temperature of 35 ℃ were the best culture conditions. The fermented stock solution had a bacteriostatic diameter of (13.3±0.1)mm. Concentration could effectively improve the bacteriostatic effect of fermentation broth. The bacteriostatic activity of the fermentation broth was kept at 121 ℃ for 30 min or -80 ℃-0 ℃ for 20 d, but the light stability was poor. The bacteriostatic activity was not changed in pH of 3.0 for 24-h storage. With the increase of pH, the bacteriostatic diameter was decreased, and the bacteriostatic diameter was 0 in pH≥10.0 for 24-h storage.
