外源SA对李花抗坏血酸-谷胱甘肽循环的影响1)
2017-08-01李学玲牛东伟庞海颖任士福李彦慧
李学玲 牛东伟 庞海颖 任士福 李彦慧
(河北农业大学,保定,071000)
外源SA对李花抗坏血酸-谷胱甘肽循环的影响1)
李学玲 牛东伟 庞海颖 任士福 李彦慧
(河北农业大学,保定,071000)
为研究外源水杨酸(SA)对李花抗坏血酸-谷胱甘肽循环以及对李花抗寒性的影响,以‘大石早生李’‘安哥诺李’2个品种为试材,以喷水处理为对照,研究了喷施适宜浓度的外源水杨酸(SA)对-2 ℃低温处理4 h后2个品种的李花H2O2质量摩尔浓度以及对抗坏血酸-谷胱甘肽循环中酶及抗氧化物质的影响。结果表明:0.20、0.15 mmol·L-1SA可以分别降低‘大石早生李’‘安哥诺李’的H2O2质量摩尔浓度,显著增强谷胱甘肽过氧化物酶(GPX)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)、脱氢抗坏血酸还原酶(DHAR)活性,提高抗坏血酸(AsA)、谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)、总抗坏血酸、总谷胱甘肽质量摩尔浓度和AsA/DHA、GSH/GSSG。低温胁迫下,AsA-GSH循环受到破坏,但喷施适宜浓度的外源SA可以显著增强李花的抗氧化酶活性,提高抗氧化物质质量摩尔浓度,降低李花的膜质过氧化作用,降低低温对细胞膜的破坏,维持AsA-GSH循环系统的稳定性,从而一定程度上提高李花的抗寒性。
李花;低温胁迫;水杨酸;抗坏血酸-谷胱甘肽循环
Plum flower; Low temperature stress; SA; AsA-GSH cycle
李(PrunussalicinaLindl.)为蔷薇科(Rosaceae)李亚科(Prunoideae)李属(Prunus)植物,原产于我国长江流域,有着悠久的栽培历史,栽培面积广阔[1]。李不仅含有多种人体健康不可或缺的营养成分,还能够很好地调节鲜果市场的供给状况[2]。但花期易遭受晚霜危害一直在生产上制约了李的生产发展,给生产带来了巨大损失。
许多研究表明,植物的抗寒性可以通过施加一些外源激素(如SA等)而有所提高。水杨酸(salicylic acid,SA)作为内源信号分子不仅可以激活植物过敏反应还对植物系统获得性抗性有重要的作用[3-4]。可见,外源激素与植物的抗寒性密切相关。此外,有研究表明,AsA-GSH循环系统能够清除在逆境中产生的活性氧(ROS)及再生AsA、GSH[5]。但目前关于外源激素对低温胁迫下李花AsA-GSH循环系统的影响尚未见报道。因此,文中通过对‘大石早生李’‘安哥诺李’两个品种的李花喷施适宜浓度的SA溶液,分析其对低温胁迫下李花AsA-GSH循环系统中的酶活性和主要抗氧化物质的影响,进而探讨外源SA对李花抗寒性的影响,为外源激素防治李树花期霜冻害提供理论依据。
1 材料与方法
2016年3月中下旬在河北省保定市易县中独乐试验基地选择15年生‘大石早生李’、15年生‘安哥诺李’作为供试材料,在显蕾期分别从树冠中部东、南、西、北4个方向采取1年生花枝,水培至实验室。
利用过冷却点温度进行外源SA浓度的筛选试验处理:将各品种的花枝放在盛有0.05、0.10、0.15、0.20、0.50 mmol·L-1SA的水溶液烧杯中进行溶液培养加喷施处理,每品种每处理5个花枝,3次重复,以清水处理为对照。在常温下每隔2 h喷施1次,喷施到花枝及花蕾湿润为止,总共喷施2次。之后转入能够准确模拟开花季节自然霜夜降温过程的MSX-2F人工霜箱内,参照孟庆瑞[6]的方法测定各处理的过冷却点温度。
适宜浓度外源SA处理:将各品种花枝放入与其相对应最适浓度激素(‘大石早生李’0.20 mmol·L-1SA、‘安哥诺李’0.15 mmol·L-1SA试验确定的适宜浓度)的烧杯中,进行溶液培养和喷施,每品种每处理5个花枝,3次重复,在常温下每隔2 h喷施1次,喷施到花枝及花蕾湿润为止,总共喷施2次。之后转入人工霜箱内,1.5 h降到0 ℃,之后以0.5 h 1 ℃的速度降温,降到-2 ℃后保持4 h。取出材料后立即摘取全部李花,液氮速冻后存于冰箱中-80 ℃超低温,用于生理指标的测定。每个处理设3次重复。
指标测定:H2O2质量摩尔浓度的测定采用林植芳等[7]方法。APX活性的测定参照沈文飚等[8]方法进行。DHAR活性参照Ma et al.[9]的方法进行测定。GPX和GR活性参照张景萍等[10]方法进行测定。AsA和DHA质量摩尔浓度参考Cakmak et al.[11]方法测定,GSH和GSSG质量摩尔浓度参照Ellmen[12]方法测定。
数据分析:采用Excel对试验数据进行计算和作图,采用DPS软件进行显著性分析。
2 结果与分析
2.1 外源SA浓度的筛选
不同浓度的外源SA处理对李花过冷却点温度的影响见表1。由表1可知,喷施不同浓度的SA处理对李花过冷却点温度的影响不同。0.05、0.10 mmol·L-1的SA处理均极显著地提高了‘大石早生李’李花的过冷却点温度,分别是对照的1.31倍、1.25倍;而0.20 mmol·L-1的SA处理极显著地降低了李花的过冷却点温度,比对照降低了15.63%,0.20、0.50 mmol·L-1的SA处理使‘安哥诺李’李花的过冷却点温度分别比对照提高了31.25%、18.75%,均与对照差异极显著,而0.15 mmol·L-1的SA处理降低了李花的过冷却点温度,并与对照存在极显著差异。
表1 不同浓度外源SA处理对不同品种李花过冷却点温度的影响
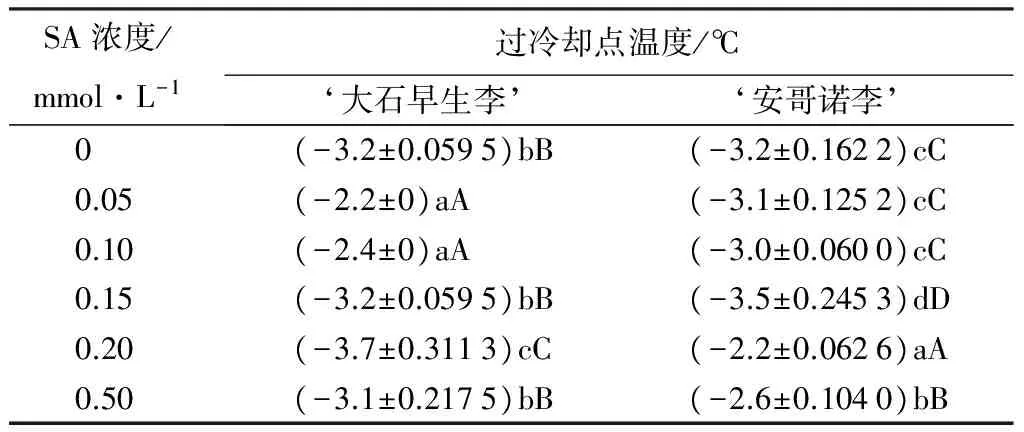
SA浓度/mmol·L-1过冷却点温度/℃‘大石早生李’‘安哥诺李’0(-3.2±0.0595)bB(-3.2±0.1622)cC0.05(-2.2±0)aA(-3.1±0.1252)cC0.10(-2.4±0)aA(-3.0±0.0600)cC0.15(-3.2±0.0595)bB(-3.5±0.2453)dD0.20(-3.7±0.3113)cC(-2.2±0.0626)aA0.50(-3.1±0.2175)bB(-2.6±0.1040)bB
注:表中数据为平均值±标准差;同列不同大写字母表示1%极显著水平,不同小写字母表示5%显著水平。
过冷却点温度作为评价植物抗寒性的重要指标,温度越低,抗寒性越强。由表1可知,对于不同品种不同浓度激素的作用不同。通过比较,喷施0.20、0.15 mmol·L-1SA分别使‘大石早生李’‘安哥诺李’过冷却点温度显著降低,提高了其李花的抗寒性。因此,0.20、0.15 mmol·L-1SA分别是‘大石早生李’‘安哥诺李’的最适外源施用浓度。文中以后的SA处理‘大石早生李’均是施用的0.20 mmol·L-1,‘安哥诺李’均是施用的0.15 mmol·L-1。
2.2 外施适宜浓度的SA对低温胁迫下李花H2O2质量摩尔浓度的影响
低温胁迫下外施SA处理对李花H2O2质量摩尔浓度的影响如表2所示。由表2可知,喷施与之相对应的适宜浓度激素(‘大石早生李’喷施0.20 mmol·L-1SA、‘安哥诺李’喷施0.15 mmol·L-1SA)之后,2个品种的H2O2质量摩尔浓度均有所下降,‘大石早生李’‘安哥诺李’的H2O2质量摩尔浓度分别比对照低了19.99%、53.15%。说明不同品种选择适宜浓度的SA处理能清除李花细胞内积累的过量H2O2,减轻膜质过氧化,降低活性氧伤害。
表2 外源SA处理对低温胁迫下不同品种李花H2O2质量摩尔浓度的影响
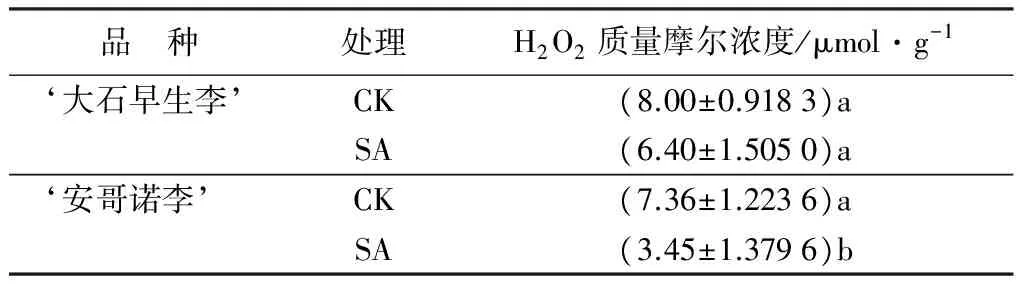
品 种处理H2O2质量摩尔浓度/μmol·g-1‘大石早生李’CK(8.00±0.9183)aSA(6.40±1.5050)a‘安哥诺李’CK(7.36±1.2236)aSA(3.45±1.3796)b
注:表中数据根据鲜质量测得;表中数据为平均值±标准差;同列不同小写字母表示5%显著水平。
2.3 外施适宜浓度的SA对低温胁迫下李花AsA-GSH循环中抗氧化物酶活性的影响
对GPX活性的影响:低温胁迫下不同处理对李花GPX活性的影响见表3。由表3可知,喷施与之相对应的适宜浓度SA之后,‘大石早生李’‘安哥诺李’的GPX活性均高于对照的,分别是对照的3.59倍、2.59倍,且均与对照存在极显著差异。
对APX活性的影响:由表3可知,喷施与之相对应的适宜浓度激素之后,‘大石早生李’‘安哥诺李’的APX活性均极显著地高于对照的。‘安哥诺李’提高效果比‘大石早生李’的好,分别比对照提高了818.74%、132.34%。
对GR活性的影响:低温胁迫下不同处理对李花GR活性的影响见表3。由表3可知,喷施与之相对应的适宜浓度SA均极显著的提高了‘大石早生李’‘安哥诺李’的GR活性。‘大石早生李’的提高效果比‘安哥诺李’的好,分别比对照提高了103.33%、75.73%。
对DHAR活性的影响:脱氢抗坏血酸还原酶(DHAR)是调控AsA氧化还原态的关键酶,可以将DHA还原成AsA[13]。由表3可知,喷施与之相对应的适宜浓度SA之后,‘大石早生李’‘安哥诺李’的DHAR活性均高于对照的。分别比对照提高了54.42%、87.65%,均与对照存在显著差异。
2.4 外施适宜浓度的SA对低温胁迫下李花抗坏血酸循环的影响
对AsA质量摩尔浓度的影响:低温胁迫下不同处理对李花AsA质量摩尔浓度的影响见表3。由表3可知,喷施与之相对应的适宜浓度SA之后,‘大石早生李’‘安哥诺李’的AsA质量摩尔浓度均高于对照的,分别比对照提高了107.35%、210.96%。‘大石早生李’与对照存在显著差异,‘安哥诺李’与对照存在极显著差异。
对DHA质量摩尔浓度的影响:低温胁迫下不同处理对李花DHA质量摩尔浓度的影响见表3。由表3可知,喷施与之相对应的适宜浓度SA之后,‘大石早生李’的DHA质量摩尔浓度高于对照,比对照提高了78.69%。‘安哥诺李’的DHA质量摩尔浓度比对照降低18.32%,与对照差异不显著。
对(AsA+DHA)质量摩尔浓度的影响:低温胁迫下不同处理对李花(AsA+DHA)质量摩尔浓度的影响见表3。喷施与之相对应的适宜浓度SA之后,‘大石早生李’‘安哥诺李’的(AsA+DHA)质量摩尔浓度均高于对照。分别比对照提高了87.72%、80.94%,与对照均存在极显著差异。
对AsA/DHA的影响:低温胁迫下不同处理对李花AsA/DHA的影响见表3。由表3可知,喷施与之相对应的适宜浓度SA之后,‘大石早生李’‘安哥诺李’的AsA/DHA均高于对照的,分别比对照提高了17.98%、226.00%。‘安哥诺李’与对照存在极显著差异,‘大石早生李’与对照差异不显著。
2.5 外施适宜浓度的SA对低温胁迫下李花谷胱甘肽循环的影响
对GSSG质量摩尔浓度的影响:低温胁迫下不同处理对李花GSSG质量摩尔浓度的影响见表3。由表3可知,喷施与之相对应的适宜浓度SA之后,‘大石早生李’‘安哥诺李’的GSSG质量摩尔浓度均高于对照,分别比对照提高了25.98%、38.84%。‘大石早生李’与对照存在显著差异,‘安哥诺李’与对照存在极显著差异。
对GSH质量摩尔浓度的影响:由表3可知,喷施与之相对应的适宜浓度SA之后,‘大石早生李’‘安哥诺李’的GSH质量摩尔浓度均高于对照,分别比对照提高了27.57%、29.87%。‘大石早生李’‘安哥诺李’均与对照存在显著差异。
对(GSH+GSSG)质量摩尔浓度的影响:低温胁迫下不同处理对李花(GSH+GSSG)质量摩尔浓度的影响见表3。由表3可知,喷施与之相对应的适宜浓度SA之后,‘大石早生李’‘安哥诺李’的(GSH+GSSG)质量摩尔浓度均极显著的高于对照,分别比对照提高了27.08%、31.94%。
对GSH/GSSG的影响:GSH在氧化胁迫条件下能够将H2O2等活性氧还原,同时自身又被氧化为GSSG,因而胞内的氧化还原状态可以通过GSH/GSSG反映出来[14]。低温胁迫下不同处理对李花GSH/GSSG的影响见表3。由表3可知,喷施与之相对应的适宜浓度SA之后,‘大石早生李’的GSH/GSSG高于对照的,比对照提高了0.58%。‘安哥诺李’GSH/GSSG比对照降低了6.24%。‘大石早生李’和‘安哥诺李’与对照均不存在显著差异。
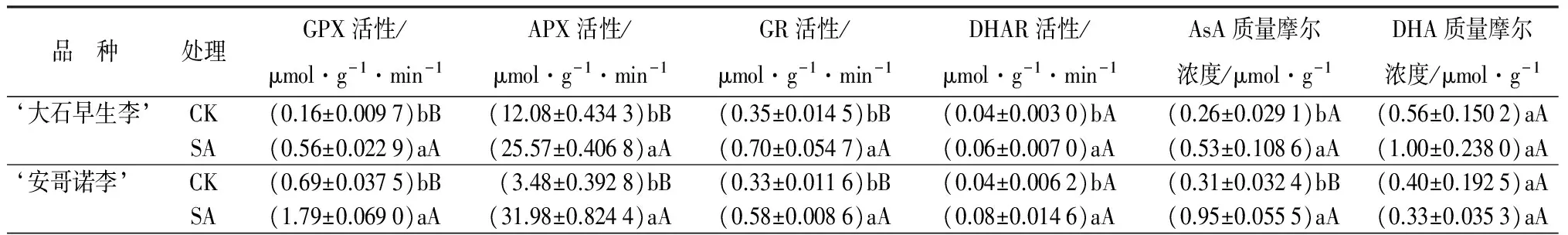
表3 外源SA处理对低温胁迫下不同品种李花AsA-GSH循环系统的影响
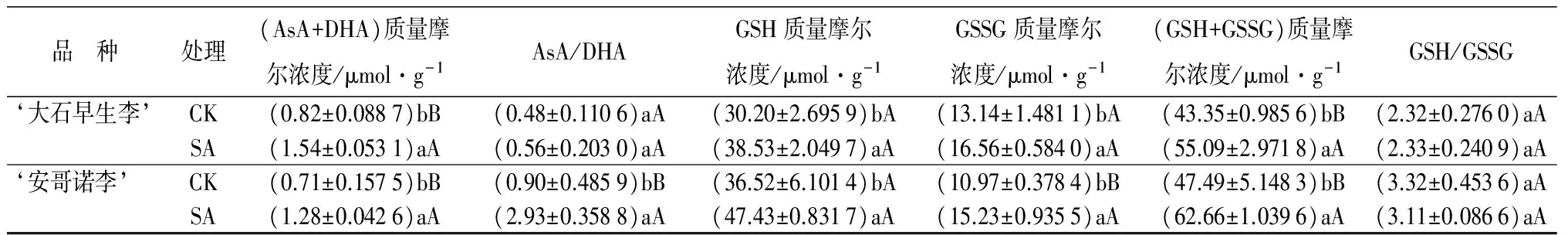
品 种处理(AsA+DHA)质量摩尔浓度/μmol·g-1AsA/DHAGSH质量摩尔浓度/μmol·g-1GSSG质量摩尔浓度/μmol·g-1(GSH+GSSG)质量摩尔浓度/μmol·g-1GSH/GSSG‘大石早生李’CK(0.82±0.0887)bB(0.48±0.1106)aA(30.20±2.6959)bA(13.14±1.4811)bA(43.35±0.9856)bB(2.32±0.2760)aASA(1.54±0.0531)aA(0.56±0.2030)aA(38.53±2.0497)aA(16.56±0.5840)aA(55.09±2.9718)aA(2.33±0.2409)aA‘安哥诺李’CK(0.71±0.1575)bB(0.90±0.4859)bB(36.52±6.1014)bA(10.97±0.3784)bB(47.49±5.1483)bB(3.32±0.4536)aASA(1.28±0.0426)aA(2.93±0.3588)aA(47.43±0.8317)aA(15.23±0.9355)aA(62.66±1.0396)aA(3.11±0.0866)aA
注:表中数据根据鲜质量测得;表中数据为平均值±标准差;同列不同大写字母表示1%极显著水平,不同小写字母表示5%显著水平。
3 结论与讨论
植物器官生理适应的最低温度即为过冷却点温度[15],作为描述植物抗寒能力强弱的重要指标,过冷却点温度越低,植物的抗寒性越强[16]。本试验研究表明,在低温条件下,经0.20 mmol·L-1SA处理的‘大石早生李’、0.15 mmol·L-1SA处理的‘安哥诺李’的李花过冷却点均是最低,抗寒性最强。因此,0.20、0.15 mmol·L-1SA分别是提高‘大石早生李’‘安哥诺李’李花抗寒性的适宜浓度。
AsA-GSH循环系统可以清除植物体内的ROS[17]。低温胁迫环境下APX、DHAR、GR、GPX可以清除H2O2等活性氧,是AsA-GSH循环中具有重要作用的酶[18]。APX和DHAR其活性的高低直接影响到AsA和DHA在AsA-DHA库的含量[19]。Jin et al[18]的研究表明,APX和DHAR活性的平衡对维持较高含量的AsA具有非常重要的作用。GR是一种黄素蛋白,与NADPH电子传递功能有关。Foyer et al.[20]研究表明,植物体内较高活性的GR能够使GSH质量摩尔浓度提高以及保持合适的GSH/GSSG,GR在维持细胞氧化还原势方面具有重要作用。本研究结果表明,喷施适宜浓度的SA后的2个品种的李花均极显著地提高了AsA-GSH循环系统抗氧化酶的活性,能够及时清除过量产生的H2O2;同时保障了AsA、GSH的再生及AsA-GSH循环的正常运转,提高了李花的抗寒性。作为植物细胞内主要的抗氧化剂AsA和GSH可以直接与活性氧反应,生成DHA和GSSG,再在DHAR和GR的还原作用下生成AsA和GSH[21]。本研究结果显示,适宜浓度的外源SA可显著提高低温胁迫下李花DHAR和GR的活性,有利于再生还原态的AsA和GSH,这与Lin et al.[22]的研究结果一致。逆境下产生的活性氧会破坏AsA-GSH循环系统,阻碍氧化态的DHA和GSSG向还原态的AsA和GSH转化,而研究发现,较高的AsA/GSH和GSH/GSSG有利于清除活性氧,提高植物的抗逆性[23]。本研究结果显示,在适宜浓度的SA处理下,2个品种李花的AsA/GSH和GSH/GSSG均有所升高,表明适宜浓度的外源SA可以及时清除细胞内的活性氧,增强李花对低温胁迫的抵抗能力,与前人研究结果一致。另外,本研究结果表明,适宜浓度的SA能够显著提高低温胁迫下李花(AsA+DHA)和(GSH+GSSG)质量摩尔浓度,从而促进抗坏血酸和谷胱甘肽的合成,保持较高的AsA-GSH循环效率,有效降低H2O2的积累。
本研究结果表明,0.20、0.15 mmol·L-1SA可分别使低温胁迫下‘大石早生李’‘安哥诺李’李花的AsA-GSH循环中抗氧化酶活性增强,AsA和GSH的再生能力增强,还原态/氧化态提高,活性氧的清除能力增强,抑制了H2O2的积累,降低膜脂过氧化程度,从而维护了细胞结构的稳定性,提高了李花的抗寒性。
[1] 靖玉柱,任慧卿.高产李子栽培与加工[M].北京:中国农业科学技术出版社,1989.
[2] 宋俊伟.三种长效基肥对李果园土壤养分及果实产量品质的影响[D].保定:河北农业大学,2015.
[3] HEINO P, SANDMAN G, Lang V, et al. Abscisic acid deficiency prevents development of freezing tolerance inArabidopsisthaliana(L.) Heynh[J]. Theoretical and Applied Genetics,1990,79(6):801-806.
[4] 张俊环,王玉柱,孙浩元,等.外源水杨酸对低温下杏花抗氧化酶和CBF转录因子表达的影响[J].植物生理学报,2014.50(2):171-177.
[5] NOCTOR G, FOYER C H. Ascorbate and glutathione: keeping active oxygen under control[J]. Annual Review of Plant Physiology & Plant Molecular Biology,1998,49:249-279.
[6] 孟庆瑞.杏花器官霜冻害生理机制研究[D].保定:河北农业大学,2009.
[7] 林植芳,李双顺,林桂珠,等.衰老叶片和叶绿体中H2O2的累积与膜脂过氧化的关系[J].植物生理学报,1988,14(1):12-16.
[8] 沈文飚,徐朗莱,叶茂炳,等.抗坏血酸过氧化物酶活性测定的探讨[J].植物生理学通讯,1996,32(3):203-205.
[9] MA F, CHENG L. The sun-exposed peel of apple fruit has higher xanthophyll cycle-dependent thermal dissipation and antioxidants of the ascorbate-glutathione pathway than the shaded peel[J]. Plant Science,2003,165(4):819-827.
[10] 张景萍,吴珍龄.几种植物中谷胱甘肽过氧化物酶活性测定[J].广西农业科学,2004,35(3):177-178.
[11] CAKMAK I, MARSCHNER H. Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase, and glutathione reductase in bean leaves[J]. Plant Physiology,1992,98(4):1222-1227.
[12] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry & Biophysics,1959,82(1):70.
[13] MEYER A J. The integration of glutathione homeostasis and redox signaling[J]. Journal of Plant Physiology,2008,165(13):1390-1403.
[14] SEN C K, PACKER L. Antioxidant and redox regulation of gene transcription[M]. Pittsburgh: Academic Press,1996.
[15] 孟庆瑞,王文凤,梁隐泉,等.杏品种花器官过冷却点及结冰点的研究[J].中国农业科学,2008,41(4):1128-1133.
[16] 宁超,孟庆瑞,李淑贤,等.抗霜冻仁用杏优株花器官抗寒性的比较研究[J].河北农业大学学报,2010,33(3):37-41.
[17] 郑小林,陈燕,敬国兴,等.草酸处理对札果采后果实AsA-GSH循环系统的影响[J].园艺学报,2011,38(9):1633-1640.
[18] JIN Y H, TAO D L, HAO Z Q, et al. Environmental stresses and redox status of ascorbate[J]. Acta Botanica Sinica,2003,45(7):795-801.
[19] 王聪,朱月林,杨立飞,等.NaCl胁迫对菜用大豆种子抗坏血酸-谷胱甘肽循环的影响[J].植物营养与肥料学报,2010,16(5):1209-1216.
[20] FOYER C H, NOCTOR G. Ascorbate and glutathione: the heart of the redox hub[J]. Plant Physiology,2011,155:2-18.
[21] 李秀,巩彪,徐坤.外源NO对高温胁迫下姜叶片活性氧代谢的影响[J].园艺学报,2014,41(2):277-284.
[22] LIN Y, LIU Z, SHI Q, et al. Exogenous nitric oxide (NO) increased antioxidant capacity of cucumber hypocotyl and radicle under salt stress[J]. Scientia Horticulturae,2012,142(4):118-127.
[23] SHALATA A, MITTOVA V, VOLOKITA M, et al. Response of the cultivated tomato and its wild salt-tolerant relativeLycopersiconpennelliito salt-dependent oxidative stress: The root antioxidative system[J]. Physiologia Plantarum,2001,112(4):487-494.
1)公益性行业(农业)科研专项资助项目(201003058-5)、河北省科技支撑项目(16236802D)。
李学玲,女,1991年3月生,河北农业大学林学院, 硕士研究生 。E-mail:1556770793@qq.com。
李彦慧,河北农业大学园林与旅游学院, 教授 。E-mail:YanHuili01@163.com。
2017年1月11日。
S662.3;Q945.78
Effect of Exogenous SA Hormones on AsA-GSH Cycle of Plum Flower//Li Xueling, Niu Dongwei, Pang Haiying, Ren Shifu, Li Yanhui(Agricultural University of Hebei, Baoding 071000, P. R. China)//Journal of Northeast Forestry University,2017,45(7):75-78.
责任编辑:任 俐。
To investigate the effects of exogenous SA hormones on AsA-GSH cycle and the cold resistance of plum flower, with water as control, we studied the effects of exogenous SA in the proper concentration on the peroxide content and ascorbate-glutathione cycle ofPrunussalicina‘Oishiwas’ and ‘Angeleno’ flowers under -2 ℃ chilling stress. The 0.2 mmol·L-1SA forP.salicina‘Oishiwas’, 0.15 mmol·L-1SA for ‘Angeleno’ could reduce the H2O2content and significantly enhance the activities of APX, DHAR, GR and GPX. The contents of AsA, GSH, GSSG, AsA+DHA, GSH+GSSG and the rations of AsA/DHA, GSH/GSSG were higher than those of the control. Therefore, low temperature stress could block AsA-GSH cycle. Compared with the control, the application of suitable content of exogenous SA could significantly enhance activities of antioxidant enzymes, enhance contents of antioxidants, reduce the membrane lipid peroxidation as well as the destruction of cell membrane, and maintain the stability of AsA-GSH cycle system to improve the cold resistance of plum flowers.
