外源Ca对旱柳Cd毒害的缓解作用
2019-09-17李崇豪薛文秀尚晓硕邹金华蒋志勤
李崇豪,薛文秀,尚晓硕,邹金华,蒋志勤
(1.天津师范大学生命科学学院,天津300387; 2.天津师范大学天津市动植物抗性重点实验室,天津300387;3.天津师范大学化学学院,天津300387)
镉(Cd)是自然界较为常见的重金属元素,因其毒性大、不能被微生物降解等原因备受关注.Cd 对植物有较强的毒害作用:①抑制细胞有丝分裂,使生物量下降;②影响植物对营养元素的吸收,导致物质合成和代谢紊乱;③使植物细胞内产生活性氧,对内膜系统造成严重伤害[1].Ca 是植物生长发育的必需元素,参与植物体内众多的生理生化反应[2],对于植物抵抗逆境胁迫和提高重金属耐性也具有重要作用[3-4].研究表明,Ca 能有效降低植物的Cd 吸收,这是因为二者具有相似的化学性质,Ca 是土壤中Cd 吸附位点的主要竞争者,从而减少Cd 对植物的毒害作用[3].Toyota 等[5]研究发现,植物体内的谷氨酸作为一种胁迫或机械损伤的信号物质,能够将信号转化为细胞质内Ca2+浓度的增加,从而将信号传播到远端器官并诱导发生防御反应.
旱柳是杨柳科(Salicaceae)中常见的树种,因其具有根系发达、生长快、易繁殖等特点,被广泛应用于园林绿化中[6].研究发现[7-8],柳树在吸收、积累以及修复土壤Cd 污染方面具有较大的潜力.如Greger 等[7]报道柳树是Cd高积累型植物,对Cd 的富集能力优于超积累植物遏蓝菜(Thlaspi arvense L),但柳树仅适用于低、中等剂量环境Cd 污染;贾中民等[8]的研究表明,培养液的Cd 质量浓度小于10 mg/L 时,垂柳和旱柳萌条均具有较强的生长适应性,旱柳对Cd 的耐受能力大于垂柳,旱柳地上部分积累的Cd 含量和Cd 向地上部分的转移系数均大于垂柳.本课题组以旱柳为实验材料,采用水培法,研究外源Ca 对于Cd 胁迫下旱柳生理特征的影响,包括光合色素含量、光合日进程、保护酶活性、丙二醛含量等,为环境重金属污染的生物修复提供参考.
1 材料和方法
1.1 材料、试剂和仪器
一年生旱柳(Salix matsudana Koidz)枝条,取自天津师范大学科技园.
1.1.2 试剂与仪器
氯化镉(CdCl2·2.5H2O),天津市光复精细化工研究所;硝酸钙,北京市北联精细化学品开发有限公司.
紫外分光光度计(Lambda 35 UV/Vis Spectrometer),美国Perkin Elmer 公司; 便携式光合仪(LI6400XT),美国LI-COR 公司.
1.2 实验方法
1.2.1 植物材料的培养和处理
把修剪好的旱柳枝条分为4 组,每组28 枝,固定在培养盆上,用蒸馏水进行培养.待长出一定的根后,更换为1/2 Hoagland 培养液,培养7 d 后更换为Hoagland全培养液.设置4 个处理:对照组;Ca 处理组,Ca2+浓度为5 mmol/L;Cd 处理组,Cd2+浓度为50 μmol/L;Ca+Cd处理组,Ca2+浓度为5 mmol/L,Cd2+浓度为50 μmol/L.室温下培养,实验周期为28 d,每7 d 更换一次处理液,整个实验过程通气.
1.2.2 光合色素含量的测定
嘉琪对于自己的舞蹈,要求非常严格。每次要出去比赛或是要准备考试之前,嘉琪都会主动在写完作业后,对着母亲从废物回收站买回来的镜子跳上1个小时,每个周末,她还会去广州跟着老师学3个小时。即便有学业的压力,她也没有放弃过跳舞。
在添加处理液后的7、14、21、28 d,剪取各处理组叶片,冲洗干净,吸干叶片表面水分.准确称取0.2 g 叶片,采用丙酮法进行萃取、定容,分别测定663、646、670 nm下的吸光度,叶绿素a、叶绿素b 和类胡萝卜素含量的具体测定方法参照文献[9].
1.2.3 光合日进程测定
在加入处理液后的第14 d,使用便携式光合仪进行光合日进程测定.分别在8 ∶00、10 ∶00、12 ∶00、14 ∶00、16 ∶00 测定旱柳植株的各项光合数据.测定内容为:净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr).
1.2.4 保护酶活性的测定
以0.05 mol/L 的磷酸缓冲液为提取液,提取SOD、POD、CAT 3 种保护酶的粗酶液.具体的提取液制备和酶活性测定方法参照文献[9-10].
1.2.5 丙二醛(MDA)含量的测定
用体积分数为10%的三氯乙酸溶液提取旱柳叶片和根中的丙二醛,采用TBA 比色法[9]测定叶片和根中MDA 的含量。
1.3 数据统计方法
采用SigmaPlot10.0 软件和WPS 进行数据处理和作图,采用平均值和标准误差进行统计分析,采用SPSS13.0 对数据进行差异性分析.
2 结果与分析
2.1 不同处理对旱柳叶片光合色素含量的影响
不同处理组中,旱柳叶片的3 种光合色素含量如图1 所示.由图1 可以看出,4 个处理组中,叶绿素a、叶绿素b 和类胡萝卜素含量均是对照组最高,其次是添加外源Ca 的处理组,二者的光合色素含量远远高于其余2 组(P <0.05);再次是Ca+Cd 组,光合色素含量明显高于Cd 胁迫处理组;Cd 胁迫处理组中的光合色素含量始终最低.由此可见,外源Ca 的添加能够缓解Cd 胁迫造成的旱柳光合色素含量的下降.
比较4 个处理组中3 种光合色素含量随时间的变化趋势,总的来看,对照组和Ca 处理组的趋势相近,Ca+Cd 处理组和Cd 处理组的趋势相近.
2.2 不同处理对旱柳叶片光合日进程的影响
不同处理组中,旱柳的光合日进程如图2 所示.由图2 可以看出,4 个处理组中,对照组的净光合速率、蒸腾速率、气孔导度和胞间二氧化碳浓度始终最大,尤其是蒸腾速率,远远高于其他3 组的数值;其次是Ca 处理组,4 项光合作用指标的数值低于对照组,均高于Ca+Cd 处理组和Cd 处理组,差异具有统计学意义(P <0.05);再次是Ca+Cd 处理组,净光合速率等显著高于Cd 处理组,差异具有统计学意义(P <0.05).这说明外源Ca 的添加确实缓解了Cd 胁迫造成的旱柳光合作用的下降.4 个处理组中旱柳的净光合速率、蒸腾速率和气孔导度日进程均为典型的双峰曲线,Cd 胁迫下,旱柳的光合日进程虽呈双峰曲线,但变化较为平缓,添加了外源Ca 后,净光合速率等显著增加,变化幅度增大.
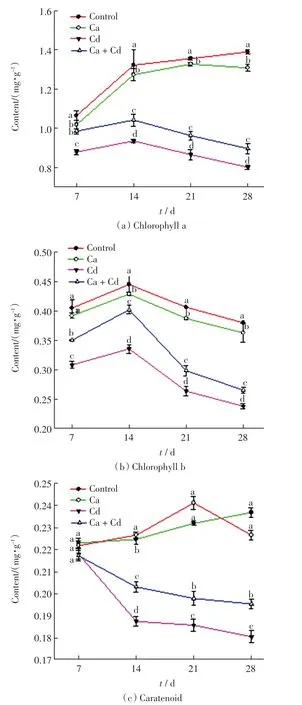
图1 不同处理组中旱柳叶片3 种光合色素的含量Fig.1 Contents of three kinds of photosynthetic pigments in leaves of S.matsudana in different groups

图2 不同处理组中旱柳的光合日进程Fig.2 Photosynthetic daily process of S.matsudana in different groups
2.3 不同处理对旱柳保护酶活性和MDA 的影响
4 个处理组中,旱柳叶片和根中的SOD 酶活性如图3 所示.由图3(a)可以看出,Cd 处理组中旱柳叶片的SOD 酶活性最大,其次是Ca+Cd 组,对照组的数值最低.由图3(b)可以看出,对照组根中的SOD 酶活性最大,其次是Ca 处理组,Cd 处理组中的数值最低.旱柳叶片和根中的POD 活性如图4 所示.由图4 可以看出,旱柳叶片和根中均是Cd 处理组的POD 活性最大,其次是Ca+Cd 组,对照组的数值最低.旱柳叶片和根中的CAT 活性如图5 所示.
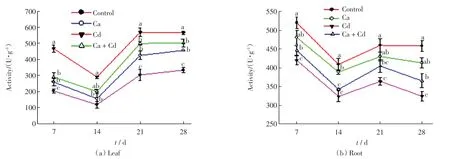
图3 不同处理组中旱柳的SOD 活性Fig.3 SOD activity of S.matsudana in different groups

图4 不同处理组中旱柳的POD 活性Fig.4 POD activity of S.matsudana in different groups
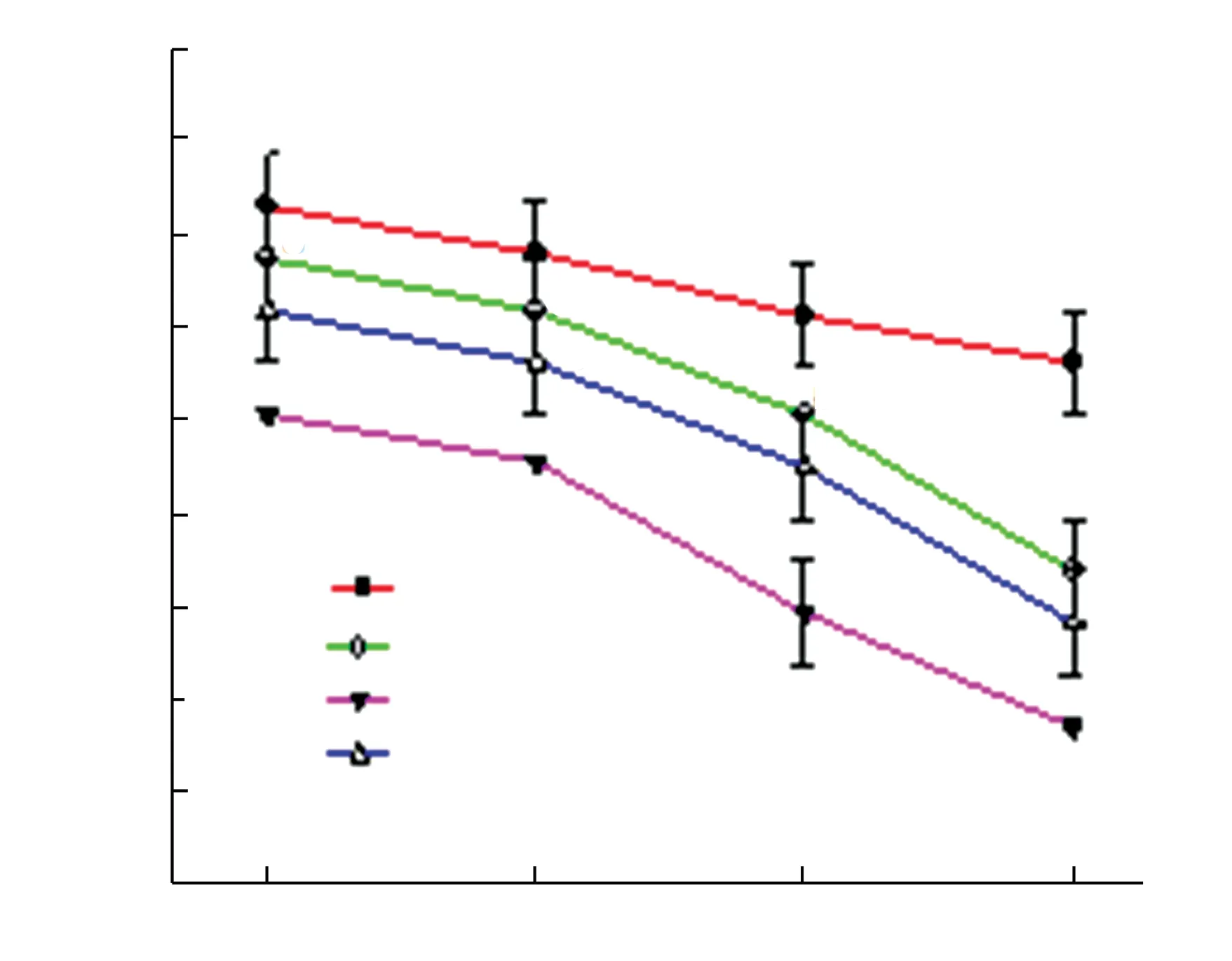
图5 不同处理组中旱柳的CAT 活性Fig.5 CAT activity of S.matsudana in different groups
由图5 可以看出,旱柳叶片和根中的CAT 活性均是在对照组中的数值最大,其次是Ca 处理组,Cd 处理组中的活性最低.
旱柳叶片和根中的MDA 含量如图6 所示.由图6可以看出,叶片和根中均是Cd 处理组的MDA 含量最大,其次是Ca+Cd 处理组,对照组的MDA 含量最低.由此可见,Cd 胁迫确实能够对旱柳造成过氧化损伤,外源Ca 则能够缓解这种损伤.

图6 不同处理组中旱柳的MDA 含量Fig.6 MDA contents of S.matsudana in different groups
3 讨论与结论
Cd 是植物生长发育中的非必需微量元素,它对植物的生长发育有显著抑制作用[11].本研究用50 μmol/L的CdCl2处理旱柳枝条,发现Cd 处理显著降低了旱柳叶片的叶绿素含量和光合作用效率,对叶片和根的保护酶系统以及MDA 含量都有不同程度的影响,而外源Ca 的添加则会缓解旱柳因Cd 胁迫而遭受的损伤.
光合作用是植物生长发育的基础生命活动,叶绿素含量是决定光合作用的基础,同时也是可以代表光合作用强度的指标[12].Cd 胁迫下旱柳叶片叶绿素含量减少的原因可能是:①Cd 进入植物体内占据了叶绿素合成酶相应的离子结合位点,造成酶的失活[13];②Cd胁迫下,植物产生过量的过氧化物和超氧化物加速了叶绿素的分解,从而导致叶绿素含量的降低; ③Cd胁迫影响植物细胞正常的分裂分化,内膜系统遭到破坏,从而降低了叶绿素含量[14].添加外源Ca 后,旱柳叶绿素含量有显著提高,即外源Ca 可以在一定程度上缓解Cd 对旱柳叶绿素的损伤[15].但过多的Ca进入植物细胞则会造成光合色素含量的降低[16],本研究发现单独添加Ca 时旱柳的叶绿素含量也会减少.
Cd 胁迫降低了旱柳的净光合速率、胞间二氧化碳浓度、气孔导度和蒸腾速率.一方面,可能是因为Cd影响了光合作用中PSⅡ催化中心的金属结合位点[17];另一方面,Cd 进入植物细胞后会抑制植物对Mg2+的吸收,而后者是构成叶绿素的必需元素且在光合作用中有着重要的催化作用[18].相关研究表明,外源Ca 的添加能够促进Mg2+在光合作用中的电子传递,从而提高植物的光合作用[19].本研究也证实了外源Ca 的添加能够显著缓解Cd 胁迫对旱柳光合作用的负面影响.
当植物受到Cd 胁迫时会产生大量的过氧化物[19],引起细胞内膜系统的损伤,从而抑制植物的生长发育.植物体内的SOD、POD、CAT 酶是保护细胞免受过氧化物伤害的保护酶,在植物受到过氧化物伤害时大量合成[20].SOD 酶可以将超氧阴离子自由基歧化成H2O2和O2;POD 酶可以通过愈创木酚作为电子供体在底物氧化过程中清除H2O2;CAT 酶可以将H2O2转化为H2O和O2.添加外源Ca 后,叶片和根中的保护酶活性均发生了显著变化,证明Ca 作为第二信使可以通过钙调蛋白影响蛋白激酶的活性,在一定程度上缓解了Cd 对旱柳的伤害作用[21].
MDA 是植物体受到外界胁迫时膜质过氧化的产物,其含量可以反映植物受到伤害的程度[22].本研究中Cd 处理组叶片和根的MDA 含量均显著高于其他处理组,证明Cd 胁迫导致旱柳体内发生了大量的膜质过氧化作用.在添加Ca 后,旱柳根和叶片中的MDA含量均明显降低,证明Ca 对Cd 胁迫造成的旱柳膜质过氧化具有缓解作用[23].
综上所述,外源Ca 能够通过提高植物的叶绿素含量和光合作用效率、影响保护酶系统、降低MDA 含量等,缓解Cd 污染环境中旱柳遭受的毒害.因此,在利用旱柳修复环境重金属污染中,可以适度添加Ca,以此缓解Cd 对旱柳生长的破坏作用,提高旱柳的成活率.
