Ⅰ群禽腺病毒液相基因芯片检测方法的建立
2017-08-01朱余军伍妙梨练月晓黄碧洪徐凤娇刘助红尹雪琴陈梅丽郭鹏举
朱余军,饶 丹,丛 锋,伍妙梨,袁 文,王 静,练月晓,黄碧洪,徐凤娇,刘助红,尹雪琴,黄 韧,张 钰,陈梅丽,郭鹏举
(广东省实验动物监测所 广东省实验动物重点实验室,广东 广州 510663)
Ⅰ群禽腺病毒液相基因芯片检测方法的建立
朱余军,饶 丹,丛 锋,伍妙梨,袁 文,王 静,练月晓,黄碧洪,徐凤娇,刘助红,尹雪琴,黄 韧,张 钰,陈梅丽,郭鹏举
(广东省实验动物监测所 广东省实验动物重点实验室,广东 广州 510663)
为了建立一种快速、特异、灵敏的检测I群禽腺病毒的液相基因芯片方法。根据Hexon基因序列设计特异引物,上游引物5'端加TAG序列,下游引物5'端加生物素,进行PCR扩增,将扩增产物与链霉素亲和蛋白、磁珠37℃孵育30 min,通过Luminex200仪器分析。用所建立的液相基因芯片方法进行特异性、灵敏度、重复性及病料样品的检测。结果该方法的特异性强;检测的敏感性可达1×102copies/μL;批内批间的变异系数都在5%以下;检测结果与SYBR Green I荧光PCR方法100%相符。表明建立的液相基因芯片方法特异性好、灵敏高、重复性好,可用于 I群禽腺病毒的检测。
Ⅰ群禽腺病毒(AAV);Hexon基因;液相基因芯片
禽腺病毒(AAV)是禽类一种常见的病毒,属于禽腺病毒科禽腺病毒属。禽腺病毒根据其抗原性不同可分为3个群,进一步利用RFLP技术把I群禽腺病毒划分为A-E5个基因型,根据中和试验可将其分为12个血清型(FAdV-1-FAdV 8a,8b-11),I群禽腺病毒具有相同的群抗原,该病毒主要表现为包涵体肝炎、严重性贫血、呼吸道症状、出血性肠炎和产蛋量下降[1-2]。该病给我国养禽业带来一定的经济损失。液相芯片既可以检测核酸又可以检测蛋白质,应用范围非常广泛[3-4]。具有高通量大、灵敏度高、灵活等特点,使得该技术在基础研究及检测领域得到广泛应用。本研究根据Hexon基因的保守序列设计了1对检测I群禽腺病毒的特异性引物,系国内外首次建立I群禽腺病毒的液相基因芯片检测方法,为I群禽腺病毒的流行病调查、防治等提供一种有效的方法。
1 材料与方法
1.1 毒株 12个血清型的禽腺病毒由青岛农业大学尹燕博教授惠赠;产蛋下降综合征病毒(EDSV)、传染性腔上囊病病毒(IBDV)、禽呼肠孤病毒(REO)、禽传染性支气管炎病毒(IBV)和马立克病病毒(MDV)均由本实验室保存。
1.2 主要试剂 DNA提取试剂盒、胶回收试剂盒、质粒抽提试剂盒,购自天根生化科技(北京)有限公司;Premix Ex TaqTMDNA聚合酶、pMD19-T克隆载体、DL-2000 DNA Marker、6×Loading Buffer,购自宝生物工程(大连)有限公司;荧光编码微球MagPlex-TAG022、鞘液,购自 luminex公司;Streptavidin RPhycoerythrin(SAPE),购自美国Thermo Fisher Scientific公司。
1.3 主要仪器 luminex200仪器,检测软件为xPONENT 3.1版本,核酸扩增仪,购自BIO-RAD公司。
1.4 引物设计与合成 根据GenBank中Hexon基因的保守序列设计了一对特异性引物(AAV-F1、AAV-F2),预期扩增片段大小为191 bp(表1),其中AAV-F1的5'端通过间隔臂(Spacer 18)添加有tag序列,tag序列能与微球MTAG-A022上所连的antitag序列反向互补,AAV-F2的5'端标记生物素。引物由上海生工生物工程技术服务有限公司合成。均经过HPLC纯化,用双蒸水溶解成10μmol/L储存液备用。

表1 所用的引物及TAG序列
1.5 方法
1.5.1 病毒DNA的提取 按照病毒DNA提取试剂盒的操作步骤提取禽腺病毒DNA,-80℃保存备用。
1.5.2 Hexon质粒标准品的制备 通过PCR扩增Hexon基因片段,将PCR产物经胶回收纯化后,与pMD19-T载体连接,并转化至DH5α感受态细胞,37℃过夜,挑取单个菌落,进行PCR及测序鉴定,将阳性克隆进行质粒抽提备用。
1.5.3 PCR反应体系的建立 PCR扩增体系(25μL)如下:Premix Ex TaqTMDNA聚合酶(2×) 12.5μL,上、下游引物各1μL,DNA模板2μL,补水至25μL。反应条件为:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,共进行35个循环,72℃ 10 min,于4℃结束反应。
1.5.4 PCR扩增产物、荧光编码微球和链霉素亲和-藻红蛋白杂交 杂交缓冲液将荧光微球稀释至125个/μL;取20μL稀释的荧光编码微球,5μL PCR产物,75μL SAPE使用液于一PCR管中,37℃孵育30 min,在Luminex200仪器上读取荧光中位数(MFI)值。
1.5.5 结果判定 最低检测阈值(cutoff值)的确定:选取10只健康鸡组织样品(每个样品平行重复3次),分别读取MFI值并计算其平均值和标准差。以平均值加3倍标准差的MFI值设定其为cutoff值[5]。当检测样品的MFI值大于cutoff值时,判断该试验数据有效且为阳性样本;否则,为阴性。
1.5.6 特异性试验 利用上述方法,对12个血清型的I群禽腺病毒、EDSV、IBDV、REO、IBV、MDV和空白对照进行特异性试验。
1.5.7 灵敏度试验 将已知浓度为1×1010copies/ μL的pMD19-T Hexon质粒做10倍系列稀释,每个稀释度取2μL作为模板进行扩增,测定本方法的敏感性。
1.5.8 重复性试验 选用1×107和1×105copies/ ul的作为标准品,进行批内、批间重复性试验。
1.5.9 病料样品的检测 应用上述液相基因芯片方法,对广东省某鸡场送检的60份鸡组织病料样本进行检测,同时用SYBR Green I荧光PCR[6]法复检。比较这两种方法的检测结果的符合率。
2 结果
2.1 PCR扩增结果 分别以12个血清型的I群禽腺病毒DNA作为模板,进行PCR扩增,2%琼脂糖凝胶电泳分析PCR产物,均能扩出191 bp的条带(图1)。
2.2 特异性试验结果 本试验的最低检测阈值为250。应用本试验建立的液相基因芯片方法进行检测,12个血清型的Ⅰ群禽腺病毒均为阳性,而EDSV、IBDV、REO、IBV、MDV和空白对照均为阴性,表明所建立的液相基因芯片方法具有良好的特异性,与其他检测对象无交叉反应(图2)。
2.3 灵敏度试验结果 对10倍系列稀释的质粒进行检测,结果表明,本试验建立的液相基因芯片方法的灵敏度达1×102copies/μL(图3)。

图1 Ⅰ群禽腺病毒12个血清型PCR结果
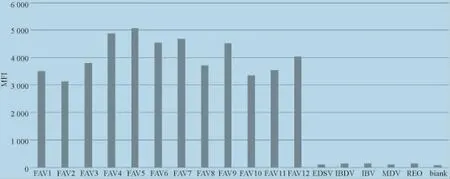
图2 液相基因芯片方法特异性检测结果

图3 液相基因芯片方法的灵敏度试验结果
2.4 复性试验结果 对重复性结果进行统计学分析(表2),批内试验的变异系数在4%以下,批间试验的变异系数在5%以下,表明该方法的稳定,结果可靠,具有可重复性。

表2 标准品的批内和批间重复性试验
2.5 病料样品的检测 使用新建立的液相基因芯片方法从60份病料样品中检出阳性样本33份(阳性率为55%),液相基因芯片检测结果与 SYBR Green I荧光PCR检测结果符合率为100%。
3 讨论
液相芯片检测技术是一种特异、敏感、快速、高通量的检测技术。基于Luminex xMAP系统的液相芯片技术是惟一得到美国 FDA批准的芯片类技术[6]。液相基因芯片检测技术是将多重荧光免疫分析(MFIA)和TAG技术结合起来,TAG技术使用Luminex专有的通用标签,通过标签序列与反标签序列的专一性互补配对,进行核酸试验优化,产品开发和分子诊断化验。该技术避免了过去还需要将合成的寡核苷酸序列偶联到微球上的复杂操作,有效地降低了成本和劳动力,同时大大地缩短了检测的时间。
I群禽腺病毒有12个血清型,各血清型毒株的Hexon基因较为保守。因此,针对Hexon基因的保守区设计引物,该方法敏感性高,可达1×102copies/μL;特异性强,对EDSV、IBDV、REO、IBV、MDV等均无交叉反应;该方法具有很好的重复性,批内、批间试验的变异系数均在5%以下。本试验无需电泳,避免了电泳过程中的污染。应用该方法对60份鸡组织病料样本进行检测,阳性率为55%,检测结果与SYBR Green I荧光PCR法100%相符。本试验建立的I群禽腺病毒的液相基因芯片检测方法具有快速、灵敏度高、特异性强、重复性好等优点。
[1] 殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997.
[2] Domermuth C H,Weston C R,Cowen B S,et al.Incidence and distribution of avian adenovirus group II splenomegaly of chickens[J].Avian Disease,1980,24(3):591-599.
[3] Martins T B,Burlingame R,Von Muhlen C A,et al.Evaluation of multiplexed fluorescent microsphere immunoassay for detection of autoantibodies to nuclear antigens[J].Clin Diagn Lab Immun,2004,11(6):1 054.
[4] Lash G E,Scaife P J,Innes B A,et al.Comparison of three multiplex cytokine analysis systems:Luminex,SearchLightTM and FAST Quant[J].J Immun Meth,2006,309:205-208.
[5] Crowther J R.Validation of Diagnostic Tests for Infectious Diseases[M].Volume 149 ofthe series Methods in Molecular Biology,The ELISA Guidebook,2001:301-345.
[6] 谢明星,彭小莉,苗春柳,等.牛白细胞黏附缺陷病液相基因芯片检测方法的建立[J].繁殖育种,2013,17:48-52.
Development of a magnetic beads suspension array for the detection of aviadenovirus group I
ZHU Yu-jun,RAO Dan,CONG Feng,WU Miao-li,YUAN Wen,WANG Jing,LIAN Yue-xiao,HUANG Bi-hong,XU Feng-jiao,LIU Zhu-hong,YIN Xue-qin,HUANG Ren,ZHANG Yu,CHEN Mei-li,GUO Peng-ju
(Guangdong Laboratory Animals Monitoring Institute,Guangdong Key Laboratory of Laboratory Animals,Guangzhou 510663,China)
To develop a rapid,specific and sensitive magnetic beads suspension array for the detection of Aviadenovirus group I (AAV).According to the hexon gene sequences,a pair of specific primers were designed for amplified Aviadenovirus group I.The forward primer was designed with a unique TAG sequence at5’end,and the reverse primer was biotin-labeled at5’end.After amplifying the PCR fragment,the product,Streptavidin R-Phycoerythrin and magnetic beads were incubated at37℃ for 30 min.The resuls were analyzed using luminex 200 instrument.The specificity,sensitivity,reproducibility and clinical samples for this assay were evaluated.The assay was specific for 12 serotypes of Aviadenovirus group I,and there was nonspecific reactions with other viruses.Sensitivity analysis showed that the limit of detection of the developed magnetic beads suspension array was 1×102copies/ul of plasmid DNA.From the coefficient of variation analysis,the intra-and inter-assay coefficient of variation was lower than 5.Compared to SYBR Green I real-time PCR,there had a same detection rate(55%)of60 clinical samples.These results show that the assay is specific,sensitive,repeatable and flexible,and can be utilized for the detection of Aviadenovirus group I.
Aviadenovirus group I;Hexon;magnetic beads suspension array
CHEN Mei-li
S855.3
A
0529-6005(2017)06-0050-03
2016-09-14
广东省科技计划项目(2016A040403065);广东省科技计划项目(2015B070701003);国家科技支撑计划(2015BAI07B00)
朱余军(1988),女,研究实习员,硕士,研究方向为预防兽医学,E-mail:837895642@qq.com
陈梅丽,E-mail:chml@gdlami.com
