GnRH二聚体和GnRH并列二聚体合成肽疫苗对大鼠的免疫去势效果
2017-08-01陈文娟吕传忠任东兴付旭彬
陈文娟,魏 冰,吕传忠,任东兴,陈 庚,付旭彬
(1.天津农学院动物科学与动物医学学院,天津 西青 300384;2.天津瑞普生物技术股份有限公司,天津 东丽 300308)
GnRH二聚体和GnRH并列二聚体合成肽疫苗对大鼠的免疫去势效果
陈文娟1,魏 冰1,吕传忠2,任东兴2,陈 庚2,付旭彬2
(1.天津农学院动物科学与动物医学学院,天津 西青 300384;2.天津瑞普生物技术股份有限公司,天津 东丽 300308)
为了比较GnRH二聚体和GnRH并列二聚体单次和两次免疫对雄性大鼠的免疫去势效果。将上述两种GnRH疫苗,分组免疫SD大鼠,免疫后每两周检测大鼠血清中的GnRH抗体滴度和血清睾酮水平、睾丸重量和组织结构变化。结果显示,两次免疫试验组的抗体滴度显著高于单次免疫试验组的抗体滴度(P<0.05);GnRH二聚体抗原免疫效果优于GnRH并列二聚体抗原的免疫效果,且差异极显著(P<0.01)。免疫组大鼠血清睾酮水平及睾丸重量均极显著低于空白对照组(P<0.01)。免疫去势效果显著的大鼠只数统计显示,GnRH二聚体(5/6)和GnRH并列二聚体(4/6)两次免疫均多于单次免疫(4/6和3/6)。同时,组织学观察结果可见,免疫组大鼠睾丸组织结构萎缩,曲精小管管径变窄,内部精母细胞脱落,精子变少或者没有。表明GnRH二聚体疫苗与GnRH并列二聚体疫苗均能达到去势效果,前者优于后者,两次免疫优于一次免疫。
免疫去势;GnRH二聚体;GnRH并列二聚体;单次免疫;两次免疫;合成肽疫苗
免疫去势是用促性腺激素释放激素(Gonadotropin-releasing hormone,GnRH)类似物疫苗免疫的方法抑制性器官的发育,以达到去势目的。采用免疫去势,可有效防止手术去势导致的出血、感染情况的发生,具有安全方便、应激小、适合集约化养殖等优点,在促进动物生长、改善肉质、提高肉用家畜生产性能上具有广阔的应用前景[1-2]。目前,世界范围内商品化的GnRH疫苗只有硕腾公司旗下CSL动物保健公司(Pflier,CSL animal health,Australia)生产的Improvac 疫苗,用于去除公猪膻味,需要在屠宰前4周和 8周两次皮下注射(剂量:2 mL/次)[1,3]。合成肽疫苗(synthetic peptide vaccine)是用化学合成法制备具有保护作用的类似天然抗原决定簇的多肽疫苗,随着合成肽制备技术的发展,合成肽抗原的生产成本大大降低,合成肽疫苗在兽医临床上的应用成为现实[4]。因此,在前人研究的基础上,我们设计并合成了GnRH二聚体抗原肽和GnRH并列二聚体抗原肽,分别单次和两次免疫雄性SD大鼠,在免疫后不同时间采血,检测血清中抗体及睾酮水平的变化,进一步分析两种疫苗及两种免疫方式在作用过程中的区别,为免疫去势疫苗的应用提供理论依据。
1 材料与方法
1.1 试验动物 健康、体重相近(240 g~280 g)的雄性SD大鼠,购自天津市津南区春乐实验动物养殖场。
1.2 主要试验试剂和仪器 GnRH二聚体合成肽抗原、GnRH并列二聚体合成肽抗原(201505,瑞普生物技术股份有限公司);MONTANIDE ISA 61VG佐剂(T30311,赛彼科(上海)特殊化学品有限公司);睾酮放免试剂盒(20151120,北京北方生物技术研究所有限公司);HRP标记的羊抗大鼠IgG(14-16-06,KPL Corporation);TMB单组份显色液(20151105,Solarbio公司);高剪切分散乳化机(FA25型,FLUKO公司);酶标检测仪 (Bio-RAD15146型,iMark);台式冷冻离心机(3K-15型,北京五洲东方科技发展有限公司);医用冷藏箱(HYC-260型,Haier公司);冰箱(BCD-221CHC型,美菱公司);生化培养箱(SPX-250型,宁波江南仪器厂)。
1.3 多肽疫苗制备 采用固相合成技术合成两种GnRH抗原肽,分别与Montanide ISA 61VG佐剂进行乳化制成油包水疫苗,终浓度为100μg/mL,分装后于4℃保存。
1.4 动物免疫与采血 8周龄的SD大鼠,随机分为A、B、C、D、E共5组,每组6只。一周后背部皮下两点注射,每只0.5 mL,其中C、E组于两周后加强免疫一次,方法同第一次免疫,详细免疫情况见表1。常规饲养,自由饮食。于免疫前一天(即0周)和免疫后每两周眼眶后静脉丛采血一次,3 000 r/min(4℃)离心10 min,收集血清,-20℃保存备用,连续采集10次。

表1 动物分组与免疫
1.5 大鼠血清睾酮检测 采用碘[125I]睾酮放射免疫分析法,由北京北方生物技术研究所有限公司检测。
1.6 间接ELISA方法检测大鼠血清GnRH抗体GnRH合成肽抗原以常规方法包被,随后以2%BSA进行封闭,待检的阴性和阳性血清分别倍比稀释后加样置37℃温育,然后加HRP-羊抗大鼠二抗,置37℃温育,洗涤后加TMB避光显色,终止反应,室温放置3 min后测量各孔吸光度值A450nm。绘制抗体滴度-A450nm曲线,计算样品血清的抗体滴度。
1.7 睾丸外观及组织学观察 首次免疫后第18周,摘取SD大鼠两侧睾丸,测量睾丸的重量(除去附睾后),然后置于10%福尔马林缓冲液中固定,待用。常规脱水、透明、浸蜡进行组织包埋,切片,苏木精-伊红染色(hematoxylin-eosin staining,H.E.染色)后镜检。
2 结果与分析
2.1 免疫后小鼠安全评价 通过观察,试验期内所有免疫大鼠未出现异常症状。
2.2 大鼠血清抗体检测结果 免疫及针对GnRH二聚体和GnRH并列二聚体抗原肽的抗体检测结果表明,空白组大鼠血清的抗体滴度接近于零,而试验组大鼠免疫后0~6周血清抗体滴度迅速上升,极显著高于空白对照组(P<0.01),6周后趋于平稳,到免疫后第18周滴度在2.5以上。GnRH二聚体与GnRH并列二聚体两次免疫的抗体滴度均高于单次免疫的抗体滴度,在免疫后第6、10周差异显著(P<0.05)。同时,免疫原性上GnRH二聚体优于GnRH并列二聚体,在免疫后第10、12、16、18周差异极显著(P<0.01)(图1)。
2.3 大鼠血清睾酮检测结果 免疫后第4周,Gn-RH二聚体抗原肽与GnRH并列二聚体抗原肽免疫组的血清睾酮与空白对照组的相比较,含量极显著下降(P<0.01),首次免疫后第18周仍维持在较低水平(图3)。如果以血清睾酮含量≤0.1 ng/mL作为免疫去势效果显著的判定标准,统计显示,GnRH二聚体抗原肽两次免疫试验组5只大鼠去势效果显著、GnRH并列二聚体抗原肽两次免疫试验组4只大鼠去势效果显著,均多于GnRH二聚体抗原肽单次免疫(4只)和GnRH并列二聚体抗原肽单次免疫(3只),与抗体检测结果相符。
2.4 睾丸重量 睾丸称重结果显示,所有免疫组大鼠睾丸重量均极显著低于空白对照组(P<0.01)。C组大鼠睾丸重量为(0.33±0.13)g,均低于其他3个 免疫组,免疫组之间差异不显著(P>0.05)(表2)。
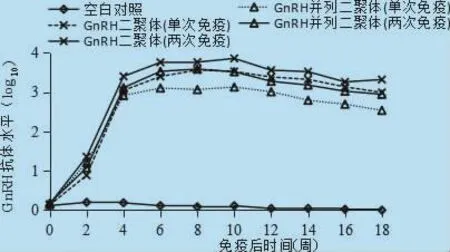
图1 免疫后不同时期对照组、免疫组大鼠血清抗GnRH抗体滴度(log10)
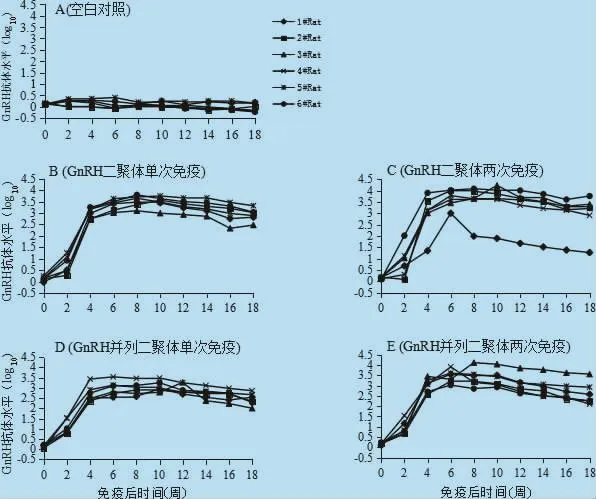
图2 免疫后不同时期空白对照组、免疫组大鼠血清中GnRH抗体滴度(log10)
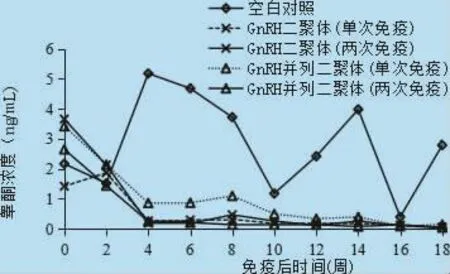
图3 免疫后不同时期对照组、免疫组大鼠血清中睾酮浓度(ng/mL)

表2 对照组、免疫组大鼠睾丸重量
2.5 睾丸组织学观察 组织染色结果显示,空白对照组(见中插彩版图4 a、b)大鼠睾丸组织结构完整,曲细精管内的精原细胞逐渐向管腔发育,明显分化成初级精母细胞、次级精母细胞、精子细胞和精子。免疫组C组的大鼠睾丸明显萎缩,曲细精管管径变小,精原细胞脱落,管腔中仅有少量精原细胞,无成熟精子细胞(见中插彩版图4 c、d)。
3 讨论
GnRH是下丘脑调节生殖系统的一种重要性激素,通过刺激垂体前叶分泌促黄体素(luteinizing hormone,LH)进而调节睾丸生长、发育。主动免疫可使动物产生GnRH抗体,中和内源性GnRH,导致下丘脑-垂体-睾丸轴功能的破坏,抑制LH和FSH促卵泡激素(follicle-stimulating hormone,FSH)的释放,使被免疫动物表现睾丸萎缩和重量减轻,血清睾酮水平下降,从而达到免疫去势的效果[5]。
Brunius C等研究表明,GnRH疫苗可以诱导抗体的产生,通过间接ELISA方法检测血清中GnRH抗体滴度[4,6],可对免疫去势效果评价提供参考。本研究中,使用GnRH二聚体及并列二聚体合成肽疫苗免疫的大鼠均可产生免疫应答,采用单次免疫和两次免疫均能抑制睾丸生长,使睾丸重量极显著减轻。与对照组相比,免疫组大鼠睾丸组织结构萎缩,曲精小管管径变窄,内部精母细胞脱落,精子变少甚至缺如。因此,组织结构变化表明,GnRH合成肽疫苗与以往报道的GnRH疫苗一样,能够诱导免疫去势。
睾酮主要由睾丸间质细胞合成和分泌,血清中睾酮浓度的高低可以间接反映去势疫苗对睾丸机能及生殖性能的影响的程度[5,12-13]。本研究显示,免疫后伴随着GnRH抗体滴度的快速升高,血清中睾酮浓度迅速下降,免疫后第4周至第18周,GnRH二聚体及并列二聚体免疫组大鼠血清中睾酮浓度极显著低于空白组,这一结果与以往报道的GnRH疫苗作用机制相符[7-9]。值得注意的是,免疫组B组B-2、B-3大鼠和免疫组C组C-1大鼠的睾酮水平没有显著下降,其抗体滴度也比组内其他大鼠的抗体滴度低,这一现象说明不同大鼠对GnRH肽抗原肽的免疫反应存在个体差异。因此,为提高该疫苗免疫的有效率,有必要通过改进疫苗的抗原结构、加入免疫增强剂(如蛋白脂质体或细胞表位[10-11])、使用免疫佐剂或改变不同的剂型等措施来进一步增强疫苗的效力[14-15]。
本研究同时发现,合成肽抗原的分子量大小与抗原性强弱不呈正相关,GnRH二聚体抗原分子量小,但诱导产生的抗体滴度却高于分子量大的Gn-RH并列二聚体,造成这一现象的原因可能是GnRH并列二聚体的抗原表位被覆盖。
GnRH二聚体两次主动免疫可以刺激大鼠机体免疫应答产生GnRH抗体,同时血清睾酮浓度下降至较低水平,并且能够维持至少14周,说明该疫苗在免疫去势研究上具有一定的价值。就动物饲养而言,有望用于控制宠物能育性、减少雄性动物攻击性、去除动物性肉制品中膻味等的疫苗开发;就人类医药而言,可通过抑制性激素分泌而进行性激素依赖性疾病的治疗,如前列腺癌和乳腺癌,以及子宫癌、卵巢癌、睾丸癌、颔下腺体癌,垂体病症和其他激素敏感性肿瘤等。
[1] Han X F,Li J L,Zhou Y Q,etal.Active immunization with Gn-RH-tandem-dimer peptide in young male rats reduces serum reproductive hormone concentrations,testicular development and spermatogenesis[J].Asian Journal of Andrology,2015,18(3):485-491.
[2] Goodwin D,Simerska P,Chang C H,et al.Active immunisation of mice with GnRH lipopeptide vaccine candidates:Importance of T helper or multi-dimer GnRH epitope[J].Bioorganic&Medicinal Chemistry,2014,22(17):4 848-4 854.
[3] 刘志南,杨汉春.公猪异味控制疫苗效力试验[J].中国兽医杂志,2011,47(7):18-20.
[4] Finstad C L,Wang C Y,Kowalski J,et al.Synthetic luteinizing hormone releasing hormone(LHRH)vaccine for effective androgen deprivation and its application to prostate cancer immunotherapy[J].Vaccine,2004,22(9-10):1 300-1 313.
[5] Ferro V A.Current advances in antifertility vaccines for fertility control and noncontraceptive applications[J].Expert Review of Vaccines,2002,1(4):443-452.
[6] Meloen R H,Turkstra J A,Lankhof H,et al.Efficient immunocastration ofmale piglets by immunoneutralization of GnRH using a new GnRH-like peptide[J].Vaccine,1994,12(8):741-746.
[7] Ferro V A,Harvey M J,Colston A,et al.Part II:influence ofdimerization ofa modified GnRH-Ipeptide sequence on a male antifertility vaccine[J].American Journalof Reproductive Immunology,2002,48(6):372-380.
[8] Turkstra J A,Oonk H B,Schaaper W M,et al.The role ofthe individual amino acids of a GnRH-tandem-dimer peptide used as an antigen for immunocastration of male piglets determined with systematic alanine replacements[J].Vaccine,2001,20(3-4):406-412.
[9] Talwar C P.Vaccines and passive immunological approaches for the control of fertility and hormone-dependent cancers[J].Immunological Reviews,1999,171(1):173-192.
[10] Talwar G P,Vyas H K,Purswani S,et al.Gonadotropin-releasing hormone/human chorionic gonadotropinβbased recombinant antibodies and vaccines[J].Journal of Reproductive Immunology,2009,83(1-2):158-163.
[11] Zamaratskaia G,Rydhmer L,Andersson H K,et al.Long-term effect of vaccination against gonadotropin-releasing hormone, using ImprovacTM,on hormonal profile and behaviour ofmale pigs[J].Animal Reproduction Science,2008,108(1-2):37-48.
[12] Claus R,Rottner S,Rueckert C.Individualreturn to Leydig cell function after GnRH-immunization of boars[J].Vaccine,2008,26(35):4 571-4 578.
[13] Sáenz L,Neira-Carrillo A,Paredes R,et al.Chitosan formulations improve the immunogenicity of a GnRH-I peptide-based vaccine[J].International Journal of Pharmaceutics,2008,369 (1-2):64-71.
[14] Earl E R,Waterston M M,Aughey E,etal.Evaluation oftwo Gn-RH-I based vaccine formulations on the testes function of entire Suffolk cross ram lambs[J].Vaccine,2006,24(16):3 172-3 183.
[15] Zeng X Y,Turkstra J A,Meloen R H,etal.Active immunization against gonadotrophin-releasing hormone in Chinese male pigs:effects of dose on antibody titer,hormone levels and sexual development[J].Animal Reproduction Science,2002,70(4):223-233.
Efficacy of Immunocastration Vaccines Composed of GnRH-dimer or GnRH-tandem-dimer Peptides in Rats
CHEN Wen-juan1,WEI Bing1,LV Chuan-zhong2,REN Dong-xing2,CHEN Geng2,FU Xu-bin2
(1.College of Animal Science and Animal Medicine,Tianjin Agriculture University,Tianjin 300384,China;2.Tianjin Ringpu Bio-Technology Co.,Ltd.,Tianjin 300308,China)
This study was performed to evaluate the castration efficacies of GnRH-dimer and GnRH-tandem-dimer peptide vaccines in male SD rats by single and double immunization.GnRH-dimer and GnRH-tandem-dimer peptides were prepared as emulsion vaccines.The testosterone concentration and GnRH antibodies in the sera,weight of testes and histological structural changes were observed.The results showed that in immunization groups,GnRH-dimer and GnRH-tandem-dimer peptide vaccines both induced higher titer anti-GnRH antibodies(P<0.01).The antibody titers of double immunization group were significautly higher than those of single immunization group(P<0.05).In the GnRH-dimer immunized group,the titers of anti-GnRH antibodies were higher than those immunized with GnRH-tandem-dimer vaccine(P<0.05).Serum testosterone and testis weights indicated that the concentrations in all immunization groups were lower than those of control group(P<0.01).Significantly,in the groups which were immunized twice,the serum testosterone of 5 rats in Gn RH-dimer group and 4 rats in Gn RH-tandem-dimer group was even decreased to be undetectable.However,the corresponding number was 4 and 3 when the rats were immunized once with the respective vaccine.Meanwhile,the testes were observed atrophy in tissue structure as well as a narrowing of the internal diameter of seminiferous tubule,shedding of internal spermatocyte and less or even no sperm.Gn RH dimer vaccine and Gn RH-tandem-dimer vaccine respectively have significant effect of immunocastration in rats.The effect of double immunization is better,and GnRH-dimer peptide is more promising than Gn RH-tandem-dimer peptide as a vaccine candidate.
Immunocastration;GnRH-dimer;GnRH-tandem-dimer;Immunization;Synthetic peptide vaccine
FU Xu-Bin
2017-02-27
国家科学技术部资助项目(2014DFA31180)
陈文娟(1991-),女,硕士生,研究方向为预防兽医学,E-mail:cwj128534@163.com
付旭彬,E-mail:fxb@ringpu.com
S852.4
A
0529-6005(2017)06-0014-04
