转 pGH基因猪与非转基因猪成纤维细胞系的建立及鉴定
2017-08-01崔小荣李晓玲于光辉魏成晓赵玲玲巩建飞张廷荣孙金海
崔小荣,李晓玲,于光辉,魏成晓,赵玲玲,巩建飞,张廷荣,孙金海
(青岛农业大学动物科技学院,山东 青岛 266109)
转 pGH基因猪与非转基因猪成纤维细胞系的建立及鉴定
崔小荣,李晓玲,于光辉,魏成晓,赵玲玲,巩建飞,张廷荣,孙金海
(青岛农业大学动物科技学院,山东 青岛 266109)
本试验采用组织块贴壁法对初生仔猪的耳组织进行原代培养,成功分离出转pGH基因猪与非转基因猪成纤维细胞,并对细胞进行形态学观察,冻存前和复苏后细胞活力检测,生长动力学分析,波形蛋白免疫组化,染色体计数以及微生物污染检测等生物学特性分析。结果表明,原代细胞经过胰蛋白酶消化和差速离心分离培养出成纤维细胞,7组细胞冻存前细胞活力均在为92%以上,冻存3个月后细胞复苏活力仍在89%以上;细胞生长总趋势呈“S”型,即经历了潜伏期、指数生长期和平台期3个阶段;细胞波形蛋白免疫组化在成纤维细胞中呈阳性反应;染色体计数结果表明,染色体数量稳定;成纤维细胞的细菌、真菌、病毒和支原体检测均为阴性。本试验成功建立了转pGH基因猪与非转基因猪成纤维细胞系。
pGH基因;转基因猪;成纤维细胞系;细胞培养;生物学特性
猪生长激素(pGH)是由猪脑垂体前叶嗜酸性细胞分泌的单一肽链蛋白质类激素。生长激素生理作用广泛,能够影响几乎所有的组织类型和细胞的生长分裂,可显著影响动物的生长发育。pGH通过IGF-I的介导发挥作用,是调节肌肉形成的主要内分泌因子之一。因为生长激素在动物生长轴中的重要作用,使其一直是育种研究的热点之一。1985年,科学家第1次将人的生长激素基因导入猪的受精卵获得成功,转基因猪与同窝非转基因猪比较,生长速度和饲料利用效率显著提高,胴体脂肪率也明显下降[1]。国内外专家学者对pGH的应用效果进行了大量的试验,证实注射生长激素能够提高猪日增重、瘦肉率,降低脂肪含量。2010年,吴明明等成功构建了pGH基因真核表达载体,通过精子介导纳米基因载体法成功制备转pGH基因猪[2],阳性率高达45.83%。蒋亚军等对F0代转基因猪进行荧光原位杂交确定了外源pGH基因已经整合到染色体上,并且整合位点具有随机性和差异性[3]。刘剑飞等利用SYBR Green I Real-time PCR法检测F0代转pGH基因母猪与非转基因公猪配种所得的7头转pGH基因猪与9头非转基因猪3月龄生长激素的表达水平,结果显示,F1代转基因猪生长激素平均表达水平是同窝非转基因猪的1.77倍[4],证实了外源pGH基因在猪体内的稳定传代。此外,本实验室对F1和F3代转pGH基因猪分别进行生长性能测定,结果显示,转基因猪的生长、发育及胴体品质均优于非转基因猪[5-6]。姚延珠等采用相同的方法制备出转pGH/IGF-1双基因猪,阳性率为30.76%[7]。范岩岩等对转pGH/IGF-1双基因猪、转pGH基因猪和非转基因猪的生长性状进行比较,结果显示,转双基因猪个体均重比转单基因猪的高2.83%,差异显著(P<0.05);转双基因猪比非转基因猪高7.37%,差异显著(P<0.05)[8]。各项试验结果均表明,pGH基因对猪的生长性状具有显著影响,转入的pGH基因是优良基因。为将该优良资源从细胞水平上长期保存下来,并且为后序试验研究提供易于保存和获取的试验材料,降低饲养成本,本试验采用组织块贴壁法培养转pGH基因猪初生仔猪的耳组织,建立转pGH基因猪成纤维细胞系。
1 材料与方法
1.1 材料
1.1.1 样本 转pGH基因母猪与非转基因公猪杂交后产仔7头,采集初生仔猪耳组织带回实验室进行原代细胞培养。7头仔猪中有4头为转pGH基因猪,3头为非转基因猪。4头转pGH基因猪为2头公猪和2头母猪,3头非转基因猪为2头公猪和1头母猪。
1.1.2 培养基及主要试剂 DMEM,购自Hyclone公司;胰蛋白酶、L-Glutamine、标准胎牛血清,购自Transgen Biotech北京全式金生物技术有限公司; DPBS、二甲基亚砜(DMSO)、兔抗猪免疫血清、0.4%台盼蓝染液、非必需氨基酸、青链霉素和Giemsa,均购自Solarbio北京索莱宝科技有限公司;免疫组化试剂盒,购自Biotopped北京波奥拓科技有限公司。
1.2 试验方法
1.2.1 细胞原代培养和传代培养 将采集的初生仔猪耳尖组织浸入含有双抗的PBS中立刻带回实验室进行细胞分离,原代培养和传代培养的方法采用马康[9]等的方法。
1.2.2 细胞冻存与复苏 细胞的冻存与复苏方法采用李晓玲[10]等的方法。
1.2.3 细胞形态观察 观察原代细胞和传代细胞的形态,包括细胞类型、形状、大小、核质比例和核仁大小等。通过姬姆萨(Giemsa)染色,于显微镜下观察染色后细胞形态。
1.2.4 细胞冻存前和复苏后活力检测 在冻存前和复苏后分别取90μL细胞悬液加入10μL台盼蓝染色液染色后,用血球计数板记染成蓝色的死细胞数和未染色的活细胞数,并计算活细胞数占细胞总数的百分比。
1.2.5 生长曲线绘制 取24孔培养板,每孔接种1.0×104个细胞。将其置于恒温培养箱(37.5℃,5.0%CO2)中进行培养。从接种时间算起,每24 h取3孔细胞进行细胞计数,求平均值,连续计数9 d,直至细胞密度降低为止。以培养时间为横坐标,细胞密度为纵坐标,绘制生长曲线。
1.2.6 免疫组化鉴定 当培养皿中细胞生长密度达90%左右时,采用S-P法进行免疫组化,按照试剂盒的操作说明书进行试验,DAB溶液显色5~10 min,用蒸馏水冲洗终止显色反应,置于荧光显微镜下观察。
1.2.7 成纤维细胞染色体制片 选择80%~90%汇合的对数生长期的单层培养细胞,于4℃冰箱中放置6 h,消化细胞后常规方法进行染色体制片,具体步骤采用张德福[11]等的方法稍加改进。Giemsa染色后在显微镜下观察并拍照。随机选取100个铺展完好的中期分裂相进行染色体计数。
1.2.8 微生物污染检测 细菌检测:将待检细胞在无双抗的培养基中培养3~4 d,观察培养液是否变浑浊或者变黄;真菌检测:观察培养液是否出现云雾状,于显微镜观察是否出现纤维状菌丝体或密集孢子;病毒检测:于显微镜下观察细胞形态,观察有无蚀斑、空斑等损伤情况;支原体检测:Hoechst 33258 DNA荧光染色法染色后将玻片置于荧光显微镜下,观察细胞的荧光分布状态,判断是否有支原体污染。
2 结果与分析
2.1 细胞形态观察
2.1.1 细胞原代培养形态观察 图1A显示为培养48 h后细胞形态,可观察到组织块附近有少量梭形、不规则三棱形的成纤维细胞游离生长,除此细胞外还有椭圆形或圆形的上皮样细胞生长,没有组织块的区域细胞密度极低。图1B显示为培养至第7天时细胞形态,培养皿皿底长满细胞,即可进行传代培养。
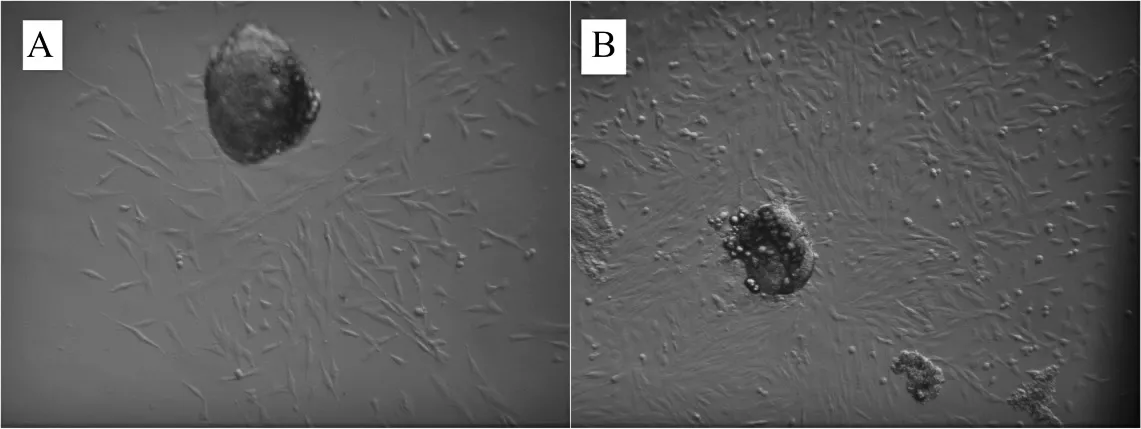
图1 原代细胞培养 (×100)A:原代培养2 d后的细胞形态;B:原代培养7 d后的细胞形态
2.1.2 细胞传代培养形态观察 当细胞汇合达90%左右时进行传代,采用胰酶消化法和差速离心法可将成纤维细胞和上皮样细胞及其他细胞分离开来,胰酶消化后的细胞形态如图2 A所示。经3~4代培养的细胞仅剩成纤维细胞,经传代后细胞生长速度加快,细胞形态没有发生明显的变化。传代后的细胞形态如图 2 B所示。

图2 传代后成纤维细胞形态(×100)A:胰酶消化后细胞形态;B:传代后细胞形态
2.1.3 染色后细胞形态观察 经Giemsa染色后观察,细胞呈长梭形、不规则三角形或扁平状星形,核较大,卵圆形,胞质较多,为典型的成纤维细胞形态。染色结果如中插彩版图3所示。
2.2 细胞冻存前与复苏后活力检测结果 将冻存3个月的细胞复苏,复苏的细胞在6 h后大量贴壁,24 h后大部分细胞都已贴壁并呈梭形生长。培养24 h后更换培养液,去除死细胞和未贴壁细胞,培养4~5 d细胞汇合至80%~90%,即可进行传代。转pGH基因猪与同期培养的非转基因猪成纤维细胞复苏后活力较冻存前细胞活力稍有下降,转pGH基因猪与非转基因猪冻存前细胞活力均在90%以上,复苏后均在89%以上。冻存前和复苏后的成纤维细胞均有较高的活力,说明本细胞的活性较好,并且冻存方法适宜。
2.3 生长曲线绘制 转pGH基因猪与非转基因猪成纤维细胞的生长曲线均呈“S”型,分为潜伏期、指数生长期和平台期3个阶段。细胞计数结果见表1,生长曲线如图4所示。
2.4 免疫组化鉴定结果 细胞波形蛋白在成纤维细胞中呈阳性反应,如图5所示,细胞浆内呈大量黄色颗粒状沉淀,即可确认为成纤维细胞。
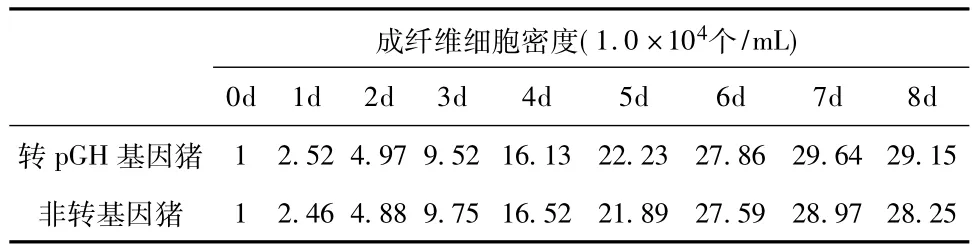
表1 转pGH基因猪与非转基因猪成纤维细胞计数结果
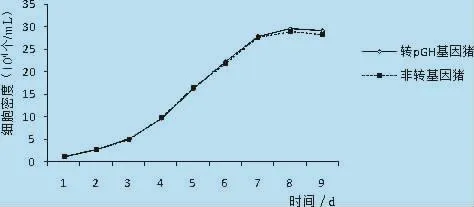
图4 转pGH基因猪与非转基因猪成纤维细胞的生长曲线
2.5 染色体观察结果 公猪和母猪成纤维细胞中期分裂相染色体如图6、图7所示,染色体形态正常,数目为2n=38。分别对所培养的7组成纤维细胞所制染色体玻片计数100个4~5代细胞的染色体数目,染色体众数2n=38的细胞数占总细胞数的百分比均在90%以上,均达到建立细胞系75%~80%的要求,所建细胞系为稳定的二倍体细胞系。

图5 成纤维细胞免疫组化鉴定结果(×100)
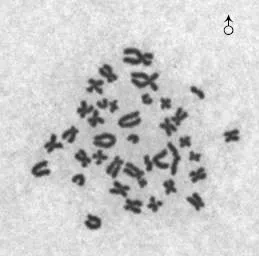
图6 公猪成纤维细胞中期分裂相染色体(×1 000)
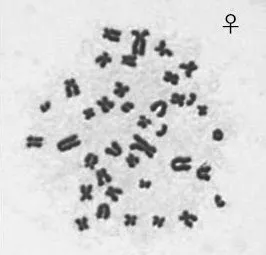
图7 母猪成纤维细胞中期分裂相染色体(×1 000)
2.6 微生物污染检测结果
2.6.1 细菌、真菌及病毒检测结果 显微镜观察工作液培养的细胞,未见细胞培养液变浑浊,也无丝状物生长,显微镜下观察无空斑、蚀斑现象,表明细菌、真菌及病毒检测结果均呈阴性。
2.6.2 支原体检测结果 Hoechst 33258荧光染料检测,如中插彩版图8所示细胞核呈蓝色椭圆状或圆状,表明细胞内无支原体存在,结果呈阴性。
3 讨论
3.1 成纤维细胞的培养和冻存 目前原代细胞培养主要有组织块贴壁法和酶消化法2种。酶消化法是利用胰酶的消化作用使细胞从组织中游离,收集游离出的有活性的单个细胞或是细胞团接种于培养皿或培养瓶中培养[13]。这种方法的优点是接种后细胞生长较快,利于后续试验,但是胰酶作用时间长易对细胞造成损伤,损伤后细胞不易贴壁,细胞活性下降,消化时间难把握,适用于胎儿组织的原代细胞培养。组织块法是将所取得的动物组织,在无菌条件下剪碎、或机械分散成适当体积的组织块,将组织块接种到培养皿中培养,随着时间的推移,细胞在组织块周围分裂增殖形成生长晕,最终汇合铺满整个皿底。此方法操作简便,对动物损伤小[11],对组织和细胞损伤小,但组织来源的年龄大小、生理状态对后续试验影响较大,老病动物体的组织不适合细胞培养。本研究直接使用初生仔猪打耳号剪下的耳组织采用组织块贴壁法进行细胞原代培养,试验成本低,而且对动物的存活和正常生长没有任何不良影响。
3.2 成纤维细胞的生物学特性 培养的细胞经姬姆萨染色后呈长梭形、不规则三角形或扁平状星形,可初步判断所培养的细胞为成纤维细胞。波形蛋白是特异性存在于成纤维细胞中的中间丝纤维。纯化后的细胞进行波形蛋白免疫组化试验后发现细胞包浆中有大量黄色颗粒状沉淀,可以确认所培养的细胞为成纤维细胞。细胞的生长符合细胞生长的一般规律,每一代的细胞生长过程有3个阶段[13],分为潜伏期(第1~2天)、指数生长期(第3~6天)和平台期(第7天开始)3个阶段。在潜伏期,由于细胞需适应环境并恢复损伤,细胞需重新贴壁生长,此阶段没有细胞增殖。潜伏期后进入细胞对数生长期,细胞大量分裂、增殖,逐渐铺满整个空间,随着细胞密度的增大,营养物质逐渐减少,代谢物质逐渐增多,细胞生长变缓,进入停滞期。其生长特点与太湖猪成纤维细胞[14]和巴马香猪成纤维细胞[15]基本一致。染色体的数目、形状、结构为不同生物所特有,在生物的繁殖进化以及生物个体的生长发育中,保持相对的稳定性,体外细胞培养,可用作细胞遗传学方面的研究,以确定细胞供体的种属、供体的性别等特征[16]。但是细胞在培养过程中,由于细胞生活环境的变化,染色体容易发生缺失、重组或断裂,因此染色体形态观察和数目统计是确定细胞建系是否成功的关键[17]。正常猪的染色体数目为2n=38,本试验通过染色体制片后获得分裂相良好的染色体玻片,在显微镜下观察染色体的形态并对染色体进行计数,经统计,染色体的数目稳定在2n=38,染色体数目正常的比例均在90%以上,达到建立细胞系的要求。
3.3 成纤维细胞的应用 王蓉蓉获取北山羊肌肉组织成功建立成纤维细胞系的体外培养体系,北山羊为国家一级保护动物,成纤维细胞系的成功建立使得北山羊的遗传资源从细胞水平上长期保存下来[18]。张明军利用肝脏特异性启动子α1人抗胰蛋白酶启动子构建肝脏特异性表达猪源Cre重组酶表达载体,然后将其转入小型猪胚胎成纤维细胞,得到肝脏特异性表达Cre重组酶转基因猪成纤维细胞,为后续构建肝脏特异性表达Cre重组酶转基因猪研究奠定了基础[19]。De Haan等对谷胱甘肽过氧化酶基因敲除的小鼠成纤维细胞系进行建立,为进一步研究活性氧导致衰老的病理生理学研究奠定了基础[20]。Amir等建立转hFIX基因羊成纤维细胞系,通过体细胞核移植生产转基因克隆羊,作为乳腺生物反应器生产凝血因子IX[21]。成纤维细胞已被广泛用于生产体细胞克隆、转基因诱导多功能性干细胞以及生理病理学研究。成纤维细胞系建立可以使优良的遗传资源从细胞水平上长期保存下来,为在细胞水平上研究转基因猪的生理机理以及构建基因组文库,基因遗传多样性研究等方面提供理想的生物学材料。
4 结论
本研究采用组织块贴壁法,通过纯化培养、细胞形态观察、免疫组化、染色体分析、微生物污染检测等方法确定成功建立转pGH基因猪和非转基因猪成纤维细胞系,经冻融试验检测细胞系能够稳定传代和保存,为转基因猪的后续研究提供了基础。
[1] Hammer R E,Pursel V G,Rexroad C E,et al.Production of transgenic rabbits,sheep and pigs by microinjection[J].Nature,1985,315(10):680-683.
[2] 吴明明.精子介导纳米基因载体法制备转基因猪的研究[D].青岛:青岛农业大学,2010.
[3] 蒋亚军,吴明明,孙金海.转外源基因(pGH)在猪染色体上整合状况[J].中国兽医学报,2013,35(7):1103-1107.
[4] 刘剑飞,吴明明,蒋亚军,等.实时荧光定量PCR技术在转基因猪生长激素基因差异表达中的应用[J].农业生物技术学报,2012,20(8):928-935.
[5] 党丽鑫.F1代转pGH基因猪生长性能的研究[D].青岛:青岛农业大学,2012.
[6] 王友升.F3代转pGH基因猪生长性能的研究[D].青岛:青岛农业大学,2016.
[7] 姚延珠,吴明明,孙金海.pGH和IGF-I双基因共表达载体的构建及转双基因猪的获得与检测[J].华北农学报,2016,31 (3):94-100.
[8] 范岩岩,刘倩倩,张廷荣,等.转pGH IGF-1基因对猪生长和繁殖性能的影响[J].中国畜牧杂志,2016,52(9):15-18.
[9] 马康,戚顺民,于光辉,等.13/17罗伯逊易位猪成纤维细胞系的建立[J].黑龙江畜牧兽医,2015(21):13-15.
[10] 李晓玲,于光辉,孙金海.转双基因(pGH/IGF-Ⅰ)猪胎儿成纤维细胞系的建立及鉴定[J].中国畜牧兽医,2016,43 (8):2053-2059.
[11] 张德福,吴彩凤,戴建军,等.梅山猪耳成纤维细胞体外培养及其克隆[J].中国兽医学报,2014,36(7):1188-1190.
[12] 司徒镇强,吴军正.细胞培养[M].西安;世纪图书出版社,1988.
[13] 翟中和,王喜中,丁明孝,等.细胞生物学[M].北京:高等教育出版社,2000.
[14] 张丽娟,刘海峰,李学伟.太湖猪成纤维细胞系的建立及其生物学特性研究[J].四川农业大学学报,2008,26(1):85-88.
[15] 杨素芬,汪彩珠,陈凌声.广西巴马香猪耳皮成纤维细胞的分离与培养[J].湖北农业科学,2009,48(3):547-552.
[16] 周雪雁,关伟军,马月辉.染色体显带技术及其在生物学研究中的意义[J].上海畜牧兽医通讯,2004,5:2-3.
[17] 陈亮,刘丑生,王新庄,等.滩羊成纤维细胞系的建立及其生物学特性研究[J].中国畜牧兽医,2010,37(6):50-54.
[18] 王蓉蓉.北山羊成纤维细胞体外培养体系的建立及特性分析[D].呼和浩特:内蒙古大学,2014.
[19] 张明军.肝特异性表达Cre重组酶载体和转基因猪成纤维细胞的构建[D].吉林:吉林大学,2008.
[20] De Haan JB,Bladier C,Lotfi Miri M,et al.Fibroblasts derived from Gpx1 knockout mice display senescent-like features and are susceptible to H2O2-mediated celldeath[J].Free Radical Biology and Medicine,2004,36(1):53-64.
[21] Amir Amiri Yekta,Azam Dalman,Poopak Eftekhari-Yazdi,et al.Production of transgenic goats expressing human coagulation factor IX in the mammary glands after nuclear transfer using transfected fetal fibroblast cells[J].Transgenic Research,2013,22(1):131-142.
The Establishment and Identification of Fibroblast Cell Lines with pGH Transgenic Pigs andnon-transgenic pigs
CUI Xiao-rong,LI Xiao-ling,YU Guang-hui,WEI Cheng-xiao,ZHAO Ling-ling,GONG Jian-fei,ZHANG Ting-rong,SUN Jin-hai
(College of Animal Science and Technology,Qingdao Agriculture University,Qingdao 266109,China)
In this study,we adopted the method ofexplants cell culture for the newborn piglets’ears to the primary culture,isolated pig fibroblasts cells from pGH transgenic pigs and non-transgenic pigs.Morphological observation,determination of viability before cryopreservation and after recovery,dynamic growth analysis,vimentin immunohistochemistry,chromosome counts and microbial contamination detection were all done to study the biological characteristics of the cell lines.The results showed that the fibroblasts were cultured and isolated successfully by trypsin digestion and differential centrifugation.The viability of seven cell lines was above 92%and 89%before cryopreservation and after recovery,respectively.The growth curves were sigmoid,and experienced the incubation period,exponential growth period and platform period.The vimentin immunohistochemistry was positive.The chromosome counting showed that the number of chromosomes was stable.The microbial contamination detection was negative.The results indicate that the fibroblast cell lines of pGH transgenic pigs and non-transgenic pigs are successfully established.
pGH gene;transgenic pigs;fibroblast cell line;cell culture;biological characteristics
s:SUN Jin-hai;ZHANG Ting-rong
S828
A
0529-6005(2017)06-0003-05
2017-02-09
国家转基因生物新品种培育科技重大专项(2016ZX08006-003);山东省现代农业产业技术体系生猪创新团队建设项目(SDAIT-08-13)
崔小荣(1990-),男,硕士生,主要从事分子遗传与动物育种研究,E-mail:18765908861@163.com
孙金海,E-mail:sunjinhai00528@sina.com;张廷荣,E-mail:zhangtr2006@126.com
