曲妥珠单抗联合长春瑞滨治疗HER-2阳性晚期乳腺癌患者的疗效分析
2017-07-31崔剑锋
崔剑锋
曲妥珠单抗联合长春瑞滨治疗HER-2阳性晚期乳腺癌患者的疗效分析
崔剑锋
目的 探讨曲妥珠单抗联合长春瑞滨治疗HER-2阳性晚期乳腺癌患者的疗效。方法 自2010年1月至2014年1月,前瞻性研究我院收治的HER-2阳性的晚期乳腺癌患者120例,将患者随机分为研究组和对照组,每组60例。研究组采用曲妥珠单抗联合长春瑞滨治疗,对照组采用曲妥珠单抗联合卡培他滨治疗。观察两组患者化疗期间相关并发症、生存时间、健康相关的生存质量(SF-36)、实体瘤疗效评价等级。结果 与对照组比较,研究组患者部分缓解率显著升高(53.00% vs. 28.33%,P=0.005);健康相关的生存质量(SF-36)显著提高(72.95±10.37 vs. 65.32±10.40,P<0.01)。随访2年后,研究组共11例患者死亡,对照组共19例患者死亡,两组比较差异无统计学意义(18.33% vs. 31.67%,P=0.092)。Wilcoxon检验显示,研究组患者生存期显著高于对照组(P=0.041)。两组患者末梢神经炎、手足综合征、转氨酶升高、胆红素升高、中性粒细胞减少、白细胞减少和消化道症状等差异均无统计学意义(P>0.05)。结论 曲妥珠单抗联合长春瑞滨有助于改善晚期乳腺癌患者生存时间,改善其生活质量。
晚期乳腺癌;HER-2;曲妥珠单抗;长春瑞滨;卡培他滨
0 引言
乳腺癌是中老年女性最常见的恶性肿瘤,严重危害了女性患者的身心健康[1-2]。虽然乳腺癌早期诊断率已明显提高,但仍有部分患者初诊时已发生转移,转移的乳腺癌患者5年生存率极低[3-4]。少部分的乳腺癌患者为HER-2阳性乳腺癌,HER-2全称是人类表皮生长因子受体2,是一种原癌基因,每个人体内的正常细胞膜表面都有少量HER-2蛋白,HER-2在细胞生长因子信号传导途径中起关键作用。当癌细胞内的HER-2基因高表达时,细胞膜上会产生过多的HER-2蛋白,刺激癌细胞疯狂增长,增加癌细胞的侵袭性。因此,HER-2阳性乳腺癌患者的病情较为凶险,较易出现复发转移,生存期较短[5-6]。化疗联合靶向治疗是HER-2阳性的晚期乳腺癌患者常用的治疗方法,旨在延长晚期乳腺癌患者生存期和改善其生活质量[7]。近年有学者尝试使用曲妥珠单抗联合长春瑞滨治疗晚期乳腺癌,郭继红等[8]研究显示,使用曲妥珠单抗联合长春瑞滨治疗HER-2阳性的晚期乳腺癌患者安全有效,5年存活率高达45.7%。曲妥珠单抗联合卡培他滨也是临床上常用的治疗方法,然而哪种治疗方法更好,目前尚缺乏系统性的研究。本文前瞻性研究了这两种化疗方案在HER-2阳性的晚期乳腺癌患者中的临床价值,具有一定的临床意义和创新性,现报道如下。
1 资料与方法
1.1 一般资料 2010年1月至2014年1月,前瞻性研究我院收治的HER-2阳性的晚期乳腺癌患者,纳入标准:①晚期乳腺癌(经穿刺或术中病理确诊为乳腺癌,术前未发现转移而术后发现转移,进而入组或首次诊断时即发现乳腺癌转移);②HER-2阳性(FISH试验确诊);③年龄≥18岁且≤65岁;④同意参与本研究。排除标准:①合并肝肾等脏器功能不全;②严重心脑血管疾病;③骨髓抑制;④甲状腺功能不全;⑤内分泌系统疾病;⑥血液系统疾病;⑦凝血功能障碍;⑧研究期间转院、放弃治疗、失访或不配合治疗。研究期间,根据纳入标准和排除标准,共纳入HER-2阳性的晚期乳腺癌患者120例,根据随机数字表原则将患者按照1∶1随机分为研究组和对照组,每组60例。研究组年龄32~65岁,平均年龄(52.38±8.28)岁,ER阳性38例,PR阳性32例,58例为术后发现转移,平均术后至发现转移时间为(9.48±2.47)个月,58例入组前接受过化疗,2例首诊确定转移,浸润型导管癌51例,小叶癌7例,黏液腺癌2例,全部合并腋下淋巴结转移,1个部位远处转移的患者41例,多个部位转移的患者19例。对照组年龄30~65岁,平均年龄(52.88±9.12)岁,ER阳性35例,PR阳性33例,55例为术后发现转移,平均术后至发现转移时间为(9.18±2.51)个月,55例入组前接受过化疗,5例首诊确定转移,浸润性导管癌53例,小叶癌5例,黏液腺癌2例,全部合并腋下淋巴结转移,1个部位远处转移的患者43例,多个部位转移的患者17例。两组患者年龄、ER阳性率、PR阳性率、平均术后至发现转移时间、接受过化疗率、腋下淋巴结转移、病理组织类型和远处转移情况等差异无统计学意义(P>0.05),具有可比性。本研究中所有患者均知情同意并签署知情同意书,本研究通过我院伦理委员会批准。
1.2 治疗方法 所有患者入院后均完善相关检验检查,择期开始化疗。研究组采用曲妥珠单抗联合长春瑞滨治疗,曲妥珠单抗6 mg/kg(d1,首次剂量为8 mg/kg),长春瑞滨25 mg/m2(d1和d8)。21 d为1个疗程,共4~6个疗程。对照组采用曲妥珠单抗联合卡培他滨治疗,曲妥珠单抗6 mg/kg(d1,首次剂量为8 mg/kg),卡培他滨2 000 mg/m2(d1~d14)。21 d为1个疗程,共4~6个疗程。
1.3 数据收集 主要观察指标包括相关并发症、生存时间、化疗开始后3个月时健康相关的生存质量(SF-36)和实体瘤疗效评价等级。健康相关的生存质量(SF-36):总分为100分,得分越高,表明生活质量越高,由同一医师对所有患者健康相关的生存质量进行评价。实体瘤疗效评价等级:采用系统实体瘤疗效评价(RECIST1.0)对患者进行疗效分级,包括:完全缓解、部分缓解、疾病稳定和疾病进展。完全缓解:病灶消失持续4周以上;部分缓解:病灶最大直径缩小30% 4周以上;疾病稳定:指介于部分缓解和病情进展之间;病情进展:指病灶直径增加20%以上或发现新的病灶。
1.4 统计学方法 采用SPSS 22.0统计软件。计量资料比较采用t检验;计数资料比较采用卡方检验;两组患者生存期采用生存函数Wilcoxon检验进行统计分析。
2 结果
2.1 两组患者实体瘤疗效评价等级比较 与对照组比较,研究组患者部分缓解率显著升高(53.00% vs. 28.33%,P=0.005)。见表1。
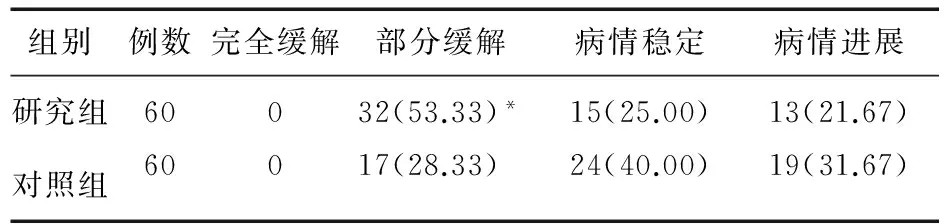
表1 两组患者实体瘤疗效评价等级比较(例,%)
注:*与对照组比较,χ2=7.761,P=0.005
2.2 两组患者生存质量比较 与对照组比较,研究组患者健康相关的生存质量(SF-36)显著提高(72.95±10.37 vs.65.32±10.40,P=0.000)。见图1。
2.3 两组患者生存期比较 随访2年后,研究组共11例患者死亡,对照组共19例患者死亡。Wilcoxon检验显示,研究组患者生存期显著高于对照组(P=0.041)。见图2。
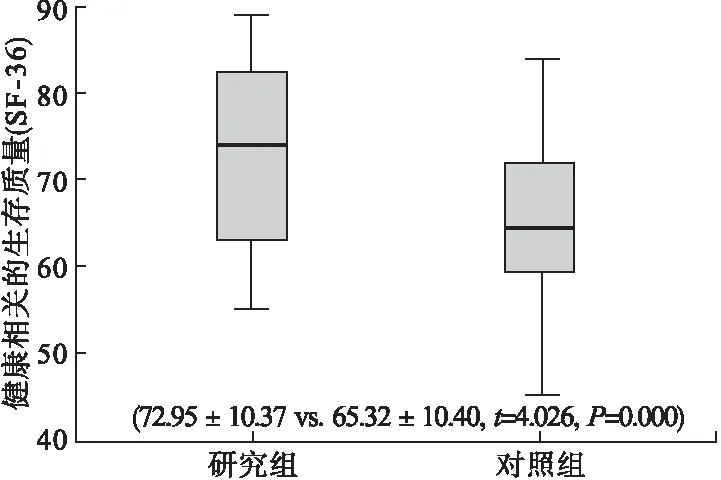
图1 两组患者生存质量比较

图2 两组患者生存期比较
2.4 两组患者并发症比较 两组患者末梢神经炎、手足综合征、转氨酶升高、胆红素升高、中性粒细胞减少、白细胞减少和消化道症状等比较差异均无统计学意义(P>0.05)。见表2。
3 讨论
长春瑞滨是一种半合成的长春花生物碱,临床上主要用于非小细胞肺癌、乳腺癌等的治疗[9-13]。可以通过与微管蛋白的结合,从而使肿瘤细胞在有丝分裂过程中微管形成障碍,进而抑制肿瘤细胞的增殖。作为一种抗HER-2的单克隆抗体,曲妥珠单抗可以显著改善HER-2阳性的晚期乳腺癌患者的临床预后[14-16]。联合应用曲妥珠单抗和化疗更有助于改善患者的临床预后[17]。目前,临床上常采用曲妥珠单抗联合长春瑞滨治疗HER-2阳性的晚期乳腺癌患者。Andersson等[18]使用曲妥珠单抗联合长春瑞滨治疗HER-2阳性的晚期乳腺癌患者,结果无进展生存期为15.3个月,中位生存期为38.8个月,1年生存率高达88%。曲妥珠单抗联合卡培他滨也是治疗HER-2阳性晚期乳腺癌的一种方法。目前对于这两种方案哪一种更好,尚未有定论。本研究系统性地分析了这两种方案对HER-2阳性的晚期乳腺癌患者的临床预后、生存质量和并发症的影响。结果显示,曲妥珠单抗联合长春瑞滨有助于改善HER-2阳性的晚期乳腺癌患者的生存期,改善其生活质量,且不增加患者治疗相关的并发症。因此,本文具有一定的创新性和临床意义。HER-2阳性乳腺癌的肿瘤细胞生长迅速,早期即可发生转移,因此,抑制HER-2信号通路是这类患者治疗的一个重点方向。曲妥珠单抗可以在这方面发挥较好的抑制作用。Fujimoto等[19]研究显示,曲妥珠单抗可以抑制乳腺癌患者肿瘤细胞的快速生长,停止曲妥珠单抗治疗后,肿瘤细胞增殖明显加速。Von等[20]研究了曲妥珠单抗联合卡培他滨、卡培他滨单药化疗对HER-2阳性晚期乳腺癌临床预后的影响,结果发现,曲妥珠单抗联合卡培他滨显著提高了治疗的有效率(48.1% vs. 27.0%,P=0.011 5)和无进展生存期(8.2个月 vs. 5.6个月,P=0.033 8)。肯定了曲妥珠单抗在HER-2阳性乳腺癌患者中的应用价值。卡培他滨在人体内可以代谢为5-FU的抗代谢氟嘧啶脱氧核苷氨基甲酸酯类药物,进而发挥抑制细胞分裂、干扰RNA和蛋白质合成的作用,与长春瑞滨均可用于晚期乳腺癌患者的治疗。本研究表明,曲妥珠单抗联合长春瑞滨优于卡培他滨,但是其具体机制尚不清楚,且目前相关研究较为缺乏,尚需要进一步的临床研究证实。
虽然长春瑞滨在晚期乳腺癌的治疗中具有较好的应用价值,但是其可以与神经轴突的微管结合,进而产生近期神经毒性[21-22]。本研究显示,研究组共有5例患者发生末梢神经炎,对症处理后均好转。提示长春瑞滨的毒副作用是可以接受的。
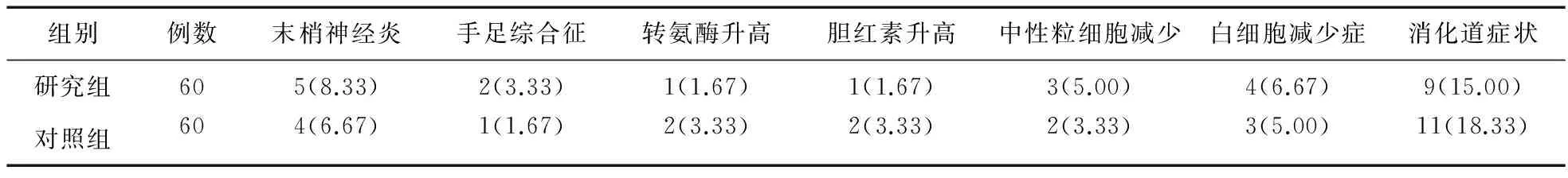
表2 两组患者并发症比较(例,%)
综上所述,曲妥珠单抗联合长春瑞滨有助于改善晚期乳腺癌患者的生存时间,改善其生活质量。但其具体机制尚需要进一步的临床研究证实。
[1] Rojas K,Stuckey A.Breast cancer epidemiology and risk factors[J].Clin Obstet Gynecol,2016,59(4):651-672.
[2] Ghoncheh M,Momenimovahed Z,Salehiniya H.Epidemiology,incidence and mortality of breast cancer in asia[J].Asian Pac J Cancer Prev,2016,17(S3):47-52.
[3] Ording AG,Heide-Jørgensen U,Christiansen CF,et al.Site of metastasis and breast cancer mortality:a Danish nationwide registry-based cohort study[J].Clin Exp Metastasis,2017,34(1):93-101.
[4] Sathiakumar N,Delzell E,Morrisey MA,et al.Mortality following bone metastasis and skeletal-related events among women with breast cancer:a population-based analysis of U.S.Medicare beneficiaries,1999-2006[J].Breast Cancer Res Treat,2012,131(1):231-238.
[5] Yoshida T,Jin K,Song H,et al.Effective treatment of ductal carcinoma in situ with a HER-2-targeted alpha-particle emitting radionuclide in a preclinical model of human breast cancer[J].Oncotarget,2016,7(22):33306-33315.
[6] Li MH,Hou CL,Wang C,et al.HER-2,ER,PR status concordance in primary breast cancer and corresponding metastatic lesion in lymph node in Chinese women[J].Pathol Res Pract,2016,212(4):252-257.
[7] Lekovic G,Drazin D,Mak AC,et al.Cyberknife radiosurgery and concurrent Intrathecal chemotherapy for leptomeningeal metastases:case report of prolonged survival of a HER-2+ breast cancer patient status-post craniospinal irradiation[J].Cureus,2016,8(1):453-462.
[8] 郭继红,徐兵河,马飞,等.曲妥珠单抗联合含长春瑞滨方案治疗人表皮生长因子受体2阳性晚期乳腺癌的研究[J].中国肿瘤临床与康复,2013,20(12):1348-1351.
[9] Samala R,Thorsheim HR,Goda S,et al.Vinorelbine delivery and efficacy in the MDA-MB-231BR preclinical model of brain metastases of breast cancer[J].Pharm Res,2016,33(12):2904-2919.
[10]Thallinger C,Lang I,Kuhar CG,et al.Phase II study on the efficacy and safety of Lapatinib administered beyond disease progression and combined with vinorelbine in HER-2/neu- positive advanced breast cancer:results of the CECOG LaVie trial[J].BMC Cancer,2016,16(8):121-129.
[11]Takase N,Hattori Y,Kiriu T,et al.Concurrent chemoradiotherapy with cisplatin and S-1 or vinorelbine for patients with stage III unresectable non-small cell lung cancer:a retrospective study[J].Respir Investig,2016,54(5):334-340.
[12]刘仁杰,段天林,李景钊,等.不同铂类药物联合长春瑞滨治疗晚期非小细胞肺癌临床效果及安全性分析[J].中国医药,2015,10(9):1289-1292.
[13]王波,张彤,王群.药物联合使用在高耐药性乳腺癌化学治疗中的应用价值[J].中国医药,2015,10(1):5-7.
[14]Parkinson B,Viney R,Haas M,et al.Real-World Evidence:A Comparison of the Australian Herceptin Program and Clinical Trials of Trastuzumab for HER2-Positive Metastatic Breast Cancer[J].Pharmacoeconomics,2016,34(10):1039-1050.
[16]莫雪莉.HER2阳性乳腺癌靶向治疗历程[J].中国临床实用医学,2015,6(5):1-2.
[17]邱佳宁,韩涛,刘璐,等.曲妥珠单抗联合多西他赛加顺铂治疗HER-2阳性晚期胃癌相关射血分数降低与疗效关系[J].临床军医杂志,2017,45(1):34-37.
[18]Andersson M,Lidbrink E,Bjerre K,et al.Phase III randomized study comparing docetaxel plus trastuzumab with vinorelbine plus trastuzumab as first-line therapy of metastatic or locally advanced human epidermal growth factor receptor 2-positive breast cancer:the HERNATA study[J].J Clin Oncol,2011,29(3):264-271.
[19]Fujimoto-Ouchi K,Sekiguchi F,Yamamoto K,et al.Preclinical study of prolonged administration of trastuzumab as combination therapy after disease progression during trastuzumab monotherapy[J].Cancer Chemother Pharmacol,2010,66(2):269-276.
[20]Von Minckwitz G,Schwedler K,Schmidt M,et al.Trastuzumab beyond progression:overall survival analysis of the GBG 26/BIG 3-05 phase III study in HER2-positive breast cancer[J].Eur J Cancer,2011,47(15):2273-2281.
[21]Liu X,Ma L,Yang K,et al.Vinorelbine plus oxaliplatin versus vinorelbine plus cisplatin for advanced non-small cell lung cancer:a systematic review[J].Zhongguo Fei Ai Za Zhi,2010,13(2):112-117.
[22]Keller S,Seipel K,Novak U,et al.Neurotoxicity of stem cell mobilization chemotherapy with vinorelbine in myeloma patients after bortezomib treatment[J].Leuk Res,2015,39(7):786-792.
Efficacy of trastuzumab combined with vinorelbine in the treatment of HER-2 positive advanced breast cancer
CUI Jian-feng
(Clinical Medicine College of Henan University of Science and Technology,Thyroid Gland and Breast Tumor Surgery,the First Affiliated Hospital of Henan University of Science and Technology,Luoyang 471003,China)
Objective To investigate the efficacy of trastuzumab combined with vinorelbine in the treatment of patients with HER-2 positive advanced breast cancer.Methods Totally 120 patients admitted to our hospital with positive HER-2 advanced breast cancer from January 2010 to January 2014 were prospectively studied.All patients were randomly assigned into study group and control group,with 60 cases in each group.Study group was given trastuzumab combined with vinorelbine for treatment,while control group
trastuzumab plus capecitabine for treatment.The chemotherapy-related complications,survival time,health-related quality of life (SF-36),and solid tumor efficacy evaluation grade of the two groups were observed.Results Compared with control group,patients in study group got a higher rate of remission (53% vs.28.33%,P=0.005),and an elevated level of health-related quality of life (SF-36) (72.95±10.37 vs.65.32±10.40,P<0.01).After 2 years of follow-up,11 patients died in study group and 19 cases died in control group,and there was no significant difference in 2-year mortality (18.33% vs.31.67%,P=0.092).Wilcoxon test showed that the survival time of patients in study group was significantly longer than that in control group (P=0.041).Peripheral neuritis,hand foot syndrome,elevated transaminases,elevated bilirubin,neutropenia,leukopenia and gastrointestinal symptoms had no significant difference between the two groups (P>0.05).Conclusion Trastuzumab combined with vinorelbine is helpful to prolong the survival time and improve the quality of life in patients with advanced breast cancer.
Advanced breast cancer;HER-2;Trastuaumab;Vinorelbine;Capecitabine
2016-11-03
河南科技大学临床医学院,河南科技大学第一附属医院甲状腺乳腺肿瘤外科,河南 洛阳471003
10.14053/j.cnki.ppcr.201707008
