扁咽口服液抗炎及其对急性咽炎模型大鼠治疗作用的实验研究
2017-07-31马建丽黎春彤朴晋华
马建丽,李 翔,黎春彤,刘 茜,蒋 伟,梁 璐,朴晋华
扁咽口服液抗炎及其对急性咽炎模型大鼠治疗作用的实验研究
马建丽1,李 翔1,黎春彤1,刘 茜1,蒋 伟1,梁 璐2,朴晋华3*
目的 观察评价扁咽口服液的抗炎作用,并考察其对急性咽炎的治疗作用和对常见呼吸道病原菌的抑菌活性。方法 运用小鼠耳廓肿胀实验、大鼠足肿胀实验和小鼠腹腔白细胞游走实验,评价扁咽口服液的抗炎作用;并采用大鼠急性咽炎模型,观察扁咽口服液的治疗作用;采用平皿法测定扁咽口服液对常见呼吸道病原菌的最低抑菌浓度。结果 扁咽口服液可显著降低二甲苯引起的小鼠耳廓肿胀度,减轻角叉菜胶所致大鼠的足肿胀(P<0.05或P<0.01);扁咽口服液高、中剂量显著降低羧甲基纤维素钠致小鼠腹腔白细胞游走(P<0.05);扁咽口服液可减轻急性咽炎模型大鼠咽部黏膜的炎症表现,缓解急性咽炎症状,并且随着药物剂量的增加,其抗炎作用和对咽部黏膜的改善作用均增强。扁咽口服液对金黄色葡萄球菌、肺炎克雷伯菌、大肠杆菌、肺炎链球菌、乙型溶血性链球菌均较为敏感,其最小抑菌浓度分别为56、28、56、28、14 mg/mL。结论 扁咽口服液具有良好的抗炎作用,对急性咽炎有明显的疗效。
扁咽口服液;急性咽炎;抗炎
0 引言
扁咽口服液是我院独立研制的中药复方制剂,已收入《中国人民解放军医疗机构制剂规范》2015版[1],由板蓝根、桔梗、西青果、山豆根、大青叶、穿心莲、大黄、蒲公英、紫苏叶、紫花地丁、黄芩、黄连、玄参、连翘、生石膏、薄荷脑、冰片共17味药材组成,具有清热解毒,排脓利咽,滋阴生津的功效,临床上适用于急、慢性咽炎、扁桃体发炎等症[2-3]。扁咽口服液临床应用多年,本课题组前期收集了大量的临床数据,并报道了其治疗急性咽炎的疗效,但扁咽口服液的抗炎效果、作用机制和物质基础尚未明确,因此,本研究开展了扁咽口服液对抗急性炎症的评价,建立大鼠急性咽炎模型,考察其对抗急性咽炎的效果,并针对呼吸道细菌开展体外抑菌实验,评价其从根源上对抗咽炎的效果[4]。
1 仪器和试药
1.1 仪器 SPX-250-Z型生化培养箱;MLS-3780型高压蒸汽灭菌器;生物安全柜;无菌操作台;BX53双目生物显微镜;电子台秤;AL204电子天平;打孔器;TU-1901紫外-可见分光光度计;一次性灭菌手术器械、灭菌注射器、医用额镜、压舌板、软尺等。
1.2 试药 扁咽口服液:本院制剂室生产,每毫升含生药0.56 g,批号:160104;肠溶阿司匹林片:拜耳医药,批号:BJ03384;注射用氨苄西林钠:山东鲁抗医药股份有限公司,批号:20151215。
二甲苯:天津市化学试剂三厂,批号:160205;角叉菜胶,SIDMA公司,批号:160203;戊巴比妥钠:德国产,科昊生物工程有限责任公司分装,批号:69020100。
1.3 实验动物与标准菌株、培养基 昆明种小鼠(20±2)g,雌雄各半,SPF级,中国药品生物制品检定所实验动物资源中心提供,实验动物合格证号:SCXK(京)2014-0017。SD大鼠(200±20)g,雌雄各半,山西医科大学实验动物中心提供,实验动物合格证号:SCXK(晋)2014-0001。
肺炎链球菌(苏联国家鉴定所)31001、肺炎克雷伯菌ATCC46117、乙型溶血性链球菌CMCC(B)32210、金黄色葡萄球菌ATCC29213、大肠杆菌ATCC25922购自中国药品生物制品检定所。营养肉汤培养基(150128)、普通琼脂培养基(150226)、血琼脂基础培养基(141016)均购自中国食品药品检定研究院。
2 实验方法
2.1 扁咽口服液对抗急性炎症作用
2.1.1 二甲苯致小鼠耳肿胀实验 取昆明种小鼠50只,雌、雄各半,随机分为5组,每组10只,分别为A组~E组,其中A组给予生理盐水,B、C、D组给予扁咽口服液,E组给予阿司匹林,给药方式为灌胃,1次/d,连续3 d。末次给药1 h后,以二甲苯试剂50 μL/只给小鼠右耳致肿胀,30 min后,将小鼠脱颈椎处死,取双耳相同位置内径8 mm打孔,称重计算肿胀度(右耳片质量-左耳片质量)和肿胀抑制率[肿胀抑制率=(阴性对照组肿胀度-用药组肿胀度)/阴性对照组肿胀度],结果见表1。
2.1.2 角叉菜胶致大鼠足肿胀实验 取SD大鼠,分组方法及给药情况同上,灌胃给药,1次/d,连续5 d。末次给药30 min后,以角叉菜胶0.1 mL/只在每只鼠右后足跖部皮下注射,致炎前后不同时间点测量踝关节周长,每隔1 h测量1次,共测5次,计算肿胀率[(致炎后踝关节周长-致炎前踝关节周长)/致炎后踝关节周长],结果见表1。
2.1.3 大鼠羧甲基纤维素囊袋实验 取SD大鼠,分组方法及给药情况同上,灌胃给药,1次/d,连续3 d。实验方法见文献[5]。
2.2 扁咽口服液对实验性急性咽炎模型大鼠的治疗作用
2.2.1 急性咽炎造模 按照文献方法[6],从冻干瓶中复苏乙型溶血性链球菌,划线法接种于血琼脂培养基斜面上,37 ℃培养,24 h后挑取单菌落接种于营养肉汤中(加入5%~10%的无菌脱纤维兔血),继续培养12 h,用0.9%生理盐水将菌落洗脱,稀释菌液,目标浓度为含菌量108~109cfu/mL,至4 ℃冰箱中备用。选择SD大鼠48只,体重(200±20)g,雌雄各半,随机分组,每组8只,分别为:空白对照组,模型组,扁咽口服液高、中、低剂量组及阳性对照组。除正常对照组外,其余5组造模。造模组按照文献方法[6],给SD大鼠注射乙型溶血性链球菌(含菌量108~109cfu/mL)。已感染大鼠按常规饲养24 h后,第2次给予大鼠咽部黏膜乙型溶血性链球菌细菌感染。
2.2.2 给药及标本采集与处理 造模后第4天起,按照《中药药理实验方法学》中的人与动物用药剂量换算方法[7],扁咽口服液给药剂量分别确定7.51、3.76、1.86 g/kg(相当于临床等效量的20、10、5倍),阳性对照组给药剂量为0.6 g/kg氨苄西林钠,正常组给等容量的灭菌水,给药方式均为灌胃,连续给药5 d。观察动物的一般情况。
模型对照组,在造模第4天,用戊巴比妥钠溶液经腹腔注射麻醉,处死,摘取咽部黏膜以及黏膜下组织,10%福尔马林溶液固定,切片,分别进行HE染色和免疫组化实验。阳性对照组,扁咽口服液高、中、低剂量组均于给药第5天后处死,同法取咽部组织。咽部黏膜组织经HE染色后,光镜下观察。
2.3 扁咽口服液抑菌试验
2.3.1 试验菌准备 取复苏的金黄色葡萄球菌、肺炎克雷伯菌和大肠埃希菌,营养肉汤培养24 h,培养物接种至中国兰平板,37 ℃再孵育24 h,取复苏的乙型溶血性链球菌和肺炎链球菌同法接种至血平板;分别取上述各菌24 h培养菌落,用麦氏比浊法调制108/mL,稀释至105/mL作为工作液。
2.3.2 药物制备 扁咽口服液用0.22 μm微孔滤膜过滤,以倍比稀释法稀释药液浓度至1∶1、1∶2、1∶4、1∶8、1∶16。分别取上述溶液1 mL加培养基9 mL加入直径为7 cm倾注平皿制成平板,肺炎链球菌、乙型溶血性链球菌用培养基在HM培养基中加入5%的脱纤维羊血,制成血琼脂培养基。平皿含药液浓度为56、28、14、8、4 mg/mL。
2.3.3 最小抑菌浓度检测 克雷伯菌、大肠杆菌、金黄色葡萄球菌的菌悬液20 μL涂布于平皿琼脂上,肺炎链球菌、乙型溶血性链球菌菌悬液涂布于血琼脂培养基,同时用原液制成平板不接种任何菌作为阴性对照。37 ℃孵育18~24 h,检查有无细菌生长。
3 结果
3.1 扁咽口服液对抗急性炎症作用
3.1.1 扁咽口服液对二甲苯致小鼠耳廓肿胀的抑制 扁咽口服液不同剂量组和阳性药对照组均可抑制二甲苯导致的小鼠耳廓肿胀,其中中、高剂量组和阳性对照组与空白组比较,差异有统计学意义(P<0.01),与低剂量组比较,差异有统计学意义(P<0.05)。随着剂量的增加,其抑制率显著提高,结果见表1。

表1 扁咽口服液对二甲苯致小鼠耳廓肿胀的抑制作用 (n=10)
注:与A组比较,*P<0.05,**P<0.01
3.1.2 扁咽口服液对角叉菜胶致大鼠足肿胀的抑制 给予角叉菜胶后,大鼠的足趾肿胀明显增加,并随着时间延长而持续增加,至3 h达到最高值48.81%。而不同剂量的扁咽口服液和阳性对照药对大鼠足肿胀均有抑制作用,其中高剂量组与阳性药作用接近,在1~5 h内与空白组比较,差异有统计学意义(P<0.01);中剂量组在1 h和2 h时比较,差异有统计学意义(P<0.05),在3~5 h时比较,差异有统计学意义(P<0.01);低剂量组仅在3 h与空白组比较,差异有统计学意义(P<0.01)。我们发现扁咽口服液和阳性药组的肿胀得到抑制,并且炎症反应时间与空白组相比延后1 h。结果见表2。
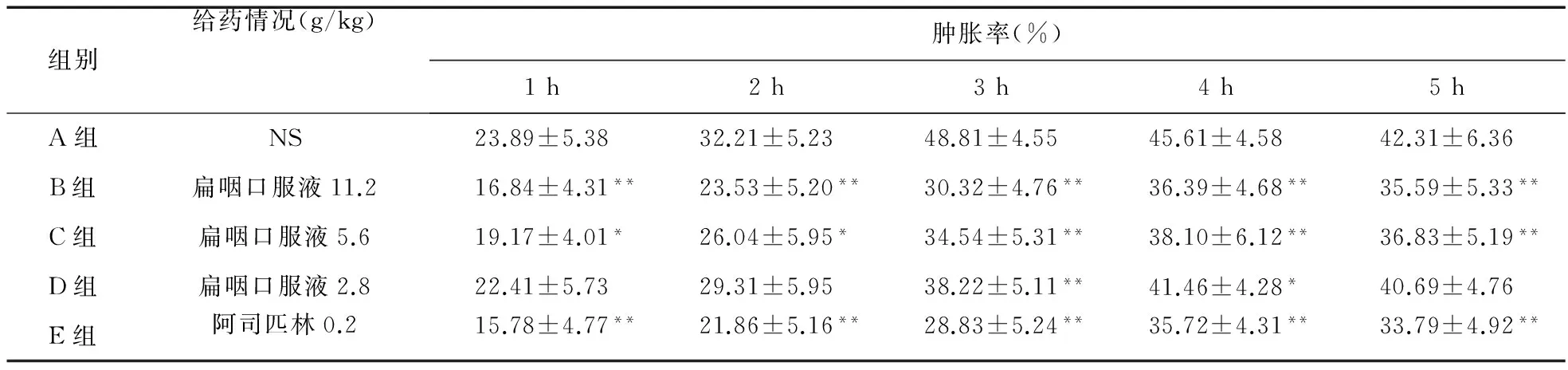
表2 扁咽口服液对角叉菜胶致大鼠足肿胀的抑制作用(n=10)
注:与A组比较,*P<0.05,**P<0.01
3.1.3 扁咽口服液对羧甲基纤维素钠所致大鼠腹腔白细胞游走的抑制 试验结果表明,阿司匹林和扁咽口服液中、高剂量组均能够抑制局部注射羧甲基纤维素后引起的白细胞游走,与空白组比较,差异有统计学意义(P<0.05),低剂量组与空白组比较差异无统计学意义。结果见表3。

表3 扁咽口服液对羧甲基纤维素钠所致大鼠腹腔白细胞 游走的抑制作用(n=10)
注:与A组比较,*P<0.05
3.2 扁咽口服液对实验性急性咽炎模型大鼠的治疗作用
3.2.1 一般状态观察 32只造模后SD大鼠出现精神状态欠佳、频饮水、纳食少、体重下降等症状,在分别给予阳性药及扁咽口服液高、中、低剂量后,上述症状有所缓解,空白对照组无上述症状。
3.2.2 咽部组织病理形态学观察 空白组黏膜及黏膜下层间质结构清晰,上皮表层可见角化,可见巢状分布的黏液腺体,细胞无病变。与空白对照组相比,模型组上皮角化明显,固有层内可见大量炎症浸润伴水肿,病变累及黏膜、黏膜下层、黏膜下层黏膜腺体周围及横纹肌间质,小血管扩张充血。扁咽口服液给药组和阳性给药组能有效改善造模后大鼠咽部黏膜组织的炎细胞浸润,固有层充血、腺体的肥大、上皮增生等症状,中性粒细胞显著减少,可见少量淋巴细胞浸润,血管扩展不明显。扁咽口服液高剂量组炎性细胞减少显著,与阳性给药组效果基本相同,较低剂量组改善效果明显(见图1)。

图1 扁咽口服液治疗急性咽炎模型大鼠咽部粘膜组织病理改变
3.3 扁咽口服液抑菌试验 扁咽口服液对金黄色葡萄球菌、肺炎克雷伯菌、大肠杆菌、肺炎链球菌、乙型溶血性链球菌较为敏感,其最小抑菌浓度分别为56、28、56、28、14 mg/mL,见表4。
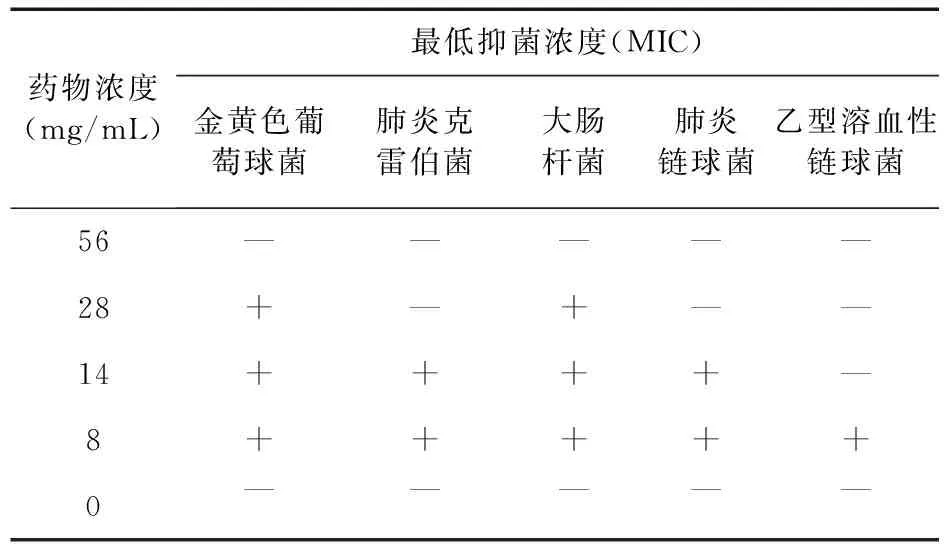
表4 扁咽口服液抑菌试验结果
4 讨论
扁咽口服液基于中医理论治疗风热邪毒侵袭所致的“喉弊”,以连翘、板蓝根为君,清热解毒;大黄、玄参为臣,通便滋肺肾阴;佐以山豆根、大青叶,清热利咽,对症治疗;并以桔梗为舟楫之药,载药上行。扁咽口服液有着深厚的中医辨证理论指导,临床应用基础扎实,可作为中成药治疗急性咽炎的典型代表。
本文系统地评价了扁咽口服液对抗急性炎症的效果,采用小鼠耳肿胀和大鼠足肿胀两个模型,验证其对抗以充血和胀大为特点的炎症第一时相反应;采用大鼠腹腔白细胞游走试验,验证了其对抗以浸润和白细胞游走为特点的炎症第二时相反应[8]。试验结果表明,扁咽口服液中、高剂量组和阳性对照组,抗炎效果均显著,炎症的发展程度受到抑制,炎症的发作进度有所延缓。
基于扁咽口服液对急性炎症的影响,本试验进一步开展了对急性咽炎大鼠模型治疗作用的考察。课题前期对急性咽炎模型进行探讨,并建立了采用给大鼠咽部黏膜注射临床最易引起上呼吸道感染、引发咽喉炎和扁桃体炎的致病力较强的病原菌-乙型溶血性链球菌的方式造模[9-10],本研究所采用的造模方法更接近咽炎的临床发病机制,模型大鼠与临床急性咽炎症状更相近,因此在继续试验中,我们依然采用本模型。
急性炎症大多是由病原菌引起的,对抗炎症治疗仅仅是对症治疗,抑制病原菌才能从根本上治愈急性咽炎。因此,本实验进一步开展了扁咽口服液的抑菌试验,由试验结果可见,扁咽口服液对呼吸道常见菌-金黄色葡萄球菌、肺炎克雷伯菌、大肠杆菌、肺炎链球菌、乙型溶血性链球菌有不同程度的抑制作用。
本研究系统评价了扁咽口服液对抗急性咽炎的疗效,结果显示,中、高剂量扁咽口服液明显改善了局部的炎症反应,体外抑菌试验结果亦表明,扁咽口服液对呼吸道常见的病原菌均有一定的抑制作用,这可能是其能够改善急性咽炎,防止急性咽炎恶化甚至转为慢性咽炎的原因之一。但其调节炎症反应的具体分子基础和对炎症因子的调节作用尚未明确,这将成为我们下一步实验的重点。
[1] 中央军委后勤保障部卫生局.中国人民解放军医疗机构制剂规范[S].北京:人民军医出版社,2015:95.
[2] 马建丽,刘皈阳,李翔,等.高效液相色谱法同时测定扁咽口服液中黄芩苷和肉桂酸的含量[J].药学实践杂志,2013,31(6):451-453.
[3] 李翔,刘皈阳,马建丽,等.HPLC法测定扁咽口服液中苦参碱的含量[J].解放军药学学报,2014,30(6):532-534.
[4] 马建丽,钱丽旗,李素那,等.扁咽口服液治疗急性咽炎疗效观察[J].中国药师,2014,17(4):649-651.
[5] 王小晓,闫艳仓,王旭丹,等.复方牛蒡子含片的抗炎作用及其对急性咽炎模型大鼠的治疗作用[J].中国实验方剂学杂志,2010,16(11):147-149.
[6] 梁璐,朴晋华,高天红,等.注射用炎琥宁对实验性急性咽炎动物模型的疗效与作用机制研究[J].药物评价研究,2012,35(3):165-168.
[7] 李仪奎.中药药理实验方法学[M].上海:上海科学技术出版社,1991:562.
[8] 黄慧敏,柯昌虎,陈琴华.四氢黄连碱体内抗炎作用的研究[J].实用药物与临床,2016,19(7):830-834.
[9] 梁璐,朴晋华,马建丽.急性和慢性咽炎的发病机制与动物模型建立的研究现状[J].临床医药实践,2012,21(7):540-543.
[10]杨建新,李艳宇,高鹏.2012年-2014年A群乙型溶血性链球菌监测与耐药分析及PFGE分型[J].中国卫生检验杂志,2015,25(20):3583-3585.
Anti-inflammatory effect of Bianyan oral solution and its treatment of acute pharyngitis in rat model
MA Jian-li1,LI Xiang1,LI Chun-tong1,LIU Qian1,JIANG Wei1,LIANG Lu2,PIAO Jin-hua3*
(1.First Affiliated Hospital of PLA General Hospital,Beijing 100048,China;2.Shanxi Cardiovascular Hospital,Taiyuan 030024,China;3.Shanxi Institute for Food and Drug Control,Taiyuan 030001,China)
Objective To observe and evaluate the anti-inflammatory effect of Bianyan oral solution,explore its treatment effect on acute pharyngitis and test the bacteriostasis in common respiratory pathogenic bacteriainvitro.Methods The anti-inflammatory effects of Bianyan oral solution was evaluated by the auricle swelling experiments in mouse,the swelling experiments of rats′ feet and the abdominal leukocyte migration experiments in mouse.The treatment effect of Bianyan oral solution on acute pharyngitis was observed by using the rat model of acute pharyngitis.The minimum inhibitory concentration of Bianyan oral solution against common respiratory pathogenic bacteria was tested by plating method. Results Bianyan oral solution significantly reduced the auricle swelling caused by xylene in mouse and feet swelling caused by carrageen glue of rats (P<0.05 orP<0.01).High-dose and mid-dose of Bianyan oral solution significantly reduced the abdominal leukocyte migration caused by sodium carboxymethyl cellulose of mouse (P<0.05).Bianyan Oral Solution could alleviate the inflammatory reaction of pharyngeal mucosa in acute pharyngitis rats and remit symptoms of acute pharyngitis.Anti-inflammatory effects and improvement of pharyngeal mucosa were enhanced while the dosage of Bianyan oral solution was increased.Bianyan oral solution showed good sensitivity to the selected five bacteria,includingStaphylococcusaureus,Streptococcuspneumonia,Escherichiacoli,Klebsiellapneumoniastreptococcusandbetahemolyticstreptococcus,with the minimum inhibitory concentration at 56,28,56,28,and 14 mg/mL,respectively. Conclusion Bianyan oral solution shows good anti-inflammatory effects and obvious curative effects on acute pharyngitis.
Bianyan oral solution;Acute pharyngitis;Anti-inflammatory
2017-01-17
1.解放军总医院第一附属医院,北京 100048,2.山西省心血管病医院,太原 030024,3.山西省食品药品检验所,太原 030001
*通信作者
10.14053/j.cnki.ppcr.201707004
