长春瑞滨诱导人上皮性卵巢癌细胞系SKOV3凋亡及降低端粒酶活性
2018-01-10申丽媛徐冬梅刘潇涵文亚玲
申丽媛,徐冬梅*,刘潇涵,杨 玫,文亚玲
(1.重庆市妇幼保健院 妇产科,重庆 400021; 2.重庆医科大学附属第一医院 妇产科,重庆 400016)
研究论文
长春瑞滨诱导人上皮性卵巢癌细胞系SKOV3凋亡及降低端粒酶活性
申丽媛1,徐冬梅1*,刘潇涵2,杨 玫1,文亚玲1
(1.重庆市妇幼保健院 妇产科,重庆 400021; 2.重庆医科大学附属第一医院 妇产科,重庆 400016)
目的探讨长春瑞滨对人上皮性卵巢癌细胞系SKOV3细胞凋亡、端粒酶活性及亚单位人端粒酶反转酶mRNA(hTERT mRNA)表达的影响。方法将不同浓度的长春瑞滨作用于SKOV3细胞后,用CCK- 8法检测细胞增殖;流式细胞计量术检测细胞凋亡;端粒重复序列扩增酶联免疫吸附试验(TRAP-ELISA)检测端粒酶活性; RT-PCR检测细胞中hTERT mRNA表达。结果长春瑞滨可抑制SKOV3细胞增殖,诱导细胞凋亡(P<0.01),降低SKOV3细胞中端粒酶活性及hTERT mRNA的表达(P<0.01),且存在浓度-时间依赖关系。结论检测端粒酶的活性及hTERT mRNA表达,可能有助于判定长春瑞滨诱导上皮性卵巢癌细胞凋亡的敏感性。
上皮性卵巢癌;长春瑞滨;凋亡;端粒酶活性
目前,肿瘤细胞减灭术和联合化疗是中晚期卵巢癌的主要治疗策略,但因其广泛的盆腹腔转移,极大降低了手术的满意率,因此,发现有效的化疗药物具有重要意义[1]。长春瑞滨是第3代长春花碱类药物,在分子水平,它干扰细胞微管的动态平衡,与微管蛋白单体结合,抑制微管的形成,在有丝分裂中期阻断细胞活动,进而使细胞停滞在有丝分裂中期或使细胞死亡,为细胞周期特异性药物[2]。
端粒位于真核细胞染色体的末端,在维持染色体的稳定性、完整性和细胞活性有重要作用。端粒酶是由核苷酸和蛋白质组成的复合体,能延长缩短的端粒,从而增强细胞的增殖能力,hTERT是端粒酶的催化亚基,其表达情况与端粒酶的活性相关[3]。近年研究表明,多数化疗药物诱导肿瘤细胞凋亡与端粒酶的活性有关[4],长春瑞滨发挥抗癌作用的机制与端粒酶活性密切相关[5],本实验观察长春瑞滨对人上皮性卵巢癌细胞系SKOV3凋亡的诱导作用及对细胞端粒酶活性的影响及其机制。
1 材料与方法
1.1 材料与试剂
卵巢癌细胞系SKOV3(中科院上海细胞库);小牛血清(杭州四季青公司);长春瑞滨(Pierre Farmos公司);CCK- 8(上海生物公司);Annexin V-FITC(凯基公司);引物由上海生工合成,端粒酶活性检测试剂盒(武汉优尔生公司);将10 mg长春瑞滨溶于0.9%氯化钠溶液,配成1 mmol/L液体,使用前稀释成所需浓度。
1.2 方法
1.2.1 细胞分组及处理:取对数增殖期卵巢癌细胞SKOV3,实验设对照组、长春瑞滨组和调零组。对照组加入20 μL细胞培养液,长春瑞滨组加入等体积长春瑞滨药物,使其浓度为1、5和10 μg/mL,调零组加入与长春瑞滨组等量的PBS。
1.2.2 CCK- 8法检测细胞增殖:以1×104个/ mL细胞接种于96孔板中,每孔200 μL,各组均设5个复孔,分别在24、48及72 h取样,每孔加入CCK- 8 20 μL,37 ℃继续孵育,2 h后酶标仪检测吸光度(570 nm),计算细胞增殖抑制率。细胞增殖抑制率%=[1-(A给药组-A空白组)/(A阴性对照组-A空白组)]×100%,实验重复3次。
1.2.3 流式细胞计量术检测细胞凋亡:以5×105个/mL细胞接种于24孔板,分别在24、48及72 h用不含乙二胺四乙酸的胰酶消化收集细胞,PBS洗涤2次,依次加入500 μL 结合缓冲液、5 μL Annexin V/FITC及5 μL PI溶液,流式细胞仪检测细胞凋亡率,实验重复3次。
1.2.4 端粒重复序列扩增酶联免疫吸附试验(TRAR-ELISA)检测端粒酶活性:收集各实验组细胞,用冷PBS洗涤2次,加入冰冷裂解缓冲液40 μL,4 ℃离心(600 r/min),收集上清,按试剂盒说明进行PCR扩增实验。分别取阴性、阳性及待测样本各2.5 μL,加入变性剂10 μL,静置10 min后加入杂交缓冲液100 μL,吹打均匀,取100 μL混合液至亲和素包被的微孔板中,37 ℃中孵育2 h。洗涤3次后加入抗体100 μL,静置30 min,依次加入TMB显色液及终止液。酶标仪检测各孔在450 nm和690 nm处的吸光度值,依据公式:A=A450-A690计算端粒酶活性。
1.2.5 RT-PCR检测端粒酶hTERT mRNA水平:hTERT mRNA扩增引物序列:上游引物5′-CGGAAG AGTGTCTGGAGCAA-3′,下游引物5′-GGATGAAGCG GAGTCTGGA-3′。GAPDH作为内参照:上游引物5′-GGTGAAGGTCGGAGTCAACGG-3′,下游引物5′-CCTG GAAGATGGTGATGGGATT-3′。收集各实验组细胞,按Trizol试剂盒说明书提取细胞总RNA,反转录合成cDNA。PCR扩增条件:94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共进行35个循环,最后72 ℃延伸5 min,4 ℃保存。1.5%琼脂糖凝胶上进行电泳。
1.3 统计学分析

2 结果
2.1 长春瑞滨对卵巢癌细胞SKOV3的抑制作用
长春瑞滨可呈时间及剂量依赖性抑制SKOV3细胞增殖(图1)。
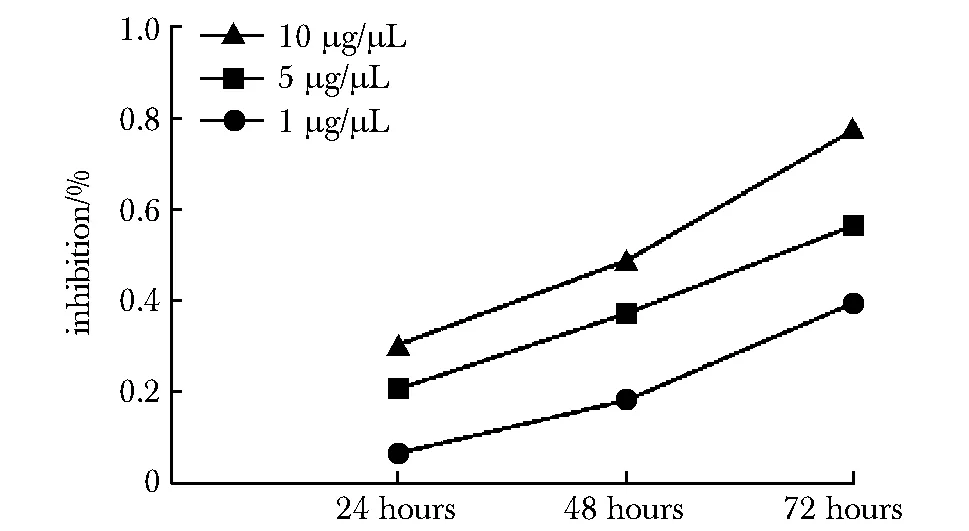
图1 长春瑞滨对卵巢癌细胞SKOV3增殖抑制的影响Fig 1 Inhibition of SKOV3 by different concentration of vinorelbine
2.2 长春瑞滨对细胞SKOV3凋亡的影响
长春瑞滨呈时间-浓度依赖性诱导SKOV3凋亡(表1)。
2.3 长春瑞滨对卵巢癌细胞端粒酶活性的影响
1 μg/mL长春瑞滨作用48和72 h时,端粒酶活性明显降低(P<0.01)。5和10 μg/mL长春瑞滨作用24、48及72 h后,端粒酶活性相比对照组明显降低(P<0.01)(表2)。

表1 长春瑞滨对卵巢癌细胞SKOV3凋亡率的影响
*P<0.01 compared with control.

表2 长春瑞滨对卵巢癌细胞SKOV3端粒酶活性的影响
*P>0.05,**P<0.01 compared with control.
2.4 长春瑞滨对卵巢癌细胞hTERT mRNA的影响
长春瑞滨处理的卵巢癌细胞中hTERT mRNA表达随时间延长及浓度升高而降低(图2,表3)。
表3 长春瑞滨对卵巢癌细胞SKOV3 hTERTmRNA的影响
*P<0.01 compared with control.
3 讨论
端粒酶是一种特殊核糖蛋白复合体,可将端粒重复序列整合到染色体末端,具有维持肿瘤细胞永生化的能力[6],抑制端粒酶的活性能够通过诱导细胞凋亡从而抑制肿瘤形成[7- 8]。因此,研究端粒酶的表达和活性及其在肿瘤细胞药物敏感性中的规律,为肿瘤的检测和治疗提供了新的临床思路。长春瑞滨针对复发和难治性上皮性卵巢癌有显著疗效[9- 10]。目前与长春瑞滨治疗上皮性卵巢癌相关的基础研究鲜有报道。
hTERT mRNA是调控端粒酶活性的关键因子,与细胞凋亡密切相关[11]。研究表明,hTERT与端粒酶活性具有一致性[12- 13],本实验在不同时间用不同浓度的长春瑞滨作用SKOV3细胞后,发现长春瑞滨与SKOV3细胞的凋亡及增殖抑制作用呈时间-浓度效应关系。1 μg/mL长春瑞滨作用24 h即可显著下调上皮性卵巢癌细胞中hTERT mRNA的表达,然而端粒酶活性未见明显改变,1 μg/mL长春瑞滨作用48 h才见端粒酶活性的降低,5和10 μg/mL长春瑞滨在各时间点,均可见hTERT mRNA和端粒酶活性的下降,提示hTERT mRNA表达的改变比端粒酶活性更敏感,更有助于判定长春瑞滨治疗上皮性卵巢癌的疗效。
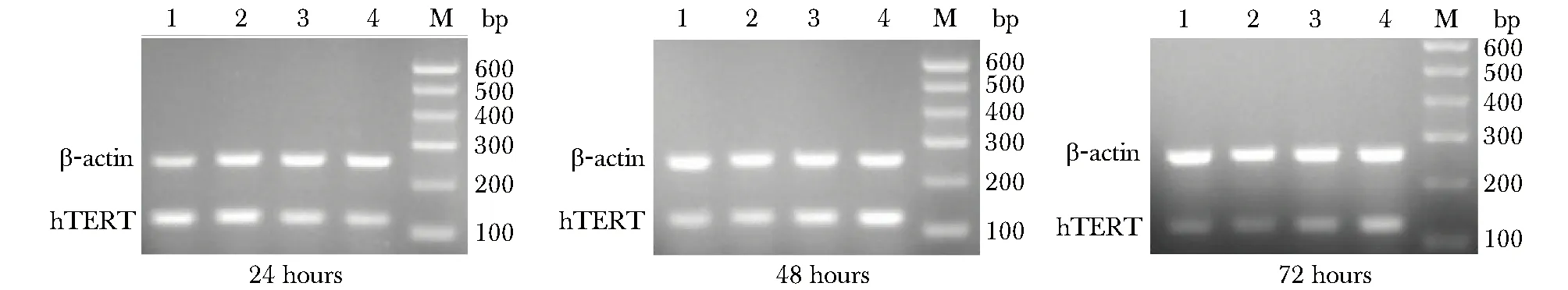
M.marker;1.control;2.1 μg/mL vinorelbine;3.5 μg/mL vinorelbine;4.10 μg/mL vinorelbine图2 1、5和10μg/mL长春瑞滨作用卵巢癌SKOV3细胞24、48和72 h时hTERT mRNA表达情况Fig 2 Expression of hTERT mRNA in SKOV3 by different concentration of vinorelbine in different time
端粒酶是目前较广泛、特异性强的肿瘤标志物,其活性与恶性肿瘤的生存预后显著相关,有报道端粒酶可能通过下调hTERT表达抑制其活性,从而诱导细胞凋亡[5],与本研究结果相符。研究显示,hTERT mRNA和端粒酶在SKOV3细胞株及上皮性卵巢癌患者中显著高表达[14],因此,通过检测患者病理性渗出物、血液及肿瘤脱落细胞等临床标本中hTERT mRNA表达和端粒酶活性,可能有助于上皮性卵巢癌的治疗疗效监测及预后的判断,亦可为上皮性卵巢癌的治疗提供新的靶点。
综上所述,长春瑞滨在SKOV3细胞中诱导细胞凋亡且下调hTERT的表达,其作用机制可能是通过下调hTERT mRNA抑制端粒酶活性,从而促使肿瘤细胞凋亡。与端粒酶活性相比较,hTERT表达更灵敏。因此,其可作为长春瑞滨治疗上皮性卵巢癌的理想监测指标,其具体作用机制待进一步研究。
[1] Chen M,Jin Y,Bi Y,etal.Prognostic significance of lymphovascular space invasion in epithelial ovarian cancer [J].J Cancer,2015,6:412- 419.
[2] Gabriele L,Vedangana S,Bibhudatta M,etal.,Vinorelbine and epirubicin share common features with polysialic acid and modulate neuronal and glial functions [J].J Neurochem,2016,136:48- 62.
[3] Lu W,Zhang Y,Liu D,etal.Telomeres-structure,function,and regulation [J].Exp Cell Res,2013,319:133- 141.
[4] Paul Y,Karen LM,Patricia H,etal.Therapeutic targeting of replicative immortality [J].Semin Cancer Biol,2015,35:S104- 128.
[5] 柳菁菁,陈公琰,王萌.长春瑞滨对人肺腺癌Anip973细胞凋亡和端粒酶表达的影响 [J].中华肿瘤杂志,2010,32:743- 747
[6] Boscolo-Rizzo P,Da-Mosto MC, Rampazzo E,etal.Telomeres and telomerase in head and neck squamous cell carcinoma:from pathogenesis to clinical implications [J].Cancer Metastasis Rev,2016,35:457- 474.
[7] Trochet D,Mergui X,Ivkovic I,etal.Telmere regulation during ageing and tumorigenesis of the grey mouse lemur [J].Biochimie,2015,113:100- 110.
[8] Jafri MA, Ansari SA, Alqahtani MH,etal. Roles of telomeres and telomerase in cancer, and advances in telomerase-targeted therapies [J].Genome Med, 2016,8:69- 86.
[9] Xenidis N,Neanidis K,Amarantidis K,etal.Biweekly vinorelbine and gemcitabine as second-line and beyond treatment in ovarian cancer [J].Cancer Chemother Phanrmacol,2011,67:69- 73.
[10] Capasso A.Vinorelbine in cancer therapy [J].Curr Drug Target,2012,13:1065- 1071.
[11] Kellermann G, Kaiser M, Dingli F,etal. Identification of human telomerase assembly inhibitors enabled by a novel method to produce hTERT [J]. Nucleic Acids Res,2015,43:1093- 1104.
[12] Chen W, Lu J, Qin Y,etal.Ret finger prtein-like 3 promotes tumor cell growth by activating telomerase reverse transcriptase expression in human lung cancer cells [J].Oncotarget,2014,5:11909- 11923.
[13] Xi L, Cech TR. Inventory of telomerase components in human cells reveals multiple subpopulations of hTR and hTERT [J]. Nucleic Acids Res,2014,42:8565- 8577.
[14] Park TW,Riethdorf S,Riethdorf L,etal.Differential telomerase activity,expression of the telomerase catalytic subunit and telomerase-RNA in ovarian tumors [J]. Int J Cancer,1999,84:426- 431.
Vinorelbine induces apotosis and decreases telomerase activity in human epithelial ovarian cancer cells line SKOV3
SHEN Li-yuan1, XU Dong-mei1*, LIU Xiao-han2, YANG Mei1, WEN Ya-ling1
(1.Dept. of Gynaecology and Obstetrics,Chongqing Health Cencer for Women and Children, Chongqing 400021;2.the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China)
ObjectiveTo investigate the effect of different concentrations of vinorelbine on apoptosis,telomerase activity and expression of human telomerase-reverse transcriptase gene (hTERT) in human epithelial ovarian cancer cells SKOV3.MethodsOvarian cancer cells SKOV3 were treated with vinorelbine under different concentrations. The cell proliferation was measured by cell counting kit- 8 (CCK- 8) assay, and the cell apoptosis was detected by flow cytometry. The telomerase activity of SKOV3 cells was determined by TRAP-PAGE-silver staining; The mRNA expression of hTERT was performed by RT-PCR assay.ResultsVinorelbine could significantly inhibited the proliferation of SKOV3 cells,induce cell apoptosis(P<0.01),reduce the telomerase activity and expression of hTERT mRNA(P<0.01), in dependent of a concentration-time manner.ConclusionsThe detection of telomerase activity and the mRNA expression of hTERT might be vital for predicting the prognosis of patients with epithelial ovarian cancer.
epithelial ovarian cancer; vinorelbine; apotosis;telomerase activity
2017- 08- 24
2017- 11- 17
*通信作者(correspondingauthor):76548265@qq.com
1001-6325(2018)01-0087-04
R711.75
A
