mTOR抑制剂雷帕霉素对肺癌LK2细胞的抑制作用
2017-07-31杜美琳
杜美琳,张 毅,白 雪,彭 扬,何 平
mTOR抑制剂雷帕霉素对肺癌LK2细胞的抑制作用
杜美琳,张 毅,白 雪,彭 扬,何 平*
目的 观察mTOR抑制剂雷帕霉素对肺癌LK2细胞生长的影响。方法 LK2细胞在0.25、0.5、1、2、4、8 μmol/L不同浓度的雷帕霉素组以及0 μmol/L雷帕霉素空白对照组作用下,采用MTT比色法检测细胞生长情况,流式细胞术检测细胞的凋亡改变。结果 雷帕霉素能够抑制LK2细胞增殖,且具有时间-剂量效应关系。流式细胞仪检测提示,雷帕霉素各浓度组均可以促进肺癌细胞LK2凋亡,且随着雷帕霉素浓度的升高,LK2细胞凋亡率逐渐增加。结论 雷帕霉素对肺癌LK2细胞有抑制作用。
雷帕霉素;mTOR抑制剂;LK2细胞;凋亡
0 引言
近年来,肺癌的发病率明显升高,其被临床诊断时,多为中晚期,生存率极低。其目前对于不能手术治疗的肺癌患者,其药物治疗的研究仍然需要进一步探讨。
哺乳动物雷帕霉素靶向蛋白(Mammalian target of rapamycin,mTOR)信号通路是影响肿瘤细胞增殖表达的作用靶点。雷帕霉素是mTOR抑制剂,虽然已有研究证明其对肿瘤细胞的抑制作用,但雷帕霉素对不同肿瘤细胞株可能产生不同的影响[1-2]。目前,对于雷帕霉素抑制肺癌LK2细胞株及其对细胞周期的抑制等方面研究报道仍然较少。本实验通过使用雷帕霉素作用于肺癌细胞株LK2,观察细胞的生长和周期变化状态,为抗肺癌药物的实际临床应用提供一些实验依据。
1 材料与方法
1.1 细胞与材料 人肺癌LK2细胞由中国医科大学细胞生物教研室提供。雷帕霉素购自上海纯优生物科技有限公司;胰蛋白酶购自以色列Biological Industries公司;四甲基偶氮唑蓝(MTT)购自Sigma公司;胎牛血清购自天津索莱宝生物工程有限公司。
1.2 实验方法
1.2.1 细胞的培养 复苏人肺癌LK2细胞株,采用含有10%胎牛血清的RPMI-1640培养基,在37 ℃下,体积分数比例为5%二氧化碳、饱和湿度的培养箱中培养LK2细胞。培养过程中严格遵守实验操作规范,避免污染。每隔3~4 d传代,弃去培养瓶中的陈旧培养基,使用0.25%胰蛋白酶进行消化,消化液充分接触瓶底细胞后,在显微镜下观察,待细胞的胞质回缩变圆,即弃掉消化液,使用PBS冲洗2次,加入含胎牛血清的培养基停止细胞继续被消化,用吸管轻轻吹打使细胞脱离培养皿壁且均匀分布后,分别装入其他培养瓶中,传代培养细胞至对数生长期。
1.2.2 MTT法检测LK2细胞增殖抑制率 消化并且收集对数增殖期肺癌LK2细胞,调整成浓度为1×105/mL的细胞悬液,接种于96孔的培养板,在培养板的每个孔中分别加入100 μL的细胞悬液,设置3个复孔,并设空白对照。接种的LK2细胞培养过夜后,在显微镜下认真观察确认LK2细胞的贴壁状态良好,弃去上清。实验组中加入稀释的雷帕霉素药物,使其在每个孔的最终浓度依次为0.25、0.5、1、2、4、8 μmol/L。实验另设含全培养基的空白对照以及未加入雷帕霉素作用的阴性空白对照。之后,培养板中的LK2细胞在恒定温度(37 ℃)下、饱和湿度、含5%二氧化碳的培养箱中继续培养,分别再继续培养24、48、72 h。每次在培养结束前4 h,MTT 20 μL加入到培养孔中,继续在37 ℃下孵育4 h,用吸管小心吸去上清,分别加入二甲基亚砜(DMSO)150 μL,振荡10 min,使药物混匀,终止反应后使用酶标仪,检测波长为570 nm的各孔光吸收值,计算细胞增殖抑制率。实验重复3次。按公式计算细胞增殖抑制率:抑制率=[1-加药组OD值/对照组OD值]×100%。
1.2.3 检测雷帕霉素作用下LK2细胞凋亡的程度 使用流式细胞仪(FCM)AnnexinV/PI双染法分析雷帕霉素诱导LK2细胞凋亡,将细胞以5×105接种于12孔板中,分别加入终浓度为1、4 μmol/L的雷帕霉素溶液,设空白对照组(加等量RPMI-1640培养基),于37 ℃、饱和湿度、5%二氧化碳的培养箱中培养,24 h后应用胰酶消化收集细胞,4 ℃、1 500 r/min离心5 min,更好地收集细胞、弃清培养基,且需冷PBS洗涤离心的细胞2次。用500 μL 1×Binding Buffer让细胞悬浮,形成浓度约为1×106/mL的细胞悬液。在悬浮细胞液中加入5 μL×AnnexinV-FITC轻摇混匀,再加入5 μL PI轻晃摇匀,于2~8 ℃避光条件下作用15 min。在1 h内应用流式细胞仪进行检测。结果应用Cellquest专业软件分析数据。每组实验重复3次。

2 结果
2.1 MTT检测雷帕霉素对LK2细胞增殖的影响 随着雷帕霉素作用浓度的增加和作用时间的延长,其对LK2细胞的增殖有明显的抑制作用,均呈现明显的时间-剂量效应关系(图1)。

图1 MTT检测雷帕霉素对LK2细胞增殖的影响
2.2 流式细胞仪AnnexinV/PI双染法检测药物诱导细胞凋亡 药物雷帕霉素作用24 h,随着浓度的增高,早期凋亡和晚期凋亡的细胞比例都逐渐增加,实验组与对照组相比差异具有统计学意义(P<0.05)(图2)。
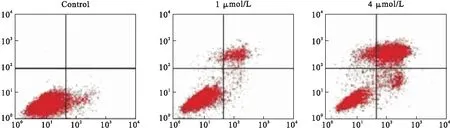
图2 流式细胞仪AnnexinV/PI双染法检测药物诱导细胞凋亡
3 讨论
雷帕霉素又称西罗莫司,1975年研究者从南太平洋的一座岛上的土壤中发现了能够产出雷帕霉素的吸水链霉菌,其产出的雷帕霉素具有大环内酯类结构,因此最初的雷帕霉素是被当作一种低毒性的抗生素,未引起重视。之后,由于雷帕霉素具有良好的免疫抑制活性,在1999年被美国食品药品监督管理局批准,作为器官移植排异反应抑制剂上市。随着对雷帕霉素的深入研究,研究者发现雷帕霉素具有抗肿瘤细胞增殖的作用,其在实验中使用雷帕霉素作用于喉癌细胞、乳腺癌细胞、肾癌细胞、膀胱癌细胞、骨肉瘤细胞等多种器官的肿瘤细胞,均提示有一定的肿瘤抑制作用[3-6],但效果不尽相同[7],且只有少数进入了临床前期试验[8]。本研究选用非小细胞肺癌细胞株LK2作为实验对象,观察分析雷帕霉素对肺癌细胞增殖的抑制作用,增加了雷帕霉素作用于肺癌的不同细胞株研究。本实验采取0.25~8 μmol/L不同浓度的雷帕霉素作用于LK2细胞,结果提示雷帕霉素可以抑制肺癌LK2细胞增殖,且抑制作用具有时间和剂量依赖性,为雷帕霉素治疗肺癌临床试验的开展提供了一定的数据基础。
雷帕霉素能够靶向阻断mTOR相关蛋白的表达,提示雷帕霉素可靶向抑制肿瘤细胞增殖[9]。已有研究表明,mTOR高度表达的肿瘤细胞多呈现为恶性肿瘤,正常细胞中mTOR亦可表达,但为低度表达,mTOR在肿瘤细胞发生发展中均有一定作用[10]。mTOR抑制剂不仅可以抑制癌细胞增殖、生长,还可以抑制肿瘤转移、减少肿瘤血管新生成[11-13],已成为研究的一个热点方向,因此,研究开发雷帕霉素的抗肿瘤作用、探讨其在肺癌治疗中的作用非常有意义[14]。mTOR与衰老疾病调节有关,是衰老过程中的调节因子,主要与mTOR信号通路在细胞内稳态维持的功能有关[15]。mTOR信号通路异常引起的细胞增殖、肿瘤生长和细胞代谢的过程复杂[16],细胞通过自噬作用维持细胞的内稳态,mTOR包括2种复合物:mTORC1、mTORC2,其中,mTORC1可以调节细胞增殖、生长和自噬等过程[17],雷帕霉素则通过影响mTOR通路中的mTORC1[18],诱导自噬作用的发生,使细胞维持细胞内稳态、抑制肿瘤细胞的增长,成为研究抗癌和延长正常细胞寿命的一个要点。但雷帕霉素在治疗过程中存在不良反应,如免疫抑制作用和延迟发育等[19]。雷帕霉素已作为免疫抑制剂应用于临床,其抑制作用良好,因此,如何使其在抗癌过程中避免或产生最小不良反应,同时选择合适的应用剂量,仍需要更多的实验数据观察探索。
综上所述,雷帕霉素可以抑制肺癌LK2细胞,本研究为探讨雷帕霉素在不同肿瘤细胞中及肺癌不同细胞株抗瘤效果的差异提供了参考,为针对治疗肿瘤设计用药方案提供了实验依据。
[1] Vignot S,Faivre S,Aguirre D,et al.mTOR-targeted therapy of cancer with rapamycin derivatives[J].Ann Oncol,2005,16(4):525-537.
[2] Noh WC,Mondesire WH,Peng J,et al.Determinants of rapamycin sensitivity in breast cancer cells[J].Clin Cancer Res,2004,10(3):1013-1023.
[3] Heuer M,Benk T,Cicinnati VR,et al.Effect of low-dose rapamycin on tumor growth in two human hepatocellular cancer cell lines[J].Transplant Proc,2009,41(1):359-365.
[4] 陈斌,顾蔚卿,倪健.雷帕霉素联合缺氧诱导肺腺癌A549细胞凋亡及分子机制[J].肿瘤,2010,30(4):293-297.
[5] 刘添文,张北平,赵小青,等.miR-143在mTOR大肠癌发生发展中的作用及其机制[J].实用医学杂志,2016,32(2):192-195.
[6] 劳海黎,李霞,王海珍,等.乳腺癌组织中mTOR/p70S6K信号通路表达及临床意义[J].中国临床实用医学,2016,7(2):50-53.
[7] Fasolo A, Sessa C.mTOR inhibitors in the treatment of cancer[J].Expert Opin Investig Drugs,2008,17(11):1717-1734.
[8] Hudes G,Carducci M,Tomczak P,et al.A phase 3,randomized,3-arm study of temsirolimus (TEMSR) or interferon-alpha (IFN) or the combination of TEMSR + IFN in the treatment of first-line,poor-risk patients with advanced renal cell carcinoma (adv RCC)[J].Prec Am Soc Clin Oncol,2006,24:2.
[9] 白波,马梁明,鹿育晋,等.雷帕霉素靶蛋白抑制剂PP242对急性T淋巴细胞白血病Jurkat细胞株增殖的影响[J].中国医药,2015,10(4):520-522.
[10]Ellis L,Ku SY,Ramakrishnan S,et al.Combinatorial antitumor effect of HDAC and the PI3K-Akt-mTOR pathway inhibition in a Pten defecient model of prostate cancer[J].Oncotarget,2013,4(12):2225-2236.
[11]Efeyan A,Sabatini DM.mTOR and cancer:many loops in one pathway[J].Curr Opin Cell Biol,2010,2(2):169-176.
[12]康晓明,白莉,梅梅,等.雷帕霉素对大鼠肾间质纤维化中肝细胞生长因子、转化生长因子-β及中性粒细胞明胶酶相关载脂蛋白表达的影响[J].中国小儿急救医学,2015,22(11):775-779.
[13]徐涛,赵娜,安娜,等.针刺对缺氧缺血性脑病模型大鼠哺乳动物雷帕霉素靶蛋白的干预研究[J].中国小儿急救医学,2016,23(1):28-32.
[14]Petroulakis E, Mamane Y, Le Bacquer O.mTOR signaling:implications for cancer and anticancer therapy[J].Br J Cancer,2006,394(2):195-199.
[15]Robida-Stubbs S,Glover-Cutter K,Lamming DW,et al.Tor signaling and rapamycin influence longevity by regulating skn-1/ nrf and daf-16/ foxo[J].Cell Met,2012,15(5):713-724.
[16]Petroulakis E,Mamane Y,Le Bacquer O,et al.mTOR signaling:implications for cancer and anticancer therapy[J].Br J Cancer,2006,94(2):195-199.
[17]Tasian SK,Teachey DT,Rheingold SR.Targeting the PI3K/mTOR pathway in pediatric hematologic malignancies[J].Front Oncol,2014,4:108.
[18]Mohammed A,Janakiram NB,Brewer M,et al.Antidiabetic drug metformin prevents progression of pancreatic cancer by targeting in part cancer stem cells and mTOR signaling[J].Transl Oncol,2013,6(6):649-659.
[19]Gonzalez D,Garcia CD,Azocar M,et al.Growth of kidney-transplanted pediatric patients treated with sirolimus[J].Pediatr Nephrol,2011,26(6):961-966.
Inhibitory effects of rapamycin on lung cancer LK2 cells
DU Mei-lin,ZHANG Yi,BAI Xue,PENG Yang,HE Ping*
(Department of Geriatric Medicine,Shengjing Hospital of China Medical University,Shenyang 110004,China)
Objective To observe the effect of rapamycin on the growth of LK2 cells in lung cancer.Methods LK2 cells were evaluated by MTT assay and flow cytometry to detect their growth and apoptosis in different concentrations of rapamycin groups and blank control group.Results Rapamycin could inhibit the proliferation of LK2 cells and had a time-dose effect relationship. Flow cytometry result showed that the apoptosis ratio of LK2 cells increased with the increase of rapamycin concentration in the experiment.Conclusion Rapamycin has an inhibitory effect on lung cancer LK2 cells.
Rapamycin;mTOR inhibitor;LK2 cells;Apoptosis
2017-04-10
中国医科大学附属盛京医院老年病科,沈阳 110004
盛京自由研究者计划(201205)
10.14053/j.cnki.ppcr.201707003
*通信作者
