“食盐中碘元素含量测定的实验探究”的教学设计与反思
2017-07-31孟静
孟 静
“食盐中碘元素含量测定的实验探究”的教学设计与反思
孟 静
以碘酸根的氧化性为基础,结合氧化还原滴定法的实验原理,引导学生设计测定食盐中碘元素含量的实验步骤,使学生通过自主实验得出数据并进行具体分析。在实验设计和探究过程中,学生能够认识学科知识发展逻辑,体验科学探究的过程及提升科学思维能力。
碘含量测定 实验探究 氧化还原滴定
滴定法以其操作简便、准确度高等优点在分析检测中被普遍应用。其中,酸碱滴定原理易懂,操作易掌握,因此,沪科版《化学 高中二年级第一学期(试用本)》以酸碱滴定为例来介绍滴定法。但笔者在教学实践中发现,学生在学习滴定法时往往只局限于酸碱滴定,对其他滴定方法知之甚少,甚至一无所知。而且对于高二学生来说,根据物质性质设计定量实验是学习的难点。故笔者基于“食盐中碘元素含量测定的实验探究”内容设计了这节拓展课,帮助学生学习氧化还原滴定的原理和方法,体验物质性质与定量测定的内在联系。
一、教学思路设计
本节课是一节拓展实验课。从教学内容层面分析,该节课涉及碘单质、碘离子、碘酸根的化学性质,氧化还原原理和定量测定实验等知识内容,学科认知难度较大;从教学实践层面分析,该节内容属于教材第十章“学习几种定量测定方法”单元[1]。以往教学中通常较为关注对定性和定量测定的实验步骤和实验装置的探究,相对弱化了元素化合物性质与化学实验知识之间的有机联系,从而造成部分学生在学习过程中将实验操作与实验原理割裂,给学习带来困难。
此外,考虑到高二学生处于将学习过的元素化合物基本知识与化学实验有效整合的关键时期,虽然知识储备丰富,但在实验设计、探究等方面的能力还有待提高。笔者尝试以碘及其化合物的性质为突破口,逐步深入开展食盐中碘元素含量的探究。具体设计思路如图1所示。

图1 食盐中碘含量测定设计思路
二、教学目标设计
高中化学课程指出要进一步提高学生的科学素养,激发学生学习化学的兴趣,促进学生的个性发展;提高学生的科学探究能力;形成科学的价值观和实事求是的科学态度;激发学生的创新潜能,提高学生的实践能力[2]。根据这一要求并结合教学实践,本文从课程标准的三维目标出发设计了本节课的教学目标,具体内容如表1所示。

表1 三维目标设计
三、教学过程设计
(一)图片展示碘元素的重要作用,引入课题
介绍碘元素对生活和生理的重要作用,指出市售食盐中加入碘元素的意义,引出教学主题——食盐中碘元素的含量测定。
运用PPT展示的方法与学生一起体会加碘盐的重要性,启发学生对本课题的学习兴趣,激发学生学习的积极性。讲解简短,但内容能有效引发学生的思考,是课堂能顺利开展的良好基础。
(二)开展系列实验,检验市售食盐中碘元素的存在形式
要进行物质定量测定,须先掌握物质的性质,从物质的性质入手选择合理的实验试剂和方法,设计合理的实验方案。
本节课通过习题1,请学生自主设计实验过程,观察实验现象,得出正确的结论:食用盐中的碘元素以IO3-形式存在。
习题1:加碘食盐中碘元素的存在形式主要为( )
A.I2
B.I-
C. IO3
实验设计如表2所示。
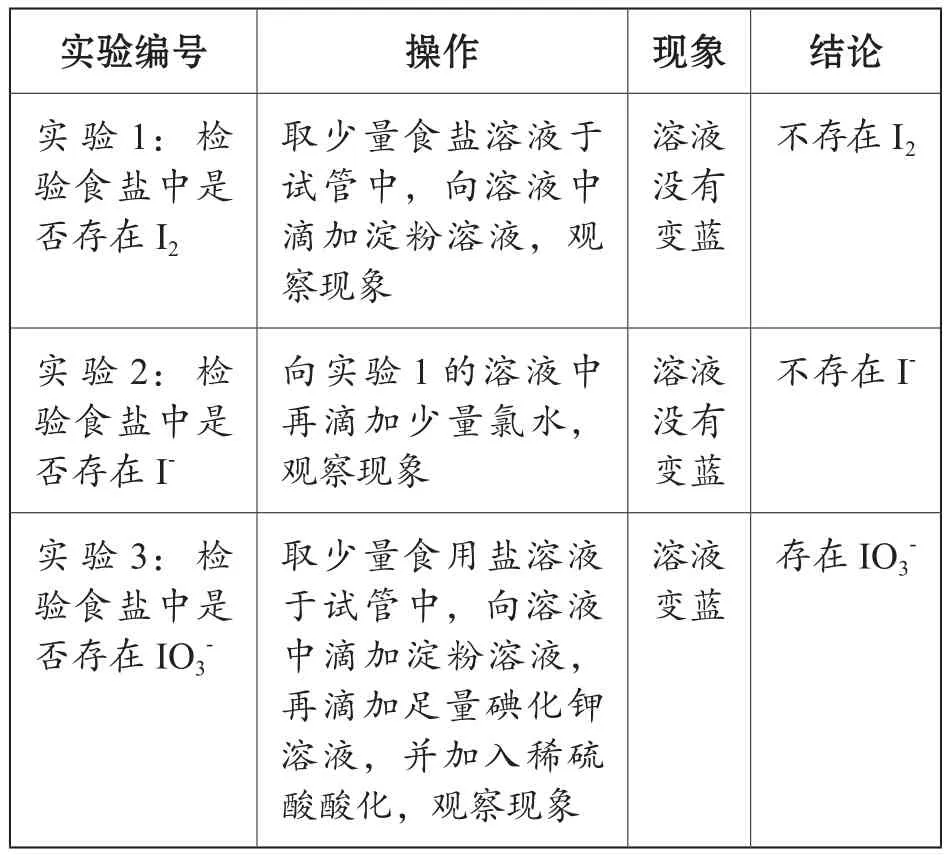
表2 实验设计
学生利用已经学习过的碘及其化合物的化学性质,通过科学的实验操作,观察实验现象,获得实验结论。学生在观察现象的同时,思考反应原理,并在此基础上了解IO3-的氧化性。
(三)利用物质化学性质,设计定量测定方法
食用盐中加入一定量的碘酸钾,是为了满足人体对碘的需要。但值得注意的是,人体摄入过多的碘也是有害的。因此,相关国家标准中规定了食用盐中碘含量的平均水平(以碘元素计)为20—30mg/kg。
基于上述标准,教师可以接着提出问题:“如何测定市售食盐中碘元素的含量?”并且,在教材第十章“学习几种定量测定的方法”中,学生已经学习过酸碱滴定是通过测定溶液完全反应时消耗的体积从而得到定量结果的方法,被称为“滴定法”。基于此教师可以进一步追问“滴定法只适用于酸碱中和反应吗?”促使学生运用IO3-的氧化性和离子反应相关知识,思考用滴定法定量测定碘元素含量的方法。
1.实验原理
先在一定量食盐样品中加入略过量硫酸酸化的碘化钾溶液,把碘酸钾中的碘元素还原为碘分子,再用硫代硫酸钠溶液滴定生成的碘分子即可。
滴定实验的关键,一是正确判断滴定的终点;二是准确测定液体的体积[3]。本实验是用标准液硫代硫酸钠溶液滴定待测液中的碘单质,选择淀粉溶液为指示剂,当待测液恰好由蓝色变为无色,且充分振荡溶液不变蓝时即到达滴定终点,此时准确记录消耗的标准液体积。
本实验利用IO3-的氧化性和I2的显色反应,在巩固滴定法原理和操作的基础上,进一步培养学生的思维能力,使其更深入地思考和分析物质的定量测定,学科知识的认知得到升华。
2.实验步骤
①称量:称量约10g食盐于250mL锥形瓶中,并记录准确的质量数值。
②溶解:加入约50mL蒸馏水使其完全溶解。
③还原:用2mL稀硫酸酸化上述溶液,并加入5mL碘化钾溶液,使其与KIO3充分反应。
④滴定:以1mL淀粉溶液为指示剂,用5.4×10-4mol/L的Na2S2O3溶液滴定,当溶液恰好由蓝色变为无色,且充分振荡不变蓝时,记录所用Na2S2O3溶液的体积。
⑤重复上述操作进行第二次实验。
⑥实验结果:两次实验平均值为________。
⑦实验误差:本实验所用食用盐中碘元素含量的理论值为15mg/kg,则实验误差________。
依据滴定实验的基本操作方法,利用实验原理设计碘元素的定量测定实验活动,培养了学生设计实验的意识和能力。
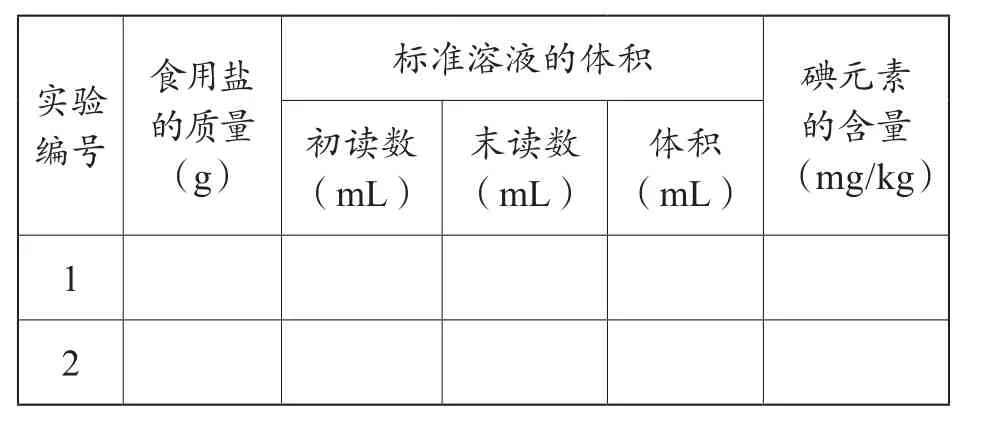
表3 实验记录
3.误差分析
任何定量测定的方法,得到的数据都有一定的精确范围,或者说存在一定误差。教师应引导学生针对实验结果,思考误差的产生原因,并与同学讨论采取什么方法能尽量减小实验误差,体会在定量测定中,正确操作、准确读数和记录的意义。在此过程中,学生感受到定量实验的“准确性”,理性思维品质得到提升。
(四) 课堂总结,突出核心内容
滴定法定量测定实验的一般设计思路为:明确测定物质的性质→根据已有知识,结合查阅的资料,确定有关反应所需测定的物理量以及计算方法→选择标准液和指示剂→预计实验操作可能产生的问题,设想采取的措施→讨论实验结果,进行误差分析。
(五) 作业布置,突出探究思想
笔者设计了两个不同性质、不同要求的作业:①完成本实验的实验报告,并做出符合实际情况的误差分析;②查阅资料,结合所学知识,设计实验测定空气(内含N2、O2、CO2、SO2)中二氧化硫的体积分数。
作业充分挖掘教材资源,来源于教材,又高于教材。通过资料查阅,拓展学生视野,进一步提高学生学习化学的兴趣,加强探究方法的实践应用。
四、教学反思
本课设计源于教材,又是对教材内容的拓展应用。这节课密切结合学生已有的知识经验,让学生基于熟悉的化学性质思考实验原理,在已有的实验操作基础上设计实验步骤,获得实验结果,并做出合理的误差分析。本节课利用3个定性实验逐步展开,到氧化还原滴定达到高潮,归纳出滴定法实验设计的一般思路,提高学生的科学素养和思维能力。
本课设计紧扣实验中碘元素含量测定这一主线,层层递进,为学生思维品质的提升和问题解决能力发展奠定了基础。
[1] 姚子鹏. 化学 高中二年级第一学期(试用本)[M]. 5版. 上海:上海科学技术出版社,2011.
[2] 中华人民共和国教育部. 普通高中化学课程标准(实验)[M]. 北京:人民教育出版社,2003.
[3] 姚子鹏. 化学 拓展型课程(试用本)[M]. 上海:上海科学技术出版社,2013:209.
孟 静 华东师范大学第二附属中学 201203
