骨肉瘤患者外周血单个核细胞m icroRNA-21与骨肉瘤组织中K i-67表达水平检测及其临床价值
2017-07-31宋魏张建波马杰于庆凯
宋魏,张建波,马杰,于庆凯*
(郑州大学附属肿瘤医院1病理科,2分子病理科,郑州450000)
骨肉瘤患者外周血单个核细胞m icroRNA-21与骨肉瘤组织中K i-67表达水平检测及其临床价值
宋魏1,张建波2,马杰1,于庆凯1*
(郑州大学附属肿瘤医院1病理科,2分子病理科,郑州450000)
目的探讨外周血单个核细胞中m icroRNA-21(m iR-21)水平和组织中Ki-67表达在骨肉瘤发展中的临床价值。方法采用RT-qPCR法检测120例骨肉瘤患者、80例骨软骨瘤和70例正常健康人群miR-21的表达水平,应用免疫组织化学技术检测Ki-67表达,采用受试者工作特征曲线(ROC)分析m iR-21对骨肉瘤的诊断价值。结果m iR-21在骨肉瘤患者外周血中的表达显著高于正常人群,miR-21表达与临床分期、术后复发、转移有关,而与年龄、性别、病理类型、病变部位均无关。m iR-21的ROC曲线下面积为0.858,敏感度和特异度分别为91.89%和79.61%。Ki-67在骨肉瘤组织中的免疫组织化学表达水平明显高于骨软骨瘤和正常人群组织。结论miR-21和Ki-67的表达水平与骨肉瘤的发生发展相关,外周血miR-21水平和Ki-67表达检测可增强对骨肉瘤的发生发展的预测能力。
microRNA-21;Ki-67;骨肉瘤;骨软骨瘤;外周血单个核细胞;临床分期;转移
骨肉瘤是一种恶性程度高的原发性肿瘤,其特点是癌细胞直接形成骨样组织。骨肉瘤大多发生在10~25岁人群,男性发病率高于女性;其发病部位多处于骨端,偶尔发生在骨干或骨骺[1]。即使现在治疗方式增多,如化疗、保守治疗、截肢术、其他治疗等,但其存活率或修复率仍是不理想[2]。由于骨肉瘤发病率的成倍增加,患者一般可以活15个月至5年,常伴随引发的并发症有心脏病、肺病、糖尿病、和病理骨折;术后极易出现肺部转移,即使截肢,患者3~5年存活率仅为5%~20%,预后非常不理想[3]。外周血单个核细胞包括淋巴细胞和单核细胞,多用密度梯度离心法提取需要成分[4]。M icroRNAs(miRNAs)是一类存在于真核生物的非常常见和广泛的非编码单链RNA分子,在细胞内具有多种调节作用,如细胞增殖、细胞凋亡、以及程序性死亡等[5,6];其通过参与转录后基因表达调控,提供了新的基因表现调控方式。既往研究已证实,m iRNAs在研究疾病发病机制中的重要作用[7,8]和优势,其性质稳定,可抗热、抗酸碱等物理化学变化[9]。m iRNAs与肿瘤相关进程有着密切联系,起着促癌或者抑癌基因的作用,有望成为早期肿瘤诊断的分子标识物[10,11]。m icroRNA-21(m iR-21)是一种在肿瘤癌症中有着高表达的小RNA分子。人类m iR-21定位于染色体17q23.2区,常起着促癌作用[12,13]。直接抽取外周血获得实验标本,操作简便、快速且无侵[14];同时鉴于骨肉瘤的恶性程度和不良预后,研究外周血单个核细胞中m iR-21在骨肉瘤临床诊断中有重要价值。本研究通过对外周血单个核细胞进行分离检测的方法,分析m iR-21在骨肉瘤发生发展中的作用及其对骨肉瘤的诊断价值。
材料与方法
1 研究对象
在2011年12月至2013年12月期间,收集郑州大学附属肿瘤医院收治的120例原发性骨肉瘤患者手术切除的骨肉瘤标本。所有病例均经临床病理和影像学检测确诊,并经HE染色进一步验证骨肉瘤,均接受手术治疗。本研究病例纳入标准:①入院确诊,原发性骨肉瘤患者;②无任何针对肿瘤细胞的治疗史;③病变部位集中,为四肢骨骼。病例排除标准:①继发性骨肉瘤,或有严重疾病史,包括重要脏器功能衰竭,代谢性骨病,良恶性肿瘤等等;②接受既往肿瘤治疗方案,或正在接受治疗者;③妇女正在生育或哺乳期间;④患者临床资料缺失,无法配合完成随访者。120例骨肉瘤患者中,男性78例,女性42例,年龄9~48岁,中位年龄20岁,男女比例1.86:1。病理分型依据WHO骨肉瘤分类[15],共分为2类,其中普通型骨肉瘤纳入患者92例,其他类型28例。按照Ennecking外科分期法[16],临床分类为Ⅰ期18例,ⅡA期33例,ⅡB期42例,Ⅲ期27例。病变部位:胫骨上端44例,股骨下端62例,其他部位14例。另外,91例骨肉瘤患者发生转移,其中肺转移患者58例。收集80例骨软骨瘤标本作为对照研究,选自本院病理科同期手术切除的骨软骨瘤标本。其中男性52例,女性28例,年龄9~50岁,中位年龄20岁,男女比例1.86:1。收集70例同期本院来源于非肿瘤患者的新鲜正常骨组织标本和外周血标本作为健康对照,男性55例,女性25例,年龄8~50岁,中位年龄19岁,男女比例1.80:1。病例组和对照组年龄和性别差异无统计学意义。
2 血液样本制备及总RNA提取
用EDTA-K2 抗凝管采集所有的研究对象外周血3~5m l,1600g离心10m in后,将上层血浆小心转移到洁净的离心管中,再以13300g离心10min,除去所有的细胞碎屑等污染物,吸取上层血浆于洁净的离心管,置于-80 ℃冻存备用。取500μl血浆于1.5m l离心管中,75 ℃加热5m in,42 ℃温育1h。按照Invitrogen的Trizol 试剂盒说明书进行RNA提取,用NanoDrop 1000(Thermo Scientif c, America) 检测RNA浓度,并读取在260/280 nm处吸收值,此值介于1.8~2.0之间。将RNA保存在-80 ℃备用。
3 实时荧光定量PCR检测
依据RNA 逆转录试剂盒说明(TaKaRa 公司)建立本实验所需的逆转录体系(总含量为20μl),将配制好的反应试剂振荡混匀后置于PCR 反应仪(Step OneTM, APPlied Biosystems公司,美国),经逆转录(37℃ 30m in,85 ℃15s),获取合成cDNA模板。产物低温(-20℃)保存备用。随后,以逆转录合成的cDNA作为模版,进行PCR扩增。RT-qPCR反应条件为95 ℃ 10m in,95 ℃15s,60 ℃20s,72℃20s,40个循环(各基因的上下游引物如表1所示)。随后,取PCR反应产物10μl在1%琼脂糖凝胶上电泳。经琼脂糖凝胶电泳显示目的条带,采用凝胶成像仪(Bio-Rad公司,美国)对电泳凝胶图谱进行观察拍照,并保存电泳条带类型,依据电泳后条带亮度的强弱判断表达量高低。荧光定量PCR总反应体系为20 μl:1.3μl cDNA模板,1μl m iR-21(U6)特异性引物,10μl TaqMan Universal PCRmaster M ix (ABI),7.7μl H2O。所有反应均设立3个复孔。记录每个反应管中标本的CT值,实验结果采用定量PCR中的相对定量法进行分析用2-△△Ct表示病例组织相对于健康对照组织相对表达量的变化倍数,其中ΔΔCt= (CTmiR-21-CTU6)病例组织-(CTmiR-21-CTU6)健康对照组织。SPSS 21.0统计软件计算各组目的基因相对表达量并绘制柱状图。

表1 m iR-21及U6 的RT-qPCR引物Tab. 1 RT-qPCR primers of m iR-21 and U6
4 免疫组织化学染色
组织样本收集后,用酒精(福州迈新生物技术开发有限公司)梯度脱水,二甲苯(福州迈新生物技术开发有限公司)透明,石蜡(福州迈新生物技术开发有限公司)包埋、切片。切片在烤箱中烤片1 h后浸入二甲苯脱蜡、酒精入水,pH6.0柠檬酸盐缓冲液进行高压抗原修复,随后在室温冷却,PBS冲洗3次。加入鼠抗人Ki-67单克隆抗体(即用型;北京中杉金桥生物技术有限公司)孵育过夜,PBS冲洗3次(2m in/次),生物素标记的兔抗小鼠IgG(1:1000;北京中杉金桥生物技术有限公司)室温孵育1 h,辣根过氧化物酶标记的链霉卵白素工作液孵育37℃30m in,PBS冲洗,加DAB液(北京中杉金桥生物技术有限公司),苏木素复染,反蓝,梯度酒精脱水,最后进行二甲苯透明,以中性树胶(福州迈新生物技术开发有限公司)封片,显微镜下观察。实验过程以PBS代替一抗作为空白对照。
结果判定:Ki-67阳性染色主要定位细胞核,选取任意5个高倍镜视野,按所选视野阳性细胞占比计数,用平均值定义阳性细胞百分比为评定标准,以阳性细胞数>25%定义阳性。同时,应用Image-Pro Plus6.0分析系统对Ki-67标记的切片标本随机选取5个图像,测定积分光密度,取平均值为相对表达量,以此作为进行Ki-67的定量分析。
5 统计学方法
m iR-21相对表达量及Ki-67积分光密度以均数±标准差表示,阳性表达率以及其他计数资料以百分比表示。使用SPSS 21.0统计软件对比分析(组间均数t检验,多组间方差分析);应用受试者工作曲线(ROC)分析m iR-21对骨肉瘤的诊断价值,并计算对应曲线下面积,以及敏感度和特异度。P < 0.05为差异有统计学意义。
结 果
1 骨肉瘤患者外周血单个核细胞中m iR-21水平增高
通过实时荧光定量PCR检测发现,骨肉瘤患者、骨软骨瘤患者及健康对照组外周血中miR-21相对表达量2-ΔΔCt分别为1.43±0.10、1.02±0.07和0.67±0.08,骨肉瘤患者外周血中m iR-21相对表达量显著高于骨软骨瘤组和健康对照组,且骨软骨瘤组水平较健康对照组高(图1)。
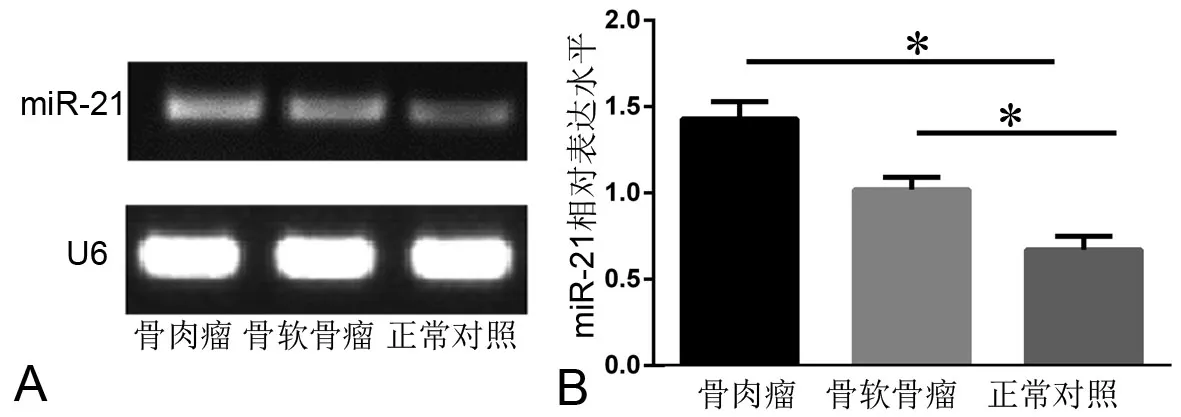
图1 骨肉瘤和骨软骨瘤患者与正常人外周血单个核细胞中m iR-21表达水平的PCR检测。A,凝胶电泳检测;B,定量PCR检测结果的统计学分析;*,0.01<P< 0.05Fig. 1 PCR detection of the level of miR-21 in peripheral blood mononuclear cells in osteochondroma patients, osteochondroma patients and healthy controls. A, detection by gel electrophoresis; B, statistical analysis of qPCR results; *, 0.01<P < 0.05
2 m iR-21水平与临床分期、术后复发、转移呈正相关
m iR-21相对表达量与骨肉瘤临床病理特征的关系见表2。miR-21在有转移、术后复发患者中的相对表达量显著高于无转移患者,临床分期IIB+III期患者m iR-21相对表达量亦显著高于I+IIA 期患者,但m iR-21相对表达量的高低与骨肉瘤患者的年龄、性别、病理类型、病变部位无关。
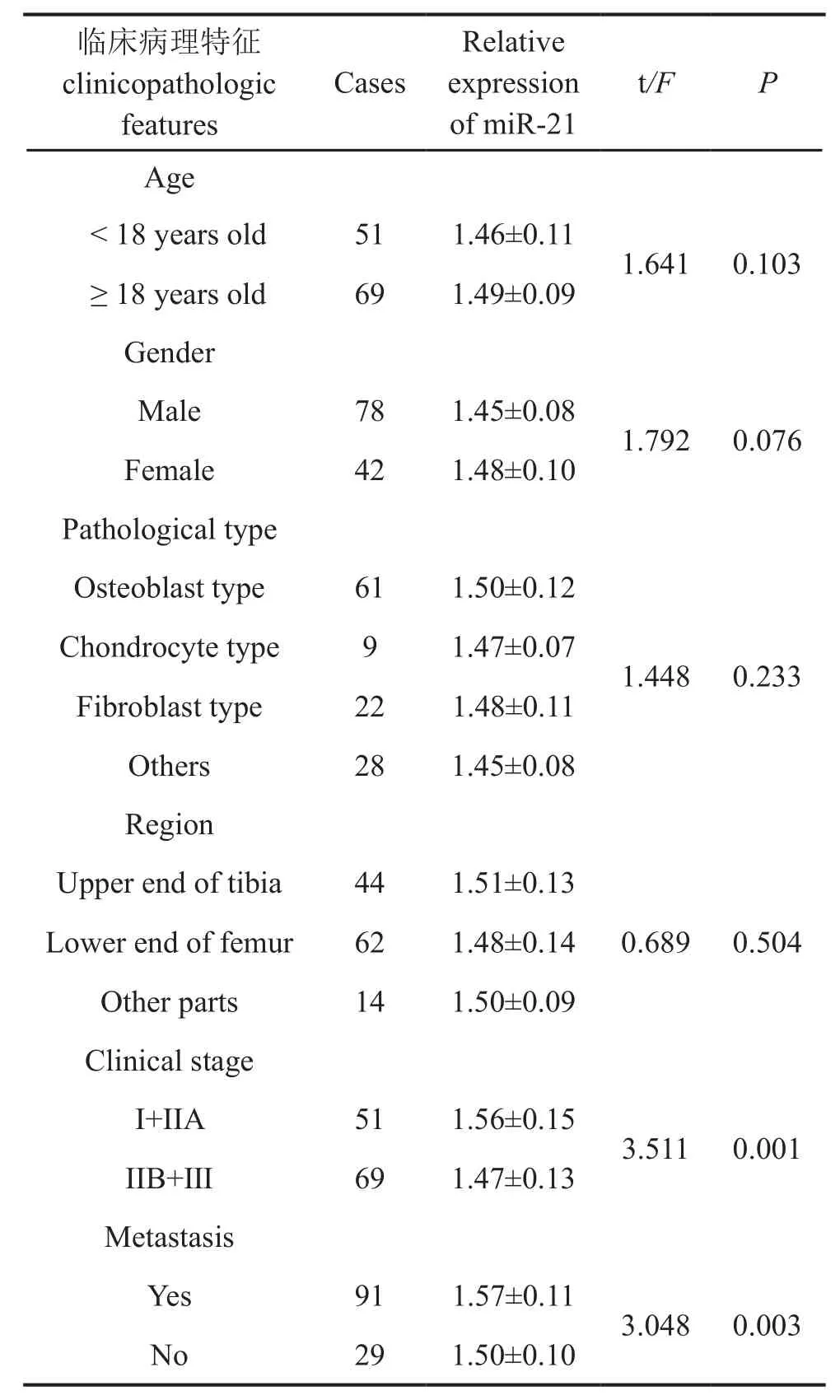
表2 M iR-21相对表达量与骨肉瘤患者临床病理特征的关系Tab. 2 The relationship between the relative expression of M iR-21 and the clinicopathological features of osteosarcoma
3 m iR-21在骨肉瘤诊断中的价值
以正常人群外周血m iR-21相对表达量为对照组,与骨肉瘤外周血m iR-21相对表达量进行ROC曲线分析(图2),m iR-21的曲线下面积为0.858,95%可信区间(95%CI)为0.805~0.910(P < 0.001),敏感度和特异度分别为91.89%和79.61%。
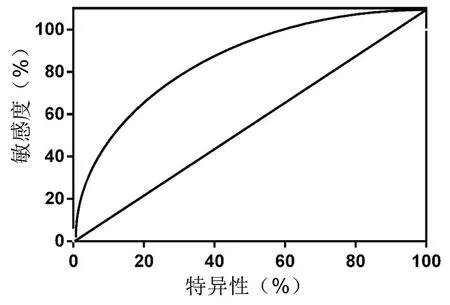
图2 m iR-21表达诊断骨肉瘤的ROC曲线Fig. 2 ROC curve of miR-21 expression in the diagnosis of osteosarcoma

图3 骨肉瘤(A)和骨软骨瘤(B)组织与正常人(C)骨组织中Ki-67表达的免疫组织化学检测。比例尺,20μmFig. 3 Immunohistochem ical detection of Ki-67 expression in (A) osteosarcoma, (B) osteochondroma and (C) normal bone tissue. Scale bar, 20μm
4 骨肉瘤中K i-67免疫反应性增强
Ki-67阳性染色主要表达于细胞核中,细胞质无明显着色,其阳性出现黄色、棕褐色大小不等的颗粒分布并明显高于背景着色为阳性(图3)。在120例骨肉瘤组织中,Ki-67的阳性表达99例,阳性率为82.50%,其中强阳性(+++)表达为24例,中度阳性(++)表达为48例,弱阳性(+)表达有27例,阴性(-)表达21例。骨软骨瘤组织中表达阳性率为32.50%,阳性表达26例,阴性表达54例。而在正常骨组织中,阳性表达为6例,阳性率为8.57%,其中仅6例为弱阳性,其余均为阴性表达。Ki-67在骨肉瘤组织中的表达明显高于骨软骨瘤和正常骨组织,骨软骨瘤组织中的表达高于正常骨组织。
应用Image-Pro Plus6.0分析系统对Ki-67免疫性强度分析显示,骨肉瘤组织、骨软骨瘤组织中及正常对照组织的积分光密度值分别为(38.21±6.23)、(35.55±5.40)和(27.96±4.68),骨肉瘤和骨软骨瘤组织积分光密度值均高于正常对照骨组织,且差异具有统计学意义(骨肉瘤vs.正常对照:t=13.15,P<0.001;骨软骨瘤vs.正常对照:t=10.62,P<0.001),且骨肉瘤组织的Ki-67积分光密度亦高于骨软骨瘤组织,具有显著性差异(t=3.226,P=0.015)(表3)。

表3 骨肉瘤和骨软骨瘤组织与正常人骨组织中Ki-67表达的阳性率比较Tab. 3 Com parison of the positive rates of K i-67 expression in osteosarcoma, osteochondroma and normal bone tissue
讨 论
骨肉瘤在原发性恶性肿瘤中发病率常位居首位,对患者生命质量安全影响重大,需高度重视。在现有一系列治疗方法之上,更多可以提前采取预防措施,普及相关的知识,少年若是发现膝关节周围无明显外伤的疼痛时,早期出现持续性疼痛后,应及时检查预防[3,6]。同时,近年来m iRNAs在生命进程中扮演的角色逐渐凸显,其在生物发育和生理活动中的调控功能也逐渐明朗,针对m iRNAs的研究成为当前热点之一。M iRNAs是在各类小分子RNA中基因调节功能最为明显的一类,其在正常和病理样本中水平差异明显,不同临床阶段的同一检测样本,其表达也不同[9,11],提示m iRNAs可作为疾病监测指标,也能为后期诊疗研究提供一定依据。现阶段,针对骨肉瘤及其肺转移等其他并发症,在原有的治疗方式上,开展了免疫基因治疗、反义基因治疗、抑癌基因治疗等新型方法[17]。而m iR-21在肿瘤中常起着促癌基因的作用[13],因此,本研究通过探讨分析纳入研究对象外周血m iR-21表达水平和组织Ki-67表达与骨肉瘤的相关关系,对于骨肉瘤的临床诊疗有很重大意义。
本研究采用密度梯度离心法对从研究对象采集的外周血单个核细胞进行分离,运用实时荧光定量PCR方法对m iR-21进行检测分析[18]。实时荧光定量 PCR具有高度的特异性和敏感性及相对费用低的优点,是包括m iRNAs在内的核酸定量检测的金标准[19]。本实验提示外周血m iR-21的表达水平与骨肉瘤的发生发展相关,外周血单个核细胞中的m iR-21水平可作为骨肉瘤患者的诊断指标。目前主要影响骨肉癌发病率的主要因素有p53和Rb抑癌基因异常、转录调节因子活化蛋白-1、原癌基因、m iRNAs失调等;而在骨肉瘤转移过程中,转移和入侵肿瘤细胞从原发肿瘤上分离,进入血流后,经过转染,从而形成转移性骨肉瘤[20,21]。m iR-21作为一组非编码RNA的组合,参与调控基因表达,并在多种肿瘤中扮演着促癌基因的作用。孙腾龙在研究中提到,在多发性骨髓癌(MM)中,m iR-21在MM患者中的表达水平要高于正常健对照组,与细胞增殖、化疗和疾病预后治疗有着密切联系[22]。通过调节miR-21在骨肉瘤细胞中的表达水平来研究细胞的变化与miR-21的关系,上调m iR-21表达水平后,细胞生长增殖能力加强,而下调m iR-21表达水平后,细胞增殖能力受到抑制;在转染m iR-21抑制剂后,发现其能抑制细胞增殖;进一步说明了m iR-21是骨肉瘤细胞侵袭的重要因子,m iR-21的失调是骨肉瘤发病因素之一[20,23];吴夕在对人甲状腺乳头状癌细胞(PTC)研究中提到,m iR-21在PTC组织中的表达远高于癌旁正常组织,转染后的m iR-21细胞凋亡率明显增加;吴子宴在研究中提到,转染m iR-21后,细胞凋亡明显增加,说明转染后的m iR-21可有效抑制m iR-21的致癌作用,反之,说明m iR-21有促进癌细胞发散的作用,以上均表明外周血m iR-21与骨肉瘤的发生有着相关作用[12,24]。与此同时,以健康正常组为对照组,与骨肉瘤外周血m iR-21水平结果做ROC曲线分析,m iR-21曲线下面积为0.858,95%CI为0.805~0.910,关联度高,表明在骨肉瘤中,m iR-21可以作为骨肉瘤患者的诊断指标,呈现高表达的m iR-21常伴随骨肉瘤细胞转移和较高的临床分期,提示miR-21外周血水平的检测可用于预判骨肉瘤的发展趋势及临床病理特征的严重程度。同时,为进一步确定影响骨肉瘤的重要生物标记,我们关注了Ki-67表达在骨肉瘤中的变化。免疫组织化学染色结果显示Ki-67阳性表达率有助于区分恶性骨肉瘤、良性骨软骨瘤和正常人群,该结果提示作为细胞增殖相关抗原[25],Ki-67的检测有助于预测骨肉瘤发展。
[1] 赵亚恒,冯和林,郑丽华,等. 骨肉瘤发病机制的研究进展. 肿瘤防治研究,2014,41(3):283-286.
[2] Wang WG, Wan C, Liao GJ. The ef cacy of high-dose versus moderate-dose chemotherapy in treating osteosarcoma: a systematic review and meta-analysis. Int J Clin Exp Med, 2015, 8(9): 15967.
[3] 胡涂,杨庆诚,程冬冬. 骨肉瘤转移侵袭机制研究进展.中国骨与关节杂志,2015,4(1):41-44.
[4] de Mello VD, Kolehmanien M, Schwab U, et al. Gene expression of peripheral blood mononuclear cells as a tool in dietary intervention studies: What do we know so far? Mol Nutr Food Res, 2012, 56(7): 1160-1172.
[5] 程冬冬,杨庆诚. M icroRNA与骨肉瘤研究进展. 医学综述,2013,19(11):1967-1970.
[6] 荆玉龙,吕智. 微RNA在骨肉瘤中的研究进展. 肿瘤研究与临床,2016,28(9):638-641.
[7] 禹欢欢,王晓华,蔡碧珊,等. 银屑病相关miRNAs表达的研究进展. 皮肤性病诊疗学杂志,2015,22(3):258-260.
[8] 李栋,林珊. m icroRNAs在糖尿病肾病发病机制中的作用. 天津医药,2015,43(6):698-702.
[9] 侯杏芳,孟娟,张国良,等. 肺结核患者外周血单个核细胞中miRNA-150的表达及意义. 临床肺科杂志,2016,21(3):501-504.
[10] Colangelo T, Fucci A, Votimo C, et al. M icroRNA-130b promotes tumor development and is associated w ith poor prognosis in colorectal cancer. Neoplasia, 2013, 15(9): 1086-1099.
[11] Zhu H, Wu H, Liu XP, et al. Role of M icroRNA m iR-27a and m iR-451 in the regulation of MDR 1/P-glycoprotein expression in human cancer cells. Biochem Pharmacol, 2008, 76(5): 582-588.
[12] 吴子晏,刘小云,杨述华. miR-21对骨肉瘤细胞增殖的影响. 中国癌症杂志,2010,20(8):561-565.
[13] Corsini LR, Bronte G, Terrasi M, et al. The role of microRNAs in cancer: diagnostic and prognostic biomarkers and targets of therapies. Expert Opin Ther Targets, 2012, 16 (S2): S103-S109.
[14] 黄巧容,温博, 李雪,等. 建立九色流式检测人外周血中TCR Vβ淋巴细胞亚群活化及凋亡方案. 四川大学学报(医学版),2016,47(2):262-266.
[15] Murphey MD, Jelinek JS, Temple HT, et al. Imaging of periosteal osteosarcoma: radiologic-pathologic comparison. Radiology, 2004, 233(1): 129-138.
[16] Guo W, Yang RL, Tang XD, et al. Neoadjuvant chemotherapy for osteosarcoma. J Chin Med Assoc, 2004, 84(14): 1186-1190.
[17] 蒙辉能. 骨肉瘤非手术治疗进展. 中国医学文摘(肿瘤学),2005,19(3):245-247.
[18] 吴子晏,刘洋,杨述华. 骨肉瘤患者血清 m iR-21的表达意义及其与化疗药物敏感性的研究. 实用骨科杂志,2015,21(7):607-610.
[19] Zhou X, Yuan P, He Y. Role of m icroRNAs in peripheral artery disease (Review). Mol Med Report, 2012, 6(4): 695-700.
[20] Broadhead ML, Clark JC, Myers DE, et al. The molecular pathogenesis of osteosarcoma: a review. Sarcoma, 2011, 2011: 959248.
[21] 冯和林,郑丽华. 骨肉瘤的转移机制研究进展. 中国骨与关节杂志,2012,1(5):532-535.
[22] 张腾龙,孙丽,王松梅,等. m iR-21在多发性骨髓瘤中的表达及临床意义. 中国实验血液学杂志,2012,20(3):616-619.
[23] Chen L, Hao Y, Tu G. M icroRNA-21 promotes proliferation, invasion and suppresses apoptosis in human osteosarcoma line MG63 through PTEN/Akt pathway. Tumor Biol, 2016, 37(7): 1-10.
[24] 吴夕,缪珩. microRNA-21对人甲状腺乳头状癌细胞增殖和凋亡的影响. 南京医科大学学报(自然科学版),2014,34(4):437-441.
[25] 赵晓婷, 孙洁, 王翠芳. Ki-67在基底细胞样型乳腺癌中的诊断价值. 中国组织化学与细胞化学杂志,2016,25(5):426-430.
Detection for m icroRNA-21 level in peripheral blood mononuclear cells and K i-67 level in osteosarcoma tissue in osteosarcoma patients and analysis of the clinic signif cance
Song Wei1, Zhang Jianbo2, Ma Jie1, Yu Qingkai1*
(1Department of Pathology,2Department of Molecular Pathology, The Af liated Tumor Hospital of Zhengzhou University, Zhengzhou 450000, China)
ObjectiveTo investigate the clinical signif cance of the level of microRNA-21 (miR-21) in peripheral blood mononuclear cells and tissue Ki-67 in the development of osteosarcoma.M ethodsRT-qPCR was performed to detect the expression of miR-21 in 120 cases of osteosarcoma, 80 cases of osteochondroma and 70 cases of normal healthy controls, the level of Ki-67 protein was detected by immunohistochem istry, and receiver operating characteristic curve (ROC) was used to analyze the value of m iR-21 in the diagnosis of osteosarcoma.ResultsThe level of miR-21 in peripheral blood was signif cantly higher in osteosarcoma patients than that in normal controls. Its expression was related to clinical staging, postoperative recurrence and metastasis, while not correlated w ith age, gender, pathological type and lesion location. The area under ROC curve of miR-21 was 0.858, the sensitivity and specif city were 91.89% and 79.61%, respectively. The immunohistochem ical expression of Ki-67 was signif cantly higher in osteosarcoma tissue than in osteochondroma and normal control tissue.ConclusionThe expression of miR-21 and Ki-67 is associated w ith the development of osteosarcoma, and detection of the level of m iR-21 in peripheral blood and Ki-67 expression can help to predict the occurrence and development of osteosarcoma.
M icroRNA-21; Ki-67; osteosarcoma; osteochondroma; peripheral blood mononuclear cells; clinical stage; metastasis
R738.1
ADOI:10.16705/ j. cnki. 1004-1850.2017.03.011
2017-01-21
2017-06-09
宋魏,女(1980),汉族,主治医师
*通讯作者(To whom correspondence should be addressed):medchang@126.com
