甲状腺激素受体在扬子鳄卵巢中的免疫组织化学定位和不同繁殖时期的m RNA表达水平变化检测
2017-07-31孙龙孙洪计张瑞东汪涣晏鹏张方吴荣吴孝兵
孙龙,孙洪计,张瑞东,汪涣,晏鹏,张方,吴荣,吴孝兵
(安徽师范大学生命科学学院遗传保护生物学教研室,芜湖,241000)
甲状腺激素受体在扬子鳄卵巢中的免疫组织化学定位和不同繁殖时期的m RNA表达水平变化检测
孙龙,孙洪计,张瑞东,汪涣,晏鹏,张方,吴荣,吴孝兵*
(安徽师范大学生命科学学院遗传保护生物学教研室,芜湖,241000)
目的研究扬子鳄甲状腺激素受体(thyroid hormone receptor,TR)基因的系统进化关系和在卵巢组织中的定位,分析成年扬子鳄在不同繁殖活动期卵巢组织中甲状腺激素受体的动态变化规律。方法通过Clustal W软件对扬子鳄和其它脊椎动物TRs氨基酸序列进行序列比对,使用MEGA 6.0软件构建NJ系统发育树;应用qRT-PCR方法检测TRα和TRβ mRNA在不同繁殖时期卵巢组织中的表达水平差异;应用免疫组织化学法对扬子鳄卵巢卵泡中TR进行组织定位。结果系统发育分析显示扬子鳄与鸟类亲缘关系较近;扬子鳄卵巢中TR的mRNA表达水平在繁殖期最高,在繁殖前期和繁殖后期相对较低;免疫组织化学染色显示,TR阳性反应主要位于卵泡的颗粒层细胞、卵泡膜、卵母细胞质和卵母细胞核中,其中颗粒层细胞阳性反应最明显。结论TR基因的进化时间较早,因此序列保守性较高; TRα和TRβ对扬子鳄卵泡发育成熟具有重要作用;颗粒层细胞是TRs的功能作用主要位点。
扬子鳄;甲状腺激素受体;卵巢
在脊椎动物中,甲状腺激素有三碘甲状腺原氨酸(T3)和甲状腺素(T4)两种,T3是甲状腺激素活性最强的形式,由非甲状腺组织中的T4外环脱碘产生[1]。甲状腺激素THs影响脊椎动物多个方面,如生殖、生长、分化和新陈代谢等[2]。甲状腺激素的生物效应是由甲状腺激素受体(thyroid hormone receptor,TR)介导的[3,4],TR是转录调节因子,以配体依赖的方式调节T3靶基因的活性,即TR是甲状腺激素发挥作用的重要桥梁。甲状腺激素先与甲状腺激素受体结合形成激素受体复合物,再捆绑到靶基因中的甲状腺激素应答元件上,从而达到调控基因表达的作用[5]。在缺少配体时,TR结合特异DNA序列,通过和共抑制子相互作用主动抑制转录。配体的结合导致TR结构改变,释放共抑制子并招募共激活子而激活转录。
在多种脊椎动物(鱼类、两栖类、鸟类、哺乳类)中均克隆和分离到2种甲状腺激素受体基因:TRα和TRβ。TRα和TRβ亚型又因选择性剪接或转录起始位置的不同而产生若干变体。TRα和TRβ常存在于同一种细胞中,拥有同样的蛋白节段。研究发现TR mRNA在哺乳类和鸟类颗粒细胞中有表达[6-9],同时在人的成熟卵子和胚泡时期亦有表达[10]。
甲状腺激素对于脊椎动物生长的影响发生在其受体水平,即受体分布及功能的组织特异性,主要通过TRβ介导调控[11,12]。TRα的主要功能是调节机体的生长发育,维持甲状腺功能。TRβ可增加机体对T3的敏感性,维持甲状腺激素(TH)对促甲状腺激素(TSH)的负反馈调节。目前关于甲状腺激素受体对爬行类鳄目生殖作用的研究知之甚少,本研究分离克隆了扬子鳄甲状腺激素受体基因TRα和TRβcDNA的部分序列,通过翻译转变为氨基酸序列,并构建了系统发育树,探讨了扬子鳄甲状腺激素受体基因的亲缘进化关系;通过qRT-PCR方法初步探讨了甲状腺激素受体两种不同亚型在成年扬子鳄不同繁殖时期(繁殖前期、繁殖期和繁殖后期)的表达差异;通过免疫组织化学方法对TR蛋白进行定位研究,获知甲状腺激素受体基因在卵巢组织中的表达位点和功能作用区域。
材料与方法
1 实验材料
通过尾静脉注射戊巴比妥钠的方法,待扬子鳄麻醉后解剖,解剖取本实验所需要的卵巢组织样品,同时将其他内脏组织一并取回用于其他实验研究。从2014年至2016年共收集到6条成年雌鳄卵巢样品,根据扬子鳄繁殖时期的不同,卵巢样品可分为繁殖前期(1~3月)、繁殖期(5~7月)、繁殖后期(9~11月)3个阶段,每个阶段两个样品。卵巢组织和其它内脏组织样品均来源于安徽省扬子鳄繁殖研究中心。本实验收集的卵巢样品包括定量实验样品和免疫组织化学样品,其中定量实验样品保存在去RNA酶保存液中,免疫组织化学样品放入4%多聚甲醛中固定。实验样品从采集地运输到实验室的过程中通过低温冰盒保存的,到达实验室后定量实验样品保存在-80℃,免疫组织化学样品放在4℃冰箱保存。
2 RNA提取和反转录
使用RNAprep pure Tissue kit 试剂盒(TIANGEN,北京)对各个时期的卵巢组织进行总RNA提取,实验过程严格按照使用说明书。通过1%的琼脂糖凝胶电泳和分光光度计在A260/A280(1.8-2.0)对所提取的RNA进行质量检测。mRNA反转录为cDNA通过Prime ScriptTMRT Reagent Kit试剂盒(TaKaRa,大连),操作流程严格遵守使用说明书,并将所得到的cDNA保存在-20℃。
3 实时荧光定量PCR
根据近源物种密河鳄的TR文献引物和GenBank上已有的扬子鳄TR序列共设计出两对Q-PCR引物,L8作为内参基因(表1)。定量PCR反应体系按照SYBR Prem ix Ex Taq试剂盒(TaKaRa,大连)操作说明进行,使用BioRad IQ5 real-time PCR仪进行上机运行。TRα反应程序:95 ℃ 5 min,随后95 ℃ 15 s,63 ℃ 30 s,72℃ 30s 40个循环,72℃ 10s 47个循环;TRβ反应程序:95 ℃ 5 m in,随后95 ℃30 s,54 ℃ 45 s,72℃ 50s 40个循环,72℃ 10s 47个循环,每个样品至少进行3次重复(n≥3),最后对所有样品进行融解曲线的扩增分析。相对表达水平采用2-ΔΔCt法计算,其数据以平均值±标准误表示(±se)。统计分析采用One-way方差分析并进行Duncan多重比较。
4 TRs基因序列分析
本研究参考密河鳄文献中的引物(表1),对扬子鳄TR cDNA序列进行PCR扩增,随后对扩增产物进行克隆测序,测序所得的核苷酸序列通过人工拼接完成,使用Primer 5.0翻译为对应的氨基酸序列。在NCBI数据库(http://www.ncbi.nlm.nih.gov/)中,用Blastx搜索相关脊椎动物(鱼类、两栖类、爬行类、鸟类、哺乳类)同源蛋白序列。用Clustal W比对不同物种的TR序列,利用MEGA 6.0软件构建NJ系统发育树。构建系统发育树使用的物种及TR序列登录号信息如下:Homo sapiens 智人(TRα: NP_955366.1, TRβ: NP_000452.2),Pelophylaxnigromaculatus黑斑侧褶蛙(TRα: AGT55994.1,TRβ: AGT55995.1),Xenopuslaevis非洲爪蟾(TRα: NP_001081595.1,TRβ:NP_001090182.1),Daniorerio斑马鱼(TRα:NP_571471.1,TRβ:NP_571415.1), Cynoglossussemilaevis半滑石鳎(TRα:NP_001281144.1,TRβ:NP_001284509.1), Alligator mississippiensis密河鳄(TRα: NP_001274207.1, TRβ: NP_001274240.1,Gallus gallus 原鸡(TRα: NP_990644.1, TRβ: NP_990778.2),Capra hircus 山羊(TRα:XP_013827781.1,TRβ:XP_005698984.1),Rattusnorvegicus褐家鼠(TRα:NP_001017960.1,TRβ: NP_036804.2), Sturnus vulgaris紫翅椋鸟(TRα:XP_014740999.1,TRβ: XP_014742749.1),Pelodiscussinensis中华鳖(TRα: XP_014426128.1,TRβ:XP_006134382.1),Python bivittatus缅甸蟒蛇(TRα:XP_007420744.1, TRβ: XP_007421744.1)。
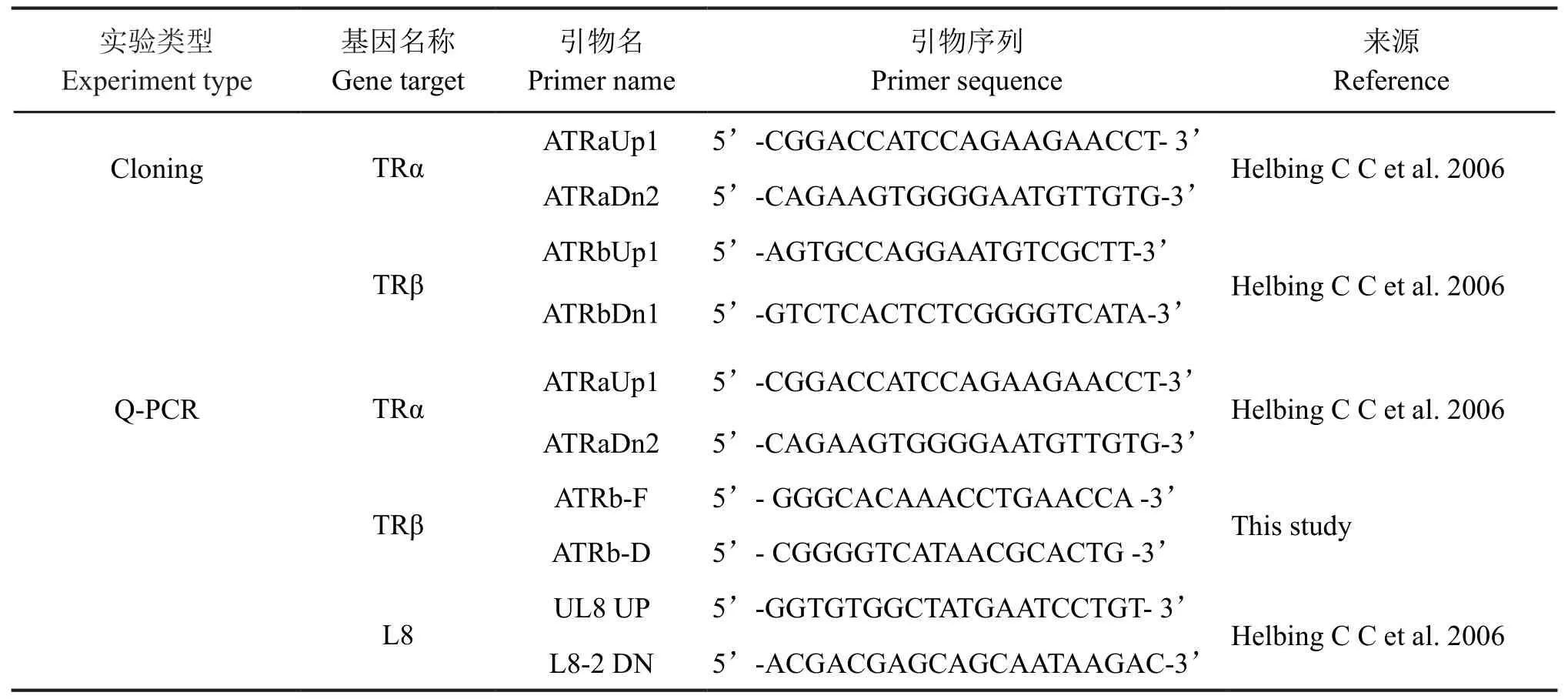
表1 引物序列Tab. 1 Primer sequences
5 免疫组织化学染色
样品组织经4%多聚甲醛固定,酒精脱水,最后进行石蜡包埋。石蜡组织通过莱卡RM 2245切片机切成5μm切片。切片经过脱蜡和水化、PBS冲洗、微波抗原修复、H2O2阻断内源性过氧化物酶活性等一系列处理后,在4℃进行一抗孵育过夜。一抗为兔多克隆抗体(TRα,bs-6222R,博奥森;TRβ,bs-11440R,博奥森)(均为1:250稀释)。在PBS中漂洗后用1:100稀释的羊抗兔IgG多克隆抗体(浓缩型SABC-POD试剂盒,SA2002,博士德)孵育30 min,待二胺联苯胺(DAB)呈色后苏木精复染,最后用中性树胶封片。阴性对照组用PBS代替一抗,切片通过Olympus BX61显微镜观察拍片。
结 果
1 扬子鳄TR基因在进化上与其它脊椎动物对应基因具有高度保守性
TRα和TRβcDNA序列克隆部分片段长度分别为855bp和453bp。这两段序列为TR的编码区部分序列,应用软件翻译为对应的氨基酸序列,并基于氨基酸序列分别构建了同源基因TRα与TRβ的系统发育树(图 1)。在TRα发育树中,扬子鳄与密河鳄紧密聚为一枝,序列同源性高,然后再与鸟类聚为一枝,这与很多分子生物学研究结果相一致。在TRβ发育树中,扬子鳄同样先与密河鳄聚为一枝,再与鸟类聚为一枝。其它所有哺乳动物、鸟类、两栖类和鱼类均聚为一簇。通过NCBI数据库(http://www. ncbi.nlm.nih.gov/)Blastx搜索发现,TRα基因序列与密河鳄(Alligator mississippiensis)的同源性高达99%,这与系统树结果相一致。其次与湾鳄(Crocodilusporosus)和食鱼鳄(Gavialisgangeticus)同源性也高达98%,与西部锦龟(Chrysemyspictabellii)同源性在92%。TRβ基因序列与密河鳄的同源性也高达99%,与绿头鸭(Anasplatyrhynchos)、朱鹮(Nipponia Nippon)等鸟类同源性高达95%。TR与人类(Homo sapiens)、非洲爪蟾(Xenopuslaevis)和斑马鱼(Daniorerio)也都有较高的序列同源性。系统发育树结果表明,扬子鳄与密河鳄TR基因进化关系最近,其次是与鸟类的进化关系最近;序列同源性大小比较结果也验证了扬子鳄TR基因在进化上具有较高的保守性。由于扬子鳄TR基因与密河鳄同源性极高,因此本研究扬子鳄TR基因序列克隆参考密河鳄文献引物(表1)。
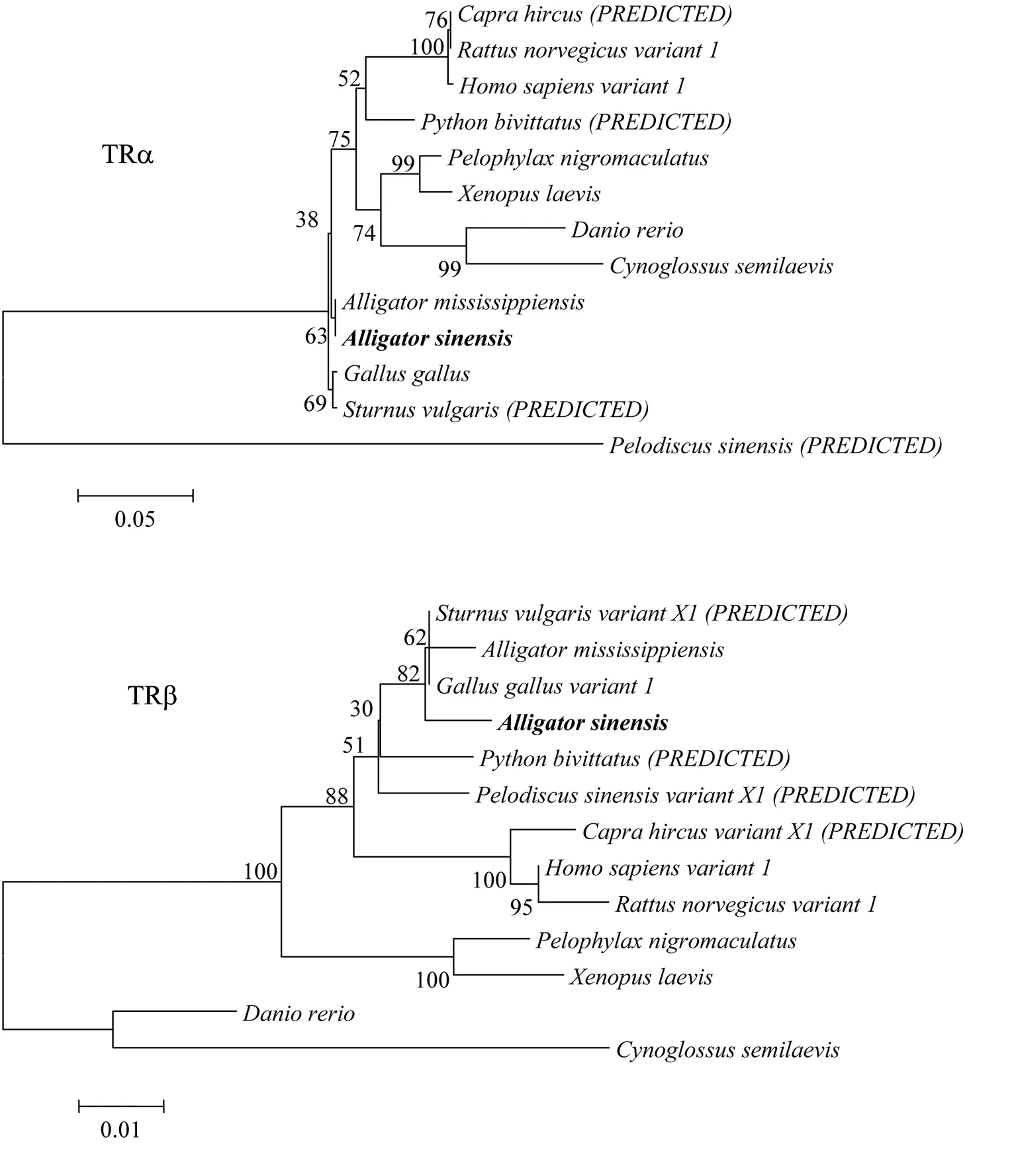
图1 TR氨基酸序列构建的NJ系统发育树Fig. 1 The NJ phylogenetic tree constructed based on the amino acid sequence of TR.
2 扬子鳄卵巢中TR m RNA表达水平在繁殖期高于非繁殖期
实时荧光定量PCR检测扬子鳄TR mRNA在不同繁殖时期卵巢组织中相对表达水平显示,TR基因在卵巢组织中不同繁殖时期均有表达,同时在不同繁殖时期之间表达水平也存在显著性差异,其中繁殖期表达水平最高;在同一繁殖期内,TRβ mRNA的表达水平均高于TRα mRNA的表达水平,同时TRα和TRβ mRNA表达水平之间也存在显著性差异;TRα mRNA在卵巢组织中不同繁殖期的表达水平动态变化状态与TRβ mRNA表达水平变化趋势相一致,即TRs从繁殖前期到繁殖期过程呈上升趋势,从繁殖期到繁殖后期过程呈下降趋势(图2)。
3 TR在扬子鳄卵泡颗粒细胞中阳性反应较其它部位显著
TRα和TRβ在卵巢卵泡中的阳性表达位点几乎相同,二者主要分布在次级卵泡的卵泡膜(theca follicle,TF)、颗粒细胞(granular cell,GC)、卵母细胞质(oocyte cytoplasm,OC)、卵母细胞核(oocyte nuclear,ON)等部位(图 3)。其中在卵泡的颗粒细胞中阳性较强,在卵泡膜、卵母细胞胞质、核膜阳性反应较弱;在颗粒层细胞中,TRα的阳性细胞数目比TRβ的阳性细胞数目少。

图2 TRα和TRβ mRNA在不同繁殖期扬子鳄卵巢中表达水平统计分析。a、b、c,TRα在不同繁殖期的单因素方差分析结果,TRα在3个繁殖期之间均存在显著性差异(0.01<P<0.05);A和B表示TRβ在不同繁殖期的单因素方差分析结果, TRβ在繁殖前期和繁殖后期之间没有显著性差异(P>0.05),TRβ在繁殖期与繁殖前期和繁殖后期之间均存在显著性差异(0.01<P<0.05);*,同一繁殖期内TRα和TRβ之间比较,0.01<P<0.05;**,同一繁殖期内TRα和TRβ之间比较,P<0.01;n=3Fig. 2 Statistical analysis of the mRNA levels of TRα and TRβ in the ovary of Chinese alligators at dif erent reproductive stages. a, b and c represent the One-Way ANOVA values of TRα at dif erent reproductive stages, show ing signif cant dif erences among all three stages (0.01<P<0.05); A and B represent the One-Way ANOVA values of TRβ at dif erent reproductive stages, show ing no signif cant dif erence between pre-reproductive and post-reproductive periods (P>0.05) but a signif cant dif erence in the breeding season (0.01<P<0.05); *, 0.01<P<0.05, comparison of TRα and TRβ at the same stage;**, P<0.01, comparison of TRα and TRβ at the same stage; n=3

图 3 TR 在扬子鳄卵泡组织中免疫组织化学定位。A、C和E,TRα;B、D和F,TRβ;TF ,卵泡膜;GC ,颗粒细胞;OC ,卵母细胞质;ON ,卵母细胞核;比例尺:A和B,80μm;C和D,40μm;E和F,20μmFig. 3 Immunohistochem ical localization of TR in the follicular tissue of the Chinese alligator. A, C and E, TRα; B, D and F, TRβ; TF, theca follicle; GC, granular cell; OC, oocyte cytoplasm; ON, oocyte nucleus; scale bar: 80μm in A and B, 40μm in C and D, 20μm in E and F
讨 论
基于扬子鳄甲状腺激素受体基因氨基酸序列与其它脊椎动物对应甲状腺受体基因氨基酸序列构建的亲缘关系树,TRα和TRβ在不同脊椎物种间表现出高度的同源性,尤其与鸟类同源性最高,这与大多分子生物学研究结果相一致,说明甲状腺激素受体在物种进化过程中出现时间较早,对动物的个体生殖发育和生长代谢等方面的调节作用非常重要[13],因此序列的保守性较高,其次可能是本研究克隆获得的TRs基因cDNA序列片段均位于高度保守的DNA结合功能区(DBD区)。
荧光定量实验结果显示,两种甲状腺激素受体基因在卵巢组织中表达呈现显著的繁殖相关变化模式,即季节性变化规律,表现为繁殖期表达水平最高。这可能是因为扬子鳄在繁殖期需要不断的进行新陈代谢以增加能量供给,这为繁殖代谢过程提供准备。此外,在同一繁殖期内,TRβ的表达水平均比TRα高,表明TRβ介导的功能作用比TRα突出。在其它脊椎动物甲状腺激素受体分布及功能的组织特异性研究表明甲状腺激素受体对动物生长发育、新陈代谢具有重要作用,并且主要通过TRβ介导[11,12,14-17]。在多种脊椎动物中甲状腺激素循环和生殖周期是正相关的[2]。在意大利壁蜥mRNA分离实验中使用的非洲爪蟾TRα基因片段特异的RNA印记杂交探针,在血清甲状腺激素水平观察中TRα转录表达水平也随着季节的变化发生着改变[18]。TRα和TRβ亚型在脊椎动物发育过程和不同的成年组织中均具有明显的时空表达模式[19,20],TRα和TRβ的mRNA表达水平在大多数组织中分布密度也不同,对T3有组织特异性反应。甲状腺激素的季节性波动与生殖活动也相一致,表现为繁殖期表达水平最高,非繁殖期表达水平相对较低[21]。
甲状腺激素及其受体对性腺组织起到重要的作用。在卵巢中,甲状腺激素浓度在卵母细胞的最终成熟过程、卵黄生成过程和胚胎形成过程中均有所增加;不同的生殖激素也存在特征性的表达变化模式,即雌激素的表达水平远高于雄激素和孕激素,这可能是雌激素对卵巢发育影响最为重要的原因[22]。同时,甲状腺激素对脊椎动物性腺的早期发育、生殖发育过程中生殖激素的表达调控起到重要作用[23-25],对人类生殖管道的发育过程中也起到适当的作用[26,27]。甲状腺激素受体对脊椎动物的发育和基因调节的变态发育过程也起到重要作用[28]。此外,TRα和TRβ mRNA表达水平在卵巢组织中也呈现高度的协同模式,表明TRα和TRβ对扬子鳄卵黄生成和卵泡发育成熟具有协同作用。
TR的免疫组织化学结果显示,TRα和TRβ在卵泡组织中的分布位置没有显著性差异,均在颗粒层细胞中阳性反应最明显,其它细胞结构中阳性反应稍弱,这说明了颗粒层细胞是甲状腺激素受体的主要功能作用部位。阳性物质多而密集的分布在卵泡区域,表明受体介导效应在该部位相对较强。TRα基因在牛成熟卵母细胞和颗粒细胞均存在表达[9],且TRα阳性细胞数随卵泡的发育成熟而增多[29],说明TRα对卵泡发育成熟具有促进作用。
本研究获得了TR基因序列,探索了扬子鳄系统发育关系;通过对TR蛋白的定位表达,即研究了甲状腺激素两种受体在扬子鳄卵巢次级卵母细胞中的主要位置分布情况;对不同繁殖时期卵巢组织中TR mRNA水平动态变化进行了分析,揭示了甲状腺激素受体对雌性扬子鳄繁殖过程中卵巢发育的影响和作用,这对濒危物种扬子鳄物种保护和种群的扩增具有重要意义。但TR对雌鳄卵黄生成作用和卵泡的发育成熟过程是怎样动态调控作用还需要进一步研究。
[1] Bianco AC, Salvatore D, Gereben B, et al. Biochemistry, cellular and molecular biology, and physiological roles of the iodothyronineselenodeiodinases. Endocr Rev, 2002, 23(1): 38-89.
[2] Bermudez DS, M ilnes MR, Bryan TA, et al. Seasonal variation in plasma thyroxine concentrations in juvenile alligators (Alligators mississippiensis) from three Florida lakes. Comp Biochem Physiol A Mol Integr Physiol, 2005, 141(1): 8-14.
[3] Lee H J, Yen P M. Recent advances in understanding thyroid hormone receptor coregulators. J Biomed Sci, 1999, 6(2): 71-78.
[4] Tsai M, O’Malley B W. Molecular mechanisms of action of steroid/thyroid receptor superfam ily members. Annu Rev Biochem, 1994, 63(1): 451-486.
[5] Zhang J, Lazar MA. The mechanism of action of thyroid hormones. Annu Rev Physiol, 2000, 62(1): 439-466.
[6] Wakim AN, Polizotto SL, Buf o MJ, et al. Thyroid hormones in human follicular fuid and thyroid hormone receptors in human granulosacells. Fertil Steril, 1993, 59(6): 1187-1190.
[7] Wakim NG, Ramani N, Rao CV. Triiodothyronine receptors in porcine granulosa cells. Am J Obstet Gynecol, 1987, 156(1): 237-240.
[8] Biswas R, Bandyopadhyay A, Guin S, et al. Binding of thyroid hormone to mouse granulosa cell nuclei and its biological relevance. J Biosci, 1993, 18(3): 327-335.
[9] Costa NN, Cordeiro MS, Silva TVG, et al. Ef ect of triiodothyronine on developmental competence of bovine oocytes. Theriogenology, 2013, 80(4): 295-301.
[10] Zhang SS, Carrillo AJ, Darling DS. Expression of multiple thyroid hormone receptor mRNAs in human oocytes, cumulus cells, and granulosa cells. Mol Hum Reprod, 1997, 3(7): 555-562.
[11] O’shea PJ, Williams GR. Insight into the physiological actions of thyroid hormone receptors from genetically modifed m ice. J Endocrinol, 2002, 175(3): 553-570.
[12] Brent GA. Tissue-specif c actions of thyroid hormone: insights from animal models. Rev Endocr Metab Disord, 2000, 1(1-2): 27-33.
[13] Glinoer D. Regulation of thyroid function in pregnancy: maternal and neonatal repercussions. Adv Exp Med Biol. Springer US, 1991, 299: 197-201.
[14] 解竞静,杨晓静,吴天星,等. 大黄鱼甲状腺激素受体基因在不同年龄与不同织织中的表达差异. 江苏农业科学,2006,2006(6): 339-343.
[15] White P, Burton KA, Fow den AL, et al. Developmental expression analysis of thyroid hormone receptor isoforms reveals new insights into their essential functions in cardiac and skeletal muscles. FASEB J, 2001, 15(8): 1367-1376.
[16] Flamant F, Samarut J. Thyroid hormone receptors: lessons from knockout and knock-in mutant mice. Trends Endocrinol Metab, 2003, 14(2): 85-90.
[17] 刘琨,陈松林,张丽燕,等. 半滑舌鳎甲状腺激素受体β基因(TRβ)的克隆与表达分析. 农业生物技术学报,2014,22(9):1157-1165.
[18] Virgilio F, Sciarrillo R, De Falco M, et al. Temporal expression of thyroid hormone receptor α1 in the liver of the lizard Podarcissicula. J Exp Zool A Comp Exp Biol, 2004, 301(3): 212-217.
[19] Billon N, Tokumoto Y, Forrest D, et al. Role of thyroid hormone receptors in timing oligodendrocyte differentiation. Dev Biol, 2001, 235(1): 110-120.
[20] Brown DD. Amphibian metamorphosis. From morphology to molecular biology. Bioche, 2000, 22, (8): 775
[21] Helbing CC, Crump K, Bailey CM, et al. Isolation of the alligator (A lligator m ississippiensis) thyroid hormone receptor α and β transcripts and their responsiveness to thyroid stimulating hormone. Gen Comp Endocrinol, 2006, 149(2): 141-150.
[22] Ogielska M, Kotusz A. Pattern and rate of ovary dif erentiation w ith reference to somatic development in anuran amphibians. J Morphol, 2004, 259(1): 41-54.
[23] Hoskins ER, Hoskins M M. Grow th and development of amphibia as af ected by thyroidectomy. J Exp Zool A Ecol Genet Physiol, 1919, 29(1): 1-69.
[24] Gruca S, M ichalowski J. The rate of development of gonads against the background of the development of the whole organism in the tadpole of Xenopus laevis Daud. Acta Biol, 1961, 4: 191-197.
[25] Rot-Nikcevic I, Wassersug RJ. A rrested development in Xenopuslaevis tadpoles: how size constrains metamorphosis. J Exp Biol, 2004, 207(12): 2133-2145.
[26] Jannini EA, Ulisse S, D’Armiento M. Thyroid hormone and male gonadal function. Endocr Rev, 1995, 16(4): 443-459.
[27] Krassas GE. Thyroid disease and female reproduction. Fertil Steril, 2000, 74(6): 1063-1070.
[28] Buchholz DR, Paul BD, Fu L, et al. Molecular and developmental analyses of thyroid hormone receptor function in Xenopuslaevis, the African clawed frog. Gen Comp Endocrinol, 2006, 145(1): 1-19.
[29] 钟俊洁,杨桂芳,刘帅,等. 甲状腺激素受体α在猪有腔卵泡发育和孤雌激活胚胎发育过程中表达模式. 畜牧兽医学报,2014, 45(6): 901-909.
Immunohistochem ical localization of thyroid hormone receptor and detection for variation of mRNA level in dif erent reproductive periods in the ovary of the Chinese alligator
Sun Long, Sun Hongji, Zhang Ruidong, Wang Huan, Yan Peng, Zhang Fang, Wu Rong, Wu Xiaobing*
(Department of Genetic Conservation Biology, College of Life Science, Anhui Normal University, Wuhu 241000,China)
ObjectiveTo investigate thyroid hormone receptor (TR) localization in the ovarian tissue, and the phylogenetic relationships of TR genes in Chinese alligators; also analyze the variation of their expression in the ovary at dif erent reproductive stages in adult Chinese alligators.MethodsThe TR amino acid sequences of the Chinese alligator and other vertebrates were compared by Clustal W software. The NJ phylogenetic tree was built by MEGA 6.0 software. The variation of the mRNA levels of TRα and TRβ in the ovary at dif erent reproductive stages was detected by qRT-PCR. Immunohistochemistry was used to locate TR in the ovarian follicles of Chinese alligators.ResultsThe phylogenetic analysis showed that the Chinese alligator had a close relationship w ith birds in the phylogeny tree. The TR mRNA level in the ovary of the Chinese alligator was the highest in the breeding season and relatively lower in the pre-reproductive and post-reproductive periods. Immunohistochem ical staining results showed that TR was mainly located in the granular layer, theca follicle, oocyte cytoplasm and nuclei of the follicle, and the reactivity was the most remarkable in the granular layer cells.ConclusionTR genes evolved early in the phylogeny tree, and their sequences are highly conserved. TRα and TRβ play an important role in the development and maturation of the follicle of Chinese alligators, and function mainly in the granular layer cells.
Chinese alligator; thyroid hormone receptor; ovary
Q955
A
10.16705/ j. cnki. 1004-1850.2017.03.004
2017-03-01
2017-06-02
中国国家自然科学基金项目(31472019)
孙龙,男(1990年),汉族,硕士研究生
*通讯作者(To whom correspondence should be addressed):wuxb@mail.ahnu.edu.cn
