幽门螺杆菌感染细胞炎症模型的建立及评价
2017-07-31连大卫任文康扶丽君许艺飞黄萍操红缨
连大卫 ,任文康,扶丽君,许艺飞,黄萍,操红缨
(广州中医药大学中药学院,广州 510405)
幽门螺杆菌感染细胞炎症模型的建立及评价
连大卫 ,任文康,扶丽君,许艺飞,黄萍,操红缨*
(广州中医药大学中药学院,广州 510405)
目的建立和评价幽门螺杆菌(H.pylori)感染的2种细胞感染模型,为进一步研究H.pylori感染及其相关机制奠定基础。方法培养人胃癌细胞株MKN45细胞,与H.pylori共孵育6h、12h和24h建立MKN45细胞H.pylori感染模型,台盼蓝染色和乳酸脱氢酶(LDH)法测定感染细胞存活率,荧光显微镜照相和流式细胞仪检测Rhodamine123染色的细胞线粒体膜电位;培养小鼠巨噬细胞株RAW 264.7细胞,与H.pylori共孵育6h、12h和24h建立RAW 264.7细胞H.pylori感染模型,Griess法检测感染细胞上清液中NO的含量变化,RT-qPCR法检测感染细胞中Tnf-α,Inos和Cox-2基因表达变化。结果在MKN45细胞H.pylori感染模型中,感染12h和24h均可显著降低细胞存活率并降低细胞线粒体膜电位,即H.pylori作用于MKN45细胞12h即产生明显的细胞毒性作用;在RAW 264.7细胞H.pylori感染模型中,感染6h、12h和24h均可增加细胞上清液中NO含量和细胞Tnf-α,Inos和Cox-2基因表达,即H.pylori作用于巨噬细胞后可明显增加其促炎因子的表达,并随着时间的延长而加强。结论H.pylori 感染MKN45细胞和RAW 264.7巨噬细胞可作为理想的H.pylori感染细胞模型。
幽门螺杆菌;细胞模型;细胞毒性;促炎因子
幽门螺杆菌(Helicobacter pylori, H.pylori)是世界范围内常见的、具有强传染性的病原菌之一,全球有超过50%的人群感染此菌[1],通过对我国大量人群调查,H.pylori感染率为60%,儿童H.pylori感染率为 54.76%,并且以每年0.5%~1%的速度递增[2,3]。H.pylori感染可以诱发包括慢性胃炎、消化性溃疡在内等常见胃部疾病的发生,其中以损伤胃上皮细胞与激活免疫细胞产生炎症反应和免疫应答为主要诱因[4,5]。因此建立H.pylori感染细胞模型对于探讨其致病机理、筛选治疗药物与研究药物作用靶点等具有重要意义。本实验将H.pylori与不同的细胞株共同孵育,观察细胞的生存状态和感染情况,为建立和优化H.pylori感染细胞模型奠定基础。
材料与方法
1 主要试剂
Brain-Heart Infusion(Oxoid,Lot:1677862);Campylobacter agar base (Oxoid,Lot:1589242);革兰氏染色液试剂盒(海博生物,Lot:HB8278);细菌基因组DNA提取试剂盒(天根生物,Lot:DP302-2);RPM I Medium 1640 basic(Gibco,Lot:8115250);胎牛血清(Gibco,Lot:730840);Super Real Pre M ix × Plus(SYBR Green)(天根生物,Lot:03120);FastQuant RT Kit (With gDNase)(天根生物,Lot:03326);Trizol Reagent(Thermo Life technology,Lot:28218); 乳酸脱氢酶(LDH)测试盒(南京建成,Lot:20160406);一氧化氮试剂盒(碧云天,Lot:S0021);台盼蓝(sigma,Lot:T6146); Rhodam ine 123(碧云天,Lot:C2007)
2 实验细胞和细菌
MKN45细胞和RAW 264.7巨噬细胞广东省中医院馈赠;H.pylori(SS1)由澳大利亚莫纳什大学Richard Ferrero教授馈赠。
3 细菌培养与鉴定
3.1 幽门螺杆菌的复苏和传代
将H.pylori(SS1)复苏于弯曲杆菌琼脂培养基为基础、含7% 脱纤维新鲜羊血及联合抗生素( 万古霉素10mg/L,甲氧苄氨嘧啶5mg/L、头孢磺啶5mg /L、两性霉素5mg/L) 的平板上。倒置平板置于37 ℃、5%O2、10%CO2、85%N2的培养箱中复苏48~72 h。待细菌长满平板后,传代于新的培养基上,再生长48~72 h。
3.2 幽门螺杆菌菌株的鉴定
使用革兰染色试剂盒染色细菌,于显微镜下使用油镜观察细菌形态。油镜下观察H. pylori形态呈红色弯曲杆状,无球变(图1A)。同时,取少量菌液置于快速脲素酶试剂里,1m in后观察试剂颜色变化(变为紫红色,图1B)。
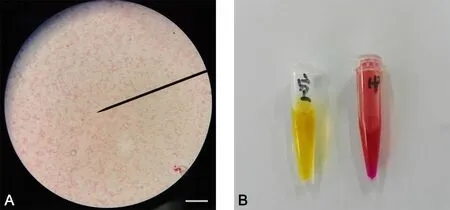
图1 幽门螺杆菌鉴定。A,H.pylori革兰染色;比例尺,10μm;B,快速尿素酶试验(空白对照为黄色,红色为细菌阳性反应)Fig. 1 Identif cation of H. pylori. A, Gram staining of H. pylori; scale bar, 10μm; B, rapid urease test; yellow, control group; red, positive reaction
4 细胞培养与传代
将RAW 264.7和MKN45细胞株从液氮罐取出后置于37 ℃水浴中迅速震摇解冻后, 1000 r/m in、5 m in离心,弃上清,加入含有双抗(青霉素100U/m l和链霉素100U/m l)和10% FBS的1640培养液转移至培养瓶中,置于37 ℃、5% CO2的培养箱中培养24h~48h。待细胞铺满瓶底后,传代于新的培养瓶中,在37 ℃、5% CO2培养24h~48 h。
5 造模方法及检测
5.1 细胞分组及造模
取对数生长期的MKN45和RAW 264.7细胞消化后,调节细胞浓度至2×106/孔种于6孔板中,分为空白对照组、模型6h组、12h组和24h组,每组3个复孔。无血清1640培养4h,模型组再加入2×108的H.pylori(MOI=100)共同孵育6h、12h和24h。
5.2 细胞存活率和线粒体膜电位检测
按说明书配制0.4%台盼蓝染色液,将各组MKN45细胞消化之后与染色液混合,在显微镜下分别计数活细胞和死细胞的数量,计算细胞活力[细胞活力(%)=活细胞数量/(活细胞数量+死细胞数量)×100%]。取各组MNK45细胞上清液12000r/min离心5min,取上清液按说明书检测上清LDH;同时向各孔中加入细胞裂解液,冰上裂解10m in后12000r/min离心5m in,取上清液检测细胞内LDH,并计算LDH释放率[LDH释放率(%)=细胞上清液中LDH/(细胞内LDH+细胞上清液LDH)×100%]。按说明书配制5mmol/L Rhodam ine 123染色液,弃去各组MKN45细胞上清液后,用PBS轻轻清洗3次,加入染色液37℃培养箱孵育20m in,再用PBS轻轻洗涤3次立即在荧光显微镜下观察、摄片。选取3个不同的视野用Image J图像分析软件分析荧光强度/细胞;同时消化收集染色液孵育后的细胞,用预冷的无血清培养液漂洗2次,充分除去细胞外的染料,加入流式细胞仪中检测细胞荧光强度(激发波长为507nm,发射波长为529nm),实验重复3 次。
5.3 RAW 264.7细胞炎症因子检测
取各组RAW 264.7细胞上清液,按照Griess法检测NO含量变化,NO含量(%)=模型组NO含量/空白对照组NO含量。弃去各组RAW 264.7细胞上清液后,用PBS轻轻清洗3次,加入Trizol裂解细胞,提取细胞总RNA,检测D(λ) 260nm/280nm比值合格后,按逆转录试剂盒操作方法得到cDNA,再分别检测tnf-α,inos和cox-2的mRNA表达,实验重复3 次。
引物序列:
GAPDH:上 游 引 物5′- AGGTTGTCTCCTGCGACTTCA -3’,下游引物5’- CCAGGAAATGAGCTTGACAAAG -3’;
iNOS:上 游 引 物 5’- GGCAGCCTGTGAGACCTTTG -3’,下游引物5’- CGTTTCGGGATCTGAATGTGA -3’;
COX-2:上游引物5’- CAGGAAGTCTTTGGTCTGGTGCC -3’,下游引物5’- GCTGGTTTGGAATAGTTGCTCATCA -3’;
TNF-α:上游引物5’- GCACCACCATCAAGGACTCA -3’,下游引物5’- TCGAGGCTCCAGTGAATTCG -3’
在Bio-rad荧光定量PCR仪(CFX 96)上进行实时荧光定量PCR(RT-qPCR)扩增(荧光定量检测试剂盒:Super Real Pre M ix × Plus,天根公司)。扩增条件:95℃预变性10m in,95℃变性15s,60℃延伸60s,40个循环。分析结果,得出各组内参基因和目的基因Ct值,运用2-△△Ct公式计算。
6 统计方法
结 果
1 幽门螺杆菌感染降低MKN45细胞活力和增加LDH释放率
台盼蓝染色显示,MKN45细胞感染H.pylori菌12h后,其活细胞比例明显降低,感染24h后降低更为明显(图2A)。LDH检测显示,MKN45细胞感染H.pylori菌12 h后,其LDH释放率较未感染细胞明显增加,感染24h后增加更加显著(图2B)。
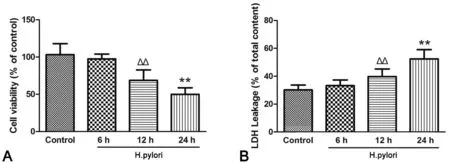
图2 幽门螺杆菌感染对MKN45细胞活力的影响。A,台盼蓝染色检测细胞活力的统计学分析;B,LDH检测细胞活力的统计学分析;ΔΔ,与未感染细胞比较,P<0.01;**,与感染12h的细胞比较,P<0.01;n=9Fig. 2 The ef ect of H. pylori on MKN45 cell viability. A, statistical analysis of cell viability detected by trypan blue staining; B, statistical analysis of cell viability measured by LDH method;ΔΔ, P<0.01, compared w ith control group;**, P<0.01, compared w ith 12h model group; n=9
2 幽门螺杆菌感染降低MKN45细胞线粒体膜电位
对感染H.pylori菌的MKN45细胞以Rhodam ine 123染料染色后进行荧光显微镜观察和流式细胞术分析显示,与未感染的对照细胞相比,感染12 h后的Rhodam ine 123荧光强度/ 细胞和总荧光强度均显著下降,24 h后其下降程度更加明显(图3),说明感染细胞的线粒体膜电位降低程度随着时间的延长而加重。

图3 幽门螺杆菌对MKN45细胞的线粒体膜电位的影响。A,幽门螺杆菌感染MKN45细胞后Rhodam ine123染色的荧光显微镜观察(比例尺,50μm);B,幽门螺杆菌感染MKN45细胞后Rhodam ine123染色荧光强度/ 细胞的统计学分析;C,幽门螺杆菌感染MKN45细胞后Rhodamine123染色总荧光强度的流式细胞术检测;D,流式细胞术检测幽门螺杆菌感染MKN45细胞后Rhodamine123染色总荧光强度的统计学分析;与未处理组比较:Δ, 0.01<P<0.05;ΔΔ,P<0.01;与感染6h组比较:*,0.01<P<0.05;**,P<0.01;与感染12h组比较:#,0.01<P<0.05;##,P<0.01;n=9Fig. 3 The ef ect of H. pylori infection on the MMP of MKN45 cells. A, representative fuorescent images of H. pylori-infected MKN45 cells stained w ith Rhodam ine123; scale bar, 50μm; B, statistical analysis of the f uorescent intensity per cell of H. pylori-infected MKN45 cells stained w ith Rhodam ine123; C, fow cytometry detection of the total f uorescent intensity of H. pylori-infected MKN45 cells stained w ith Rhodam ine123; D, quantitative analysis of the total fuorescent intensity of H. pylori-infected MKN45 cells stained w ith Rhodamine123 detected by fow cytometry. Compared w ith control group:Δ, 0.01<P<0.05;ΔΔ, P<0.01; compared w ith 6h model group:*, 0.01<P<0.05;**, P<0.01; compared w ith 12h model group:#, 0.01<P<0.05;##, P<0.01; n=9
4 幽门螺杆菌感染上调RAW 264.7细胞的促炎因子表达
Griess法检测显示,幽门螺杆菌感染可时间依赖性上调RAW 264.7细胞NO含量(图4A)。定量PCR检测显示,幽门螺杆菌感染可显著上调RAW 264.7细胞Cox-2,Inos基因表达,并随着时间增加而逐渐上升(图4B,图4C);幽门螺杆菌感染可显著上调Tnf-α基因表达,但未见明显时间依赖性(图4D)。
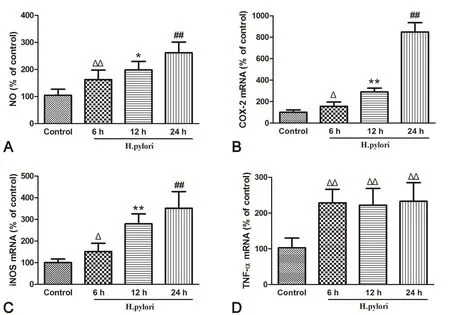
图4 幽门螺杆菌感染对RAW 264.7细胞促炎因子表达的影响。A,幽门螺杆菌感染RAW 264.7细胞后6h、12h和24h时NO含量;B,幽门螺杆菌感染RAW 264.7细胞后6h、12h和24h时Cox-2表达水平;C,幽门螺杆菌感染RAW 264.7细胞后6h、12h和24h时Inos基因表达水平;D,幽门螺杆菌感染RAW 264.7细胞后6h、12h和24h时Tnf-α表达水平;与未处理组比较:Δ,0.01<P<0.05;ΔΔ,P<0.01;与感染6h组比较:*,0.01<P<0.05;**,P<0.01;与感染12h组比较:#,0.01<P<0.05;##,P<0.01;n=9Fig. 4 The ef ect of H. pylori infection on the expression of proinf ammatory factor in RAW 264.7 cells. A, NO contents in RAW 264.7 cells co-cultured w ith H. pylori for 6h, 12h and 24h, respectively; B, the levels of Cox-2 gene expression in RAW 264.7 cells co-cultured w ith H. pylori for 6h, 12h and 24h, respectively; C, the levels of Inos gene expression in RAW 264.7 cells co-cultured w ith H. pylori for 6h, 12h and 24h, respectively; D, the levels of Tnf-α gene expression in RAW 264.7 cells co-cultured w ith H. pylori for 6h, 12h and 24h, respectively. Compared w ith control group:Δ, 0.01<P<0.05;ΔΔ, P<0.01; compared w ith 6h model group:*, 0.01<P<0.05;**, P<0.01; compared w ith 12h model group:#, 0.01<P<0.05;##, P<0.01; n=9
讨 论
H.pylori的长期感染可以导致发生胃黏膜萎缩和肠化生等相关慢性胃炎的主要诱因之一[6,7],这些病变的发生不仅是由于H.pylori自身可产生毒力因子,例如细胞毒性相关蛋白A和空泡细胞毒素A等,会使宿主细胞在增殖,细胞骨架重排,细胞连接,形态延伸与散射等方面的改变,进而损伤胃粘膜上皮细胞,而且由于其具有特殊的逃逸机制使机体免疫系统无法彻底清除[8],导致过度累积活性氧/活性氮及各类促炎因子造成炎症的持续发生,继而引发慢性炎症反应[9,10]。
本实验探讨了两种感染H.pylori(SS1)的细胞模型,其中感染MKN45细胞模型模拟细菌入侵机体黏附于细胞后产生的毒性作用,感染RAW 264.7巨噬细胞模型模拟了机体固有免疫抵抗细菌的作用。MKN45细胞感染H.pylori 12h即出现明显的存活率下降,线粒体膜电位下降的现象;24h后产生的细胞毒性更加严重。巨噬细胞通常在感染部位聚集并吞噬细菌,分泌TNF-α、COX-2,iNOS等促炎因子介导免疫反应,同时生成NO参与清除入侵的细菌[11]。模型感染6h后即可出现NO含量和促炎因子COX-2,iNOS,TNF-α的基因表达均增加,并且随着时间的延长而增加,表现出更严重的炎症程度。
因此H.pylori 感染MKN45细胞和RAW 264.7巨噬细胞24h后可分别出现显著的细胞毒性和明显炎症表达,可考虑作为理想的H.pylori感染细胞模型。
[1] Kusters JG, van V liet AH, Kuipers EJ. Pathogenesis of Helicobacter pylori infection. Clin M icrobiol Rev, 2006, 19(3): 449-490.
[2] Handa O, Naito Y, Yoshikawa T. Helicobacter pylori: a ROS-inducing bacterial species in the stomach. Inflamm Res, 2010, 59(12): 997-1003.
[3] Parsonnet J. The incidence of Helicobacter pylori inefection. Aliment Pharmacol Ther, 1995, 9(suppl 2): 45-51.
[4] Peek RJ, Blaser MJ. Helicobacter pylori and gastrointestinal tract adenocarcinomas. Nat Rev Cancer, 2002, 2(1): 28-37.
[5] Covacci A, Telford JL, Del GG, et al. Helicobacter pylori virulence and genetic geography. Science, 1999, 284(5418): 1328-1333.
[6] 李慕然,刘艳迪,唐涛,等.幽门螺杆菌和慢性胃炎胃黏膜病理变化的关系研究.天津医药,2015,43(1):54-56.
[7] Park YH, Kim N. Review of atrophic gastritis and intestinal metaplasia as a premalignant lesion of gastric cancer. Cancer Prev, 2015, 20(1): 25-40
[8] Salama NR, Hartung ML, Muller A. Life in the human stomach: persistence strategies of the bacterial pathogen Helicobacter pylori. Nat Rev M icrobiol, 2013, 11(6): 385-399.
[9] Lazaraki G, Kountouras J, Metallidis S, et al. Helicobacter pylori infection upregulates endothelial nitric oxide synthase expression and induces angiogenesis in gastric mucosa of dyspeptic patients. Eur J Gastroenterol Hepatology, 2008, 20(5): 441-449.
[10] Xu H, Chaturvedi R, Cheng Y, et al. Sperm ine Oxidation Induced by Helicobacter pylori Results in Apoptosis and DNA Damage Implications for Gastric Carcinogenesis. Cancer Res, 2004, 64(23): 8521-8525.
[11] Kuwahara H, M iyamoto Y, Akaike T, et al. Helicobacter pylori urease suppresses bactericidal activity of peroxynitrite via carbon dioxide production. Infect Immun. 2000, 68:4378-4383.
Establishment and evaluation of infammation models induced by Helicobacter pylori in culture
Lian Dawei, Ren Wenkang, Fu Lijun, Xu Yifei, Huang Ping, Cao Hongying*
(College of Traditional Chinese Medicine, Guangzhou University of Chinese Medicine,Guangzhou 510405, China)
ObjectiveTo establish and evaluate two infammation models infected w ith Helicobacter pylori (H. pylori) in 2 cell lines to provide a basis method for further studying H. pylori infection and its mechanism.M ethodsH. pylori-infected MKN45 cell models were established by co-culturing MKN45 cells and H. pylori for 6h, 12h and 24h, respectively. The cell viability was measured by trypan blue staining and lactate dehydrogenase (LDH) method; the m itochondrial membrane potential (MMP) was detected by rhodamine123 staining w ith fuorescent m icroscopy and fow cytometry. H. pylori-infected RAW 264.7 cell models were established by the same procedures as above. The content of nitric oxide (NO) in the supernate was measured by Griess method; the expression of Tnf-α, Inos and Cox-2 genes in the cells was detected by RT-qPCR.ResultsIn MKN45 models, 12h and 24h co-culture w ith H. pylori signif cantly reduced cell viability and MMP, suggesting that 12h H. pylory infection could generate remarkable cytotoxic ef ect. In RAW 264.7 models, co-cultured w ith H. Pylori for 6h, 12h and 24h, the NO content in the supernate and the expression of Tnf-α, Inos and Cox-2 all increased, suggesting that H. pylori infection promoted the expression of proinfammatory factors in macrophages and this ef ect strengthened w ith time.ConclusionH. pylori-infected MKN45 cells and RAW 264.7 macrophages are ideal cell models for studying H. pylori infection and its mechanism.
Helicobacter pylori; cell model; cytotoxicity; proinfammatory factor
R573
A
10.16705/ j. cnki. 1004-1850.2017.03.006
2016-12-23
2017-06-02
广东省科技计划资助项目(2016A020217019);广州市科技计划资助项目(201607010336)资助;国家自然科学基金资助项目(81374043)
连大卫,男(1988年),汉族,博士在读
*通讯作者(To whom correspondence should be addressed):1171629708@qq.com
