T淋巴细胞用于肿瘤过继细胞治疗的研究进展
2017-07-25周玉川肖东琴冯刚李光明
周玉川,肖东琴,冯刚,李光明
(川北医学院第二临床学院·南充市中心医院组织工程与干细胞研究所,四川 南充 637000)
T淋巴细胞用于肿瘤过继细胞治疗的研究进展
周玉川,肖东琴,冯刚,李光明
(川北医学院第二临床学院·南充市中心医院组织工程与干细胞研究所,四川 南充 637000)
自从Burnet和Thomas创立并完善免疫监视学说以来,医学界研究人员清楚地认识到免疫系统,尤其是T淋巴细胞在抗肿瘤过程中的重要作用,因而出现了一系列改造和利用T细胞预防甚至杀灭肿瘤的研究。此外,过继性细胞治疗作为当前有效的治疗手段,特别是基于改造后的T淋巴细胞(如肿瘤浸润淋巴细胞,T细胞受体基因转导的T细胞,嵌合抗原受体T细胞)用于人体肿瘤的治疗,取得了极大的疗效,引起了人们的广泛关注。本文就T淋巴细胞用于肿瘤过继细胞治疗的最新的研究进展做如下综述。
T细胞;肿瘤;过继细胞治疗
近年来,肿瘤在我国的发病率越来越高[1],手术、放疗、化疗作为目前治疗肿瘤的主要手段,存在手术伤害大,放化疗副作用大等问题。这导致患者总体生活质量低下,并且经过这些治疗,大多数患者还是会复发。面对这些难题,科研人员致力于开发更高效的肿瘤治疗手段。自上世纪八十年代,Rosenberg等[2]在体外运用肿瘤过继细胞(adoptive cell transfer, ACT)治疗黑色素瘤取得良好的治疗效果,ACT疗法用于肿瘤治疗经历了几十年的发展,至今成为全球肿瘤治疗研究的热点。
1 肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)用于肿瘤治疗的研究
当人体有肿瘤细胞出现时,免疫细胞如T 细胞, B 细胞, 自然杀伤细胞(natural killer cells,NKs), 单核巨噬细胞(Macrophages)等可浸入肿瘤组织并杀伤肿瘤,这便是TIL。其中最主要的抗肿瘤细胞是T淋巴细胞,它可通过主要组织相容性复合体(major histocompatibility complex,MHC)限制性识别肿瘤细胞表面出现的特异性抗原并杀伤肿瘤,使人体保持健康。但是,随着肿瘤负荷增加,能特异识别肿瘤细胞表面抗原的T细胞数量不足以清除肿瘤。鉴于此,Rosenberg等[3]运用体外细胞培养技术,对TIL进行大量扩增,再将扩增后的TIL回输到患者体内,使肿瘤患者病情缓解,至此,TIL开始运用于人体试验[4]。
自TIL问世以来,最常用于黑色素瘤的治疗。最初TIL治疗肿瘤包含一系列复杂的过程,首先要利用外科手术切除多个病灶,然后体外分离出TIL,经过细胞毒性测试,体外培养2~3个星期获得大量细胞后,再运用于患者的治疗。然而,这些临床试验也逐步暴露出制作时间长,分离和扩增TIL困难以及细胞毒性测试困难等问题[5]。为此,研究人员去除了TIL毒性检测,缩短了TIL的培养时间,细胞质量却与之前相似。分析原因是短时间培养的TIL纯度高,突变少,细胞端粒长,进入体内的复制能力强,且传代少的细胞高表达共刺激因子CD27,CD28,4-1BB等,因此抗肿瘤能力强[6-7]。
TIL杀伤肿瘤细胞的重要原因在于TIL能通过MHC限制性识别肿瘤细胞表达的特异性抗原。鉴于此,1991年Bruggen用一名黑色素瘤患者的TIL克隆出了肿瘤抗原,即MZ2-E[8],在此基础上,更多肿瘤特异性抗原被筛选出来[9-10]。这些特异性抗原存在于各种肿瘤组织中。目前治疗黑色素瘤的TIL识别的抗原有以下几种:(1)黑色素细胞分化抗原,如MART-1和gp100,这些抗原存在于所有的黑色素细胞中,不论正常还是恶性组织,虽然TIL能识别并提取这些抗原,但针对这些抗原的细胞毒性作用并未观察到,是否具有抗肿瘤作用也不清楚;(2)癌胚抗原,如NY-eso-1[11],MAGE[12]。这类抗原属于肿瘤共同特异性抗原,即抗原在多种肿瘤中表达。这类抗原多定位于X染色体,表达于胚胎组织或生殖系统中,在成年人正常组织中极少表达;(3)抗原存在于正常组织和肿瘤组织中,但在肿瘤细胞中过表达,如Meloe-1[13],因基因表观遗传学的改变,导致了该蛋白的过表达;(4)基因突变所致的新抗原,包括CDK4和β-catenin[14],虽然基因突变所出现的新抗原是肿瘤所独有且稀少的,但TIL识别这些抗原后并不产生细胞毒性效应,具体机制不明,可能与肿瘤细胞逃避机体免疫监视有关。
鉴于TIL治疗黑色素瘤所取得的成功,研究人员迫切希望验证TIL在其他实体瘤上的效果,先后有宫颈癌、卵巢癌、肾癌、胃肠道肿瘤、头颈部鳞癌等纳入研究[15]。尽管TIL治疗黑色素瘤表现出了强大的细胞增殖能力和杀伤作用,但在其他肿瘤中并未出现类似疗效,至今仍不清楚TIL在这些肿瘤中到底识别哪些肿瘤抗原以及为何不产生细胞毒性作用。但是正是这些尝试,使得TIL细胞的提取扩增有了更多选择方法,为后续的临床应用提供了研究基础。
2 基因改造的T细胞(genetically engineered T cells)用于肿瘤治疗的研究
2.1 TCR-T和CAR-T的技术原理
TIL可使部分黑色素瘤患者病情缓解,但其治疗范围窄,总体有效率低。随着基因工程技术的发展,将目的基因转入人类外周血T细胞内的技术已经成熟,运用慢病毒载体或逆转录病毒载体设计的抗肿瘤免疫细胞也已在许多患者体内实验[16]。至今,已成功制备出T细胞受体基因转导的T细胞(t-cell receptor genetically transdused T cells,TCR-T)和嵌合抗原受体T细胞(chimeric antigen receptor T cells,CAR-T),它们的出现大大提高了抗肿瘤的效率和范围。TCR-T的制备与TIL成功治疗黑色素瘤有关。在TIL通过MHC限制性识别抗原并杀伤肿瘤后,利用基因克隆技术获取该段TCR序列[17],再利用载体将该段基因转染至更多的T细胞上,使识别该抗原的T细胞上万倍的增长,这就是TCR-T的技术原理。而CAR-T最初由Eshhar和同事在1993年设计[18],它的基本原理是利用基因转染技术将能识别肿瘤表面抗原的单链抗体(single chain variable fragment,scFv)[19]、跨膜区、胞内信号识别区依次表达于T细胞。CAR-T在识别位于肿瘤细胞表面的抗原后被激活,然后无MHC 限制性直接杀伤肿瘤细胞。正常的人体免疫系统清除肿瘤必须依赖MHC的限制性,然而大多数肿瘤通过调节或不表达MHC来逃避T细胞的监视,基于此,基因改造后的CAR-T能有效的清除肿瘤细胞。
2.2 TCR-T和CAR-T的结构
TCR-T的结构简单,其本身来源于正常的人体TCR,它是识别了抗原肽-MHC分子复合物(peptide-MHC)的特定TCR,含有特定的序列。运用基因克隆技术将该TCR的基因转染至其他T细胞内便可成功制备。
而相对于TCR-T,CAR-T的结构更复杂,制备更困难,一般可分成四部分,即抗原识别区,铰链连接区,跨膜区和胞内区。抗原识别区即scFv,它是能识别抗原的免疫球蛋白的最小单位,来源于各种单克隆抗体。为了优化抗原识别效率,Grada等[20]将两个不同的scFv通过铰链串联起来,可同时识别两种不同的抗原,可以更精确的靶定肿瘤细胞。铰链连接区,它是连接抗原识别区和T细胞膜的结构。普遍认为铰链连接区与胞内信号激活、抗原识别区的活动度、调节T细胞与肿瘤细胞间的反应距离有关。铰链连接区由IgG亚类的基因编码,如IgG1,IgG4,IgD,CD8,最常用的是IgG1[21]。需要指出的是,铰链连接区并不是必须具备的结构。以CD3ζ为胞内信号传递的CARs需要铰链连接作为信号传递,而以FcεRIγ为胞内信号传递的CARs不需要[22]。CARs识别抗原表位碳端需要铰链连接区,识别抗原表位为氮端则不需要[23]。跨膜区和铰链连接区相似,来源于CD3、CD4、CD8、CD28跨膜基因区段[24]。总的来说,铰链连接区和跨膜区的虽然不是整个反应系统的最重要的组分,但它们在抗原识别与信号传导中发挥了积极作用。胞内区来源于淋巴细胞信号启动分子,这些分子启动后可产生一系列免疫效应,如激活T细胞,启动基因的转录,发挥免疫细胞毒性反应等。根据胞内信号分子的组成不同可将CAR-T分成四代。第一代的CARs的胞内信号仅由TCR/CD3复合物的ζ链或IgE高亲和力受体γ链(FcεRIγ)组成[25],体内外实验也观察到了T细胞增殖,但细胞毒性弱,增殖能力不强。分析原因是肿瘤诱导免疫耐受,导致共刺激分子缺失,导致T细胞失能。因此便有了加入一个共刺激分子信号与CD3ζ串联的第二代CAR-T,因为T细胞激活的共刺激分子可有多个,又设计了含两个共刺激分子与CD3ζ串联的第三代CAR-T。目前常用的共刺激分子是CD28、OX40(CD134)、4-1BB(CD137)[26]。第四代CAR-T在第二代和第三代的基础上,对CAR-T做了各种各样的改造,这些改造后的细胞可产生各种免疫增强效应,减轻副作用。为了将免疫细胞聚集在肿瘤位点,可在细胞上共表达CXCR2、CCR4、CCR2b、VEGFR2等细胞因子受体[27]。此外,为了提高CAR-T的生存期和增殖能力,研究人员选用了增殖能力强的记忆细胞来基因改造,观察到短期内细胞增殖活跃。同时基因改造后的细胞共表达IL12,IL15等细胞因子可延长细胞生存期,提高细胞活力[28-29]。为克服异体CAR-T所产生的移植物抗宿主病,采用RNA干扰技术敲除α和β链提高移植细胞的存活率[30]。免疫系统预防肿瘤失败的重要原因是免疫抑制的问题,而为了解决这个问题,各种实验开展开来,如表达生存基因Bcl-X[31],上调CD25的表达[32],共表达4-1BBL或者CD40L[33],然后抑制调节T细胞(Treg supression),阴性表达转化生长因子β(TGFβ)[34]等。利用抗NKG2D可改善实体瘤的肿瘤微环境,提高抗肿瘤疗效[35]。这些临床试验都在一定程度上增强了CAR-T抗肿瘤疗效。
2.3 TCR-T和CAR-T的临床应用
TCR-T和CAR-T是抗肿瘤的新方法,但疗效不一。TCR-T来自于TCR,因此可识别来源于细胞核、胞浆、胞膜的各种抗原。与CAR-T相比,这是TCR-T的最大优点。CAR-T的抗肿瘤效应是通过抗原抗体反应,因此理论上所有抗原均可设计成为scFv的靶点,现今用于研究的抗原有多种,包括蛋白质,蛋白多糖,高度糖基化蛋白,神经节苷脂,糖类等[24],这些位于肿瘤细胞表面的抗原大多数属于肿瘤相关抗原(tumor association antigen,TAA)。
利用抗CD19的CAR-T治疗慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL),病人出现完全缓解[36]。此后CAR-T治疗肿瘤的研究蓬勃发展。运用抗CD19的CAR-T治疗急性淋巴细胞白血病、慢性淋巴细胞白血病、多发性骨髓瘤、淋巴瘤,抗CD20治疗淋巴瘤,抗Lewis Y antigen或CD33治疗急性髓系白血病[37],它们都在不同程度上取得了疗效。在血液系统肿瘤之外,抗实体瘤也做了大量实验, 针对的抗原有Mesothelin,EGFRvⅢ,GD2,HER2,CD171,CEA,PSMA,CAⅨ,IL13等[38]。这一系列实验中,出现过肿瘤完全缓解(抗GD2)[39],但总体而言,CAR-T针对实体瘤还疗效甚微。
2.4 TCR-T和CAR-T的安全性
运用基因改造的T细胞治疗肿瘤虽然取得了一定的疗效,但同时出现了很多安全性问题。TCR-T临床试验从治疗黑色素瘤开始,它识别的TAA是MART-1和gp100,治疗后患者病情缓解,但出现了皮疹,白癜风,听觉视觉障碍等副作用[40]。在抗CEA的的临床试验中,病人出现了更严重的致死性的肠炎[41],在抗MAGE-A3的一系列试验中,病人出现了脑毒性和心脏毒性导致病人死亡[42],这些使得TCR-T的应用前景堪忧。为了规避巨大的副作用,NY-ESO1[43],一种癌胚抗原,同时也是肿瘤特异性抗原的TCR-T被应用于临床,取得良好的疗效,患者体内未观察到副作用。这又为TCR-T的临床试验开辟了新路,虽然还未有其他相关报道,但研究已经在许多实验室开展。
自从克服了第一代CAR-T增殖过低,细胞失能的问题,后面几代CAR-T又走到了反面,即增殖能力强、细胞毒性强导致的安全性问题。不管是TCR-T治疗黑色素瘤出现的皮肤病变和眼耳毒性,还是最初抗CAⅨ的CAR-T导致了病人出现胆汁郁积症[44],以及后来试验中出现的更严重的副作用,他们产生的原因都是细胞毒性反应。这些细胞毒性反应分成两种情况,其一是杀瘤效应可产生具有致死性的细胞因子释放综合征(cytokine release syndromes,CRS),巨噬细胞激活综合征(macrophage activation syndromes,MAS),以及神经毒性和融瘤综合征(tumor lysis syndrome,TLS)。这些副作用主要发生于CAR-T治疗肿瘤时。因为CAR-T进入体内可迅速发生抗原抗体反应,可短时间释放大量的细胞炎症因子,如IL6,TNFα,INFγ,继而患者出现高血压,高热,缺氧甚至严重到器官衰竭而死[45]。虽然可运用炎症因子抑制剂和激素抗炎治疗,但细胞因子释放综合征发展迅速,需要及时对症治疗,因此是临床试验必须重视的问题。第二个问题是杀伤肿瘤组织的同时对正常组织的破坏,这是TCR-T产生副作用的主要机制[46],而CAR-T经过基因改造后,识别杀伤目标细胞无MHC限制性,且目标抗原多数是肿瘤相关抗原,这些抗原可于正常组织中表达,因此CAR-T攻击肿瘤细胞时也会杀伤正常组织(表1)。例如在最有效的抗CD19CAR-T中,CD19表达于所有的B淋巴细胞,因此必须在实验前去除外周血中表达CD19的淋巴细胞,而治疗后的人体会出现B细胞缺乏症,这样会导致人体体液免疫缺失,病人必须输注丙种球蛋白。还有基因改造后的免疫细胞本身就具有免疫原性,不管是转染时所用的载体还是来源于鼠类的抗体(scFv),都具有潜在的治病性。
2.5 TCR-T和CAR-T发展方向
面对已经出现的问题,研究人员综合各种理论,运用新技术优化CAR-T的结构,为解决增殖能力强,效应细胞过多的问题。研究人员设计了在mRNA基础上基因改造的CAR-T[47],改造后的细胞不会增殖。另一种方案是在转染细胞内引入自杀基因[48],这种方案可清除过量的细胞。然而又因为暂时性表达导致体内出现了针对CAR-T的过敏反应[49],且转染的基因来源于其他动物本身可能会产生免疫原性,即使采用人体自身的抗体制成的CAR-T,也在后续的试验中证实疗效不好[50]。在转染基因序列中加入剪切后的上皮生长因子受体(epidermal growth factor receptor to generate a small,truncated derivative,tEGFR),运用西妥昔单抗可清除载有tEGFR的CAR-T[51],因此可有效清除过量的免疫细胞。为了解决脱靶效应,科研人员致力于提高CAR-T识别肿瘤细胞的特异性,设计了双靶点的的CAR-T,即需要同时识别肿瘤细胞上的(A+B)两种抗原才发挥细胞毒性作用,令一种方案抗原识别方案是(A+非B)或(非A+B),这两种方案都能显著提高识别肿瘤细胞的特异性[52]。最新的研究设计了一种可识别肿瘤细胞表面抗原密度的scFv,这种scFv与抗原低表达的正常细胞不反应,必须达到反应所需的抗原密度才与之反应[53]。此外,还有利用最新的睡美人转座子系统来基因工程改造T细胞[54],可降低潜在的病毒载体免疫原性。
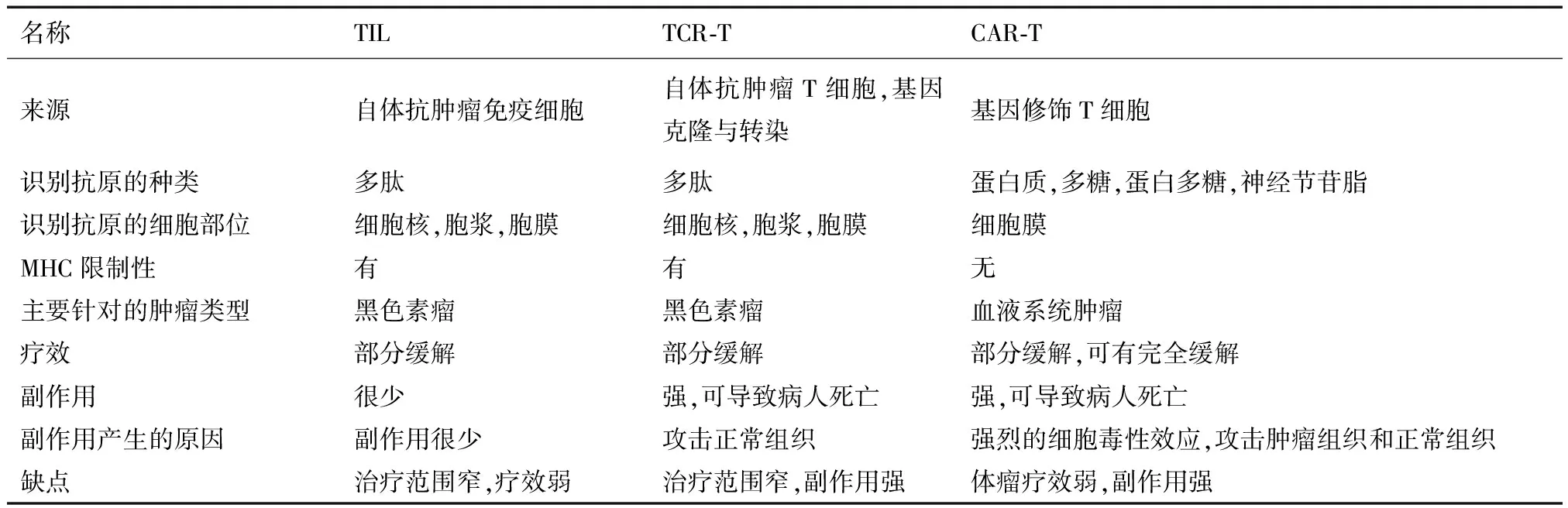
表1 3种免疫细胞的比较
3 总结
随着人们对肿瘤认识的深入,越来越多的人认识到免疫系统对人体的重要作用。基因改造后的免疫细胞作为一种高效的抗肿瘤技术,为人类最终战胜肿瘤提供了可行性。随着各种配套技术提高,在精准医疗的基础上,运用基因组学,蛋白组学等手段寻找到更高效,特异性更强的肿瘤抗原,将是人类治愈肿瘤的突破口。
[1] Chen W,Zheng R,Baade PD,etal.Cancer statistics in China 2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2] Rosenberg SA,Lotze MT,Muul LM,etal.Observations on the systemic administration of autologous lymphkine-activated killer cells and recombinant interleukin-2 to patients with metastatic cancer[J].Cell Immunol,2012,278(1-2):21-26.
[3] Rosenberg SA,Packard BS,Aebersold PM,etal.Use of tumor-infiltrating lymphocytes and interleukin-2 in the immunotherapy of patients with metastatic melanoma.A preliminary report[J].N Engl J Med,1988,319(25):1676-1680.
[4] Dudley ME,Gross CA,Langhan MM,etal. CD8+ enriched “young” tumor infiltrating lymphocytes can mediate regression of metastatic melanoma[J].Clin Cancer Res,2010,16(24):6122-6131.
[5] Dudley ME,Wunderlich JR,Yang JC,etal.Adoptive cell transfer therapy following non-myeloablative but lymphodepleting chemotherapy for the treatment of patients with refractory metastatic melanoma[J].J Clin Oncol,2005,23(10):2346-2357.
[6] Itzhaki O,Hovav E,Ziporen Y,etal.Establishment and large-scale expansion of minimally cultured “young” tumor infiltrating lymphocytes for adoptive transfer therapy[J].J Immunother,2011,34(2):212-220.
[7] Radvanyi LG,Bernatchez C,Zhang M,etal.Specific lymphocyte subsets predict response to adoptivecell therapy using expanded autologous tumor-infiltrating lymphocytes in metastatic melanoma patients[J].Clin Cancer Res,2012,18(24):6758-6770.
[8] Van der Bruggen P,Traversari C,Chomez P,etal.A gene encoding an antigen recognized by cytolytic T lymphocytes on a human melanoma[J].Science,1991,254(5038):1643-1647.
[9] Verdegaal EM,de Miranda NF,Visser M,etal.Neoantigen landscape dynamics during human melanoma-T cell interactions [J].Nature,2016,536(7614):91-95.
[10]Kawakami Y,Eliyahu S,Delgado CH,etal.Cloning of the gene coding for a shared human melanoma antigen recognized by autologous T cells infiltrating into tumor[J].Proc Natl Acad Sci USA,1994,91(9):3515-3519.
[11]Tarnowski M,Czerewaty M,Deskur A,etal.Expression of Cancer Testis Antigens in Colorectal Cancer:New Prognostic and Therapeutic Implications[J].Dis Marker,20162016:1987505.
[12]Scanlan MJ,Welt S,Gordon CM,etal.Cancer-related serological recognition of human colon cancer:identification of potential diagnostic and immunotherapeutic targets[J].Cancer Res,2002,62(14):4041-4047.
[13]Godet Y,Moreau-Aubry A,Guilloux Y,etal.MELOE-1 is a new antigen overexpressed in melanomas and involved in adoptive T cell transfer efficiency[J].J Exp Med,2008,205(11):2673-2682.
[14]Wang RF,Rosenberg SA.Human tumor antigens recognized by T lymphocytes:implications for cancer therapy[J].J Leukoc Biol,1996,60(3):296-309.
[15]Geukes Foppen MH,Donia M,Svane IM,etal.Tumor-infiltrating lymphocytes for the treatment of metastatic cancer[J].Mol Oncol,2015,9(10):1918-1935.
[16]June CH,Blazar BR,Riley JL.Engineering lymphocyte subsets:tools, trials and tribulations[J].Nat Rev Immunol,2009,9(10):704-716.
[17]Morgan RA,Dudley ME,Wunderlich JR,etal.Cancer regression in patients after transfer of genetically engineered lymphocytes[J].Science,2006,314(5796):126-129.
[18]Esshar Z,Schindler DG,Waks T,etal.Targeting of T lymphocytes to Neu/HER2-expressing cells using chimeric single chain Fv receptors[J].J Immunol,1993,151(11):6577-6582.
[19]Yuasa N,Koyama T,Subedi GP,etal.Expression and structural characterization of anti-T-antigen single-chain antibodies (scFvs) and analysis of their binding to T-antigen by surface plasmon resonance and NMR spectroscopy[J].J Biochem.2013,154(6):521-529.
[20]Grada Z,Hegde M,Byrd T,etal.TanCAR: A Novel Bispecific Chimeric Antigen Receptor for Cancer Immunotherapy[J].Mol Ther Nucleic Acids,2013,2(192):e105.
[21]Kradin R,Kurnick J,Gifford J,etal.Adoptive immunotherapy with interleukin-2 (IL-2) results in diminished IL-2 production by stimulated peripheral blood lymphocytes[J].J Clin Immunol,1989,9(5):378-385.
[22]Shi H,Sun M,Liu L,etal.Chimeric antigen receptor for adoptive immunotherapy of cancer:latest research and future prospects[J].Mol Cancer,2014,13:219.
[23]Guest RD,Hawkins RE,Kirillova N,etal.The role of extracellular spacer regions in the optimal design of chimeric immune receptors:evaluation of four different scFvs and antigens[J].J Immunother,2005,28(3):203-211.
[24]Dai H,Wang Y,Lu X,etal.Chimeric Antigen Receptors Modified T-Cells for Cancer Therapy[J].J Natl Cancer Inst,2016,108(7):djv439.
[25]Jensen MC,Riddell SR.Designing chimeric antigen receptors to effectively and safely target tumors[J].Curr Opin Immunol,2015,33:9-15.
[26]Vonderheide RH,June CH.Engineering T cells for cancer:our synthetic future[J].Immunol J Rev,2014,257(1):7-13.
[27]Chmielewski M,Kopecky C,Hombach AA,etal.IL-12 release by engineered T-cells expressing chimeric antigen receptors can effectively Muster an antigen-independent macrophage response on tumor cells that have shut down tumor antigen expression[J].Cancer Res,2011,71(17):5697-5706.
[28]Pegram HJ,Lee JC,Hayman EG,etal.Tumor-targeted T-cells modified to secrete IL-12 eradicate systemic tumors without need for prior conditioning[J].Blood,2012,119(18):4133-4141.
[29]Hoyos V,Savoldo B,Quintarelli C,etal.Engineering CD19-specific T lymphocytes with interleukin-15 and a suicide gene to enhance their anti-lymphoma/leukemia effects and safety[J].Leukemia,2010,24(6):1160-1170.
[30]Torikai H,Cooper LJ.Translational Implications for Off-the-shelf Immune Cells Expressing Chimeric Antigen Receptors[J].Mol Ther,2016,24(7):1178-1186.
[31]Eaton D,Gilham DE,O’Neill A,etal.Retroviral transduction of human peripheral blood lymphocytes with Bcl-X(L) promotes in vitro lymphocyte survival in pro-apoptotic conditions[J].Gene Ther,2002,9(8):527-535.
[32]Chang ZL,Silver PA,Chen YY.Identification and selective expansion of functionally superior T cells expressing chimeric antigen receptors[J].J Transl Med,2015,13(1):1-16.
[33]Curran KJ,Seinstra BA,Nikhamin Y,etal.Enhancing antitumor efficacy of chimeric antigen receptor T cells through constitutive CD40L expression[J].Mol Ther,2015,23(4):769-778.
[34]Foster AE,Dotti G,Lu A,etal.Antitumor activity of EBV-specific T lymphocytes transduced with a dominant negative TGF-beta receptor[J].J Immunother,2008,31(5):500-505.
[35]Barber A, Rynda A, Sentman CL. Chimeric NKG2D expressing T-cells eliminate immunosuppression and activate immunity within the ovarian tumor microenvironment[J]. J Immunol, 2009, 183(11):6939-6947.
[36]Porter DL,Levine BL,Kalos M,etal.Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia[J].N Engl J Med,2011,365(8):725-733.
[37]Hossain NM,Chapuis AG,Walter RB.T-Cell Receptor-Engineered Cells for the Treatment of Hematologic Malignancies[J].Curr Hematol Malig Rep,2016,11(4):311-317.
[38]Klebanoff CA,Rosenberg SA,Restifo NP.Prospects for gene-engineered T cell immunotherapy for solid cancers[J].Nat Med,2016,22(1):26-36.
[39]Louis CU,Savoldo B,Dotti G,etal.Antitumor activity and long-term fate of chimeric antigen receptor-positive T-cells in patients with neuroblastoma[J].Blood,2011,118(23):6050-6056.
[40]Johnson LA,Morgan RA,Dudley ME,etal.Gene therapy with human and mouse T-cell receptors mediates cancer regression and targets normal tissues expressing cognate antigen[J].Blood,2009,114(3):535-546.
[41]Parkhurst MR,Yang JC,Langan RC,etal.T cells targeting carcinoembryonic antigen can mediate regression of metastatic colorectal cancer but induce severe transient colitis[J].Mol Ther,2011,19(3):620-626.
[42]Linette GP,Stadtmauer EA,Maus MV.etal.Cardiovascular toxicity and titin cross-reactivity of affinityenhanced T cells in myeloma and melanoma[J].Blood,2013,122(6):863-871.
[43]Robbins PF,Morgan RA,Feldman SA,etal.Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1[J].J Clin Oncol,2011,29(7):917-924.
[44]Lamers CH,Sleijfer S,Vulto AG,etal.Treatment of metastatic renal cell carcinoma with autologous T-lymphocytes genetically retargeted against carbonic anhydrase IX:first clinical experience[J].Journal of Clinical Oncology,2006,24(13):e20- e22.
[45]Gross G,Eshhar Z. Therapeutic Potential of T Cell Chimeric Antigen Receptors (CARs) in Cancer Treatment:Counteracting Off-Tumor Toxicities for Safe CAR T Cell Therapy[J].Annu Rev Pharmacol Toxicol,2016,56(1):59-83.
[46]Bendle GM,Linnemann C,Hooijkaas AI.etal.Lethal graft-versus-host disease in mouse models of T cell receptor gene therapy[J].Nat. Med,2010,16(5):565-570.
[47]Zhao Y,Moon E,Carpenito C,etal.Multiple injections of electroporated autologous T-cells expressing a chimeric antigen receptor mediate regression of human disseminated tumor[J].Cancer Res,2010,70(22):9053-9061.
[48]Quintarelli C,Vera JF,Savoldo B,etal.Co-expression of cytokine and suicide genes to enhance the activity and safety of tumor-specific cytotoxic T lymphocytes[J].Blood,2007,110(8):2793-2802.
[49]Maus MV,Haas AR,Beatty GL,etal.T-cells expressing chimeric antigen receptors can cause anaphylaxis in humans[J].Cancer Immunol Res,2013,1(1):26-31.
[50]Song DG,Ye Q,Poussin M,etal.A fully human chimeric antigen receptor with potent activity against cancer cells but reduced risk for off-tumor toxicity[J].Oncotarget,2015,6(25):21533-21546.
[51]Wang X,Chang WC,Wong CW,etal.A transgene-encoded cell surface polypeptide for selection,in vivo tracking,and ablation of engineered cells[J].Blood,2011,118(5):1255-1263.
[52]Fedorov VD,Themeli M,Sadelain M.PD-1-and CTLA-4-based inhibitory chimeric antigen receptors (iCARs) divert off-target immunotherapy responses[J].Sci Transl Med,2013,5(215):1283-1299.
[53]Caruso HG,Hurton LV,Najjar A,etal.Tuning Sensitivity of CAR to EGFR Density Limits Recognition of Normal Tissue While Maintaining Potent Antitumor Activity[J].Cancer Res,2015,75(17):3505-3518.
[54]Kacherovsky N,Liu GW,Jensen MC,etal.Multiplexed gene transfer to a human T-cell line by combining Sleeping Beauty transposon system with methotrexate selection[J].Biotechnol Bioeng,2015,112(7):1429-1436.
(学术编辑:马代远)
本刊网址:http://www.nsmc.edu.cn
作者投稿系统:http://noth.cbpt.cnki.net
邮箱:xuebao@nsmc.edu.cn
本刊网址:http://www.nsmc.edu.cn
作者投稿系统:http://noth.cbpt.cnki.net
邮箱:xuebao@nsmc.edu.cn
10.3969/j.issn.1005-3697.2017.03.041
四川省科技厅应用基础项目(2016JY0123);四川省教育厅创新团队资助项目(13TD0030);川北医学院科研发展计划(CBY15-A-ZD01,CBY15-A-ZD06)
2016-09-12
周玉川(1990-),男,硕士研究生。E-mail:zhouyuchuan1990@163.com
李光明,E-mail:liguangming9999@yahoo.com.cn
时间:2017-6-21 18∶11 网络出版地址:http://kns.cnki.net/kcms/detail/51.1254.R.20170621.1811.082.html
1005-3697(2017)03-0461-06
R730.5
A
