嗜酸乳酸杆菌对实验性溃疡性结肠炎治疗的最佳浓度探索及免疫学机制初探
2017-07-25陈琳琳郑倩
陈琳琳,郑倩
(1.中南大学湘雅医院消化科,湖南 长沙 410000;2.郴州市第一人民医院消化内科,湖南 郴州 423000)
嗜酸乳酸杆菌对实验性溃疡性结肠炎治疗的最佳浓度探索及免疫学机制初探
陈琳琳1,郑倩2
(1.中南大学湘雅医院消化科,湖南 长沙 410000;2.郴州市第一人民医院消化内科,湖南 郴州 423000)
目的:比较不同浓度嗜酸乳酸杆菌治疗实验性溃疡性结肠炎(ulerativecolitis,UC)的疗效,分析其对结肠近、远端菌群的影响,寻找治疗UC适宜的嗜酸乳酸杆菌浓度,并探索其免疫学机制。方法:雌性Balb/c小鼠56只,随机分为7组(n=8),葡聚糖硫酸钠(DSS)造UC模型鼠,分别予以不同浓度嗜酸乳酸杆菌、激素、生理盐水干预UC模型鼠,观察小鼠一般情况,计算疾病活动指数(DAI) 评分、组织损伤评分,留取小鼠肠道组织进行肠道固生菌群分析,并进行PCR及Western-Blotting检测UC相关的IL-23、IL-17、TNF-α。结果:106CFU/mL浓度级嗜酸乳酸杆菌干预组小鼠UC症状缓解最明显,且远端结肠益生菌(乳酸杆菌和双歧杆菌)数量最多,致病菌(金黄色葡萄球菌)最低;UC相关的IL-23、IL-17、TNF-α无论mRNA水平还是蛋白质水平,均为嗜酸乳酸杆菌干预组最低,尤其以106U/10g嗜酸乳酸杆菌灌胃组最低。结论:嗜酸乳酸杆菌治疗UC与其在结肠远端有较高浓度乳酸杆菌有关,然而疗效并非与细菌浓度完全正相关,炎性因子IL-23、IL-17、TNF-α与UC疾病严重程度呈正相关,与嗜酸乳酸杆菌对UC的治疗作用相关。
嗜酸乳酸杆菌;菌群分析;实验性结肠炎;免疫学机制;白细胞介素23;白细胞介素17
炎性肠病(inflammatory bowel disease,IBD)包括克罗恩病(Crohn’s disease,CD) 和溃疡性结肠炎(ulcerative colitis,UC),其病因主要包括遗传、免疫、环境等因素。近年来, 由于外界环境因素的改变,IBD发病率呈现上升趋势[1],这些现象说明外界环境对IBD的影响比遗传更为重要。外界环境通过食物等与肠道接触,对肠道菌群产生最直接的影响。由于IBD中的UC主要发病部位集中于有高浓度细菌的结直肠部位,无论临床观察、干预治疗还是动物研究,均已证明UC的发生与肠道菌群异常密切相关,环境对UC的影响最终归结于肠道细菌[2]。
研究表明益生菌对UC具有一定的疗效。益生菌是一类对宿主有益的活性微生物,但仍为一种活菌制剂,具有繁殖、分泌等功能。补充大量的益生菌后是否会改变肠道细菌的种类和数量以及是否会产生潜在的致病性还不甚明确。已知UC的发病部位集中在结、直肠,根据细菌的定植特点,益生菌能否到达有效部位、细菌浓度以及与其它菌群的关系等都是影响其疗效的重要因素。此外,已有研究[3]表明,粪便细菌受食物的影响很大,如果改变饮食的成份,24 h就可出现完全不一样的细菌群。而UC是一种慢性反复发作性的疾病,显然,仅分析肠道粪便或肠内容物的细菌难以反映UC菌群异常的真实情况。因此,找出UC患者稳定存在于肠道固生菌群,才能反映UC肠道菌群异常的真实情况。
本实验以葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导UC模型鼠,选择前期研究对UC有效的嗜酸乳酸杆菌以不同浓度(104~108/mL)分组治疗,并与生理盐水和激素类药物比较,计算疾病活动指数(disease activity index,DAI)评分和结肠组织损伤评分以验证其疗效,并分析结肠近、远端菌群变化情况。IBD虽然病因不明,但已有的研究已证实IBD存在明显的免疫紊乱,大量动物和临床研究显示抗TNFα免疫疗法对UC的治疗有效,提示TNFα在IBD发病中起着重要作用,然而从IBD相关的CD4+T细胞亚群的分化情况可以看出,TNFα并非为Th1和Th2细胞主要产生,提示有其它的免疫细胞存在。近来发现的Th17细胞证实了这个观点,本实验进一步分析了Th17/IL-23轴与UC相关的主要细胞因子(TNF-α、IL-23、IL-17)以期有新的发现,为益生菌治疗UC提供理论基础。
1 材料与方法
1.1 材料
菌株:嗜酸乳酸杆菌由本实验室从正常人肠道自行分离鉴定后采用。
主要试剂:醋酸泼尼松(45 μg/10 g);DSS(MW 5 000, sigma公司);抗体:β-actin、IL-17、IL-23、TNF-α(San Cruz公司)。
1.2 方法
1.2.1 实验动物分组及实验设计 实验用Balb/c小鼠56只,雌性,6~8周龄,体重(20.0±2.0)g(购于湖南农业大学),随机分成7组,每组8只。分组情况如下:(1)模型组:5%DSS自由饮用;(2)生理盐水组(Normal saline,NS组):5%DSS自由饮用+NS(1 mL/10 g)灌胃;(3)A组:5%DSS自由饮用+1×104U/10 g 嗜酸乳酸杆菌灌胃;(4)B组:5% DSS自由饮用+1×106U /10 g 嗜酸乳酸杆菌灌胃;(5)C组:5%DSS自由饮用+1×108U/10 g 嗜酸乳酸杆菌灌胃;(6)醋酸泼尼松组:5%DSS自由饮用+醋酸泼尼松45 μg/10 g)灌胃;(7)正常组:正常饮食。实验期间观察小鼠一般情况,计算DAI评分。实验第7天,乙醚麻醉状态下处死小鼠,于结肠距回盲部1.0 cm处和肛门1.0 cm处各留取0.5 cm长的结肠用于细菌分析,另取肛门附近结肠组织约0.5 cm H&E染色。留取剩余结肠组织进行PCR及Western blotting检测。
1.2.2 肠道菌群分析 肠道组织,称量后匀浆,用NS按梯度稀释法稀释,并接种于各非选择性基及选择性培养基上,不同细菌的培养基选择情况见表1。
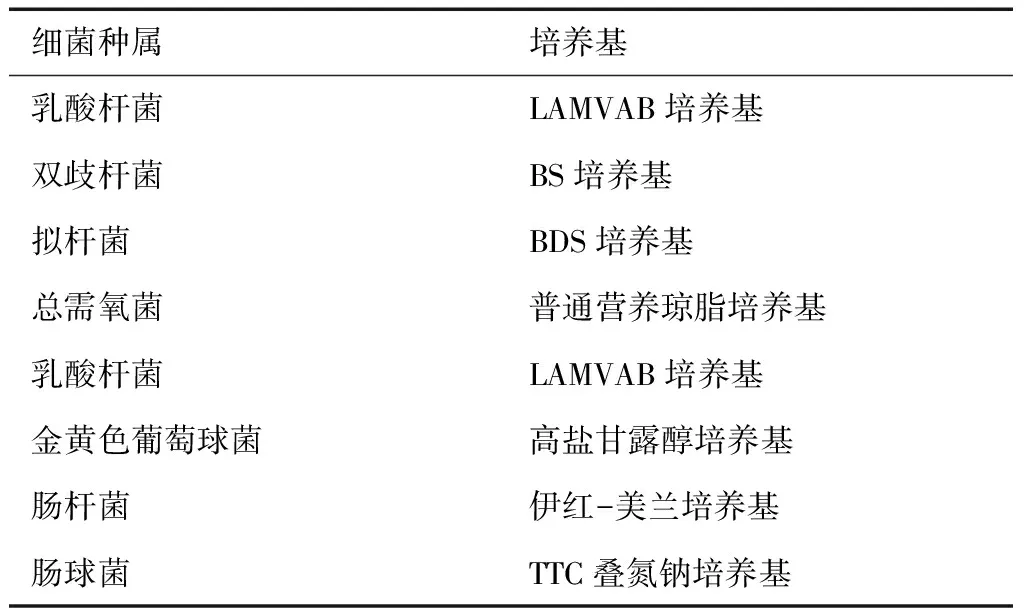
表1 细菌培养基
细菌鉴定:(1)根据各菌菌落形态特征、革兰染色及光镜下特征进行初步鉴定;(2)厌氧菌(双歧杆菌及乳酸杆菌)及肠球菌的进一步鉴定。取培养基上各种形态的菌落,分离提纯后,分别接种于各自适宜的培养基,进一步扩增,厌氧菌置于37 ℃厌氧箱中培养24 h,需氧菌在37 ℃生化培养箱中培养24 h,克隆数代后,选取外观及镜下形态均一的菌落进行细菌鉴定,应用数字图谱判定鉴定结果。
1.2.3 PCR检测IL-23、IL-17、TNF-α Quantity One分析软件测得各产物OD值,以OD测定值/ODβ-actin比值代表基因表达量的相对多少,进行半定量分析 ,引物见表2。
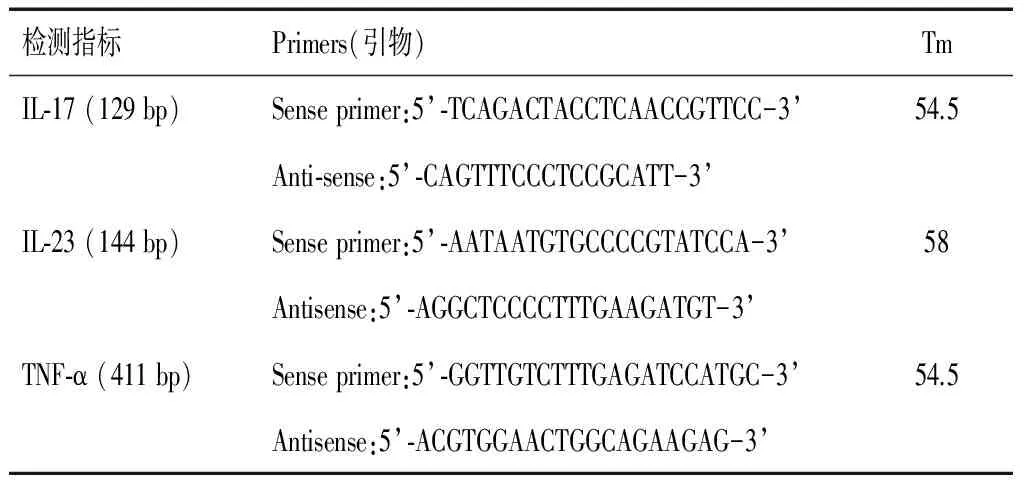
表2 IL-17、IL-23、TNF-α引物
1.2.4 Western-Blotting检测 IL-23、IL-17、TNF-α蛋白质样本得制备后与一抗结合反应,抗体稀释比例为:(1)IL-17、IL-23为 1∶400;(2)TNF-α为1∶2 000;(3)β-actin为1∶5 000。结果判读方法同PCR。
1.3 统计学分析
2 结果
2.1 各组实验小鼠一般状态
实验小鼠一般状态包括小鼠的毛色、精神、食欲及运动状态等,结果见表3。

表3 各组小鼠的一般状态比较
2.2 DAI评分
参考Hamamoto等[4]的方法对小鼠进行DAI评分:A组与模型组无统计学差异(P>0.05)。B组、C组及醋酸泼尼松组DAI评分均低于模型组,差异有统计学意义(P<0.05),其中以B组DAI评分最低。见表4。
2.3 组织损伤评分
参照Dieleman等[5]的评分标准评分。与正常组比较,5%DSS造模后组织损伤评分均有不同程度升高,差异有统计学意义(P<0.05)。醋酸泼尼松和各嗜酸乳酸杆菌组小鼠,结肠组织的损伤评分低于模型组,且B组损伤评分低于醋酸泼尼松组,差异有统计学意义(P<0.05)。见表5。
2.4 结肠细菌分析
2.4.1 近端细菌分析 各组细菌在近端结肠的比较无统计学意义。
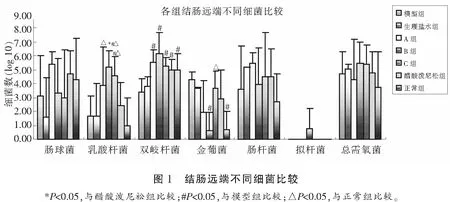
2.4.2 远端细菌比较 各组实验小鼠结肠远端细菌比较结果见图1。
表4 各组小鼠DAI评分
*P<0.05,与模型组比较。
表5 各组小鼠组织损伤评分比较
*P<0.05,与正常组比较;#P<0.05,与模型组比较;△P<0.05,与醋酸泼尼松组比较。
2.5 以β-action为参照指标,各组PCR检测结果比较
结果显示:正常组小鼠结肠组织IL-23、IL-17、TNF-α mRNA均处于较低水平,模型组为最高;其余依次为NS组、B组、醋酸泼尼松组、C组、A组;其中B组、醋酸泼尼松组、C组、A组与NS组比较有统计学差异(P<0.05);综合上述指标,以B组表达最低,与正常组比较无统计学差异(表6、图2)。
2.6 以β-action为参照指标,各组Western blotting检测结果比较
与PCR检测结果类似,以B组IL-23、IL-17、TNF-α的表达最低,与正常组比较无统计学差异(P>0.05)(表7、图3)。
表6 各组小鼠IL-23、IL-17、TNF-α PCR检测结果比较
*P<0.05,与模型组比较;#P<0.05,与NS组比较;△P<0.05,与醋酸泼尼松组比较;▲P<0.05,与正常组比较。
表7 各组小鼠IL-23、IL-17、TNF-α Western blotting检测结果比较
*P<0.05,与模型组比较;#P<0.05,与NS组比较;△P<0.05,与醋酸泼尼松组比较;▲P<0.05,与正常组比较。

3 讨论
已有大量研究发现,UC与多种细菌有关[6]。由此,大量动物及临床试验关于乳酸杆菌,双歧杆菌,大肠杆菌等益生菌对UC的治疗效果的分析,显示以上各种细菌对UC均有不同程度的治疗作用[7]。在临床应用益生菌治疗UC的实验观察中发现:不同的益生菌制剂以及给药浓度会导致不同的治疗效果,如Gionchetti等发现高剂量VSL#3对UC患者手术后有较好的恢复和维持效果,但该研究未对益生菌适宜浓度进行分析[8],是否益生菌浓度越高,其对UC的疗效越好尚不得而知。
本研究选择了前期鉴定并筛选出的嗜酸乳酸杆菌[9]干预UC模型鼠,并分为不同的浓度对比组,通过与NS和醋酸泼尼松比较,对比分析各组UC治疗效果。结果显示中等浓度的B组小鼠UC症状缓解最明显,DAI评分及组织损伤评分最低,而并非嗜酸乳酸杆菌浓度最高的C组。
为了进一步了解UC症状的缓解情况与病变部位的乳酸杆菌浓度的关系,本实验对小鼠近、远端结肠肠道菌群进行分析。由于胃肠道不同区段粘液中的细菌是不同的,一部分细菌依赖粘液固着生长被命名为“固生菌群”;另一为生活在肠内容物中的浮生菌群,随着粪便排出而消失。由于固生菌群长期定植于肠道,是与UC发病相关的最终细菌,本实验选择用近、远端结肠组织用无菌NS清洗、匀浆后接种不同选择性培养基研究不同浓度嗜酸乳酸杆菌在结肠不同部位的浓度。结果显示各实验组近端结肠细菌无明显差别,远端结肠以B组小鼠的益生菌(乳酸杆菌和双歧杆菌)数量最多,致病菌(金黄色葡萄球菌)最低。菌群分析结果与B组疗效最佳相符,提示:(1)各组远端结肠益生菌与致病菌数量不同,可能是各组疗效不同的原因之一;(2)特定部位定植的乳酸杆菌数量并非与嗜酸乳酸杆菌浓度完全正相关。由此推测:不同菌株的乳酸杆菌进入肠道后可和其它乳酸杆菌相互促进生长,但当嗜酸乳酸杆菌的浓度达到一定程度后,各种乳酸杆菌之间相互促进作用进入平台期,反而互相竞争抑制;(3)适量的嗜酸乳酸杆菌可以增加益生菌(双歧杆菌)的生长,抑制致病菌(金黄色葡萄球菌)生长。
已有的研究已证实IBD存在明显的免疫紊乱。IL-12与IL-23有相同的亚基p40,研究发现许多以往认为的与IL-12相关的免疫性疾病均与IL-12和IL-23共有的亚基p40有关[10]。Yen等[11]用IL-10/IL-23p19双基因缺陷和IL-10/IL-12p35双基因缺陷小鼠诱导肠道炎症,发现IL-23而非IL-12为诱导小鼠肠道炎症发生所需。以上研究说明主要是IL-23在UC发病中起着重要作用。进一步分析IL-23、IL-17、TNF-α的mRNA水平和蛋白质水平显示:均为模型组最高,NS组次之,醋酸泼尼松组较模型组有明显降低。结合小鼠DAI评分及病理组织学评分,提示IL-23、IL-17及TNF-α与UC的严重程度呈正相关,嗜酸乳酸杆菌干预组的上述检测指标均有降低,与小鼠炎症缓解程度相符。为临床使用补充益生菌治疗UC提供了一定的理论依据。
[1] Bernstein CN,Shanahan F.Disorders of a modern lifestyle:reconciling the epidemiology of inflammatory bowel diseases[J].Gut,2008,57(9):1185-1191.
[2] Thompson-Chagoyan OC,Maldonado J,Gil A.Aetiology of inflammatory bowel disease (IBD):role of intestinal microbiota and gut-associated lymphoid tissue immune response[J].Clin Nutr,2005,24(3):339-352.
[3] Tremaroli V,Backhed F.Functional interactions between the gut microbiota and host metabolism[J].Nature,2012,489(7415):242-249.
[4] Hamamoto N,Maemura K,Hirata I,etal.Inhibition of dextran sulphate sodium (DSS)-induced colitis in mice by intracolonically administered antibodies against adhesion molecules (endothelial leucocyte adhesion molecule-1 (ELAM-1) or intercellular adhesion molecule-1 (ICAM-1)) [J].Clin Exp Immunol,1999,117(3):462-468.
[5] Dieleman LA,Palmen MJ,Akol H,etal.Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines[J].Clin Exp Immunol,1998,114(3):385-391.
[6] Meijer BJ,Dieleman LA.Probiotics in the treatment of human inflammatory bowel diseases:update 2011[J].J Clin Gastroenterol,2011,42(5):2501-2508.
[7] Pace F,Pace M,Quartarone G.Probiotics in digestive diseases:focus on Lactobacillus GG[J].Minerva Gastroenterol Dietol,2015,61(4):273-292.
[8] Gionchetti P,Rizzello F,Morselli C,etal.High-dose probiotics for the treatment of active pouchitis[J].Dis Colon Rectum,2007,50(12):2075-2082.
[9] 杨伟峰,刘凌云,卢放根.益生菌CMS-H002和CMS-H003联用对小鼠急性溃疡性结肠炎的影响[J].实用医学杂志,2007,23(11):1613-1615.
[10] Hue S,Ahern P,Buonocore S,etal.Interleukin-23 drives innate and T cell-mediated intestinal inflammation[J].J Exp Med,2006,203(11):2473-2483.
[11] Yen D,Cheung J,Scheerens H,etal.IL-23 is essential for T cell-mediated colitis and promotes inflammation via IL-17 and IL-6[J].J Clin Invest,2006,116(5):1310-1306.
(学术编辑:杨健)
本刊网址:http://www.nsmc.edu.cn
作者投稿系统:http://noth.cbpt.cnki.net
邮箱:xuebao@nsmc.edu.cn
The appropriate concentration of Lactobacillus acidophilus and immunological mechanisms for the treatment of UC
CHEN Lin-lin1,ZHENG Qian2
(DepartmentofGastroenterology,1.XiangyaHospitalofCentralSouthUniversity,Changsha410011;2.TheFirstPeople’sHospitalofChenzhou,Chenzhou423000,Hunan,China)
Objective:To compare the effect of different concentration of Lactobacillus acidophilus (L.acidophilus) on ulerative colitis (UC),and to analysis the influenceof of proximal and distal colon of bacteria,to find the appropriate concentration of L.acidophilus for UC,and to explore the immunological mechanism.Methods:56 female Balb/c mice were randomly divided into 7 groups (n=8),dextran sulfate sodium (DSS) made of UC model rats were given different concentration of L.acidophilus, hormones,physiological saline intervention UC model rats,observed the general condition of the mice,calculated the disease activity index (DAI) score,tissue injury score,the intestinal flora of mice was taken for intestinal flora analysis,and PCR and Western-Blotting were used to detect UC related IL-23,IL-17,TNF-α.Results:In the 106CFU/mL concentration group,the UC symptoms relief of the L.acidophilus intervention group were the most obvious,and the number of probiotics (lactobacillus and bifidobacteria) in the distal colon was the most,and the pathogen (staphylococcus aureus) was the lowest.UC related IL-23,IL-17,TNF-α regardless of mRNA level or protein level,were lowest in the L.acidophilus intervention group,especially in the 106U /10 g L.acidophilus gavage group.Conclusion:L.acidophilus UC and its treatment in the distal colon have higher concentrations of lactic acid bacteria,but the result is not completely positive correlation with the concentration of bacteria,inflammatory factor IL-23,IL-17 and TNF-α are positively correlated with the UC disease severity,associate with the therapeutic effect of L.acidophilus on UC.
Lactobacillus acidophilus;Flora analysis;Experimental colitis;Immunological mechanism;Interleukin 23;Interleukin 17
10.3969/j.issn.1005-3697.2017.03.007
国家自然科学基金青年科学基金项目(8160042)
2017-01-12
陈琳琳(1982-),女,博士,主治医生。E-mail:35398784@qq.com
时间:2017-6-21 18∶09 网络出版地址:http://kns.cnki.net/kcms/detail/51.1254.R.20170621.1809.014.html
R
A
