间质性肺炎合并侵袭性肺曲霉菌病的死亡危险因素分析
2017-07-25庄谊刘寅曹孟淑张英为陈露露肖永龙蔡后荣代静泓
庄谊,刘寅,曹孟淑,张英为,陈露露,肖永龙,蔡后荣,代静泓
(南京大学医学院附属鼓楼医院呼吸内科,江苏 南京 210008)
间质性肺炎合并侵袭性肺曲霉菌病的死亡危险因素分析
庄谊,刘寅,曹孟淑,张英为,陈露露,肖永龙,蔡后荣,代静泓
(南京大学医学院附属鼓楼医院呼吸内科,江苏 南京 210008)
目的:分析间质性肺炎合并侵袭性肺曲霉病(invasive pulmonary aspergillosis,IPA)的临床特点和死亡危险因素。方法:回顾性分析2010年12月至2016年4月本院49例间质性肺炎合并IPA患者的临床资料,以诊断后12周为观察终点,将患者分为存活组和死亡组,对两组病例的临床资料进行对比,分析间质性肺炎合并IPA的死亡危险因素。结果:单因素分析显示,年龄>65岁、低蛋白血症、氧合指数<300、胸部CT示弥漫性磨玻璃影和诊断时间>7 d是间质性肺炎合并IPA的死亡危险因素(P<0.05),伏立康唑治疗的患者预后较好(P=0.033)。Logistic多因素回归分析仅发现氧合指数<300是影响间质性肺炎合并IPA患者预后的死亡危险因素(P=0.016,OR=4.833,95%CI:1.669~138.659,β=2.722,SE=1.128,Wald=5.827)。结论:入院时已发生呼吸衰竭是间质性肺炎合并IPA患者死亡的独立危险因素。
间质性肺炎;侵袭性肺曲霉菌病;死亡危险因素
侵袭性肺曲霉病(invasive pulmonary aspergillosis,IPA)多见于免疫受损患者,特别是粒缺患者,然而非粒缺患者的IPA发病却逐渐增多。间质性肺炎患者虽然很少合并粒缺的情况,但也易合并IPA[1],且死亡率高[2]。本研究通过回顾性分析单中心的住院间质性肺炎合并IPA病例,了解该类患者的死亡危险因素,为临床判断该病患者预后提供参考。
1 资料与方法
1.1 研究对象
以2010年12月至2016年4月南京鼓楼医院呼吸科住院治疗的49例间质性肺炎合并IPA患者为研究对象,收集临床资料进行回顾性分析。其中确诊患者1例,临床诊断患者48例;年龄(66.96±10.33)岁;男性28例,女性21例;特发性间质性肺炎30例,继发于结缔组织病的间质性肺炎19例(干燥综合症5例,类风湿性关节炎3例,类风湿性关节炎合并干燥综合症2例,皮肌炎2例,系统性血管炎2例,抗Jo-1抗体综合症1例,系统性硬化症1例,混合性结缔组织病1例,系统性红斑狼疮1例,系统性红斑狼疮合并类风湿性关节炎1例)。
入组的患者须符合2013年美国胸科协会和欧洲呼吸学会制定的间质性肺炎诊断标准[3],并同时满足我国2007年《肺真菌病诊断和治疗专家共识》中IPA确诊或临床诊断的标准[4]。排除标准:合并血液系统疾病;器官移植史;恶性肿瘤;AIDS。入组患者中未发现入院时存在严重粒细胞缺乏者。
1.2 观察指标
以诊断间质性肺炎合并IPA后12周为观察终点,将纳入的间质性肺炎合并IPA患者分为死亡组和存活组,比较两组间临床资料的差异,对可能的死亡危险因素进行分析。
应用广谱抗生素指入院前3个月内使用广谱抗生素疗程超过1周,使用糖皮质激素指入院前连续使用糖皮质激素(相当于泼尼松30 mg/d>14 d或<30 mg/d)1 个月以上,使用免疫抑制剂指入院前连续使用免疫抑制剂疗程超过1 个月。IPA诊断时间定义为获得第1个微生物学或病理学IPA诊断证据的时间。初始抗真菌治疗指IPA病程中最初两周内接受的抗曲霉药物治疗,且初始治疗方案疗程≥1周,这些方案包括伊曲康唑、伏立康唑、卡泊芬净单药治疗及伏立康唑联合卡泊芬净治疗。抗真菌药物联合治疗指在治疗开始两周内同时接受两种或两种以上抗真菌药物治疗,且≥72 h。在治疗最初两周内分别接受两种或两种以上抗真菌药物治疗的患者被认为是接受单药治疗,并按最先使用的药物归类。
1.3 统计学分析
2 结果
单因素分析情况见表1。分析显示,年龄>65岁、低蛋白血症、氧合指数<300、胸部CT示弥漫性磨玻璃影和诊断时间>7 d是间质性肺炎合并IPA的12周死亡危险因素(P<0.05),而接受伏立康唑治疗的患者预后较好(P=0.033)。将上述因素应用Logistic多因素回归分析后显示,仅发现氧合指数<300,即入院时已发生呼吸衰竭是影响间质性肺炎合并IPA患者预后的独立死亡危险因素(P=0.016,OR=4.833,95%CI:1.669~138.659,β=2.722,SE=1.128,Wald=5.827)。
3 讨论
非粒缺IPA患者的发病危险因素包括需要长期使用糖皮质激素、肝硬化失代偿、实体肿瘤、COPD、HIV感染和其它造成非结构破坏在慢性肺疾病,如陈旧性肺结核、支气管扩张等,其中也包括间质性肺炎[1,5]。然而,影响间质性肺炎合并IPF患者的死亡危险因素目前尚无报道。
IPA患者的病死率较高,在充分抗曲霉治疗的情况下,病死率仍高达30%以上[6]。本研究纳入的间质性肺炎合并IPA患者的12周死亡率为49%,高于IPA患者死亡率的总体平均水平,可能与疾病早期易漏诊、误诊及肺部正常结构的破坏影响药物治疗效果有关,故而了解间质性肺炎合并IPA患者的预后影响因素显得非常重要。
对于影响曲霉感染患者预后的影响因素,因研究人群及考察参数等的不同而有所差异。针对慢性坏死性肺曲霉菌病的研究显示,高龄、并发症的出现、糖皮质激素的使用、体质指数<18.5 kg/m2以及C反应蛋白>5 mg/dL是影响全因死亡率的独立危险因素[7]。对于ICU中的侵袭性曲霉菌病患者,影响死亡的独立危险因素包括高龄、有骨髓移植病史、接受机械通气、肾脏替代治疗和诊断时更高的序贯脏器衰竭评分[8]。而基线的血小板计数和肌酐清除率水平是粒缺相关性侵袭性曲霉菌病结局的预测因素[9]。肾移植前6个月内发生过IPA和诊断时双肺累及是肺移植后IPA患者6周全因死亡率的独立预测因子[10]。一项来自日本的单中心回顾性研究则发现COPD和KL-6水平升高是间质性肺炎合并肺部曲霉感染患者死亡的危险因素,但该研究仅纳入了15例肺部曲霉感染患者,且IPA患者只有1例[1]。而本研究的单因素分析结果表明,高龄、低蛋白血症、氧合指数<300、胸部CT表现为弥漫性磨玻璃影、诊断时间>7 d是间质性肺炎合并IPA患者预后差的预测因素,而伏立康唑治疗有助于改善患者预后,但多因素分析则显示仅氧合指数水平是影响间质性肺炎合并IPA患者预后的独立危险因素。
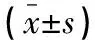
表1 间质性肺炎合并侵袭性肺曲霉菌病的12周死亡危险因素的单因素分析
a:Fisher’s精确检验。
晕轮征和结节内空洞影是IPA的典型CT表现,但主要见于粒缺和恶性血液系统疾病患者,并不是非粒缺患者和非血液系统肿瘤患者的主要CT表现[11],后者更多表现为沿气道分布的多发性结节或实变。关于IPA患者CT表现与预后关系的研究很少,1项针对非HIV感染的免疫缺陷患者合并IPA的研究认为,没有1项CT早期改变(结节、实变、支气管周围渗出)与预后有关[12]。然而,也有研究认为晕轮征与较好的预后有关[13],而出现大片实变影或新发胸腔积液时死亡风险更高[14]。结论不同主要考虑为纳入的研究对象不同及考察样本量较小所造成。临床上有时可见IPA表现为广泛磨玻璃影的CT表现,其病理实质多为弥漫性肺泡损伤(diffusealverolardamage,DAD),在间质性肺炎中多见于急性间质性肺炎和间质性肺炎的急性加重,通常会造成呼吸衰竭。目前急性间质性肺炎和特发性肺纤维化急性加重的诊断标准要求排除感染引起的病情急性加重,但在临床实践中排除感染十分困难。而且有观点认为,感染可能诱发间质性肺炎患者肺内的炎症瀑布级联反应,导致DAD的发生[15]。因此,IPA也可能是肺组织出现DAD的重要诱因,影像学上表现为肺部弥漫性磨玻璃影的DAD造成的呼吸衰竭预示患者的预后不良[16]。
IDSA的指南中,对于IPA患者首选伏立康唑或两性霉素B(包括脂质体)治疗,其它如三唑类药物伊曲康唑、泊沙康唑、棘白菌素类药物卡泊芬净等可作为备选药物。两性霉素B由于不良反应较多,在安全性上不如三唑类和棘白菌素类药物。目前对于联合用药的疗效是否优于单药使用仍然存在争议。一项单中心的对血液系统恶性肿瘤合并IA患者的研究表明,作为初始经验性治疗,与卡泊芬净相比,伏立康唑能够显著降低患者IA相关死亡率。而伏立康唑联合卡泊芬净治疗与单用伏立康唑相比,并不能获得更好的治疗效果,且不良反应发生率增加[17]。本研究的单因素分析提示,对于间质性肺炎合并IPA患者,可优先选用伏立康唑。
本研究也存在一些局限性:(1)为单中心回顾性研究,且样本量有限;(2)仅验证了有限的影响因素,可能遗漏一些未知或不易采集的影响因素,例如本院在近年才开展GM试验检测,未能将其纳入考察。
综上所述,在临床工作中,应当提高对于间质性肺炎合并IPA的认识,优化诊治流程,尽早明确诊断,选择有针对性的抗曲霉药物,避免患者病情恶化出现呼吸衰竭。
[1]KurosakiF,BandoM,NakayamaM,et al.Clinicalfeaturesofpulmonaryaspergillosisassociatedwithinterstitialpneumonia[J].InternMed,2014,53(12):1299-1306.
[2]CornilletA,CamusC,NimubonaS,et al.Comparisonofepidemiological,clinical,andbiologicalfeaturesofinvasiveaspergillosisinneutropenicandnonneutropenicpatients:a6-yearsurvey[J].ClinInfectDis,2006,43(5):577-584.
[3]TravisWD,CostabelU,HansellDM,et al.AnofficialAmericanThoracicSociety/EuropeanRespiratorySocietystatement:Updateoftheinternationalmultidisciplinaryclassificationoftheidiopathicinterstitialpneumonias[J].AmJRespirCritCareMed,2013,188(6):733-748.
[4] 中华医学会呼吸病学分会感染学组,中华结核和呼吸杂志编辑委员会.肺真菌病诊断和治疗专家共识[J].中华结核和呼吸杂志,2007,30(11):821-834.
[5]BassettiM,RighiE,DePascaleG,et al.Howtomanageaspergillosisinnon-neutropenicintensivecareunitpatients[J].CritCare,2014,18(4):458.
[6]LiD,ChenL,DingX,et al.Hospital-acquiredinvasivepulmonaryaspergillosisinpatientswithhepaticfailure[J].BMCGastroenterol,2008,8(1):32.
[7]NakamotoK,TakayanagiN,KanauchiT,et al.Prognosticfactorsin194patientswithchronicnecrotizingpulmonaryaspergillosis[J].InternMed,2013,52(7):727-734.
[8]TacconeFS,VandenAbeeleAM,BulpaP,et al.Epidemiologyofinvasiveaspergillosisincriticallyillpatients:clinicalpresentation,underlyingconditions,andoutcomes[J].CritCare,2015,19(1):7.
[9]NouerSA,NucciM,KumarNS,et al.Baselineplateletcountandcreatinineclearanceratepredicttheoutcomeofneutropenia-relatedinvasiveaspergillosis[J].ClinInfectDis,2012,54(12):e173-e183.
[10]Lopez-MedranoF,Fernandez-RuizM,SilvaJT,et al.ClinicalPresentationandDeterminantsofMortalityofInvasivePulmonaryAspergillosisinKidneyTransplantRecipients:AMultinationalCohortStudy[J].AmJTransplant,2016,16(11):3220-3234.
[11]ParkSY,KimSH,ChoiSH,et al.Clinicalandradiologicalfeaturesofinvasivepulmonaryaspergillosisintransplantrecipientsandneutropenicpatients[J].TransplInfectDis,2010,12(4):309-315.
[12]HorgerM,HebartH,EinseleH,et al.InitialCTmanifestationsofinvasivepulmonaryaspergillosisin45non-HIVimmunocompromisedpatients:associationwithpatientoutcome?[J].EurJRadiol,2005,55(3):437-444.
[13]MaromEM,KontoyiannisDP.Imagingstudiesfordiagnosinginvasivefungalpneumoniainimmunocompromisedpatients[J].CurrOpinInfectDis,2011,24(4):309-314.
[14]HuangL,HeH,DingY,et al.Valuesofradiologicalexaminationsforthediagnosisandprognosisofinvasivebronchial-pulmonaryaspergillosisincriticallyillpatientswithchronicobstructivepulmonarydiseases[J].ClinRespirJ,2016.doi:10.1111/crj.12551.
[15]CollardHR,MooreBB,FlahertyKR,et al.Acuteexacerbationsofidiopathicpulmonaryfibrosis[J].AmJRespirCritCareMed,2007,176(7):636-643.
[16]SongJW,HongSB,LimCM,et al.Acuteexacerbationofidiopathicpulmonaryfibrosis:incidence,riskfactorsandoutcome[J].EurRespirJ,2011,37(2):356-363.
[17]RaadII,ZakhemAE,HelouGE,et al.Clinicalexperienceoftheuseofvoriconazole,caspofunginorthecombinationinprimaryandsalvagetherapyofinvasiveaspergillosisinhaematologicalmalignancies[J].IntJAntimicrobAgents,2015,45(3):283-288.
(学术编辑:何清华)
本刊网址:http://www.nsmc.edu.cn
作者投稿系统:http://noth.cbpt.cnki.net
邮箱:xuebao@nsmc.edu.cn
Analysis of risk factors of mortality in interstitial pneumonia patients with invasive pulmonary aspergillosis
ZHUANG Yi,LIU Yin,CAO Meng-shu,ZHANG Ying-wei,CHEN Lu-lu,XIAO Yong-long,CAI Hou-rong,DAI Jing-hong
(DepartmentofRespiratoryMedicine,TheAffiliatedDrumTowerHospitalofNanjingUniversityMedicalSchool,Nanjing210008,Jiangsu,China)
Objective:To analyze the clinical features and risk factors of mortality in interstitial pneumonia patients with invasive pulmonary aspergillosis (IPA).Methods:The clinical data of a total of 49 cases of interstitial pneumonia patients with IPA in our hospital from December 2010 to April 2016 were collected.All the patients were followed up for 12 weeks after diagnosis and were divided into survival group and death group according to the outcome of follow-up.The clinical data was analyzed to explore the risk factors of mortality in interstitial pneumonia patients with IPA.Results:Univariate analysis showed that age >65 years old,hypoproteinemia,baseline oxygenation index <300,diffuse ground glass appearance in chest CT and diagnosis time >7 d were the risk factors of mortality in interstitial pneumonia patients with IPA (P<0.05).Patients treated with voriconazole have a better prognosis(P=0.033).After multivariate Logistic regression analysis,only oxygenation index <300 was found to be the risk factor of mortality in interstitial pneumonia patients with IPA(P=0.016,OR=4.833,95% CI:1.669~138.659,β=2.722,SE=1.128,Wald=5.827).Conclusion:Respiratory failure when being admitted to hospital is an independent factor of mortality for interstitial pneumonia patients with IPA.
Interstitial pneumonia; Invasive pulmonary aspergillosis; Risk factors of mortality
10.3969/j.issn.1005-3697.2017.03.001
国家自然科学基金(81370161);中央高校基本科研业务费专项资金(20620140732)
2017-01-05
庄谊(1978-),硕士,主治医师。E-mail:drzy78@163.com
代静泓,E-mail:23568@sina.com
时间:2017-6-21 18∶09 网络出版地址:http://kns.cnki.net/kcms/detail/51.1254.R.20170621.1809.002.html
1005-3697(2017)03-0316-04
R563.4
A
