大米蛋白与阿魏酸酶法交联物的乳化特性和抗氧化稳定性
2017-07-24赵谋明贾春晓滕建文韦保耀广西大学轻工与食品工程学院广西南宁530004华南理工大学食品科学与工程学院广东广州50640
贾 潇,赵谋明,2,贾春晓,滕建文,韦保耀,黄 丽,夏 宁,*(.广西大学轻工与食品工程学院,广西 南宁 530004;2.华南理工大学食品科学与工程学院,广东 广州 50640)
大米蛋白与阿魏酸酶法交联物的乳化特性和抗氧化稳定性
贾 潇1,赵谋明1,2,贾春晓1,滕建文1,韦保耀1,黄 丽1,夏 宁1,*
(1.广西大学轻工与食品工程学院,广西 南宁 530004;2.华南理工大学食品科学与工程学院,广东 广州 510640)
研究漆酶(laccase,LAC)催化大米蛋白(rice protein,RP)与阿魏酸(ferulic acid,FA)交联产物的乳化特性和抗氧化稳定性。发现RP乳液在pH 5和pH 3条件下出现了明显的相分离,RP乳液在pH 7和pH 9条件下有部分聚集状态,说明RP在酸性范围的乳化稳定性远远小于碱性范围的乳化稳定性;RP/FA/LAC酶法交联物乳液在pH 5、7、9条件下的乳液粒径和乳析层指数都小于RP乳液;在pH 3条件下乳液粒径和乳析层指数大于RP乳液;RP乳液中的氢过氧化物含量(11.12 mmol/kg)、硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARS)含量(0.73 mmol/kg)和己醛含量(0.986 mg/L)明显高于RP/FA/LAC酶法交联物乳液中氢过氧化物含量(3.59 mmol/kg)、TBARS含量(0.23 mmol/kg)和己醛含量(0.191 mg/L),表明RP/FA/LAC酶法交联物具有更好的抗氧化稳定性。研究结果显示LAC催化FA与RP形成的交联物在含有乳化体系等食品加工中具有潜在应用价值。关键词:大米蛋白;阿魏酸;漆酶;交联;乳化特性;抗氧化稳定性;油脂氧化
大米蛋白(rice protein,RP)作为从谷物籽实体中提取出的蛋白质,具有高生物价、氨基酸组成合理和低过敏性等特点,但是RP由于自身结构的特点,在制备、功能以及应用上仍存在很多问题,尤其在以功能性植物蛋白饮料为依托的乳液体系中的应用更加薄弱[1]。乳液体系作为食品加工中最为重要的体系之一,主要包括蛋白质、脂肪、表面活性剂等,这些大分子物质在贮藏过程中容易受到外界游离自由基的侵蚀,迅速发生氧化,从而造成品质的劣变[2]。酚类化合物是一种天然的抗氧化剂,能够有效预防脂质体系的氧化降解,它以氢键、疏水相互作用、离子键和共价键等方式与蛋白质相互作用,从而改善蛋白质的功能特性。阿魏酸(ferulic acid,FA)是稻谷中存在的一种主要酚酸,具有很强的抗氧化、抗菌、抗炎与降胆固醇的活性[3]。植物中FA很少以游离态形式存在,通常在植物细胞壁上与多糖通过酯键相联接,如谷物中的阿拉伯糖基木聚糖[4],甜菜和菠菜中果胶、竹子中的葡聚糖[5]。FA也可以与蛋白质之间通过非共价键[6]和共价键结合[7]。FA和氨基酸或FA和二肽(双甘氨肽或双丙氨肽)的混合物,对亚油酸、亚麻籽油、猪油和豆油的自氧化及过氧化的抑制作用产生了协同作用,由于FA的这些优点和低毒性,已广泛应用于食品和化妆品行业[8]。RP与FA两者能够自发结合形成非共价复合物,且其主要的作用力为疏水相互作用,但此相互作用力非常弱,在高压条件下易被破坏,游离出的FA会与RP竞争吸附,虽然会提高乳液氧化稳定性,但是会引起乳液的乳化稳定性下降。漆酶(laccase,LAC)作为一种多酚氧化酶,能够催化氧化FA形成醌类,与RP分子中的巯基、氨基、亚氨基等发生加成反应,使得FA和蛋白质之间形成更加稳定的C—N或C—S共价键[9-10]。LAC有效地促进FA与蛋白质交联从而改善蛋白的凝胶网络结构、乳化特性及流变学[11-12],这是由于交联后的蛋白具有较低的表面张力,而表面张力的下降是乳化和起泡的首要条件[13]。在前期的实验中发现LAC催化氧化FA与RP结合形成的共价交联物具有更好的体外抗氧化稳定性,且交联会引起RP氨基酸组成和二级结构的变化[14]。
因此,本实验利用RP、RP/FA/LAC酶法交联物制备玉米油乳液,研究LAC催化FA与RP交联物的乳化特性(包括液滴粒径、电位、乳析层指数和微观结构)、抗氧化稳定性(氢过氧化物、硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARS)和己醛含量),从而获得FA与RP乳化特性的相关信息。
1 材料与方法
1.1 材料与试剂
FA 武汉远程共创有限公司;RP由广西大学轻工食品工程学院实验室自制;LAC(活力≥0.3 U/mg)、尼罗红、尼罗蓝、过氧化氢异丙苯、1,1,3,3-四乙氧基丙烷美国Sigma公司;甲醇、乙腈、正己烷(均为色谱纯)德国Meker公司;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
YLB-TW12数显恒温水浴锅 德国Julabo公司;S25磁力搅拌机、RW16电子搅拌机、T25高速均质机 德国IKA公司;高压均质机 上海东华高压均质机厂;GDJ真空冷冻干燥机 兰州科近真空冻干技术有限公司;TCS-SP8MP激光共聚焦扫描电子显微镜(confocal laser scanning microscope,CLSM) 德国莱卡公司;Nanoseries ZS90粒度分析仪 英国马尔文公司;UV-1601紫外-可见分光光度计 日本岛津公司;7890B气相色谱仪 美国Agilent公司。
1.3 方法
1.3.1 RP与FA交联物的制备
将RP与FA混合,混合后二者终质量浓度分别为10.0 mg/mL和0.4 mg/mL,然后根据FA的含量在混合液中添加终质量浓度为0.1 mg/mL的LAC(ρ(FA)∶ρ(LAC)=4∶1),25 ℃条件下用磁力搅拌器搅拌4 h,透析后的样品进行冷冻干燥得到RP/FA/LAC酶法交联物。空白组不添加LAC,RP和FA混合液在25 ℃条件下用磁力搅拌器搅拌4 h,透析除去游离的FA,冷冻干燥得到FA/RP复合物。1.3.2 溶解度的测定
溶解度测定方法参照Liu Yongle等[15]的方法。称取100 mg RP溶解在10 mL 蒸馏水中,磁力搅拌30 min,搅拌过程中用2 mol/L HCl或2 mol/L NaOH,调节pH值至2~11,继续搅拌30 min,4 000 r/min离心30 min,上清液中蛋白含量采用Lowry法测定,RP纯度的测定按照GB/T 5009.5—2003《食品中蛋白质的测定》,每个样品测定3 次。蛋白质的溶解度按公式(1)计算。

式中:m1为上清液中的蛋白质质量/g;m0为样品中蛋白质质量/g。
1.3.3 表面疏水性的测定
表面疏水性(H0)的测定采用荧光探针1-苯胺基-8-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)法[16]。用pH 7.0、10 mmol/L的磷酸缓冲盐溶液(phosphate buffer saline,PBS)配制不同质量浓度的RP溶液(0.1、0.2、0.3、0.4、0.5 mg/mL)和8.0 mmol/L的ANS溶液。4 mL RP溶液与20 μL ANS溶液混合均匀,迅速测定混合液的荧光强度(Fn),未添加ANS溶液的蛋白样品荧光强度(F0)。激发波长为380 nm,发射波长为490 nm。Fn与F0的差值记为F,分别以RP质量浓度和F为横坐标和纵坐标作图,曲线的斜率即为RP的表面疏水性。
1.3.4 蛋白样品乳状液的制备
均质前将RP、RP/FA复合物、RP/FA/LAC交联物分别溶于PBS(50 mmol/L、pH 7.0)中,使得初乳液中蛋白的终质量浓度为10 mg/mL。乳液的制备是将10%玉米油与90%水相混合,经过高速均质形成的O/W型乳液,均质速率14 000 r/min,时间1 min,再经过高压均质(60 MPa)得到二次乳液。向制备好的乳状液中添加2 g/100 mL的叠氮钠溶液,使其在乳状液中终质量浓度达0.02 g/100 mL,以抑制乳状液中的微生物生长。将制备的乳液在50 ℃条件下放置12 d,测定贮藏期间乳液的氢过氧化物、TBARS含量及己醛含量。
1.3.5 乳液分层指数的测定
将制备好的乳液立刻用2 mol/L HCl和NaOH调节乳液的pH值为9、7、5、3,分别观察乳液的耐酸、耐碱能力。取10 mL新配制好的乳状液加入到试管中,将试管静置于室温条件下放置7 d,测量乳液分层后样品底部清液层的高度,每个样品测定3 次。乳液的分层指数按公式(2)计算。
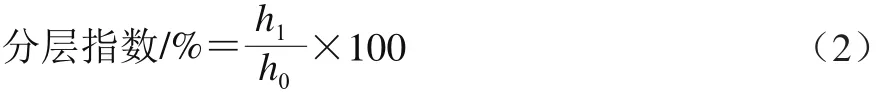
式中:h1为乳液分层后清液层高度/cm;h0为乳液样品的总高度/cm。
1.3.6 乳液粒径和Zeta电位的测定
采用Nanoseries ZS90粒度分析仪对乳液粒度和Zeta电位进行测定。测定前用不同pH值的PBS将乳液中油相的比例稀释到0.05%,消除浓度过高而导致的多次散射效应[17]。具体设置参数如下:He/Ne激光波长633 nm,散射角173°,温度25 ℃。
1.3.7 乳液的微观结构观察
采用CLSM观察乳液的微观结构。吸取1 mL乳液,加入40 μL配制好的混合荧光染料(包括0.1%尼罗蓝和0.02%尼罗红),混合均匀。测量时,吸取10 μL染色后的乳液置于载玻片上,用盖玻片覆盖,防止气泡产生,盖玻片用指甲油固定后倒置观察。测量条件如下:He/Ne离子激发波长633 nm;Ar离子激发波长488 nm,扫描密度:1024×1024;100倍物镜观察。使用LAS AF Lite软件处理图像。
1.3.8 乳液中氢过氧化物含量的测定
乳液中氢过氧化物含量的测定参照Matalanis等[18]的方法,取0.3 mL乳液加入1.5 mL异辛烷与异丙醇(3∶1,V/V),涡流混合3 次,每次10 s,然后再6 000 r/min离心10 min。取0.2 mL上清液与2.8 mL 甲醇-正丁醇(2∶1,V/V)混合,接着加入15 µL亚铁溶液(等体积的0.132 mol/L BaCl2和0.144 mol/L FeSO4混合溶液)以及15 µL(30 g硫氰酸铵溶解在100 mL蒸馏水中),20 min后在510 nm波长处测定其吸光度,氢过氧化物含量通过标准物过氧化氢异丙苯的标准曲线来确定。
1.3.9 乳液中TBARS含量的测定
乳液中TBARS含量的测定参照Mei Longyuan等[19]的方法,2 mL乳液混合4 mL硫代巴比妥酸(thiobarbituric acid,TBA)试剂(15 g三氯乙酸与0.375 g TBA混合后溶于100 mL 2.5 mol/L HCl溶液中),在沸水中加热15 min,冷却10 min后6 000 r/min离心15 min。在532 nm波长处测定其吸光度。TBARS含量根据标准物1,1,3,3-四乙氧基丙烷的标准曲线来确定。
1.3.10 乳液中己醛含量的测定
己醛是乳液中脂类氧化降解的主要产物之一,己醛的含量通过气相色谱(gas chromatography,GC)方法测定[20],略有修改。取6 mL蛋白乳液于样品瓶中,用密封圈密封,在50 ℃条件下储藏10 d。采用75 mm Carboxen/ PDMS固相微萃取纤维头插入样品瓶中,55 ℃萃取10 min。色谱柱:HP-5毛细管柱(30 m×0.32 mm,0.25 µm),氮气作为载气,进样口温度290 ℃,检测器温度300 ℃。升温程序:起始温度40 ℃保持2 min,以5 ℃/min升至60 ℃,保持2 min,以15 ℃/min升至150 ℃,以30 ℃/min速率升温至210 ℃,保持2 min。分流比10∶1。己醛含量按公式(3)计算。

式中:A0为己醛标准品的峰面积;A1为样品中己醛的峰面积;ρ0为标准己醛标准品的质量浓度(1 mg/mL)。
2 结果与分析
2.1 蛋白质的表面疏水性
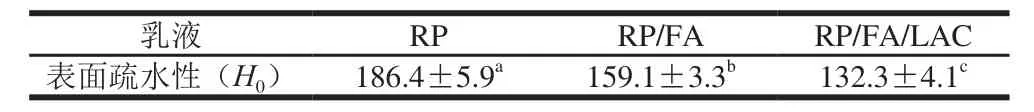
表1 RP、RP/FA和RP/FA/LAC酶法交联物的表面疏水性Table 1 Surface hydrophobicity (H0) of the control RP and RP/FA cross-linking with and without catalysis by LAC
表面疏水性是蛋白一个非常重要的生化特征,它反映了蛋白表面疏水基团的情况,这些特征往往决定了蛋白质的一些功能特性,如溶解度、吸水性、乳化性、凝胶性等。由表1可知,RP/FA复合物的表面疏水性(H0=159.1)相比较RP的表面疏水性(H0=186.4)有所降低,说明交联有助于RP的亲水性增加,可能原因是引入FA亲水的羟基基团、阻塞了疏水残基或使埋藏的亲水区域暴露[21]。由前期实验可知,当FA与RP发生非共价相互作用时,波长的红移使得色氨酸的微环境向亲水区域发生变化,从而使其表面疏水性降低[14]。其次,RP/FA/ LAC酶法交联物的表面疏水性(H0=132.3)较RP/FA复合物更低,可能原因是共价结合虽然使得相对含量较少的氨基和巯基等亲水基团的数目减少,但是可以引进大量FA的羟基基团,从而使表面更加亲水[22]。
2.2 蛋白质的溶解性
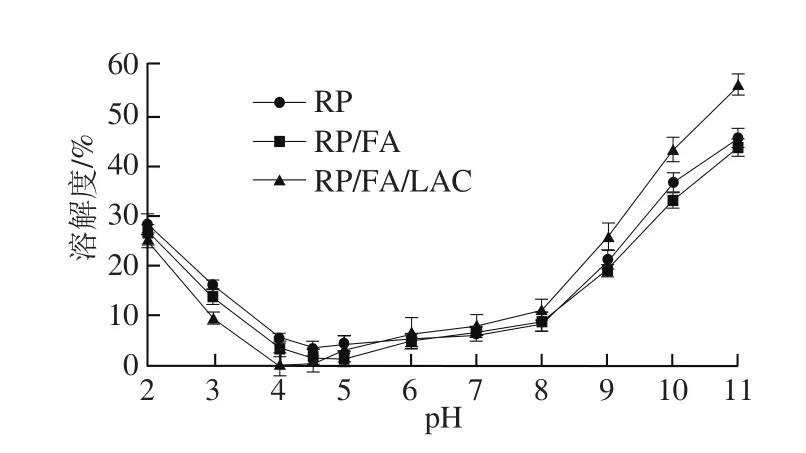
图1 不同pH值条件下RP、RP/FA和RP/FA/LAC酶法交联物的溶解度Fig. 1 Solubility of the control RP, RP/FA cross-linking, and LAC-catalyzed RP/FA cross-linking at different pHs
溶解度是蛋白另一个重要的功能性质,它与蛋白的空间结构密切相关,温度、pH值等环境因素对其的影响也很大。RP的溶解性与pH值的关系如图1所示。RP的溶解度在偏酸性和偏碱性条件下比较好,且碱性条件下溶解度优于酸性条件。RP在pH 4~5处蛋白质的溶解度最低,约为2%~4%,可能的原因是接近蛋白质等电点时溶解度最差。相比较而言,RP/FA复合物与RP的溶解度相似,然而RP/FA/LAC酶法交联物在酸性pH值时的溶解度较RP有所降低,而中性及碱性条件下有所提高。研究发现蛋白质与FA的共价结合可能是由于损失了带正电的赖氨酸[14],赖氨酸是一种亲水氨基酸,其游离氨基组倾向于定位在蛋白质的表面,而蛋白与多酚的共价结合相应的屏蔽带正电的氨基组,从而导致蛋白质分子表面的净电荷改变,等电点可能向低pH值偏移,影响共价复合物在不同
pH值的溶解度的变化[23]。
2.3 乳液的乳化特性
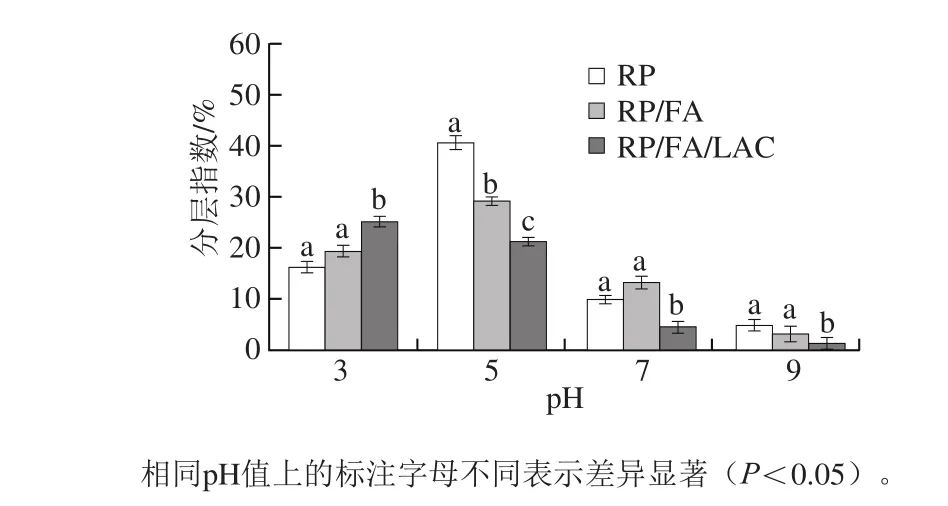
图2 不同pH值下蛋白乳状液分层指数Fig. 2 Creaming index of emulsions stabilized by RP, RP/FA crosslinking, and LAC-catalyzed RP/FA cross-linking at different pHs
RP乳液的乳化特性与pH值的关系如图2所示,可以发现在pH 7和pH 9时,RP乳液的分层指数较小,显示出较好的稳定性,但是在pH 5和pH 3时,分层指数增大,乳液出现了相分离,原因是此时pH值接近蛋白质等电点,蛋白质分子之间静电斥力会有所降低,乳液的油滴易于聚集从而导致乳液的稳定性降低[24]。由表2、3可知,当乳液的pH值较低时(pH 3),蛋白质分子以正离子状态存在(Zeta电位>0),电荷互相排斥,RP乳液的粒径也相对较小,但随着pH值的升高,当乳液pH 5时(等电点附近)时,RP分子的净电荷接近为零,静电斥力最小,油滴聚集,粒径最大,当pH值继续升高(pH 7~9),乳液的粒径又随着pH值的升高而减小。此外,对于胶体体系而言,Zeta电位的大小决定粒子之间的静电相互作用,Zeta电位的绝对值越大意味着乳液稳定性越好[25-26]。由表3结果可知,当pH 5时乳液的Zeta电位的绝对值最低,说明随着pH值降低到蛋白的等电点,被RP包裹的乳液油滴表面总电荷下降,蛋白分子间的静电斥力减少,从而增加了油滴之间的聚集。在pH>5时,Zeta电位随溶液pH值的增加而升高,这是因为随着pH值的增加,蛋白质分子的电荷增加,水化层的厚度增加,因此乳化颗粒间的静电斥力随之增加,因此形成的乳状液也较稳定。说明RP在酸性范围的乳化稳定性远远小于碱性范围的乳化稳定性[27]。
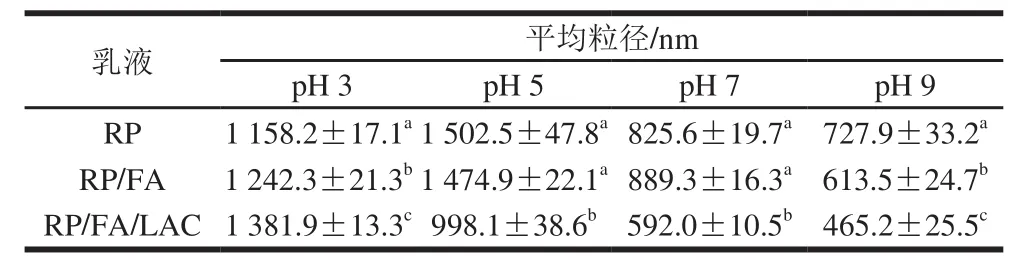
表2 不同pH值条件下的乳液平均粒径Table 2 Mean particle size of emulsions stabilized by RP, RP/FA crosslinking, and LAC-catalyzed RP/FA cross-linking at different pHs

表3 不同pH值条件下的乳液Zeta电位Table 3 Zeta potential of emulsions stabilized by RP, RP/FA crosslinking, and LAC-catalyzed RP/FA cross-linking at different pHs
RP/FA复合物乳液的粒径和分层指数在pH 7时较RP乳液有轻微增加,由于FA与RP非共价复合物之间存在弱相互作用,FA可能在高压处理的时候与RP分子分开,造成RP与FA之间在乳液界面处竞争吸附关系,导致乳化稳定性降低[22]。在pH 9条件下RP/FA复合物乳液的粒径和分层指数的较RP乳液数有轻微降低,可能的原因是在碱性条件下,FA易被氧化形成醌类与RP发生共价结合,从而改善乳液的乳化性。在pH 3时RP/FA复合物乳液的粒径和分层指数的较RP乳液数有所增加,可能的原因是RP与FA复合物的等电点向酸性条件偏移,从而降低其乳化性。
RP/FA/LAC酶法交联物乳液的粒径和分层指数在pH 5、7、9时较RP乳液有所降低、Zeta电位的绝对值增加,说明LAC催化FA与RP形成的交联物能够改善蛋白乳液的乳化稳定性。Steffensen等[13]认为通过LAC促进FA与蛋白质的相互作用可以降低蛋白质的界面张力,从而改善乳液的流变学性质。Sato等[12]的研究也表明在乳液界面上LAC催化酪蛋白和FA交联,也能有效地改善酪蛋白酸钠的乳化特性及流变学性质。
2.4 乳液的微观结构

图3 RP、RP/FA和RP/FA/LAC交联物乳液在不同pH值条件下的CLSM图片Fig. 3 CLSM images of emulsions stabilized by RP, RP/FA crosslinking, and LAC-catalyzed RP/FA cross-linking at different pHs
通过CLSM观察不同pH值条件下乳液的微观结构(图3)。CLSM图片显示了乳液在不同pH值下乳液的聚集状态,RP乳液在放置7 d后,在pH 7和pH 9的条件下有部分分层的现象,所以造成RP在CLSM图也出现聚集现象,但是,RP/FA/LAC酶法交联物在pH 7和pH 9的条件下,乳液显示出较好的稳定性;在pH 3和pH 5条件下,RP和RP/FA复合物乳液均发生了聚集或絮凝现象,乳液显示失稳的状态;在pH 3时,从RP/FA/LAC酶法交联物乳液的CLSM图也可以看出聚集现象或絮凝现象,且乳液的粒径增加(表2)、Zeta-电位降低(表3),说明RP/FA/LAC酶法交联物乳液在此pH值下的稳定性降低,而RP/FA/LAC酶法交联物乳液在pH 5、7、9时显示出好的稳定性,结果与乳液的粒径和电位的结果保持一致,可能的原因是RP与FA复合物的等电点向酸性条件偏移,从而降低其乳化性。而RP/FA复合物是没有添加LAC的,由于FA与RP非共价复合物之间存在弱相互作用,可能在高压处理的时候FA与RP分子分开,造成RP与FA之间在乳液界面处竞争吸附关系,导致RP/FA在pH 5、7时也出现聚集,说明RP/FA复合物没有显著改善RP的乳化稳定性。
2.5 乳液中油脂的氧化
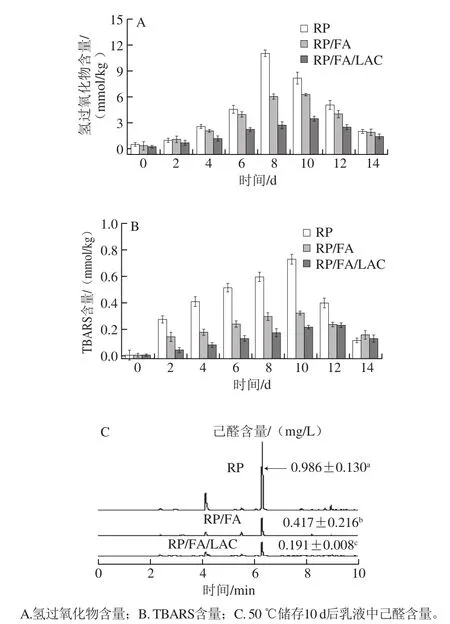
图4 乳液中油脂氧化产物的含量Fig. 4 Content of lipid oxidation products in emulsions stabilized by RP, RP/FA cross-linking, and LAC-catalyzed RP/FA cross-linking
为了评估FA对RP乳液的抗氧化稳定性的影响,通过对脂质氢过氧化物、TBARS及己醛的含量进行测定,结果如图4所示。玉米油在高温条件下易发生氧化降解,油脂氧化的初始产物主要是氢过氧化物,以氢过氧化物(油脂的初级氧化指标)和TBARS(油脂的二级氧化指标)表征油脂氧化情况。从图4A可以发现,RP乳液中油脂氢过氧化物含量在第8天达到最大值,相比较RP乳液中的氢过氧化物的含量(11.12 mmol/kg),RP/FA复合物乳液明显降低了氢过氧化物的含量(6.36 mmol/kg),而RP/FA/LAC酶法交联物产生的氢过氧化物更低(3.59 mmol/kg),说明FA/RP符合物在乳液的界面处具有更好的抗氧化活性。由图4B可知,RP乳液中油脂的TBARS含量在第10天达到最大值,相比较RP乳液中的TBARS含量(0.73 mmol/kg),RP/FA复合物乳液中显示出低的TBARS含量为0.32 mmol/kg,而RP/FA/LAC酶法交联物乳液产生的TBARS含量更低(0.23 mmol/kg),结果与氢过氧化物的结果保持一致。
己醛作为玉米油氧化的一种主要二级氧化产物,通过GC分析乳液存储10 d后顶部空间中己醛的含量。由图4C可知,己醛的含量也呈现相同的变化规律,RP/FA复合物制备的乳液中己醛的含量为0.417 mg/L、RP/FA/LAC酶法交联物乳液中己醛的质量浓度为0.191 mg/L,远低于空白RP乳液(0.986 mg/L),说明FA与RP交联后能够有效提高乳液中油脂的氧化稳定性,而且RP/FA/LAC酶法交联物的抗氧化活性高于RP/FA复合物。这些结果进一步证实了FA能有效改善乳液的抗氧化稳定性。一般来说,乳液的界面处对抗氧化至关重要[28],且抗氧化剂在O/W乳液的界面处抗氧化效果最好[29],由于共价结合中FA主要吸附在O/W界面处,暗示蛋白与FA共价结合的复合物具有更高的抗氧化潜力。Wang Xiaoya等[23]在研究发现乳清蛋白与表没食子儿茶素没食子酸酯共价交联后绑定了更多的羟基基团,从而导致蛋白与表没食子儿茶素没食子酸酯共价交联物较非共价复合物具有更高的抗氧化活性。
3 结 论
前期实验中研究了RP与FA的酶法交联前后的蛋白质结构和体外抗氧化能力的变化。为此进一步分析了RP/FA/LAC酶法交联物的功能特性,包括溶解性、表面疏水性、乳化特性和抗氧化稳定性。结果表明RP/FA/LAC酶法交联物的表面疏水性(H0=132.3)要低于RP/FA复合物的表面疏水性(H0=159.1)和RP的表面疏水性(H0=186.4);RP/FA/LAC酶法交联物在酸性条件下的溶解度低于RP,而在碱性条件下高于RP;RP乳液在pH 7和pH 9时,都显示出较好的稳定性,RP乳液在pH 5和pH 3出现了相分离,说明RP在酸性范围的乳化稳定性远远小于碱性范围的乳化稳定性;而RP/FA/LAC酶法交联物乳液在pH 5、7、9条件下较RP乳液具有更好的乳液稳定性;此外,相比较RP乳液中的氢过氧化物最高含量(11.12 mmol/kg),RP/FA复合物乳液明显降低了氢过氧化物含量(6.36 mmol/kg),而RP/FA/LAC酶法交联物产生的氢过氧化物更低(3.59 mmol/kg),TBARS和己醛含量也具有类似的趋势,说明RP/FA/LAC酶法交联物较RP/FA复合物和RP具有更好的氧化稳定性,能够有效减少乳液中氢过氧化物、TBARS和己醛的含量。综上所述,LAC能有效地促进FA与RP交联,从而改善RP的功能性质,且绑定FA基团的RP分子具有更好的氧化稳定性,说明RP与FA的LAC酶法交联物在含有乳化体系等食品加工中具有潜在应用价值。
[1] 夏宁. 喷射蒸煮制备米糠、碎米蛋白及其功能性研究[D]. 广州: 华南理工大学, 2012: 10-15.
[2] BEHZAD G, ASHKAN M. Fabrication of whey proteinpectin conjugate particles through laccase-induced gelation of microemulsified nanodroplets[J]. Food Hydrocolloids, 2014, 40(5): 189-195. DOI:10.1016/j.foodhyd.2014.02.017.
[3] SONG Y, WU T G, YANG Q H, et al. Ferulic acid alleviates the symptoms of diabetes in obese rats[J]. Journal of Functional Foods, 2014, 9(7): 141-147. DOI:10.1016/j.jff.2014.04.007.
[4] 廖律. 米糠中阿魏酸的提取分离与测定研究[D]. 长沙: 中南大学, 2007: 17-19.
[5] OU S Y, KWOK K C. Ferulic acid: pharmaceutical functions, preparation and applications in foods[J]. Journal of the Science of Food and Agriculture, 2004, 84(11): 1261-1269. DOI:10.1002/jsfa.1873.
[6] KANG J, LIU Y, XIE M X, et al. Interactions of human serum albumin with chlorogenic acid and ferulic acid[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2004, 1674(2): 205-214. DOI:10.1016/ j.bbagen.2004.06.021.
[7] KROLL N G, RAWEL H M, ROHN S. Reactions of plant phenolics with food proteins and enzymes under special consideration of covalent bonds[J]. Food Science and Technology Research, 2003, 9(3): 205-218. DOI:10.1016/S0141-8130(02)00016-8.
[8] PIAZZON A, VRHOVSEK U, MASERO D, et al. Antioxidant activity of phenolic acids and their metabolites: synthesis and antioxidant properties of the sulfate derivatives of ferulic and caffeic acids and of the acyl glucuronide of ferulic acid[J]. Journal of Agricultural and Food Chemistry, 2012, 60(50): 12312-12323. DOI:10.1021/jf304076z.
[9] OU S Y, WANG Y, TANG S Z, et al. Role of ferulic acid in preparing edible films from soy protein isolate[J]. Journal of Food Engineering, 2005, 70(2): 205-210. DOI:10.1016/j.jfoodeng.2004.09.025.
[10] PRODPRAN T, BENJAKUL S, PHTCHARAT S. Effect of phenolic compounds on protein cross-linking and properties of film from fish myofibrillar protein[J]. International Journal of Biological Macromolecules, 2012, 51(5): 774-782. DOI:10.1016/ j.ijbiomac.2012.07.010.
[11] ERICILI C D, LANTTO R, LILLE M, et al. Laccase-aided protein modification: effects on the structural properties of acidified sodium caseinate gels[J]. International Dairy Journal, 2009, 19(12): 737-745. DOI:10.1016/j.idairyj.2009.06.007.
[12] SATO A C K, PERRECHIL F A, COSTA A A S, et al. Cross-linking proteins by laccase: effects on the droplet size and rheology of emulsions stabilized by sodium caseinate[J]. Food Research International, 2015, 75(4): 244-251. DOI:10.1016/j.foodres.2015.06.010.
[13] STEFFENSEN C L, ANDERSEN M L, DEGN P E, et al. Crosslinking proteins by laccase-catalyzed oxidation: importance relative to other modifications[J]. Journal of Agricultural and Food Chemistry, 2008, 56(24): 12002-12010. DOI:10.1021/jf801234v.
[14] 贾潇, 赵谋明, 贾春晓, 等. 漆酶催化大米蛋白与阿魏酸交联及其结构和抗氧化活性的变化[J]. 现代食品科技, 2016, 32(11): 98-105. DOI:10.13982/j.mfst.1673-9078.2016.11.015.
[15] LIU Yongle, LI Xianghong, ZHOU Xiaoling, et al. Effects of glutaminase deamidation on the structure and solubility of rice glutelin[J]. LWT-Food Science and Technology, 2011, 44(10): 2205-2210. DOI:10.1016/j.lwt.2011.05.011.
[16] NOOSHIN A P, LI C, EUNICE C Y. Comparison of protein surface hydrophobicity measured at various pH values using three different fluorescent probes[J]. Journal of Agricultural and Food Chemistry, 2000, 48(2): 328-334. DOI:10.1021/jf990393p.
[17] CHENG Q, DEKERR E A, XIAO H, et al. Nanoemulsion delivery systems: influence of carrier oil on β-carotene bioaccessibility[J]. Food Chemistry, 2012, 135(3): 1440-1447. DOI:10.1016/j.foodchem.2012.06.047.
[18] MATALANIS A, DECER E A, MCCLEMENTS D J. Inhibition of lipid oxidation by encapsulation of emulsion droplets within hydrogel microspheres[J]. Food Chemistry, 2012, 132(2): 766-772. DOI:10.1016/j.foodchem.2011.11.034.
[19] MEI Longyuan, McCLEMENTS D J, WU Junnan, et al. Ironcatalyzed lipid oxidation in emulsion as acted by surfactant, pH and NaCl[J]. Food Chemistry, 1998, 61(3): 307-312. DOI:10.1016/S0308-8146(97)00058-7.
[20] CUI Z M, KONG X Z, CHEN Y M, et al. Effects of rutin incorporation on the physical and oxidative stability of soy protein-stabilized emulsions[J]. Food Hydrocolloids, 2014, 41(10): 1-9. DOI:10.1016/ j.foodhyd.2014.03.006.
[21] YANG W, LIU F G, XU C Q, et al. Molecular interaction between (-)-epigallocatechin-3-gallate and bovine lactoferrin using multispectroscopic method and isothermal titration calorimetry[J]. Food Research International, 2014, 64(4): 141-149. DOI:10.1016/ j.foodres.2014.06.001.
[22] WEI Z H, YAND W, FAN R, et al. Evaluation of structural and functional properties of protein-EGCG complexes and their ability of stabilizing a model β-carotene emulsion[J]. Food Hydrocolloids, 2015, 45(11): 337-350. DOI:10.1016/j.foodhyd.2014.12.008.
[23] WANG Xiaoya, ZHANG Jiao, LEI Fei, et al. Covalent complexation and functional evaluation of (-)-epigallocatechin gallate and α-lactalbumin[J]. Food Chemistry, 2014, 150(1): 341-347. DOI:10.1016/j.foodchem.2013.09.127.
[24] XIA N, WANG J M, YANG X Q, et al. Preparation and characterization of protein from heat-stabilized rice bran using hydrothermal cooking combined with amylase pretreatment[J]. Journal of Food Engineering, 2012, 110(1): 95-101. DOI:10.1016/ j.jfoodeng.2011.12.004.
[25] DICKINSON E. Food emulsions and foams: stabilization by particles[J]. Current Opinion in Colloid & Interface Science, 2010, 15(1/2): 40-49. DOI:10.1016/j.cocis.2009.11.001.
[26] von STASZEWSKI M, JAGUS R J, PILLOSOF A M R. Influence of green tea polyphenols on the colloidal stability and gelation of WPC[J]. Food Hydrocolloids, 2011, 25(5): 1077-1084. DOI:10.1016/ j.foodhyd.2010.10.004.
[27] 万红霞, 孙海燕, 刘冬. 动态超高压微射流均质对大米蛋白功能特性的影响[J]. 食品工业科技, 2015, 36(16): 155-161. DOI:1002-6630-201419001.
[28] WAN Z L, WANG J M, WANG L Y, et al. Complexation of resveratrol with soy protein and its improvement on oxidative stability of corn oil/water emulsions[J]. Food Chemistry, 2014, 161(15): 324-331. DOI:10.1016/j.foodchem.2014.04.028.
[29] WARAHO T, McCLEMENTS D J, DECKER E A. Mechanisms of lipid oxidation in food dispersions[J]. Trends in Food Science & Technology, 2011, 22(1): 3-13. DOI:10.1016/j.tifs.2010.11.003.
Emulsifying Properties and Antioxidant Stability of Enzymatically Cross-Linked Products between Rice Protein and Ferulic Acid
JIA Xiao1, ZHAO Mouming1,2, JIA Chunxiao1, TENG Jianwen1, WEI Baoyao1, HUANG Li1, XIA Ning1,*
(1. College of Light Industry and Food Engineering, Guangxi University, Nanning 530004, China; 2. School of Food Science and Engineering, South China University of Technology, Guangzhou 510640, China)
The aim of this study was to investigate the emulsifying properties and antioxidant stability of laccase (LAC)-mediated cross-linked products of rice protein (RP) and ferulic acid (FA). RP emulsion showed marked phase separation at pH 5 and 3, while only partial aggregation was observed at pH 7 and 9, suggesting even lower stability in the acidic pH range than in the basic pH range. The particle size and creaming index of cross-linked RP/FA/LAC emulsion were less than those of RP emulsion at pH 5, 7 and 9, but higher at pH 3, suggesting that emulsion stability of crossed RP/FA/LAC emulsion was improved at pH 5, 7 and 9, but was unstable at pH 3. Moreover, the contents of hydroperoxide (11.12 mmol/kg), TBARS (0.73 mmol/kg) and hexanal (0.986 mg/L) in RP emulsion were significantly higher than those in cross-linked RP/FA/LAC emulsion (3.59 mmol/kg, 0.23 mmol/kg and 0.191 mg/L, respectively), suggesting that RP/FA/LAC cross-linking had better oxidative stability at the emulsion interface. Enzymatic cross-linking between RP and FA will have potential application in emulsion system for food processing.
rice protein; ferulic acid; laccase; cross-linking; emulsifying property; antioxidant stability; oil oxidation
10.7506/spkx1002-6630-201713022
TS201.7
A
1002-6630(2017)13-0131-07
贾潇, 赵谋明, 贾春晓, 等. 大米蛋白与阿魏酸酶法交联物的乳化特性和抗氧化稳定性[J]. 食品科学, 2017, 38(13): 131-137. DOI:10.7506/spkx1002-6630-201713022. http://www.spkx.net.cn
JIA Xiao, ZHAO Mouming, JIA Chunxiao, et al. Emulsifying properties and antioxidant stability of enzymatically crosslinked products between rice protein and ferulic acid[J]. Food Science, 2017, 38(13): 131-137. (in Chinese with English abstract)
10.7506/spkx1002-6630-201713022. http://www.spkx.net.cn
2016-06-07
广西自然科学基金项目(2016GXNSFAA380288);广西科技攻关项目(桂科攻14122006-2;桂科重14121003-6-1);广西八桂学者团队项目及广西高校“广西特色农产品精深加工及安全控制”重点实验室项目
贾潇(1991—),女,硕士,研究方向为粮食油脂植物蛋白工程。E-mail:282172755@qq.com
*通信作者:夏宁(1977—),女,副教授,博士,研究方向为粮食油脂植物蛋白工程。E-mail:xianing@gxu.edu.cn
