山楂降脂软胶囊中4种黄酮含量的测定*
2017-07-24左非非魏双艳徐晓阳张玮杰阴兆静
杜 娟,左非非,魏双艳,徐晓阳,张玮杰,阴兆静,徐 霞
郑州大学药学院 郑州 450001
山楂降脂软胶囊中4种黄酮含量的测定*
杜 娟,左非非,魏双艳,徐晓阳,张玮杰,阴兆静,徐 霞#
郑州大学药学院 郑州 450001
#通信作者,女,1965年4月生,博士,教授,研究方向:药物分析,E-mail:xuxia@zzu.edu.cn
山楂降脂软胶囊;葛根素;木犀草素;槲皮素;儿茶素;液质联用
目的:建立同时测定山楂降脂软胶囊中4种主要黄酮葛根素、木犀草素、槲皮素及儿茶素的超高效液相-串联质谱法。方法:在超声条件下用甲醇提取山楂降脂软胶囊供试品。采用Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm)色谱柱分离,以体积分数0.1%甲酸乙腈和体积分数0.1%甲酸水溶液为流动相梯度洗脱,在负离子模式下采用多反应监测。结果:葛根素、木犀草素、槲皮素、儿茶素分别在0.03~8.10、0.04~8.27、0.02~4.45及0.01~3.11 mg/L的范围内线性良好,R2均>0.992,4种黄酮的平均加样回收率在93.6%~107.5%,相对标准偏差在1.62%~2.21%。结论:建立了适用于快速测定山楂降脂软胶囊中4种黄酮的液质联用定量方法,该方法灵敏、准确、稳定,可用于山楂降脂软胶囊的质量控制。
高脂血症是诱发动脉粥样硬化、冠状动脉粥样硬化性心脏病、脑卒中的主要危险因素之一,如何有效预防和治疗高脂血症已成为当今热点研究之一[1-2]。“药食同疗”作为一种受我国历代医药学家倡导的疾病治疗方案,当下受到越来越多人的推崇[3]。现代药理研究[4-6]表明,山楂具有降血脂、降低胆固醇含量、抗脂质过氧化等多种药理作用。山楂降脂软胶囊因原料为天然药物,制备工艺复杂、合理性不高,质量很难严格控制[7-9]。因此,将尽可能多的有效单体成分作为质量评价指标是确保山楂降脂软胶囊有效、安全及质量可控的可行手段。山楂降脂软胶囊中主要活性成分为黄酮类化合物,这类黄酮主要是以葛根素、木犀草素、槲皮素及儿茶素为苷元的一系列化合物[10-12]。现多采用高效液相色谱法(HPLC)测定山楂提取物中黄酮的含量。然而由于灵敏度的局限性, HPLC仅适用于提取物的测定[13-15],若应用于制剂中,需进一步增大取样量或采取大量溶剂提取后再浓缩富集的方法进行前处理,可操作性不强。文献[16-18]报道的制剂中HPLC测定方法均存在一定不足。该研究采用超高效液相色谱-串联质谱法(UPLC-MS)测定山楂降脂软胶囊中葛根素、木犀草素、槲皮素及儿茶素4种黄酮的含量,报道如下。
1 材料与方法
1.1 材料 仪器:XEVO TQD三重四级杆串联质谱仪、超高效液相色谱仪(ACQUITY UPLC)购自美国Waters公司),质谱工作站(Masslynx 4.1)。药品与试剂:山楂降脂软胶囊(郑州大学药学院制备),二次重蒸水(自制),甲醇、乙腈(质谱级,J.T.Baker赠),葛根素、木犀草素、槲皮素及儿茶素对照品(中国药品生物制品检定所,纯度>99.8%)。实验动物:健康SPF级成年雄性SD大鼠,体重200~250 g,均购自河南省实验动物中心,动物许可证号SCXK(豫) 2015-0004,动物房温度控制在(22±2)℃,湿度控制在60%~80%。
1.2 山楂降脂软胶囊中4种黄酮含量的测定
1.2.1 UPLC-MS/MS条件 色谱条件:液相色谱柱采用Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm);流动相为A和B;梯度洗脱程序见表1;流速为0.2 mL/min,柱温为室温,进样量为5 μL。

表1 山楂降脂软胶囊中4种黄酮液相梯度洗脱程序
A:体积分数0.1%甲酸乙腈溶液;B:体积分数0.1%甲酸水溶液。
质谱条件:所用仪器为Waters公司的XEVO-TQD,采用电喷雾离子(ESI)源,负离子模式;毛细管电压1.00 kV,离子源温度150 ℃,脱溶剂气温度500 ℃,锥孔气N2流速30 L/h,脱溶剂气流速1 000 L/h,碰撞电压14 V,透镜电压2.5 V。采用多反应监测(MRM)模式对药物离子浓度进行测定。山楂降脂软胶囊中4种黄酮的质谱分析参数如表2所示。
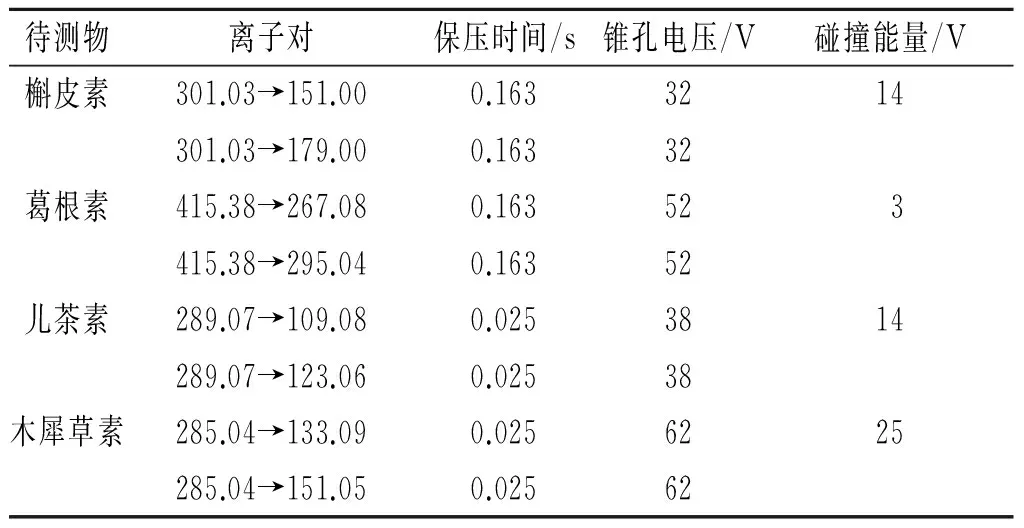
表2 4种黄酮化合物的质谱分析参数
1.2.2 山楂降脂软胶囊供试品溶液的制备 精密称取山楂降脂软胶囊内容物 31.50 mg 于具塞三角瓶中,精密加入50 mL甲醇,密塞,称取质量。超声提取 45 min,放至室温,用甲醇补足减失重量,摇匀滤过,取滤液。滤渣同法操作两次,合并滤液,挥干,残渣用甲醇溶解并定容至 50 mL,摇匀,用 0.45 μm滤膜过滤,即得山楂降脂软胶囊供试品溶液。按照“1.2.1”项下测定条件,采用超高效液相质谱联用仪测定葛根素、木犀草素、槲皮素及儿茶素的含量。
1.2.3 血浆样品的处理 精密移取100 μL血浆样品于1.5 mL的Ep管中,加入500 μL乙腈,涡旋混合3 min后,12 000 ×g离心10 min,取上清于另一洁净的Ep管中,后置于真空浓缩仪中挥干样品中的乙腈,残留物中加入100 μL甲醇复溶,涡旋混匀2 min,12 000 ×g离心10 min,取上清液90 μL过0.22 μm微孔滤膜,上超高效液相质谱联用仪进行分析。
1.3 方法学考察
1.3.1 线性范围考察 取适量葛根素、木犀草素、儿茶素和槲皮素对照品,以甲醇进行梯度稀释得一系列供试品溶液,精密移取5 μL置于100 μL的血浆样品中,涡旋混匀,使得血浆样品中葛根素质量浓度分别为33.3、100.0、300.0、900.0、2 700.0、8 100.0 μg/L,木犀草素质量浓度分别为34.0、102.2、306.5、919.7、2 759.3、 8 278.0 μg/L,槲皮素质量浓度分别为18.3、54.9、164.8、494.5、1 483.5、4 450.5 μg/L,儿茶素质量浓度分别为12.8、38.5、115.4、346.1、1 038.4、3 115.3 μg/L,按照“1.2.3”项下血浆样品处理方法处理,在上述色谱和质谱条件下进行检测,记录色谱图,以葛根素、木犀草素、槲皮素、儿茶素的质量浓度为横坐标,峰面积为纵坐标进行线性回归。
1.3.2 精密度试验 取质量浓度分别为300、2 700 和8 100 μg/L(按葛根素的质量浓度)的山楂降脂软胶囊血浆样品进行日间和日内精密度考察。日内精密度,连续进样6次;日间精密度,连续5 d采用同法测定,计算相对标准偏差(RSD)。
1.3.3 稳定性试验 取质量浓度分别为300、2 700 和8 100 μg/L(按葛根素的质量浓度)的山楂降脂软胶囊血浆样品,每一浓度配制20个样品,共配制3组样品。将这3组样品分别存放0、8、12和24 h,按照1.2.3项下方法,每个时间点处理5个样品,在上述色谱和质谱条件进行检测,考察样品的稳定性。
1.3.4 加样回收率试验 取已测得4种黄酮含量的山楂降脂软胶囊血浆样品6份,分别精密加入相同体积的约等同于成药样品含量的4种黄酮化学对照品混合液,按照1.2.3项下方法处理样品,在上述色谱和质谱条件进行检测,计算样品的加样回收率。
2 结果
2.1 山楂降脂软胶囊中黄酮含量测定 采用针泵进样方式对质谱条件进行优化,在ESI负离子模式下进行全面扫描获得最佳的化合物灵敏度。在优化条件下,4种黄酮成分峰分离较好,且响应及出峰时间稳定。山楂降脂软胶囊中4种黄酮的UPLC-MS/MS离子流图见图1。山楂降脂软胶囊中4种黄酮的含量由高到低依次为木犀草素、葛根素、槲皮素、儿茶素,分别为(1.86±0.10)%、(1.82±0.09)%、(1.00±0.05)%、(0.70±0.03)%。

从左至右:依次为葛根素、木犀草素、槲皮素、儿茶素。图1 山楂降脂软胶囊中4种黄酮的离子流图
2.2 方法学验证
2.2.1 线性范围考察 线性回归结果见表3。
2.2.2 精密度试验 葛根素、木犀草素、槲皮素及儿茶素在不同质量浓度的山楂降脂软胶囊血浆样品中的日内精密度及日间精密度见表4。由表4可知,4种黄酮的日内和日间精密度均小于10.00%,表明该方法符合样品检测的方法学要求。

表3 4种黄酮的线性范围考察结果

表4 山楂降脂软胶囊血浆样品中4种黄酮测定方法的精密度 %
2.2.3 稳定性试验 结果显示葛根素、木犀草素、槲皮素、儿茶素的RSD分别为:<1.81%、<1.95%、<1.27%、<1.71%(n=5),表明样品溶液在室温条件下,24 h内稳定。
2.2.4 加样回收率试验 结果见表5。由表5可知,RSD<15.00%,符合生物样品的测定要求。
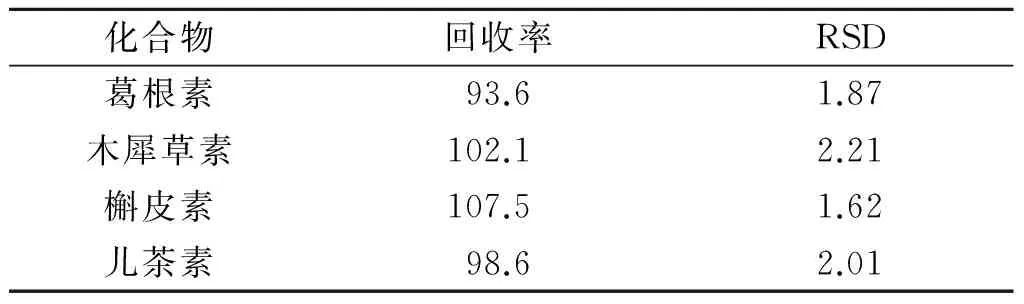
表5 山楂降脂软胶囊血浆样品中4种黄酮的加样回收率和RSD %
3 讨论
葛根素、木犀草素、儿茶素及槲皮素是山楂降脂软胶囊中4种主要的黄酮类成分,因此针对这4种黄酮化合物含量的监测对该软胶囊的质量控制具有重要意义。该研究建立了同时测定山楂降脂软胶囊中4种黄酮的定量方法,完善了山楂降脂软胶囊的质量评价体系。研究结果显示大鼠血浆中葛根素低、中、高3个浓度的相对回收率的RSD<15.00%,加样回收率也符合生物样品的测定要求。方法学评价结果表明,该方法稳定可靠,灵敏准确,短时间内即可完成一个样品的测定,且样品前处理简单,可用于生产中山楂降脂软胶囊的质量监控。
[1]BALLANTYNE CM,SHAH S,KHER U,et al.Lipid-modifying efficacy and tolerability of anacetrapib added to ongoing statin therapy in patients with hypercholesterolemia or low high-density lipoprotein cholesterol[J].Am J Cardiol,2017,119(3):388
[2]LAPPEGÅRD KT,ENEBAKK T,THUNHAUG H,et al.LDL apheresis activates the complement system and the cytokine network, whereas PCSK9 inhibition with evolocumab induces no inflammatory response[J].J Clin Lipidol,2016,10(6):1481
[3]KAMI D,SHI L,SATO T,et al.Cryopreservation of shoot apices of hawthorn in vitro cultures originating from East Asia[J].Sci Hortic,2009,120(1):84
[4]LUO YC,CHEN G,LI B,et al.Evaluation of antioxidative and hypolipidemic properties of a novel functional diet formulation of Auricularia auricula and Hawthorn[J].Innovative Food Sci Emerging Tech,2009,10(2):215
[5]LIU S,CHANG X,LIU X,et al.Effects of pretreatments on anthocyanin composition, phenolics contents and antioxidant capacities during fermentation of hawthorn(Crataegus pinnatifida) drink[J].Food Chem,2016,212(212):87
[7]张玉颖,张晾.山楂对低密度脂蛋白受体基因敲除小鼠脂代谢的影响[J].西安交通大学学报(医学版),2014,35(1):120
[8]吉中强,魏东卉,纪文岩,等.通脉降脂软胶囊对大鼠实验性高脂饮食脂肪肝模型的影响[J].世界中西医结合杂志,2008,3(9):515
[9]庞继梅,陈忠航,雷钧涛.降脂软胶囊对大鼠血脂的调节作用研究[J].中国当代医药,2012,19(30):7
[10]蒋娅兰,黄芳,毋福海,等.高效液相色谱-串联质谱法同时测定银杏保健茶中的16种黄酮类功效成分[J].色谱,2015(10):1032
[11]林秋实,陈吉棣.山楂及山楂黄酮预防大鼠脂质代谢紊乱的分子机制研究[J].营养学报,2000,22(2):131
[12]张文莉,高敏,石森林.分光光度法测定山楂叶提取物中总黄酮的含量[J].中华中医药学刊,2011,29(5):1148
[13]贾荣,倪海镜,赵春芳,等.山葡萄籽提取物中总多酚的含量测定[J].吉林大学学报(医学版),2009,35(5):877
[14]WANG CH,WANG YX,LIU HJ.Validation and application by HPLC for simultaneous determination of vitexin-2″-O-glucoside,vitexin-2″-O-rhamnoside,rutin,vitexin,and hyperoside[J].J Pharmaceutical Analysis,2011,1(4):291
[15]CHANG Q,ZUO Z,CHOW MS,et al.Effect of storage temperature on phenolics stability in hawthorn(Crataegus pinnatifida var.major)fruits and a hawthorn drink[J].Food Chem,2006,98(3):426
[16]LI H,SONG F,XING J,et al.Screening and structural characterization of α-glucosidase inhibitors from hawthorn leaf flavonoids extract by ultrafiltration LC-DAD-MSnand SORI-CID FTICR MS[J].J Am Soc Mass Spectrom,2009,20(8):1496
[17]贾金霞,李宁,郑艳涛,等.两种栽培方法苹果总黄酮含量测定[J].郑州大学学报(医学版),2010,45(2):311
[18]KARIOTI A,GIOCALIERE E,GUCCIONE C,et al.Combined HPLC-DAD-MS, HPLC-MSnand NMR spectroscopy for quality control of plant extracts: the case of a commercial blend sold as dietary supplement[J].J Pharm Biomed Anal,2014,88(88):7
(2016-12-14收稿 责任编辑徐春燕)
Simultaneous quantification of four flavonoids in hawthorn lipid-lowering soft capsules
DUJuan,ZUOFeifei,WEIShuangyan,XUXiaoyang,ZHANGWeijie,YINZhaojing,XUXia
CollegeofPharmaceuticalScience,ZhengzhouUniversity,Zhengzhou450001
hawthorn lipid-lowering soft capsule; puerarin; mignonette; quercetin; catechin; UPLC-MS/MS
Aim: To develop a quantitative method for simultaneous determination of puerarin, mignonette, quercetin and catechin in hawthorn lipid-lowering soft capsules using ultra performance liquid chromatography-tandem triple quadrupole mass spectrometry. Methods: Hawthorn lipid-lowering soft capsules were extracted with methanol under the condition of ultrasound. The separation was carried out on a Waters ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 μm) column. And the mobile phase was consisted of acetonitrile-0.1%(V/V) formic acid and H2O-0.1%(V/V) formic acid in a gradient elution mode. Then the sample solution was analyzed in electrospray ionization-ion mode with multiple reaction monitoring. Results: The results suggested that puerarin, mignonette, quercetin and catechin exhibited a good linearity in the range of 0.03~8.10,0.04~8.27,0.02~4.45 and 0.01~3.11 mg/L, respectively. And the correlation coefficient was higher than 0.992. The average recovery rate of the 4 flavonoids was in the range of 93.6%~107.5%, while the range of relative standard deviation was 1.62%~2.21%. Conclusion: The established method is sensitive, accurate and stable, and meet the requirement for determination of the 4 major flavonoids in hawthorn lipid-lowering soft capsules, thus could be used for quality control of hawthorn lipid-lowering soft capsules.
10.13705/j.issn.1671-6825.2017.04.020
R917
*河南省基础与前沿技术基金资助项目 142300410085;郑州市国际科技合作与交流项目 153PGJHZ204