葛根素通过miR- 490/E3泛素连接酶抑制非小细胞肺癌细胞生长、侵袭和迁移
2022-03-23张钰欣张臻臻赵利刚赵琳琳
张钰欣,张臻臻,赵利刚,赵琳琳
华北理工大学药学院,河北唐山 063000
肺癌是最常见的癌症之一,也是目前全球癌症死亡的主要原因之一[1- 2]。根据组织学类型分类,肺癌主要包括非小细胞肺癌和小细胞肺癌,其中非小细胞肺癌患者约占83%,且大多数确诊患者均为晚期疾病,治疗难、易复发、生存期短[3- 4]。因此,探究治疗药物及其作用机制对延长患者生存期,改善预后至关重要。
葛根素(puerarin)是从葛根中提取的主要生物活性成分,属于异黄酮类化合物[5- 6],具有舒张血管、保护心脏、保护神经、抗氧化、抗癌、抗炎、减轻疼痛、促进骨形成、抑制酒精摄入和减轻胰岛素抵抗等作用,因此被广泛应用于心脑血管疾病、糖尿病、帕金森病、骨坏死以及子宫内膜异位症等疾病的治疗[7- 10]。近期研究发现,葛根素具有抗癌作用,能够抑制胃癌、肝癌、乳腺癌等癌细胞生长,并诱导细胞凋亡[11- 12]。目前有关葛根素对肺癌细胞影响的研究甚少,且葛根素在肺癌细胞中的调控机制尚未明确。
有研究发现,葛根素可通过调控细胞内microRNA的表达,发挥抑癌作用[13- 14]。本课题组前期实验显示,不同浓度葛根素处理后miR- 490的表达明显升高。miR- 490是目前研究较多的抑癌因子之一,可抑制胃癌、乳腺癌、结肠癌、食管癌等恶性肿瘤的生长、迁移和侵袭[15- 17]。miR- 490在非小细胞肺癌中同样具有抑癌作用[18]。且经过生物信息学筛选发现miR- 490潜在下游靶基因为E3泛素连接酶(denticleless E3 ubiquitin protein ligase,DTL),DTL在非小细胞肺癌中表达异常上调[19]。本研究通过培养非小细胞肺癌细胞株A549细胞,并对细胞进行分组处理,研究了葛根素对非小细胞肺癌生长、侵袭和迁移的影响,探讨相关的分子调控机制。
材料和方法
细胞培养及分组A549细胞购自ATCC库,37 ℃、5% CO2条件下采用90% RPMI- 1640+10% FBS培养基,同时补充10%胎牛血清(Gibco,Thermo Fisher Scientific,USA)和100 U/ml青霉素和100 mg/ml链霉素进行培养。葛根素以100 mmol/L浓度的储备液储存于DMSO中,温度为-20 ℃,并用无血清培养基稀释,以供实验使用。细胞培养24 h后,采用0、5、10、20 μmol/L浓度的葛根素处理A549细胞,处理24 h,然后进行分组以供后续实验,包括如下6组:(1)对照组:单纯DMSO处理;(2)葛根素组:单纯葛根素处理;(3)葛根素+miR- 490阴性对照组:葛根素处理,转染miR- 490阴性对照;(4)葛根素+miR- 490沉默模拟物组:葛根素处理,转染miR- 490沉默模拟物;(5)葛根素+miR- 490沉默模拟物+DTL阴性对照组:葛根素处理,转染miR- 490沉默模拟物和DTL阴性对照;(6)葛根素+miR- 490沉默模拟物+DTL沉默质粒组:葛根素处理,转染miR- 490沉默质粒和DTL沉默质粒。此外,为确认质粒转染成功并采用双荧光素酶报告分析验证miR- 490靶向调控DTL表达,将未经葛根素处理的A549细胞分为以下4组:(1)miR- 490过表达对照组:转染miR- 490模拟物阴性对照;(2)miR- 490过表达模拟物组:转染miR- 490过表达模拟物;(3)miR- 490沉默阴性对照组:转染miR- 490沉默阴性对照;(4)miR- 490沉默组:转染miR- 490沉默质粒。miR- 490过表达模拟物和抑制物及其阴性对照购自上海吉玛基因公司。si-NC与Si-DTL均由美国Thermo fisher公司设计并合成。将A549细胞分别以1×106个/孔接种于6孔板中过夜,采用Lipofectamine 2000转染试剂转染细胞。
qRT-PCR检测根据操作说明书,采用Trizol试剂从细胞中提取总RNA,TIANScript cDNA第一链合成试剂盒[天根生化科技(北京)有限公司]进行反转录,SYBR PrimeScript RT-PCR试剂盒(日本Takara公司)进行qRT-PCR,其中,miR- 490使用U6进行标准化分析,DTL、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)使用GAPDH进行标准化分析。采用ABI 7500检测系统(美国Applied Biosystems公司)进行qRT-PCR检测,每个样本重复3次,用2-ΔΔCt法计算相对表达水平。qRT-PCR引物序列见表1。

表1 qRT-PCR引物序列
Western blot检测取处理后的细胞,移除细胞培养瓶中的细胞培养液,用预冷的PBS洗3遍,加入含有10%蛋白酶抑制剂的RIPA裂解液 (MCE,USA),将细胞样品移至1.5 ml离心管中,13 000 ×g离心10 min取上清,BCA法测定蛋白质浓度后保存于-20 ℃备用。采用SDS-PAGE凝胶试剂盒配制12%分离胶和浓缩胶,在聚丙烯酰胺凝胶上电泳分离蛋白后采用湿转方法将蛋白转至NC膜上,5%脱脂牛奶室温下封闭1 h。滴加稀释的一抗兔抗DTL (ab184548,abcam,USA)、E-cadherin (14- 3249- 82,Thermo Fisher,USA)、N-cadherin(PA5- 19486,Thermo Fisher,USA)、Vimentin (PA5- 27231,Thermo Fisher,USA)。4 ℃过夜,次日用PBST洗膜3次,每次10 min,孵育二抗IgG (a0208,上海碧云天生物技术有限公司),室温置于摇床振荡2 h,再次用PBST洗膜3次,每次10 min。加入显影剂并通过Bio-Rad凝胶成像系统显影 (MG8600,北京托摩根生物科技有限公司),使用IPP7.0软件 (Media Cybernetics,Singapore) 进行定量分析。
CCK- 8法检测采用CCK- 8试剂盒(美国Sigma-Aldrich公司)检测葛根素对A549细胞生长的抑制作用,具体为:A549细胞以3000个/孔的密度接种于96孔板中,用5、10、20 μmol/L葛根素处理不同时间点的细胞,并设不加药物处理(0 μmol/L)的细胞作为对照组;向每个孔中加入1/10体积的CCK- 8溶液,37 ℃、5% CO2条件下将培养皿再培养2 h;使用微板阅读器(Bio-Rad Laboratories,USA)在450 nm波长下测定光密度。每个实验分3次进行,结果表示为抑制率(inhibition rate,IR),计算公式如下:IR(%)=[(A-B)/A]× 100,其中A和B分别为对照组和样品组在不同孵育时间点后的吸光度。
Transwell检测采用包被基质凝胶(Becton Dickinson,USA)的Transwell膜对A549细胞进行体外侵袭性检测,无包被基质凝胶的Transwell膜进行细胞迁移能力检测。用加葛根素(20 μmol/L)预处理24 h的A549细胞在无血清培养基中以2×104个/孔的速度被镀在上腔中,在下腔的培养基中加入20%的胎牛血清。孵育24 h后,用棉签从上孔中取出非侵袭性细胞,底部细胞用95%乙醇固定,苏木精染色。随机选取10个视野进行细胞计数,实验重复3次。
双荧光素酶报告检测使用TargetScan数据库(http://www.targetscan.org/vert_72/)进行miR- 490和DTL结合位点分析,并获取含有作用位点的片段序列。分别克隆扩增miR- 490全长、DTL的3’UTR区到pmirGLO (E1330,Promega,USA) 荧光素酶报告载体上,命名为DTL-Wt。预测miR- 490和DTL的结合位点,进行定点突变,构建DTL-Mut载体,内参为表达海肾荧光素酶的pRL-TK载体 (E2241,Promega,USA),miR- 490过表达质粒及过表达阴性质粒分别与荧光素酶报告载体共转染进入293T细胞,荧光检测仪 (Glomax20/20,Promega,USA) 检测荧光强度。
统计学处理采用SPSS 23.0统计软件,符合正态分布的计量资料以均数±标准差表示,组间比较采用Studentt检验或方差分析,并进行Bonferroni校正[20],P<0.05为差异有统计学意义。
结 果
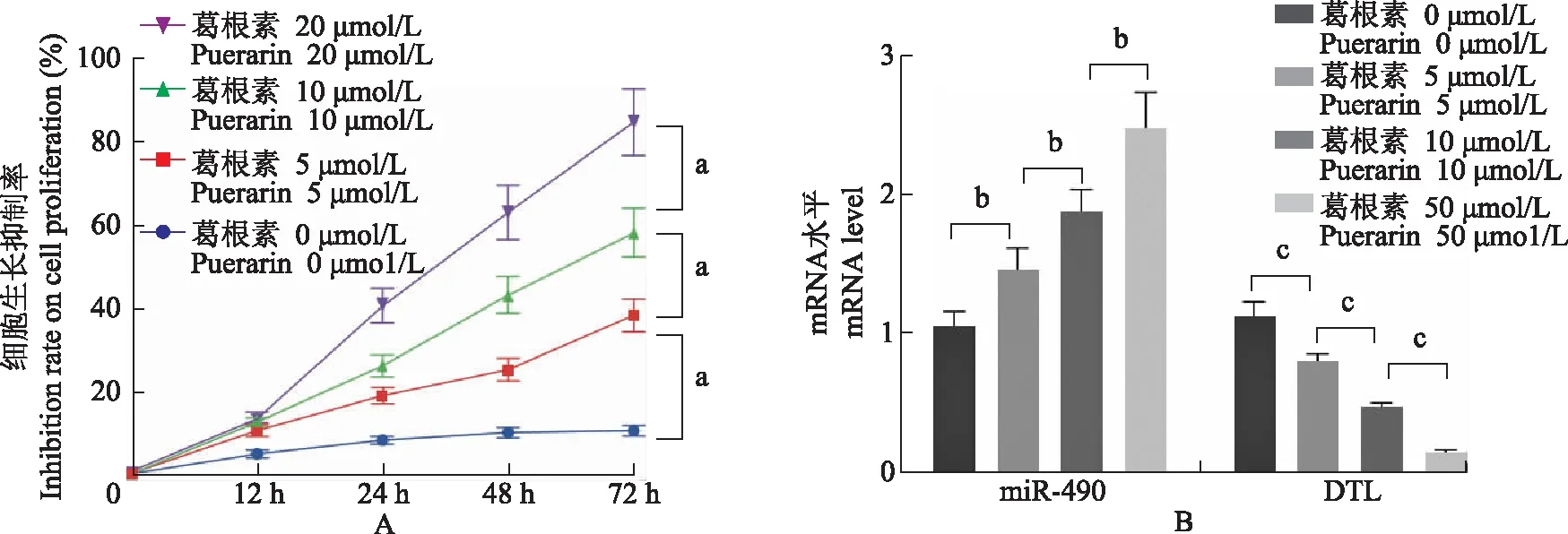
葛根素抑制非小细胞肺癌细胞生长,上调miR- 490表达,下调DTL表达用不同浓度的葛根素处理A549细胞,CCK- 8法检测经葛根素处理后细胞生长抑制率,结果显示,随着浓度逐步升高,细胞抑制率逐步升高(F=105.375,P<0.001)(图1A)。qRT-PCR检测细胞中miR- 490和DTL的表达,结果显示,随着葛根素浓度升高,miR- 490表达逐步升高(F=32.919,P<0.001),DTL表达逐步降低(F=116.120,P<0.001)(图1B)。
miR- 490靶向抑制DTL的表达通过网站(http://www.targetscan.org/vert_72/)查询发现,miR- 490和DTL之间存在结合位点(图2A)。双荧光素酶报告分析显示,与miR- 490过表达对照组相比,miR- 490模拟物和pGL3-DTL Wt共转染后,miR- 490过表达模拟物组荧光素酶活性显著降低(t=7.762,P=0.016)(图2B)。qRT-PCR检测结果显示,与miR- 490过表达对照组相比,miR- 490过表达模拟物组的miR- 490 mRNA表达显著升高(t=13.319,P<0.001),DTL mRNA表达显著降低(t=7.415,P=0.002);与miR- 490沉默阴性对照组相比,miR- 490沉默组细胞中miR- 490表达显著降低(t=9.523,P=0.001),DTL mRNA的表达显著升高(t=11.305,P<0.001)(图2C)。Western blot检测结果显示,与miR- 490过表达对照组相比,miR- 490过表达模拟物组的DTL蛋白表达显著降低(t=7.953,P=0.001);与miR- 490沉默阴性对照组相比,miR- 490沉默组细胞中的DTL 蛋白表达显著升高(t=10.552,P<0.001)(图2D、2E)。经葛根素处理后,qRT-PCR检测结果显示,与对照组相比,葛根素组细胞miR- 490表达显著升高(t=10.255,P=0.001),DTL mRNA表达显著降低(t=6.682,P=0.003);与葛根素+miR- 490阴性对照组相比,葛根素+miR- 490沉默模拟物组细胞中miR- 490表达显著降低(t=10.995,P<0.001),DTL mRNA表达显著升高(t=12.478,P<0.001);与葛根素+miR- 490沉默模拟物+DTL阴性对照组相比,葛根素+miR- 490沉默模拟物+DTL沉默质粒组细胞miR- 490表达差异无统计学意义(t=1.081,P=0.341),DTL mRNA表达显著降低(t=14.321,P<0.001)(图2F)。Western blot检测结果显示,与葛根素+miR- 490阴性对照组相比,葛根素+miR- 490沉默模拟物组DTL蛋白表达显著升高(t=11.423,P<0.001);与葛根素+miR- 490沉默模拟物+DTL阴性对照组相比,葛根素+miR- 490沉默模拟物+DTL沉默质粒组细胞的DTL蛋白表达显著降低(t=12.080,P<0.001)(图2G、2H)。
DTL:E3泛素连接酶
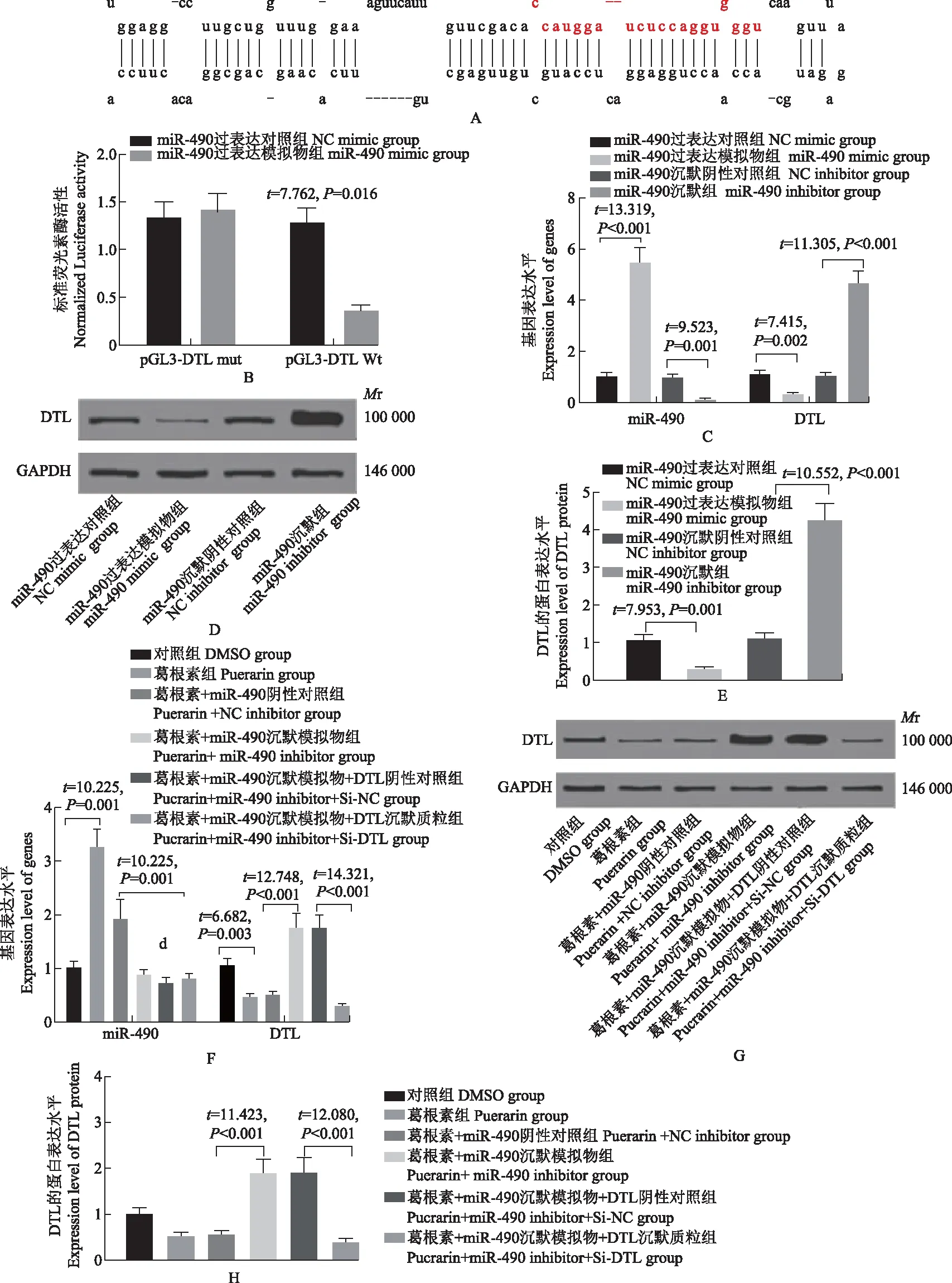
Mr:相对分子质量
葛根素通过miR- 490/DTL抑制非小细胞肺癌细胞增殖CCK- 8法检测结果显示,与对照组相比,葛根素组细胞增殖能力显著降低(F=129.27,P<0.001);与葛根素+miR- 490阴性对照组相比,葛根素+miR- 490沉默模拟物组细胞增殖能力显著升高(F=75.12,P<0.001);与葛根素+miR- 490沉默模拟物+DTL阴性对照组相比,葛根素+miR- 490沉默模拟物+DTL沉默质粒组细胞增殖能力显著降低(F=52.59,P<0.001)(图3)。
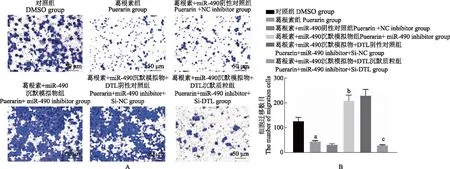
葛根素通过miR- 490/DTL抑制非小细胞肺癌细胞迁移Transwell检测结果显示,与对照组相比,葛根素组细胞迁移能力显著降低(t=8.963,P=0.001);与葛根素+miR- 490阴性对照组相比,葛根素+miR- 490沉默模拟物组细胞迁移能力显著升高(t=12.117,P<0.001);与葛根素+miR- 490沉默模拟物+DTL阴性对照组相比,葛根素+miR- 490沉默模拟物+DTL沉默质粒组细胞迁移能力显著降低(t=12.934,P<0.001)(图4)。
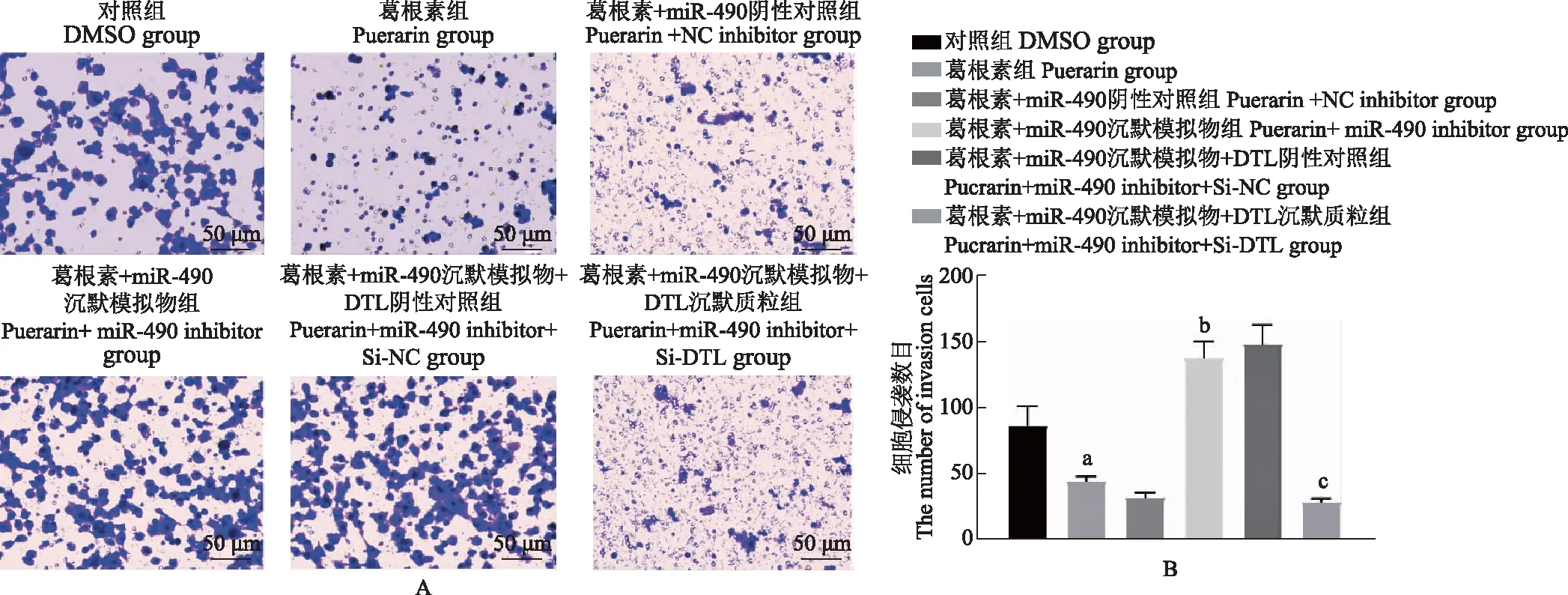
葛根素通过miR- 490/DTL抑制非小细胞肺癌细胞侵袭Transwell检测结果显示,与对照组相比,葛根素组细胞侵袭能力显著降低(t=4.710,P=0.009);与葛根素+miR- 490阴性对照组相比,葛根素+miR- 490沉默模拟物组细胞侵袭能力显著升高(t=13.264,P<0.001);与葛根素+miR- 490沉默模拟物+DTL阴性对照组相比,葛根素+miR- 490沉默模拟物+DTL沉默质粒组细胞侵袭能力显著降低(t=13.476,P<0.001)(图5)。
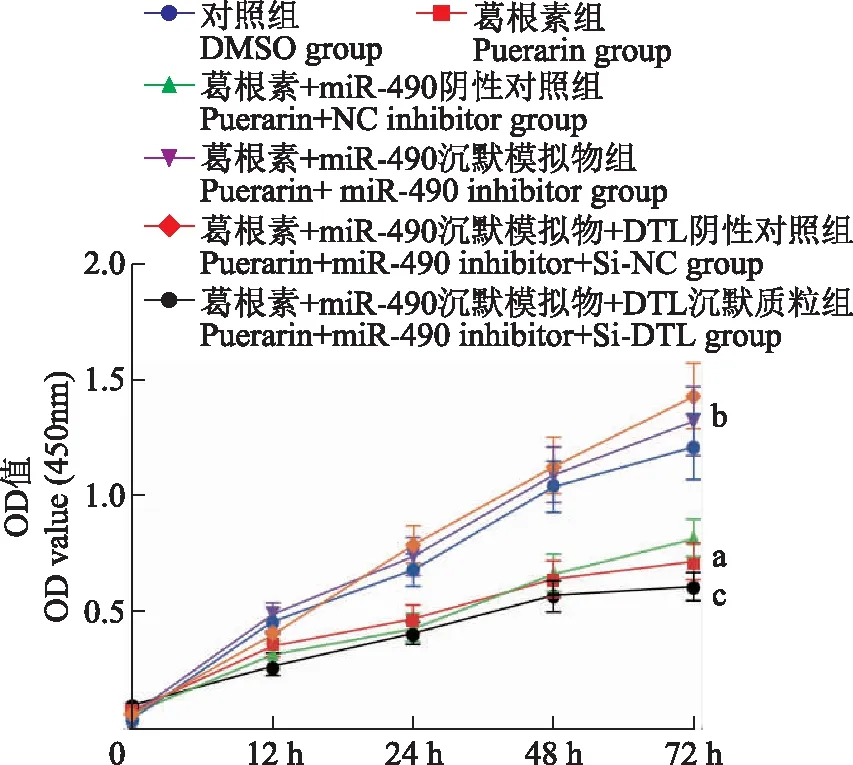
与对照组比较,aP<0.001;与葛根素+miR- 490阴性对照组比较,bP<0.001;与葛根素+miR- 490沉默模拟物+DTL阴性对照组比较,cP<0.001
葛根素通过miR- 490/DTL抑制非小细胞肺癌细胞上皮细胞-间充质转化进程为进一步研究葛根素通过miR- 490/DTL对非小细胞肺癌上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)过程的影响,本研究采用Western blot检测EMT的标志因子E-cadherin、N-cadherin和Vimentin蛋白的表达,结果显示,与对照组相比,葛根素组E-cadherin蛋白表达显著升高(t=7.137,P=0.002),N-cadherin(t=8.828,P=0.001)和Vimentin蛋白表达(t=6.594,P=0.003)显著降低;与葛根素+miR- 490阴性对照组相比,葛根素+miR- 490沉默模拟物组细胞中E-cadherin蛋白表达显著降低(t=12.376,P<0.001),N-cadherin(t=13.436,P<0.001)和Vimentin蛋白表达(t=11.467,P<0.001)显著升高;与葛根素+miR- 490沉默模拟物+DTL阴性对照组相比,葛根素+miR- 490沉默模拟物+DTL沉默质粒组E-cadherin蛋白表达显著升高(t=13.081,P<0.001),N-cadherin(t=10.835,P<0.001)和Vimentin蛋白表达(t=11.862,P<0.001)显著降低(图6)。
讨 论
葛根素是葛根中含量最丰富的次生代谢产物,且随着对葛根素的深入研究,发现葛根素不仅对退行性神经疾病和心脑血管疾病具有显著疗效,还可发挥抗癌作用[20- 21]。近年来,越来越多的文献报道葛根素在各类癌细胞中的作用。Deng等[22]研究显示,葛根素可下调促肿瘤细胞因子水平,显著降低炎症反应,抑制EMT,进而抑制结肠癌的进展。Yi等[23]研究发现,基于纳米给药系统,体内实验证实葛根素可抑制肿瘤细胞生长。Tao等[24]研究认为,葛根素可干预肺癌干细胞样细胞活力,抑制自我更新和侵袭能力,可作为治疗肺腺癌的候选化合物。此外,葛根素可抑制膀胱癌T24细胞增殖并诱导凋亡,其机制可能与抑制沉默信息调节因子1、p53信号通路有关[25]。有研究报道,葛根素在非小细胞肺癌中同样具有抑癌作用,可抑制非小细胞肺癌迁移和侵袭[26],但是葛根素在非小细胞肺癌中的调控机制目前尚未明确。本研究采用不同浓度的葛根素处理非小细胞肺癌细胞株A549细胞,结果发现随着处理浓度的升高,A549细胞生长逐步受到抑制。
与对照组比较,a P=0.001;与葛根素+miR- 490阴性对照组比较,bP<0.001;与葛根素+miR- 490沉默模拟物+DTL阴性对照组比较,cP<0.001
与对照组比较,aP=0.009;与葛根素+miR- 490阴性对照组比较,bP<0.001;与葛根素+miR- 490沉默模拟物+DTL阴性对照组比较,cP<0.001
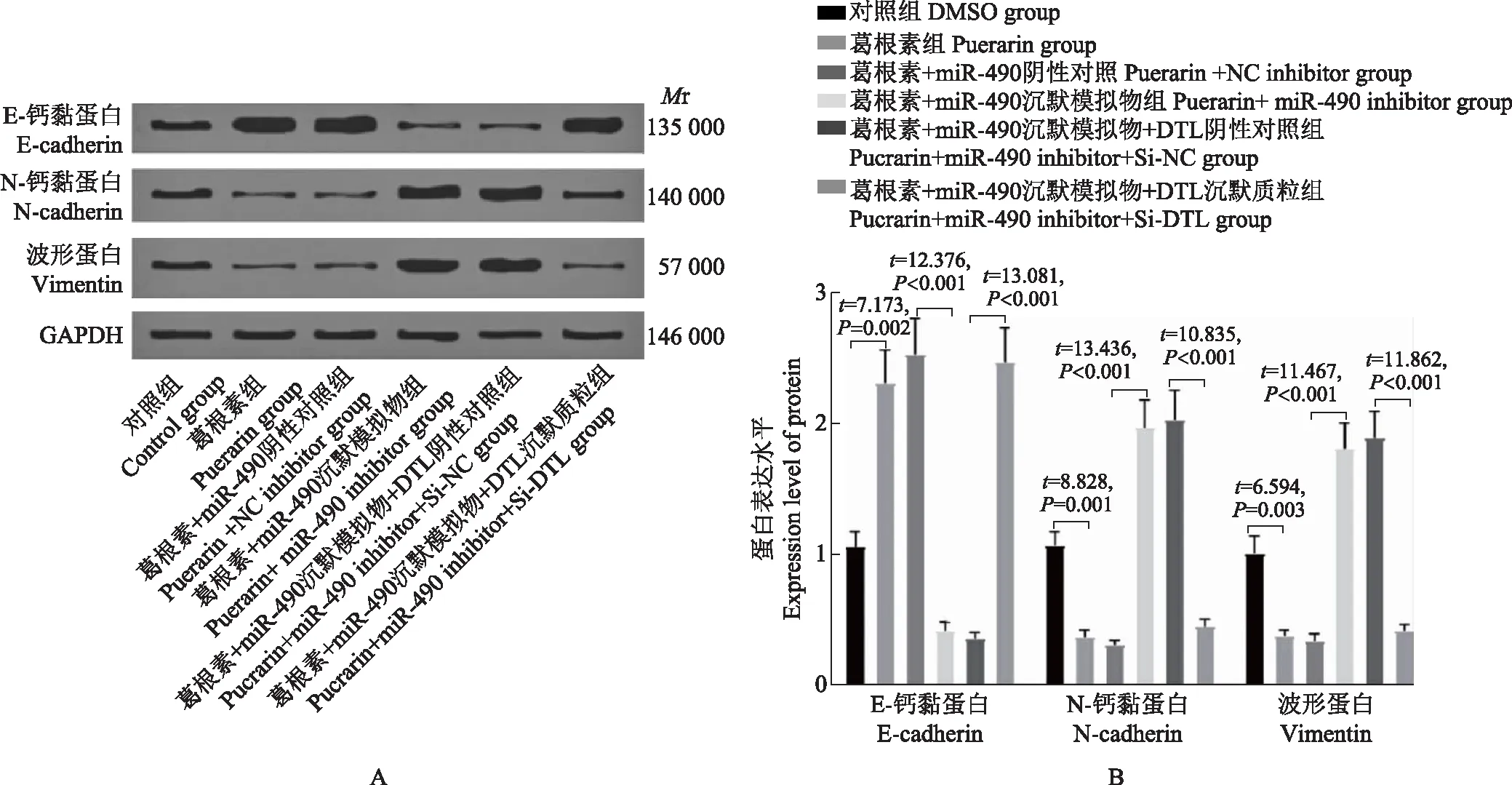
A.蛋白免疫印迹图;B.上皮细胞-间充质转化相关蛋白E-钙黏蛋白、N-钙黏蛋白和波形蛋白的表达
葛根素通常通过调控癌细胞生长、迁移和侵袭相关的分子机制,进而抑制肿瘤细胞的发展。有研究显示,在乳腺癌、卵巢癌等恶性肿瘤中,可通过调控microRNA的表达,起到抑制肿瘤发展的作用[27- 28]。本研究显示,用不同浓度葛根素处理A549细胞,miR- 490的表达出现明显变化,随着葛根素处理浓度升高,miR- 490表达也随之逐步升高。因此推测在非小细胞肺癌中,葛根素可能通过上调miR- 490的表达,进而影响非小细胞肺癌的生长、侵袭和迁移。miR- 490是目前研究较多的抑癌因子之一,其在胆管癌、肺癌、乳腺癌、卵巢癌等癌症中均具有抑癌作用[29- 30]。Gu 等[31]研究表明miR- 490在肺癌细胞中表达显著下调,并且具有抑制肺癌细胞增殖的作用。
为证实这一推测,对细胞进行葛根素与miR- 490抑制物联合处理,并检测处理后的A549细胞生长、迁移和侵袭的情况,结果显示,miR- 490抑制后,葛根素对A549细胞增殖、迁移和侵袭的抑制作用被显著阻断,由此表明葛根素可通过上调miR- 490的表达,进而抑制非小细胞肺癌生长、侵袭和迁移。
DTL已被证实是一种潜在的促癌因子[32]。Perez-Pea 等[33]研究表明,DTL在乳腺癌和肺癌中的表达均显著升高。本研究通过生物信息学筛选发现,miR- 490与DTL之间存在结合位点,因此推测DTL可能是miR- 490新的靶基因。双荧光素酶报告初步显示,miR- 490与DTL之间存在靶向关系。通过对miR- 490抑制联合DTL沉默处理证实,miR- 490可通过抑制DTL的表达,抑制非小细胞肺癌的生长和迁移。
综上,本研究结果显示,在非小细胞肺癌中,葛根素可通过上调miR- 490的表达,靶向抑制下游靶基因DTL的表达,进而抑制非小细胞肺癌生长和迁移。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
