新型微管稳定剂吲哚美辛衍生物的合成与抗肿瘤活性研究
2017-07-20颜宝红
颜宝红,常 育
新型微管稳定剂吲哚美辛衍生物的合成与抗肿瘤活性研究
颜宝红,常 育
目的 设计合成一系列吲哚美辛衍生物并测定其体外抗肿瘤和微管蛋白抑制活性。方法 以5-甲氧基-2-甲基-3-吲哚乙酸为起始原料经两步酰化反应合成12个化合物,MTT法检测目标化合物对HT29、A549、Hep-2、MCF-7肿瘤细胞的抑制活性,同时采用浊度法评价其体外微管蛋白的抑制作用。结果 12种目标化合物均呈现了优于吲哚美辛的体外抗肿瘤作用和微管蛋白抑制活性,其中3位羧基侧链苯乙基取代的化合物12作用于人结肠癌细胞HT29的IC50(2.2 μmol)为吲哚美辛的400倍,并且可以干扰微管聚合,其作用于微管蛋白的IC50为5.6 μmol。结论 改变吲哚美辛1位酰胺和3位羧酸侧链所得的系列衍生物是一类新型的以微管为靶点的抗肿瘤候选药物。
微管;吲哚美辛;合成;抗肿瘤
0 引言
微管是构成细胞完整功能的一部分,参与细胞有丝分裂中的染色体分离、细胞内物质的运输、细胞形态的形成与维持、细胞运动、细胞膜上分子的分布等[1]。因此,破坏微管的动态稳定性将直接影响肿瘤细胞的快速增殖。近年来,环氧化酶-2(COX-2)抑制剂非甾体抗炎药(NSAIDs)常被应用于临床肿瘤疾病的治疗[2],尤其对COX-2高表达的结肠癌的发生和发展具有较强的抑制作用[3-4]。另外,曾有学者通过模拟紫杉醇和秋水仙碱与微管蛋白的作用方式,采用蛋白质组学和生物化学的方法探究了COX-2抑制剂这一类非甾体抗炎药的作用靶点,结果表明其主要与人们所熟知的抗肿瘤药物靶点微管蛋白和热休克蛋白27(Hsp27)结合[5]。这些研究为今后开发具有潜力的微管蛋白抑制剂提供了新的方向。吲哚美辛(Indomethacin,IN)作为抗炎、抗风湿和解热镇痛的一类非甾体抗炎药,因具有一定的抗肿瘤作用而备受广大学者关注[6]。临床研究表明,吲哚美辛对乳腺癌[7]、皮肤鳞癌[8]、结肠癌[3]、胃癌[9-10]、肝癌[11]等患者的免疫功能都有积极的作用。Mercadante等[12-13]曾报道吲哚美辛可以减轻晚期癌症患者发热引起的疼痛。但目前临床上主要采用非甾体抗炎药与其他药物联合应用抗肿瘤[14-16]。根据Temporelli等[17]学者报道,非甾体抗炎药在临床疾病的治疗中可能会引起一系列心血管不良反应,几年前意大利药物署(AIFA)也曾警告,对于患有严重心血管疾病如心脏衰竭的患者,应谨慎应用非甾体抗炎药。因此,本课题以吲哚美辛为先导物,试图保留吲哚母核和5位的甲氧基结构,通过两步酰化反应得1位苯甲酰和3位羧基侧链有不同大小、极性基团取代的目标化合物1~12,寻求具有高微管蛋白亲和性、高肿瘤组织选择性、低毒性的吲哚美辛衍生物。
1 材料与方法
1.1 仪器与试剂 Varian Mercury-400型核磁共振仪(瑞士布鲁克公司),WRS-2型微机熔点测定仪(上海精密科学仪器公司),LCQ Deca XP plus型离子阱质谱仪(德国Bruker公司),SHZ-95B旋转蒸发仪(郑州市亚荣仪器有限公司),SHI-D(Ⅲ)循环水式多用真空泵(郑州长城仪器有限公司),DHG-9145A电热鼓风干燥箱(上海右一仪器有限公司),二氧化碳培养箱(美国Thermo公司),超净台(美国Thermo公司),BIO-RAD酶标仪(美国Bio-Rad伯乐),UV2300紫外可见分光光度计(南京菲勒仪器有限公司),人结肠癌细胞(HT29),非小细胞肺癌细胞(A549),人喉癌上皮细胞(Hep-2),人乳腺癌细胞(MCF-7)均购自上海中科院细胞库,四甲基偶氮唑蓝MTT(Amresco分装),胰酶(Sigma公司),胎牛血清(Sigma公司),胰蛋白酶(Sigma公司),DMEM高糖培养基(Gibco公司),DMSO,哌嗪-N,N-二(2-乙磺酸)倍半钠盐PIPES(Gibco公司),高纯度微管蛋白,EGTA,GTP,5-甲氧基-2-甲基-3-吲哚乙酸,对溴苯甲酰氯,草酰氯均购自百灵威科技有限公司,所用试剂均为市售分析纯。
1.2 方法
1.2.1 中间体5-甲氧基-2-甲基-3-吲哚乙酰胺的合成 称量5-甲氧基-2-甲基-3-吲哚乙酸0.219 g(1 mmol)溶于15 mL干燥四氢呋喃中,冰水浴下滴加草酰氯(1.2 mmol),滴加完毕,50 ℃回流1 h,旋干溶剂。称量相应的胺(1 mmol)溶于20 mL四氢呋喃,冰水浴下滴加上步制备的酰氯,并同时滴加3 mL三乙胺,室温搅拌4 h,TLC监测至反应完毕,蒸干溶剂,乙酸乙酯萃取,水洗,5% NaCO3溶液洗,无水MgSO4干燥,柱色谱提纯得中间体,收率69.0%~88.7%。
1.2.2 目标化合物的合成 称量中间体(0.35 mmol)溶于DMF,0~4 ℃下分批加入NaH 16.8 mg(0.70 mmol),氩气保护搅拌10 min,然后缓慢滴入对氯或对溴苯甲酰氯(0.4 mmol),搅拌0.5 h,然后反应液用20 mL碳酸氢钠溶液骤冷,并用乙酸乙酯(3×20 mL)萃取。有机层减压浓缩,柱色谱提纯得目标化合物1~12,收率45.5%~79.1%(合成路线见图1)。
N-苯基-2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1H-吲哚-3-)乙酰胺(1):白色固体,收率45.5%;1H-NMR(400 MHz,DMSO-d6)δ(ppm):7.74(2H,d,J=8.4 Hz),7.56(2H,d,J=8.0 Hz),7.40(2H,d,J=7.6 Hz),7.28(3H,m),7.08(1H,t,J=7.6 Hz),6.95(1H,s),6.71(1H,d,J=7.2 Hz),5.72(1H,s,-CONH-),3.81(5H,s),2.46(3H,s);13CNMR(100 MHz DMSO-d6)δ(ppm):169.2,168.5,156.3,139.8,138.3,136.1,134.9,131.8,131.8,131.6,131.0,131.0,129.7,129.7,129.4,124.0,119.9,119.9,115.3,114.8,111.8,102.6,56.1,31.7,14.1;ESI-MSm/z:calculated for(C25H22CIN2O3)[M+H]+:433.13,found:433.24。

图1 目标化合物合成路线
N-(3-甲氧基苯基)-2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1H-吲哚-3-)乙酰胺(2):白色粉末,收率57.3%;1H-NMR(400 MHz,DMSO-d6)δ(ppm):7.74(2H,d,J=8.4 Hz),7.56(2H,d,J=8.0 Hz),7.31(2H,d,J=7.6 Hz),7.26(1H,d,J=7.4 Hz),6.95(1H,s),6.87(2H,d,J=7.2 Hz),6.71(1H,d,J=8.4 Hz),5.71(1H,s,-CONH-),3.81(3H,s),3.79(2H,s),3.77(3H,s),2.45(3H,s);13CNMR(100MHz DMSO-d6)δ(ppm):169.2,168.5,156.2,155.7,138.3,136.1,134.9,132.9,132.9,131.8,131.6,130.9,130.9,129.7,121.5,121.5,115.2,115.2,114.9,114.5,111.8,102.6,56.1,55.8,32.6,14.1;ESI-MSm/z:calculated for(C26H24CIN2O4)[M+H]+:463.14,found:463.26。
N-(4-氯苯基)-2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1H-吲哚-3-)乙酰胺(3):白色固体,收率72.3%;1H-NMR(400 MHz,DMSO-d6)δ(ppm):7.74(2H,d,J=8.4 Hz),7.56(2H,d,J=8.0 Hz),7.41(2H,d,J=7.6 Hz),7.32(3H,m),6.95(1H,s),6.71(1H,d,J=8.4 Hz),5.72(1H,s,-CONH-),3.81(5H,s),2.46(3H,s);13CNMR(100MHz DMSO-d6)δ(ppm):169.3,168.5,156.2,138.7,138.3,136.1,134.9,131.8,131.5,131.5,130.9,129.7,129.7,129.3,129.3,127.5,121.4,121.4,115.3,114.6,111.8,102.6,56.1,32.7,14.1;ESI-MSm/z:calculated for(C25H21Cl2N2O3)[M+H]+:467.09,found:467.21。
N-(4-溴苯基)-2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1H-吲哚-3-)乙酰胺(4):淡黄色固体,收率74.4%;1H-NMR(400 MHz,DMSO-d6)δ(ppm):7.74(2H,d,J=8.4 Hz),7.56(2H,d,J=8.0 Hz),7.45(4H,m),7.26(1H,d,J=7.4 Hz),6.96(1H,s),6.71(1H,d,J=8.4 Hz),5.72(1H,s,-CONH-),3.81(5H,s),2.45(3H,s);13CNMR(100MHz DMSO-d6)δ(ppm):169.3,168.5,156.2,138.7,138.3,137.1,134.9,132.1,132.1,131.5,131.5,130.9,129.7,129.7,127.5,122.9,122.9,120.8,115.3,114.6,111.8,102.6,56.1,32.7,14.1;ESI-MSm/z:calculated for(C25H22CIN2O3)[M+H]+:511.04,found:511.17。
N-苄基-2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1H-吲哚-3-)乙酰胺(5):白色粉末,收率65.8%;1H-NMR(400 MHz,DMSO-d6)δ(ppm):8.4(1H,s,-CONH-),7.74(2H,d,J=8.4 Hz),7.56(2H,d,J=8.0 Hz),7.29(4H,m),7.18(2H,d,J=7.4 Hz),6.95(1H,s),6.70(1H,d,J=8.0 Hz),4.39(2H,d,J=4.8Hz),3.80(5H,s),2.45(3H,s);13CNMR(100MHz DMSO-d6)δ(ppm):169.2,168.5,156.3,139.8,137.7,136.1,134.9,131.8,131.8,131.6,131.0,131.0,129.4,129.0,129.0,125.2,125.2,122.7,115.3,114.8,111.8,102.6,56.1,52.3,31.7,14.1;ESI-MSm/z:calculated for(C26H24ClN2O3)[M+H]+:447.15,found:447.31。
N-苯乙基-2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1H-吲哚-3-)乙酰胺(6):白色固体,收率79.1%;1H-NMR(400 MHz,DMSO-d6)δ(ppm):8.1(1H,s,-CONH-),7.74(2H,d,J=8.4 Hz),7.56(2H,d,J=7.6 Hz),7.31(1H,d,J=7.6 Hz),7.11-7.19(5H,m),6.95(1H,s),6.70(1H,d,J=8.0 Hz),3.80(5H,s),3.35(2H,q)2.45(5H,m);13CNMR(100MHz DMSO-d6)δ(ppm):169.2,168.5,156.3,139.7,138.3,136.1,134.9,129.7,129.7,129.4,128.1,128.1,127.2,127.2,125.4,124.0,119.9,119.9,115.3,114.8,111.8,102.6,56.1,37.7,35.3,31.7,14.1;ESI-MSm/z:calculated for(C27H26ClN2O3)[M+H]+:461.18,found:461.37。
N-苯基-2-(1-(4-溴苯甲酰基)-5-甲氧基-2-甲基-1H-吲哚-3-)乙酰胺(7):白色固体,收率48.7%;1H-NMR(400 MHz,DMSO-d6)δ(ppm):7.76(2H,d,J=8.0 Hz),7.62(2H,d,J=7.6 Hz),7.40(2H,d,J=7.6 Hz),7.28(3H,m),7.08(1H,t,J=7.6 Hz),6.95(1H,s),6.71(1H,d,J=7.2 Hz),5.72(1H,s,-CONH-),3.81(5H,s),2.46(3H,s);13CNMR(100 MHz DMSO-d6)δ(ppm):169.4,168.5,156.3,138.3,136.1,134.9,132.6,132.6,132.6,132.6,132.3,129.7,129.7,129.4,128.6,124.0,119.9,119.9,115.3,114.8,111.8,102.6,56.1,31.7,14.1;ESI-MSm/z:calculated for(C25H22BrN2O3)[M+H]+:477.09,found:477.23。
N-(3-甲氧基苯基)-2-(1-(4-溴苯甲酰基)-5-甲氧基-2-甲基-1H-吲哚-3-)乙酰胺(8):白色固体,收率65.3%;1H-NMR(400 MHz,DMSO-d6)δ(ppm):7.76(2H,d,J=8.0 Hz),7.63(2H,d,J=7.6 Hz),7.31(2H,d,J=7.6 Hz),7.26(1H,d,J=7.4 Hz),6.95(1H,s),6.87(2H,d,J=7.2 Hz),6.71(1H,d,J=8.4 Hz),5.71(1H,s,-CONH-),3.81(3H,s),3.79(2H,s),3.77(3H,s),2.45(3H,s);13CNMR(100 MHz,DMSO-d6)δ(ppm):169.4,168.5,156.2,155.7,136.1,134.9,132.6,132.6,132.6,132.6,132.3,131.6,129.7,128.6,121.5,121.5,115.2,115.2,114.9,114.5,111.8,102.6,56.1,55.7,32.6,14.1;ESI-MSm/z:calculated for(C26H24BrN2O4)[M+H]+:507.10,found:507.31。
N-(4-氯苯基)-2-(1-(4-溴苯甲酰基)-5-甲氧基-2-甲基-1H-吲哚-3-)乙酰胺(9):白色固体,收率61.8%;1H-NMR(400 MHz,DMSO-d6)δ(ppm):7.76(2H,d,J=8.0 Hz),7.62(2H,d,J=8.0 Hz),7.41(2H,d,J=7.6 Hz),7.32(3H,m),6.95(1H,s),6.71(1H,d,J=8.4 Hz),5.72(1H,s,-CONH-),3.81(5H,s),2.46(3H,s);13CNMR(100 MHz,DMSO-d6)δ(ppm):169.3,168.5,156.2,138.3,136.1,134.9,131.8,132.6,132.6,132.6,132.6,132.3,129.3,129.3,128.6,127.5,121.4,121.4,115.3,114.6,111.8,102.6,56.1,32.7,14.1;ESI-MSm/z:calculated for(C25H22CIN2O3)[M+H]+:512.81,found:512.99。
N-(4-溴苯基)-2-(1-(4-溴苯甲酰基)-5-甲氧基-2-甲基-1H-吲哚-3-)乙酰胺(10):淡黄色固体,收率64.4%;1H-NMR(400 MHz,DMSO-d6)δ(ppm):7.76(2H,d,J=8.0 Hz),7.62(2H,d,J=7.6 Hz),7.45(4H,m),7.26(1H,d,J=7.4 Hz),6.96(1H,s),6.71(1H,d,J=8.4 Hz),5.72(1H,s,-CONH-),3.81(5H,s),2.45(3H,s);13CNMR(100 MHz,DMSO-d6)δ(ppm):169.4,168.5,156.2,138.3,137.1,134.9,132.6,132.6,132.6,132.6,132.3,132.1,132.1,128.6,127.5,122.9,122.9,120.8,115.3,114.6,111.8,102.6,56.1,32.7,14.1;ESI-MSm/z:calculated for(C25H21Br2N2O3)[M+H]+:554.98,found:555.15。
N-苄基-2-(1-(4-溴苯甲酰基)-5-甲氧基-2-甲基-1H-吲哚-3-)乙酰胺(11):白色固体,收率70.9%;1H-NMR(400 MHz,DMSO-d6)δ(ppm):8.4(1H,s,-CONH-),7.76(2H,d,J=8.0 Hz),7.62(2H,d,J=7.6 Hz),7.31(4H,m),7.18(2H,d,J=7.4 Hz),6.96(1H,s),6.70(1H,d,J=8.0 Hz),4.39(2H,d,J=4.8Hz),3.80(5H,s),2.45(3H,s);13CNMR(100 MHz,DMSO-d6)δ(ppm):169.4,168.5,156.3,137.7,136.1,134.9,132.6,132.6,132.6,132.6,132.3,129.4,129.0,129.0,128.6,125.2,125.2,122.7,115.3,114.8,111.8,102.6,56.1,52.3,31.7,14.1;ESI-MSm/z:calculated for(C26H24BrN2O3)[M+H]+:491.10,found:491.39。
N-苯乙基-2-(1-(4-溴苯甲酰基)-5-甲氧基-2-甲基-1H-吲哚-3-)乙酰胺(12):白色固体,收率77.4%;1H-NMR(400 MHz,DMSO-d6)δ(ppm):8.1(1H,s,-CONH-),7.76(2H,d,J=8.0 Hz),7.62(2H,d,J=7.6 Hz),7.31(1H,d,J=7.6 Hz),7.11-7.19(5H,m),6.95(1H,s),6.70(1H,d,J=8.0 Hz),3.80(5H,s),3.35(2H,q)2.45(5H,m);13CNMR(100 MHz,DMSO-d6)δ(ppm):169.4,168.5,156.3,138.3,136.1,134.9,132.6,132.6,132.6,132.6,132.3,129.7,129.7,129.4,128.6,124.0,119.9,119.9,115.3,114.8,111.8,102.6,56.1,37.7,35.3,31.7,14.1;ESI-MSm/z:calculated for(C27H26BrN2O3)[M+H]+:505.11,found:505.44。
2 体外生物活性探究
2.1 抗肿瘤活性 采用MTT法探究了12种目标化合物的抗肿瘤增殖活性,选取对数生长期的HT29、A549、Hep-2、MCF-7细胞,100 μL浓度为4 000~5 000个/μL细胞液接种于细胞培养板中,90%湿度、5% CO2、37 ℃孵育24 h。加入预先配好的不同浓度的目标化合物,空白对照组加入等量的细胞液,每组浓度设置3个平行对照,混匀,90%湿度、5% CO2、37 ℃孵育48 h。显微镜观察不同浓度作用的细胞形态变化,待药物与细胞充分作用后,每孔加入10 μL 5 mg/mL的MTT溶液,继续培养4 h,弃去上清液,然后每孔加入100 μL DMSO,振荡混匀15 min,酶标仪490 nm测定吸光度,计算抑制率。细胞抑制率(%)=(1-A实验/A对照)×100%,SPSS软件计算IC50值,结果见表1。不同浓度目标化合物12作用于HT29人结肠癌细胞48 h后,与空白组相比,0.5、5、50 μmol组均出现了较多的凋亡小体,随着浓度的增大,凋亡小体的数量增加,见图2。
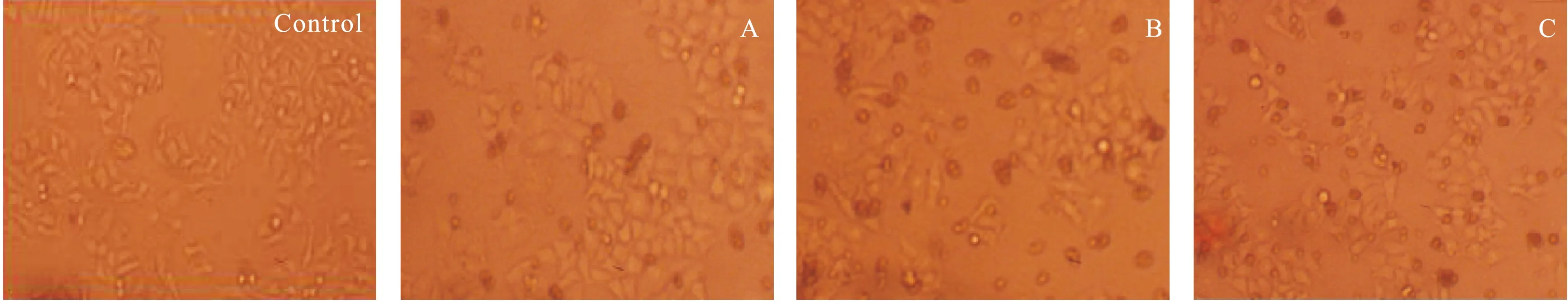
图2 不同浓度化合物12对HT29的生长抑制作用

化合物微管蛋白IC50(μmol/L)HT29Hep-2MCF-7A549Indomethacin1682±129935±851136±62971±821692±7111299±101854±92924±271214±1091417±1152693±50201±17232±11219±16351±21322±949±563±1361±395±7416±3.223±3.529±421±645±115201±35115±15132±17144±8149±1768.8±2.119±829±634±1337±47934±120711±52837±48816±261020±1078809±65123±24156±16152±15191±23911±1.939±744±641±659±3.41015±6.311±4.916±4.513±4.116±51189±9.8109±11127±12111±9135±17125.6±0.52.2±0.83.9±0.62.8±0.45.1±1.1
2.2 微管蛋白的抑制 取200 μL微管蛋白(2 mg/mL,来源于牛脑,溶于pH 6.9的80 mmol PIPES),2 mmol MgCl2、0.5 mmol EGTA、5%甘油、1 mmol GTP加入96孔板中,再加入DMSO配制的不同浓度目标化合物溶液,采用DMSO作为空白对照,37 ℃孵育,紫外分光光度计340 nm处连续监测20 min,实验重复3次,抑制率计算公式如下,抑制率(%)=(1-A样品/A空白)×100%。
3 讨论
由于近年来COX-2抑制剂被广泛应用于临床肿瘤疾病的治疗中,因此采用吲哚美辛为先导物,通过羧基侧链和苯甲酰基侧链的结构改造寻求高效低毒的吲哚类抗肿瘤药物。综合考虑电性、疏水性、氢键等因素,改变侧链取代基如卤素、甲氧基、甲基等供电子基团,确定吲哚类抗肿瘤药物对取代基和官能团的要求。以5-甲氧基-2-甲基-3-吲哚乙酸为起始原料,经两步酰化反应获得12种吲哚美辛衍生物。MTT法检测了目标化合物对HT29、A549、Hep-2、MCF-7肿瘤细胞的抑制活性,同时显微镜观察了细胞形态的变化。本研究所设计合成的目标化合物均具有强于先导化合物吲哚美辛的抗肿瘤活性,1位苯甲酰侧链连接不同卤素和3位羧基侧链连接的不同长度取代基引起了各异的肿瘤细胞抑制活性,如表1所示,1位苯甲酰对位以溴取代如目标化合物7~12(IC50=2.2~1 020 μmol)显示了优于氯取代化合物1~6(IC50=21~1 417 μmol)的抗肿瘤活性。当改变3位羧基侧链取代基抑制活性同样也引起了显著差异,与苯基取代的化合物1(IC50=854 μmol)和7(IC50=711 μmol)相比,化合物5、6和11、12表现了较好的作用效果,其中化合物6和12作用于人结肠癌细胞的IC50分别为19 μmol和2.2 μmol,推测主要原因为延长侧链长度增加了分子柔性,改变构象,使其形成更有利于与微管蛋白作用的空间结构。另外,12种目标化合物对4种肿瘤细胞显示了不同程度的抑制作用,但对人结肠癌细胞HT29表现了高度的选择性,为后期进一步探究抗肿瘤机制提供了明确的方向。1位苯甲酰对位溴取代和3位羧基侧链苯乙基取代的目标化合物12呈现了最强的HT29抑制活性,并且在一定浓度范围内呈剂量依赖性。
为了进一步探究目标化合物的抗肿瘤机制和探索其是否影响微管蛋白聚合作用。采用浊度法[18]检测了目标化合物体外微管蛋白抑制活性。如表1所示,12种目标化合物对微管聚合均有影响,作用于微管蛋白的IC50为5.6~1 299 μmol,表现出优于吲哚美辛(IC50=1 682 μmol)的抑制效果。其中3位羧基侧链苯乙基取代目标化合物6和12对微管聚合的影响最为明显,IC50分别为8.8 μmol和5.6 μmol,且体外抑制率与其浓度呈正相关的关系,目标化合物作为微管蛋白抑制剂,通过损坏微管结构来干扰微管聚合,从而破环微管聚合的动态平衡,阻断肿瘤细胞的分裂和增殖。与传统的硝酸酯类NO供体型衍生物相比,本项研究通过改变侧链取代基的电性、疏水性等因素形成与靶向微管蛋白具有较好结合能力的空间构象,并且两步绿色环保、易操作、价格低廉的酰化反应即可获得12种目标化合物,3位羧基侧链苯乙基取代目标化合物6和12体现了不同于组胺-吲哚美辛、吲哚美辛-5氟尿嘧啶、硝酸酯类等衍生物的HT29抗肿瘤活性和微管蛋白抑制活性。综合考虑体外肿瘤细胞和微管蛋白抑制试验结果,目标化合物6和12有较强的体外HT29、A549、Hep-2、MCF-7细胞增殖抑制活性与其具有显著的干扰微管聚合的作用密不可分,这对今后探究吲哚美辛衍生物抗肿瘤机制有着一定的指导意义。
综上所述,3位羧基侧链苯乙基取代的吲哚美辛衍生物具有良好的体外抗肿瘤潜力,可能是通过影响微管蛋白聚合发挥其肿瘤抑制活性,为开发以微管为靶点的抗肿瘤药物提供了理论依据和实验基础。
[1] Heald R,Nogales E.Microtubule dynamics[J].Cell Sci,2002,115(1):3-4.
[2] Vane JR,Botting RM.Mechanism of action of anti-inflammatory drugs[J].Int Tissue React,1998,20(2):3-15.
[3] Reddy B,Rao C,Rivenson A,et al.Inhibitory effect of aspirin on axoxymethane inducedcolon carcino genesis in F344 rats[J].Carcinogenesis,1993,14(6):1493-1497.
[4] Harris RE,Beebe-Donk J,Alahafie GA.Reduction in the risk of human breast cancer by selective cyclooxygenase-2 (COX-2) inhibitors[J].BMC Cancer,2006,6(1):27.
[5] Yi X,Zhong B,Smith KM,et al.Identification of a class of novel tubulin inhibitors[J].J Med Chem,2012,55(7):3425-3435.
[6] Morecki S,Yacovlev E,Gelfand Y,et al.Induction of antitumor immunity by indomethacin[J].Cancer Immunol Immunother,2000,48(11):613-620.
[7] Al-Salem T,Ali ZS,Qassab M.Skin cancers in xeroderm apigmentosum:response to indomethacin and steroids[J].Lancet,1980,2(8188):264-265.
[8] Cross DS,Platt JL,Juhn SK,et al.Administration of a prostaglandin synthetase inhibitor associated with an increased immune cell infiltrate in squamous cell carcinoma of the head and neck[J].Arch Otolaryngol Head Neck Surg,1992,118(5):526-528.
[9] 凌赵起,魏莉,徐志林.胃癌患者外周血单个核细胞产生前列素E2的研究[J].胃肠病和肝病学杂志,1998,7(3):233-253.
[10]Chiou SK,Hoa N,Hodges A,et al.Indomethacin promotes apoptosis in gastric cancer cells through concomitant degradation of Survivin and Aurora B kinase proteins[J].Apoptosis,2014,19(9):1378-1388.
[11]范建高.肝癌患者血浆PGE2含量与T细胞亚群和NK细胞活性的关系[J].上海免疫学杂志,1995,14(3):298-301.
[12]Mercadante S.The use of anti-inflammatory drugs in cancer pain[J].Cancer Treat Rev,2001,27(1):51-61.
[13]Ventafridda V,De Conno F,Panerai AE,et al.Non-steroidal anti-inflammatory drugs as the first step in cancer pain therapy:double-blind,within-patient study comparing nine drugs[J].Int Med Res,1990,18(1):21-29.
[14]De Groot DJ,De Vries EG,Groen HJ,et al.Non-steroidal anti-inflammatory drugs to potentiate chemotherapy effects:from lab to clinic[J].Crit Rev Oncol Hematol,2007,61(1):52-69.
[15]Ogino M,Minoura S.Indomethacin increases the cytotoxicity of cis-platinum and 5-fluorouracil in the human uterine cervical cancer cell lines SKG-2 and HKUS by increasing the intracellular uptake of the agents[J].Int J Clin Oncol,2001,6(2):84-89.
[16]Pollard M,Luckert PH.Prolonged antitumor effect of indomethacin on autochthonous intestinal tumors in rats[J].J Natl Cancer Inst,1983,70(6):1103-1105.
[17]Temporelli PL,Zito GB,Pedretti RF,et al.Nonsteroid anti-inflammatory drugs (NSAID) and risk of cardiovascular events:literature review and clinical implications[J].Monaldi Arch Chest Dis,2014,82(3):165-170.
[18]李占荣,刘志林.微管蛋白的分离鉴定及其在抗癌药物筛选中的作用[J].药学学报,1986,21(9):651-653.
Synthesis and anticancer activity of indomethacin analogues targeting tubulin
YAN Bao-hong,CHANG Yu
(Department of Pharmacy,Xi′an Honghui Hospital,Xi′an 710049,China)
Objective To design and synthesize a series of indomethacin derivatives,and to evaluate the activity of antitumor and tubulin interfering.Methods The target compounds were synthesized through two acylation using 5-methoxy-2-methyl-3-indoleacetic acid as starting material.The antitumor activities against HT29,A549,Hep-2 and MCF-7 were assayed by MTT.The turbidity method was used to evaluate the anti-tubulin activity.Results Inhibitory effects of most compounds on tumor cells and tubulin were higher than the positive control indomethacin.Moreover,the compound 12 was generated from substituted products with phenethyl at the 3rd position of the carboxyl,and showed the lowest IC50value of 2.2 μmol (400 times of indomethacin) against HT29 and 5.6 μmol against tubulin.Conclusion The indomethacin derivatives replaced by much flexible groups or polar groups at the position of amide and carboxyl chain are a novel and potential antitumor drug targeted on tubulin.
Tubulin;Indomethacin;Synthesis;Antitumor
2016-08-29
红会医院药剂科,陕西 西安 710049
10.14053/j.cnki.ppcr.201705005
