PCSK9抑制剂在动脉粥样硬化性心血管疾病中的临床研究进展
2017-07-20张大庆
蒋 昆,张大庆
PCSK9抑制剂在动脉粥样硬化性心血管疾病中的临床研究进展
蒋 昆,张大庆*
动脉粥样硬化性心血管疾病(ASCVD)现已成为危害人类健康的主要疾病之一。降低胆固醇治疗尤其是低密度脂蛋白-胆固醇(LDL-C),是ASCVD防治的基石,目前指南推荐控制LDL-C水平首选他汀类药物。但在临床实践中,经过他汀治疗的ASCVD患者仍存在较高剩留风险,另仍有部分患者不能耐受他汀类药物或在他汀类药物最大耐受剂量的情况下血脂仍不能达标。人前蛋白转化酶枯草溶菌素9(PCSK9)与LDL-C代谢密切相关,近年来大量基础和临床研究均证实PCSK9抑制剂能够显著降低血LDL-C水平,且耐受性和安全性良好。目前国外已批准PCSK9抑制剂用于临床。本文将系统综述有关PCSK9基因与血脂代谢的关系、PCSK9抑制剂的研发过程,总结其在基础和临床研究的最新进展。
ASCVD;低密度脂蛋白-胆固醇;PCSK9;PCSK9抑制剂
0 引言
2013年ACC和AHA联合颁布《成人降胆固醇治疗降低动脉粥样硬化性心血管疾病风险指南》[1]指出,动脉粥样硬化性心血管疾病(ASCVD)包括急性冠脉综合征、稳定或不稳定性心绞痛、冠脉血管重建、动脉粥样硬化源性卒中或短暂性脑缺血发作和外周动脉疾病或外周血管重建。ASCVD是由多重危险因素所致的全身动脉的慢性进行性疾病。其中性别、年龄、吸烟、高血压、血脂异常、血糖升高和家族史均是ASCVD的独立危险因素。遗传学、动物实验、临床流行病学和循证医学证据均证实高血胆固醇水平是ASCVD的核心致病性危险因素。2016中国血脂指南指出降低血胆固醇(尤其LDL-C)水平,可显著减少ASCVD的发病及死亡危险,目前临床上用于降低血胆固醇水平的药物首选他汀类[2]。但仍有部分患者不能耐受他汀类药物,存在他汀相关肌肉不良反应、肝酶升高、血糖升高等不良反应或在最大耐受剂量的情况下,血脂仍不能达标,致残存较高ASCVD风险[3-4]。因此,研发更安全有效的新型降胆固醇药物对于ASCVD的防治具有重要意义。近年来,以人前蛋白转化酶枯草溶菌素9(PCSK9)为代表的新的降脂靶点受到越来越多的关注,在研的PCSK9抑制剂研究也取得了较大的进展。在过去的一年里,美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)人用药品委员会(CHMP)相继批准了Evolocumab、Alirocumab上市,适应证为家族性高胆固醇血症的治疗,或他汀不能有效降低LDL-C的ASCVD高危人群。本文对PCSK9抑制剂的基因与血脂代谢的关系、研发过程及临床研究的进展进行总结。
1 PCSK9基因与心血管疾病的关系
1.1 PCSK9基因遗传学研究 PCSK9属于前蛋白转化酶家族中的一员,其编码的蛋白质最初被称为神经细胞凋亡转化酶-1(NARC-1),主要由信号序列(1~30氨基酸)、前结构域(氨基酸31~152)、催化结构域(氨基酸153~425)和羧基末端结构域(氨基酸426~694)组成,可在肝脏、小肠、肾脏及神经系统中表达,主要由肝脏分泌[5-6]。2003年,Abifadel等[7]发现,PCSK9基因与常染色体显性遗传性高胆固醇血症的发生相关,并观察到2例NARC-1功能获得性突变患者的血胆固醇水平明显升高,且与其早发心血管疾病死亡相关,这是继低密度脂蛋白-受体(LDL-R)和载脂蛋白B(ApoB)以外,第3个与常染色体显性遗传家族性高胆固醇血症有关的基因变异,该研究发表在Nature Genetics上,NARC-1从此更名为PCSK9。人类PCSK9基因位于1号染色体短臂上(1p32.3),PCSK9调节LDL-C水平按PCSK9突变形式分为两类,一类是功能获得型突变:即PCSK9突变后降解LDL-R的功能增强,血液LDL清除功能减弱致血中胆固醇水平升高,主要突变形式有S127R、D129G、F216L、R218S、D374Y、N425S、R496W、H 553R 和E670G;另一种为功能缺失型突变,主要突变形式有R46L、△R97、G106R、Y142X、L253F、A443T、Q554E和C679X,突变后可削弱或灭活PCSK9表达,从而增强LDL-R清除循环中LDL-C的能力,降低血LDL-C水平[8]。临床研究显示,与缺乏这种突变的患者相比,PCSK9功能缺失型突变可使LDL-C水平降低15%~28%,缺血性心脏疾病的发生率降低47%~88%[9]。因此,阻断PCSK9参与LDL-R降解已成为降胆固醇治疗的新靶点。
1.2 PCSK9与胆固醇的代谢关系 循环中LDL颗粒需要通过肝细胞表面的LDL-R摄取进入肝细胞内被清除。LDL颗粒与肝细胞表面的LDL-R结合形成复合物,以胞饮的形式进入细胞内后LDL-R与LDL颗粒解离,吞入细胞内的LDL颗粒被降解成胆固醇,在肝细胞内储存或经其他途径代谢,而LDL-R重返肝细胞表面参与摄取LDL颗粒的再次循环。通过上述途径,肝细胞不断经LDL-R从循环中摄取LDL颗粒进入肝细胞内代谢,从而降低循环中LDL-C水平。因此,肝脏LDL-R的表达是LDL颗粒代谢的关键,而LDL-R在肝细胞内被转录后受PCSK9影响,PCSK9表达增加可与LDL-R受体不可逆性结合,在细胞溶酶体内介导LDL-R 降解,从而降低肝脏细胞通过LDL-R清除LDL,导致循环中LDL-C水平升高[10-11]。以上提示抑制PCSK9的表达是增强循环LDL颗粒代谢的重要关键点,因此,PCKS9抑制剂的研发应运而生。
2 PCSK9抑制剂的基础研究和临床研发情况
目前有3种类型的PCSK9抑制剂处于研发和临床研究的不同阶段,包括PCSK9单克隆抗体、小分子干扰RNA和反义寡核苷酸(表1)。
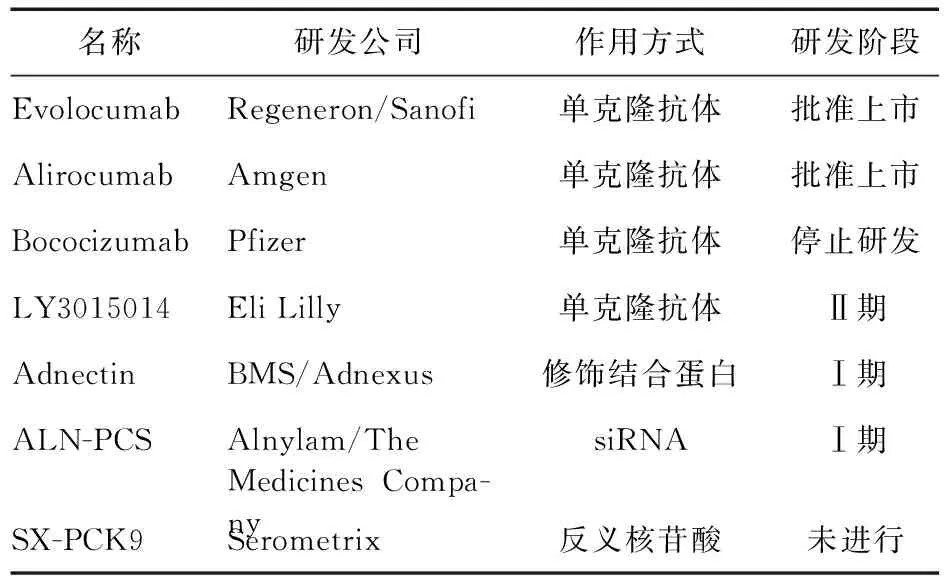
表1 PCSK9抑制剂分类及临床研究试验阶段
2.1 单克隆抗体 目前多家公司在研的PCSK9抑制剂以单克隆抗体为主,PCSK9单克隆抗体机制是与PCSK9竞争性结合LDL-R,从而阻止PCSK9与LDL受体结合,增加肝脏LDL-R的表达,降低循环中LDL-C的水平。目前部分单克隆抗体已被批准上市。
2.2 小分子干扰RNA 小分子干扰RNA(siRNA)是通过肝细胞内结合PCSK9的mRNA,从而使PCSK9 mRNA沉默、降低PCSK9的表达。Fitzgerald等[12]利用siRNA寡核苷酸ALN-PCS02,观察到其可剂量依赖性地降低PCSK9水平,在ALN-PCS试验最大剂量0.400 mg/kg时,显示PCSK9水平降低约70%,循环中LDL-C平均水平约下降40%,并且无主要不良反应。目前处于Ⅰ期临床研究阶段。
2.3 反义寡核苷酸 反义寡核苷酸是通过特异性结合PCSK9靶基因来抑制其mRNA转录,导致PCSK9合成分泌受阻,从而增加肝脏LDL-R的表达来降低LDL-C的水平。目前大多数反义核苷酸类PCSK9抑制剂仍处于临床前期研究阶段。
3 PCSK9抑制剂大型临床研究评价
目前各大国际药物研发公司开发的PCSK9抑制剂以单克隆抗体为主,现已将有关PCSK9抑制剂从Ⅰ期临床研究深入开展,并完成了多个Ⅲ期临床研究。无论是与安慰剂相比,还是在他汀基础上,在健康人群、家族性高胆固醇血症、ASCVD的中高危人群,大部分的PCKS9抑制剂取得卓越的降低LDL-C效果,同时还可改善其他血脂指标,包括HDL-C、Lp(a)等,且安全性良好,可进一步减少心血管事件[13]。但亦有公司停止有关PCSK9抑制剂的研发,使我们开始审慎对待降脂领域的这一新药。下面将介绍有关PCSK9抑制剂单克隆抗体的临床研究。
3.1 Evolocumab Evolocumab(AMG-145)是美国安进(Amgen)公司研发的人源单克隆抗体,目前已完成Ⅲ期临床研究。Ⅰ期临床研究在56例健康志愿者和56例接受他汀治疗的患者中进行。在健康志愿者中,与安慰剂相比,Evolocumab组的LDL-C水平下降约60%。在已接受他汀治疗的患者中,与安慰剂患者相比,Evolocumab组的LDL-C水平下降约81%。显示了Evolocumab可较好地降低血LDL-C水平,且无严重不良事件发生[14-15]。接下来的Ⅱ期Mendel临床研究,纳入LDL-C水平在100~190 mg/L未接受他汀类治疗患者,并且三酰甘油(TG)水平<400 mg/L、Framingham风险评分≤10%,随机分组后给予Evolocumab、依折麦布和安慰剂治疗,结果显示,Evolocumab较其余两组可有效降低LDL-C水平,且没有死亡或严重的治疗相关的不良事件发生[16]。Ⅱ期Laplace临床研究纳入正在接受他汀类治疗的高胆固醇血症患者,研究将随机分组患者分别给予不同剂量Evolocumab和安慰剂每2周1次皮下注射或不同剂量Evolocumab和安慰剂每4周皮下注射,观察12周,结果每2周不同剂量给药患者LDL-C水平下降41.8%~66.1%(P<0.001),4周不同给药剂量患者LDL-C水平下降41.8%~50.3%(P<0.001)[17],摸索了不同剂量及不同给药方式下Evolocumab降低LDL-C水平的情况。另外一个Ⅱ期临床研究即Gauss研究,研究纳入因不良反应不能耐受至少2种他汀类药物的患者,显示应用Evolocumab也可有效降低LDL-C水平,这为临床上不耐受他汀类药物的高血脂人群提供了一种有效的治疗方案,此外,该研究还显示,Evolocumab在一定程度上可增加HDL水平[18]。由于Evolocumab在不同人群中取得良好的临床效果,在接下来的系列Ⅲ期研究中,如Laplace-2、Mendel-2及Gauss-2,证实他汀治疗或未经他汀类药物治疗的高脂血症患者中,不同剂量及给药方式下Evolocumab均较依折麦布显著降低LDL-C水平。此外,Evolocumab还具有降低ApoB、TG及Lp(a)水平和增加HDL水平的能力[19-21]。另外,在纳入人群为杂合子的家族性高胆固醇血症的RUTHERFORD和RUTHERFORD-2研究,以及研究人群为纯合家族性高血脂症Tesla Part B的研究,证实应用Evolocumab后,可显著降低遗传性高胆固醇血症患者的LDL-C水平,为家族性高胆固醇血症患者治疗提供了更加切实有效的治疗方法。2015年ACC年会揭晓了关于Evolocumab的OSLER长期随访对临床终点事件影响的结果,包括OSLER-1和OSLER-2两项临床研究,该研究共纳入参加Evolocumab之前12项试验中至少1项的共4 465例患者,按照2∶1的比例随机给予标准治疗联合Evolocumab或单纯标准治疗。联合应用Evolocumab组患者OSLER-1,140 mg,每2周1次,持续56周;OSLER-2,420 mg,每月1次,持续48周。平均随访11.1个月,评估血脂水平、药物安全性以及主要心血管事件(包括死亡、心肌梗死、不稳定性心绞痛、冠脉血流重建、卒中、短暂性脑缺血发作和心衰)。结果显示,联合Evolocumab组与标准治疗组相比,Evolocumab组可使受试者LDL-C水平进一步降低61%,从120 mg/dL降至48 mg/dL(P<0.001)。联合Evolocumab组患者不良事件发生率较标准治疗组呈现下降趋势(64.8% vs. 69.2%),但两组间比较差异无统计学意义。其中不良事件导致2.4%的患者无法继续使用Evolocumab。神经认知事件发生率不足1%,且研究者发现该类事件在Evolocumab组更普遍,但神经认知事件风险不受治疗中LDL-C水平的影响[22]。OSLER研究显示,在标准治疗基础上使用PCSK9抑制剂Evolocumab,能够显著降低患者的LDL-C水平,且不增加不良事件,为临床推广应用PCSK9单克隆抑制剂Evolocumab提供了有力的证据。此外,一项评估Evolocumab的心血管事件预后的FOURIER研究目前正在进行中。
3.2 Alirocumab (SAR236553/REGN727) 是由赛诺菲及Regeneron制药公司合作研发的人源性PCSK9的单克隆抗体,目前也已完成Ⅲ期临床研究。Ⅰ期临床试验在健康志愿者和家族性或非家族性高胆固醇血症患者中进行。在给予不同剂量的Alirocumab后,可使患者LDL-C水平显著下降[23],证实了Alirocumab可有效降低患者胆固醇水平,为后续临床试验奠定基础。Ⅱ期临床试验研究纳入LDL-C水平>100 mg/L的患者,随机分组,分别给予Alirocumab、阿托伐他汀及安慰剂,比较LDL-水平下降程度,在目标值LDL-C<70 mg/L时,Alirocumab组约90%的患者达标,而应用阿托伐他汀及安慰剂组的LDL-C水平下降至70 mg/L以下仅为17%,证实Alirocumab较他汀类药物可显著提高高胆固醇血症患者的LDL-C达标率[24]。Ⅲ期ODYSSEY LONG TERM临床试验进一步评估Alirocumab对心血管事件的安全性和有效性。该研究共纳入2 341例正在接受他汀最大耐受剂量其LDL水平仍≥70 mg/dL的心血管事件高危患者,伴或不伴其他降脂治疗,按照2∶1的比例随机分配到Alirocumab(150 mg)组或安慰剂组,每2周皮下注射Alirocumab或给予安慰剂,共持续78周。结果显示,24周时,与安慰剂组相比,Alirocumab组的LDL-C水平降低了62%(P<0.001),在第78周时,LDL-C水平与24周下降水平持平。而Alirocumab组与安慰剂组相比,不良反应注射部位反应(5.9% vs. 4.2%)、肌痛(5.4% vs. 2.9%)、神经认知事件(1.2% vs. 0.5%)和眼部事件(2.9% vs. 1.9%)均无统计学差异。此外,Alirocumab组主要不良心血管事件(冠心病致死、非致死性心梗、致命或非致命性卒中及需要住院的不稳定型心绞痛患者)发生率低于安慰剂组(1.7% vs. 3.3%;HR 0.52;95%CI0.31~0.90;P=0.02)。证实在他汀最大耐受剂量的基础上给予Alirocumab治疗不仅可有效降低LDL-C水平,也可减少主要心血管事件的发生风险[25],为临床推广Alirocumab用于降低胆固醇治疗打下坚实基础。
3.3 Bococizumab Bococizumab是由辉瑞公司研发的人源性PCSK9的单克隆抗体。其中SPIRE试验包括Bococizumab的6个相关血脂下降研究和2个关于心血管事件远期疗效及安全性研究。6个相关血脂下降研究包括3个(SPIRE-HR,SPIRE-LDL,SPIRE-LL),旨在评估基础他汀类药物治疗的高危人群应用Bococizumab心血管事件的发生、1个评估家族性高胆固醇血症(FH)应用Bococizumab的疗效(SPIRE-FH)、1个不耐受他汀类药物的人群应用Bococizumab(SI)研究和1个评估自动机械装置注射Bococizumab(AI)研究。2个评估Bococizumab其有效性及安全性的试验分别为SPIRE-1和SPIRE-2[26]。目前,有关Bococizumab全球开发项目中6个降脂研究全部完成,结果表明,Bococizumab降脂疗效随时间推移而衰减,不能维持长期的降低LDL-C水平的疗效,不能为ASCVD患者提供明确的临床获益,因此,2016年11初,辉瑞公司宣布全面停止Bococizumab研发。这提醒我们应更理性、长远地看待PCSK9抑制剂的临床应用。
4 小结
PCSK9抑制剂作为一种新型降低胆固醇药物,经过10余年的基础和临床研究,证实在降低LDL-C水平方面具有显著疗效。目前国内尚处于临床试验阶段,虽然国外相继批准了Alirocumab、Evolocumab上市,但Bococizumab已停止研发,亦给临床敲响了警钟。且临床试验和实践尚不足以证明PCSK9抑制剂长期使用的有效性和安全性。另外,作为针剂药物,不像口服药物易于患者广泛接受,且其成本效益尚未明确,这些问题有待大规模人群长期深入研究提供可靠数据。但PCSK9抑制剂作为一种新兴的可有效降低循环中胆固醇水平的药物,为血脂管理和ASCVD高危人群防治提供了新的途径。
[1] Stone NJ,Robinson JG,Lichtenstein AH,et al.American College of Cardiology/American Heart Association Task Force on Practice Guidelines.2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J].J Am Coll Cardiol,2014,63(25 Pt B):2889-2934.
[2] 中国成人血脂异常防治指南修订联合委员会.中国成人血脂异常防治指南(2016年修订版)[J].中国循环杂志,2016,31(10):937-950.
[3] Norata GD,Ballantyne CM,Catapano AL.New therapeutic principles in dyslipidaemia:focus on LDL and Lp(a) lowering drugs[J].Eur Heart J,2013,34(24):1783-1789.
[4] Reiner Z,Catapano AL,De Backer G,et al.ESC/EAS Guidelines for the management of dyslipidaemias:the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS)[J].Eur Heart J,2011,32(14):1769-1818.
[5] Seidah NG,Benjannet S,Wickham L,et al.The secretory proprotein convertase neural apoptosis-regulated convertase 1 (NARC-1):liver regeneration and neuronal differentiation[J].Proc Natl Acad Sci U S A,2003,100(3):928-933.
[6] Zaid A,Roubtsova A,Essalmani R,et al.Proprotein convertase subtilisin/kexin type 9 (PCSK9):hepatocyte-specific low-density lipoprotein receptor degradation and critical role in mouse liver regeneration[J].Hepatology,2008,48(2):646-654.
[7] Abifadel M,Varret M,Rabès JP,et al.Mutations in PCSK9 cause autosomal dominant hypercholesterolemia[J].Nat Genet,2003,34(2):154-156.
[8] Wu NQ,Li JJ.PCSK9 gene mutations and low-density lipoprotein cholesterol[J].Clin Chim Acta,2014,431:148-153.
[9] Cohen JC,Boerwinkle E,Mosley TH,et al.Sequence variations in PCSK9,low LDL,and protection against coronary heart disease[J].N Engl J Med,2006,354(12):1264-1272.
[10]Lagace TA,Curtis DE,Garuti R,et al.Secreted PCSK9 decreases the number of LDL receptors in hepatocytes and in livers of parabiotic mice[J].J Clin Invest,2006,116(11):2995-3005.
[11]Zhang DW,Lagace TA,Garuti R,et al.Binding of proprotein convertase subtilisin/kexin type 9 to epidermal growth factor-like repeat A of low density lipoprotein receptor decreases receptor recycling and increases degradation[J].J Biol Chem,2007,282(25):18602-18612.
[12]Fitzgerald K,Frank-Kamenetsky M,Shulga-Morskaya S,et al.Effect of an RNA interference drug on the synthesis of proprotein convertase subtilisin/kexin type 9 (PCSK9) and the concentration of serum LDL cholesterol in healthy volunteers:a randomised,single-blind,placebo-controlled,phase 1 trial[J].Lancet,2014,383(9911):60-68.
[13]Sabatine MS,Giugliano RP,Wiviott SD,et al.Efficacy and safety of evolocumab in reducing lipids and cardiovascular events[J].N Engl J Med,2015,372(16):1500-1509.
[14]Cicero AF,Colletti A,Borghi C.Profile of evolocumab and its potential in the treatment of hyperlipidemia[J].Drug Des Devel Ther,2015,9:3073-3082.
[15]Dias CS,Shaywitz AJ,Wasserman SM,et al.Effects of AMG 145 on low-density lipoprotein cholesterol levels:results from 2 randomized,double-blind,placebo-controlled,ascending-dose phase 1 studies in healthy volunteers and hypercholesterolemic subjects on statins[J].J Am Coll Cardiol,2012,60(19):1888-1898.
[16]Koren MJ,Scott R,Kim JB,et al.Efficacy,safety,and tolerability of a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 as monotherapy in patients with hypercholesterolaemia (MENDEL):a randomised,double-blind,placebo-controlled,phase 2 study[J].Lancet,2012,380(9858):1995-2006.
[17]Sullivan D,Olsson AG,Scott R,et al.Effect of a monoclonal antibody to PCSK9 on low-density lipoprotein cholesterol levels in statin-intolerant patients:the GAUSS randomized trial[J].JAMA,2012,308(23):2497-2506.
[18]Robinson JG,Nedergaard BS,Rogers WJ,et al.Effect of evolocumab or ezetimibe added to moderate- or high-intensity statin therapy on LDL-C lowering in patients with hypercholesterolemia:the LAPLACE-2 randomized clinical trial[J].JAMA,2014,311:1870-1883.
[19]Koren MJ,Lundqvist P,Bolognese M,et al.Anti-PCSK9 monotherapy for hypercholesterolemia:the MENDEL-2 randomized,controlled phase Ⅲ clinical trial of evolocumab[J].J Am Coll Cardiol,2014,63(23):2531-2540.
[21]Stroes E,Colquhoun D,Sullivan D,et al.Anti-PCSK9 antibody effectively lowers cholesterol in patients with statin intolerance:the GAUSS-2 randomized,placebo controlled phase 3 clinical trial of evolocumab[J].J Am Coll Cardiol,2014,63:2541-2548.
[21]Sabatine MS,Giugliano RP,Wiviott SD,et al.Efficacy and safety of evolocumab in reducing lipids and cardiovascular events[J].N Engl J Med,2015,372(16):1500-1509.
[23]Stein EA,Mellis S,Yancopoulos GD,et al.Effect of a monoclonal antibody to PCSK9 on LDL cholesterol[J].N Engl J Med,2012,366(12):1108-1118.
[23]Roth EM,McKenney JM,Hanotin C,et al.Atorvastatin with or without an antibody to PCSK9 in primary hypercholesterolemia[J].N Engl J Med,2012,367(20):1891-1900.
[24]Robinson JG,Farnier M,Krempf M,et al.Efficacy and safety of alirocumab in reducing lipids and cardiovascular events[J].N Engl J Med,2015,372(16):1489-1499.
[25]Ridker PM,Amarenco P,Brunell R,et al.Evaluating bococizumab,a monoclonal antibody to PCSK9,on lipid levels and clinical events in broad patient groups with and without prior cardiovascular events:rationale and design of the Studies of PCSK9 Inhibition and the Reduction of vascular Events (SPIRE) Lipid Lowering and SPIRE Cardiovascular Outcomes Trials[J].Am Heart J,2016,178:135-144.
[26]Lambert G,Sjouke B,Choque B,et al.The PCSK9 decade[J].J Lipid Res,2012,53(12):2515-2524.
Research progress of clinical trials related to PCSK9 inhibitors in atherosclerotic cardiovascular disease
JIANG Kun,ZHANG Da-qing*
(Department of Cardiovascular Medicine,Shengjing Hospital of China Medical University,Shenyang 110004,China)
Atherosclerotic cardiovascular disease (ASCVD) has become one of major diseases threatening human health.The cholesterol-lowering therapy is the cornerstone in the treatment and prevention of ASCVD.The guidelines have recommended that statins serve as the first choice to control low density lipoprotein-cholesterol (LDL-C) level.However,patients with ASCVD still have high residual risks after statins treatment.Moreover,some patients cannot be tolerable to statins,or even large doses of stains fail to successfully achieve the optimal level of LDL-C.Recently,a pro-protein convertase subtilisin/kexin type 9 (PCSK9) has been demonstrated to be closely involved in LDL-C metabolism.A large number of basic and clinical researches have proved that PCSK9 inhibitors can significantly reduce LDL-C level with good tolerance and safety.Meanwhile,PCSK9 inhibitors have been approved to be used clinically by the FDA.We systematically summarized the relationship between PCKS9 and lipid metabolism,further analyze the development process of PCSK9 inhibitor,and elaborate its basic and clinical research progresses.
ASCVD;Low-density lipoprotein-cholesterol;PCSK9;PCSK9 inhibitors
2016-11-28
中国医科大学附属盛京医院心血管内科,沈阳 110004
国家自然科学基金(81200199)
10.14053/j.cnki.ppcr.201705029
*通信作者
