黑芸豆中花色苷的提取工艺优化试验
2017-07-19赵雯俊赵煜午
赵雯俊++赵煜午

摘要 本研究对黑芸豆的花色苷色素提取工艺进行研究。将黑芸豆放在不同乙醇浓度、不同温度、不同时间、不同盐酸浓度、不同料液比的条件下,进行5类单因素试验,并通过L16(45)正交表进行5因素4水平优化试验,确定黑芸豆中花色苷提取率最佳工艺。结果表明:乙醇浓度70%、料液比1∶20、提取温度50 ℃、提取时间45 min、0.5% HCl溶液为最佳提取工艺。
关键词 黑芸豆;花色苷;提取工艺
中图分类号 TS201.2 文献标识码 A 文章编号 1007-5739(2016)16-0244-04
Abstract This paper studied the extraction of anthocyanin pigment from black kidney bean.By different types of ethanol concentration,temperature,time and soaking liquid,5 types of the single factors and L16(45)orthogonal design were done to study the best range of extracting.The results showed that the optimum conditions were as follows:70% ethanol concentration and 0.5% hydrochloric acid as soaking liquid,rate of solid 1∶20,temperature 50 ℃,time 45 min.
Key words black kidney bean;anthocyanin pigment;extraction process
食用色素按其來源分为天然色素和化学合成色素两大类[1]。随着医学毒理学和生物学研究的不断深入,人们对合成食用色素有了新的认识,发现曾允许使用的人工合成食用色素中,多数对人体都有不同程度的伤害,有的甚至有致癌或诱发染色体变异的作用[2]。因此,世界各国已先后禁止使用多数种类的合成食用色素,由此天然色素的研究引起了人们的兴趣。目前,国内的科技工作者已经从五味子、紫苏、笃斯、火棘等果蔬中提取分离出花色苷天然食用色素[3]。相关研究表明,该类色素对人类许多疾病有预防和治疗作用,因而在食品、化妆品、医药领域有着巨大的应用潜力[4]。现代营养素研究进一步发现,黑色食品中的天然花色苷类物质有极强的防止活性氧危害和抗氧化作用,可消除机体代谢过程中产生的过多自由基,具有延缓衰老、预防各种疾病等功能[5]。黑芸豆富含花色苷类化合物,是天然色素的重要来源。本试验拟采用溶液萃取法从黑芸豆皮中提制花色苷天然色素并研究探讨其功能特性,为其下一步开发及应用提供一定的理论依据[6]。
1 材料与方法
1.1 试验材料
供试材料有黑芸豆(购于当地农贸市场)、乙醇、盐酸、花色苷标准样品(分析纯)。
供试仪器与设备:FC204型电子分析天平(分度值0.000 1 g,上海民桥精密科学仪器有限公司);HH-1数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司);722 s可见光分光光度计(上海分析仪器总厂制造);DS-1型高速组织捣碎机(上海标本模型厂制造);DGG-9140B型电热恒温鼓风干燥箱(上海森信实验仪器有限公司);TD4A台式离心机(长沙英泰仪器有限责任公司)。
1.2 花色苷含量测定方法
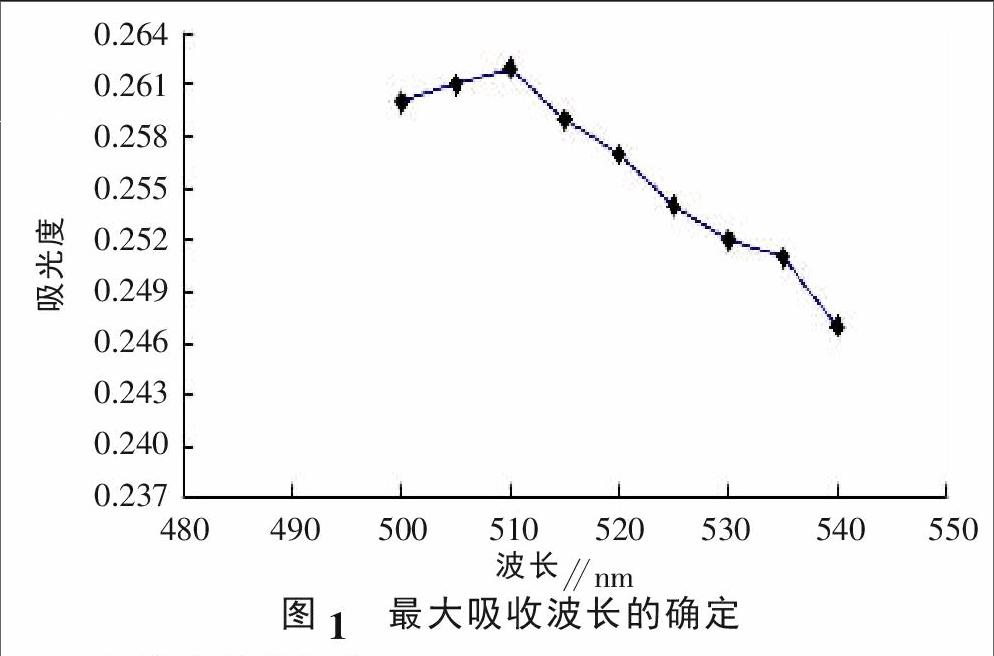
1.2.1 花色苷最大吸收波长的确定。取1 g标准花色苷样品溶于去离子水,定容至100 mL,取少量加入比色杯,用去离子水调零,分别在500、505、510、515、520、525、530、535、540 nm处测定吸光度值,以确定最大吸收波长[7]。
1.2.2 标准曲线的制作。用无水乙醇配制浓度为0.5 mg/mL的标准液。分别移取花色苷标准液1、2、3、4、5、6、7 mL,用无水乙醇定容至10 mL,以无水乙醇溶液作空白,利用722 s可见光分光光度计测定最大吸收波长处(510 nm)的吸光值。绘制花色苷标准溶液的标准曲线,并计算出回归方程(A—510 nm处吸光度,C—花色苷标样浓度)[8]。
1.2.3 黑芸豆豆皮中花色苷的提取方法。先洗涤黑芸豆,再将黑芸豆放到烧杯中,加水刚好浸没,将烧杯放入水浴锅中40 ℃水浴5~6 min[9],此时黑芸豆皮起褶,水浴的水颜色微黑,相对透明,将起褶的黑芸豆放入小桶中,用钝物压碎芸豆,此时豆与皮较易分离,用水浸泡,能先分离出一部分豆皮,沉底的豆子与豆皮搓落,然后将豆皮放入45 ℃鼓风干燥箱中干燥2~3 h,然后放入组织粉碎机粉碎,用分析天平准确量取1 g豆皮粉末[10],加入适当料液比的提取剂提取,取提上清液于离心管中以3 000 r/min离心10 min,再取上清液于100 mL容量瓶定容,取少量于比色杯,用提取液调零,于510 nm处测吸光度值。根据花色苷标准曲线计算花色苷含量[11]。
花色苷提取率(%)=[(A-0.000 2)/0.304 3×V1/m样]×100
式中,A—测得的吸光度值;V1—离心后的上清液定容的体积,mL;m样—测得干燥的黑芸豆皮质量,mg。
1.3 提取工艺的优化试验设计
通过研究浸提液乙醇体积分数、料液比、提取时间、提取温度、盐酸浓度各单因素对浸提效果的影响,确定影响较大因素的水平范围,然后进行正交试验确定最佳提取工艺条件[12]。评价指标是在最大吸收波长下测吸光度,并计算得出色价。
1.3.1 单因素试验设计。①浸提液乙醇体积分数对花色苷提取的影响。称取1 g种皮,浸提乙醇体积分数20%、30%、40%、50%、60%、70% 6个水平(配好后各留取20 mL样液取15 mL做比色标准溶液),料液比1∶15,提取温度40 ℃,浸提30 min,取上清液离心3 000 r/min,10 min取清液定容100 mL放入分光光度计比色[13]。②料液比对花色苷提取的影响。称取1 g种皮,浸提试剂0.1%HCl 30%、乙醇溶液,料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25、1∶30 6个水平,回流浸提30 min,取上清液离心3 000 r/min,10 min,取上清液定容100 mL,测吸光度值。③提取时间对花色苷提取的影响。用0.1%HCl、30%乙醇溶液在60 ℃、料液比1∶15分别回流提取15、30、45、60、75、90 min取上清液离心3 000 r/min,10 min,取清液定容100 mL放入分光光度计比色。④提取温度对花色苷提取的影响。称取1 g种皮,0.1%HCl、30%乙醇溶液浸提,料液比1∶15分别在20、30、40、50、60、70 ℃回流提取30 min。取上清液离心3 000 r/min,10 min,取上清液定容100 mL放入分光光度计比色。⑤盐酸浓度对花色苷提取的影响。称取1 g种皮,料液比1∶15,0.1%HCl溶液、0.5%HCl溶液、1.0%HCl溶液、1.5%HCl溶液、2.0%HCl溶液、2.5%HCl溶液6个水平,浸提30 min。取上清液离心3 000 r/min,10 min,取清液定容100 mL放入分光光度计比色。
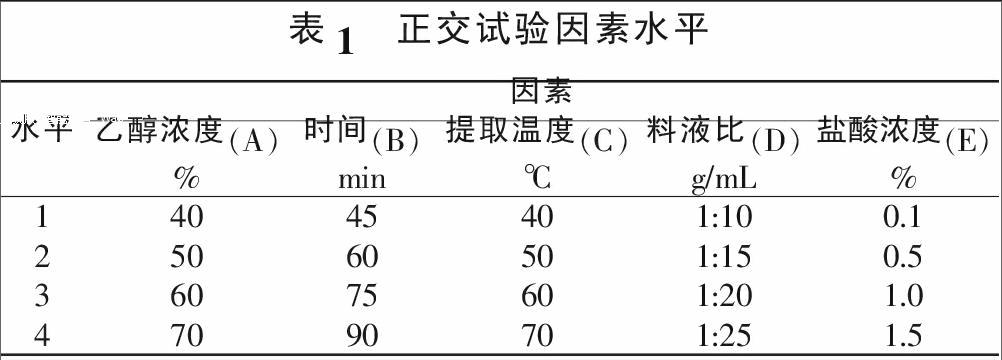
1.3.2 正交试验。在单因素的基础上,以乙醇、盐酸溶液作浸提剂,进行浸提时间、浸提温度和料液比5因素4水平L16(45)正交试验,优化提取工艺。正交试验各因素水平设置见表1。
2 结果与分析
2.1 最大吸收波长的确定
最大吸收波长的确定见图1,可以看出在510 nm处黑芸豆中花色苷有最大吸收波长。
2.2 标准曲线的制作
以原花色苷为标准样,标准曲线结果见图2。花色苷吸光度关于浓度的线性回归方程为:y=0.304 3x+0.000 2,相关系数为0.996 3。
2.3 单因素试验结果
2.3.1 浸提液乙醇体积分数对花色苷提取的影响。花色苷易溶于水更易溶于乙醇,在水中加入适当的乙醇可以增加花色苷的提取率[14]。由图3可知,当乙醇浓度在20%~50%时,提取率呈上升趋势,当乙醇浓度在50%~70%时下降,最大提取浓度为50%,其可能的原因是适当的乙醇有利于花色苷的溶解,过量的乙醇可能使花色苷变性或者抑制花色苷的溶解。
2.3.2 提取时间对花色苷提取的影响。由图4可知,当提取时间在15~60 min时,提取率呈上升趋势,当提取时间超过60 min,提取率基本不变或者缓慢下降。其可能的原因是在60 min时花色苷基本已经提取完全,当提取时间超过60 min,可能导致花色苷被破坏或者没有能够被提取液提取的花色苷[15]。
2.3.3 料液比对花色苷提取的影响。由图5可知,适当增加溶剂的量有利于色素溶出,可以提高花色苷得率,料液比为1∶20(g/mL)时浸提效果最好。继续增加溶剂的用量时,花色甘得率却逐渐下降,这可能是由于过多的溶剂降低了花青素浓度,增加了溶解的杂质。
2.3.4 提取温度对花色苷提取的影响。花色苷在高温下不稳定,而低温不利于花色苷溶解。由图6可知,当提取温度在20~40 ℃时,提取率呈上升趋势,当温度在40~70 ℃时呈下降趋势,40 ℃时最大。其原因可能是花色苷在40 ℃时提取率最大,超过40 ℃其化学结构被破坏导致提取率下降。
2.3.5 盐酸浓度对花色苷提取的影响。由图7可知,当盐酸浓度在0~1%时,花色苷提取率呈上升趋势,当盐酸浓度在1.0%~2.5%时,花色苷提取率呈下降趋势,盐酸浓度为1%时最大。其可能的原因是黑芸豆豆皮细胞在1%的盐酸浓度下细胞壁被破坏,有利于花色苷的提取,而当盐酸浓度上升,可能导致花色苷被盐酸破坏或者从豆皮细胞中提取出干扰测定的物质,从而导致提取率降低。
2.4 正交试验结果分析
由表2可知,黑芸豆色素的提取效果影响因素为A>E>B>C>D,即乙醇浓度>盐酸浓度>料液比>提取温度>提取时间。正交试验得到的最佳组合为A4B3C2D1E2,即乙醇浓度70%、料液比1:20、提取温度50℃、提取时间 45 min、盐酸浓度0.5%HCl溶液为最佳提取组合。
3 结论与讨论
利用分光光度法测黑芸豆豆皮提取液的吸光度,得到的数据比较理想,而且分光光度法操作简便,仪器检测费用较低,适用于大多数检测机构,食品生产企业应用分光光度法进行检测更具有现实可行性。同时本次试验提取剂只是酒精、盐酸和水,没有选取有害试剂和放射性试剂,在保护环境的同时也保证了试验人员的身心健康。
由5因素4水平正交试验数据表极差分析可知,黑芸豆色素的提取效果影响因素为乙醇浓度>盐酸浓度>料液比>提取温度>提取时间。
4 参考文献
[1] KREIMEYER J,PETEREIT F,NAHRSTEDT A. Separations of flavan-3-ols and dimeric proanthocyanidins by capillary electrophoresis [J].Plant Medica,1998,64:6367.
[2]杜宏等.莲房原花青素对人肝癌细胞HepG2生长及凋亡的作用[J].实用医学杂志,2008,24(6):891.
[3] ARIGA T,HAMANO M.Radical Scavenging Action and its Mode in Procyanidins B-1 and B-3 from Azuki Beans to Peroxyl Radicals [J].Agric Biol Chem,1990,54(10):2499-2504.
[4] BAHORUN T,AUMJAUD E,RAMPHUL H,et al.Phenolic constituents and antioxidant capacities of Crataegus monogyna(Hawthorn)callus extra-cts [J].Nahrung/Food.47,2003(3):191-198.
[5] 张长贵,董加宝,王祯旭.原花色素及其开发应用[J].食品与药品,2006,5(8):13-17.
[6] 梨源倩.食品理化检验保健食品中原花青素的测定[M].北京:人民卫生出版社,2006:72-73.
[7] 杨玉红,张慧霞.葡萄原花青素的生物学活性研究进展[J].农产品加工,2008(5):40-42.
[8] 姜贵全,方桂珍.地榆根中花色苷的提取工艺[J].东北林业大学学报,2008,36(1):41-42.
[9] 丁麗,王敏,杜连祥.荔枝核中黄烷-3-醇的鉴定及花色苷的提取[J].食品研究与开发. 2006,27(7):67-73.
[10] 刘睿,谢笔钧,潘思轶,等.高粱种子外种皮中原花青素提取、纯化及其抗氧化活性的研究[J].中国粮油学报,2003,18(4):43-47.
[11] 胡静.玫瑰花总原花青素的分离、纯化及分析[D].杭州:浙江大学,2006.
[12] 董瑞霞,李立祥,张桂敏,等.茶籽壳中原花表素提取工艺参数的研究[J].安徽农业大学学报,2008(2):243-245.
[13] 张兴茂,林松毅,刘静波,等.长白山笃斯越桔果实原花青素浸提工艺的研究[J].食品科学,2007(28):186-188.
[14] 罗宝生,戴万生.大黄花色苷提取纯化工艺研究[J].云南中医药杂志,2007,28(1):36-38.
[15] 于立梅,赵谋明,李莹.基于响应面法的马尾松树皮花色苷提取及抗氧化性研究[J].科研开发,2007,23(1):64-68.
