植物种子油体的提取及其性质的初步研究
2017-07-19陈雅静赵路苹华欲飞陈业明
陈雅静 赵路苹 华欲飞 陈业明
(食品科学与技术国家重点实验室;江南大学食品学院,无锡 214122)
植物种子油体的提取及其性质的初步研究
陈雅静 赵路苹 华欲飞 陈业明
(食品科学与技术国家重点实验室;江南大学食品学院,无锡 214122)
植物种子油体是一种天然的微胶囊,含有丰富的不饱和脂肪酸和磷脂、维生素E及植物甾醇等生物活性小分子。因此,在食品、化妆品和制药等领域有很大的运用潜力。本研究选取8种植物种子(椰子、油菜籽、核桃仁、南瓜籽、花生、油茶籽、杏仁和红花籽),在尿素条件下提取不同种子油体,考察并比较不同种子油体的表观、粒径大小、pH稳定性及蛋白组成,为植物种子油体的利用提供参考。研究表明,利用8 mol/L尿素可获得高纯度的油体,不同植物种子油体的颜色和风味各不相同;显微镜(400×)下观察到8种植物种子油体乳液分散较为均匀,其中除油菜油体太小观察不到外,其他油体均呈球形;不同植物种子油体粒径大小不同;pH对于8种植物种子油体乳液的分散稳定性的影响各不相同;通过电泳表征和质谱分析发现8种植物种子油体蛋白分子质量分布情况差别很大。
植物种子 油体 分散稳定性 粒径 油体蛋白
植物种子,特别是油料作物种子含有丰富的脂质。一般通过压榨或有机溶剂法得到液态油来作为食用油[1]。但实际上种子中的油脂主要以油体形式存在——天然的微胶囊,这些油体含有丰富的对人体有益的不饱和脂肪酸、磷脂、维生素E和植物甾醇等[2]。油体表面由一层磷脂-油体蛋白(对于油体的结构和稳定性非常重要)的复合膜组成,这层膜是一种亲水性带负电荷的生物膜[3]。因此,可以通过水相提取法提取油体,并且水相提取的油体具有安全、环保、结构完整和保留小分子功能性成分等优点,可以在食品(如色拉酱、蛋黄酱和蛋糕卷的夹心)、药品(如药物的载体)和化妆品(如替代矿物油)等领域进行应用[4-8]。
目前,关于植物种子油体的研究主要集中在植物生理方面,研究表明较纯的植物种子油体能够应用在食品中[9-10],因此植物种子油体在食品领域的应用研究越来越多。但是现有的研究往往只针对某一种植物种子油体[10-12],选择的植物种类范围较窄,对于油茶籽、南瓜籽等有特殊功效的植物种子油体的研究较少,限制了油体实际运用的选择性。因此,本试验选择了8种不同植物种子(花生、红花籽、核桃仁、油茶籽、杏仁、椰子、南瓜籽和油菜籽)进行研究,通过显微镜观察、电泳表征和质谱鉴定,分别考察油体的色泽、风味、粒径、分散稳定性和油体内源性蛋白的种类,旨在对比和明确不同植物种子油体的基本性质,完善植物种子油体的理论信息,为植物种子油体在食品中的应用提供更多的指导。
1 材料与方法
1.1 材料与仪器
花生、油茶籽、油菜籽、红花籽、核桃仁、杏仁、椰子、南瓜籽:杭州纳趣农业开发有限公司,贮存于4 ℃冰箱中备用;尿素(分析纯):国药集团化学试剂有限公司;丙烯酰胺、N,N’-甲叉双丙烯酰胺、溴酚蓝、巯基乙醇、三羧基氨基甲烷(Tris)、四甲基乙二胺(TEMED)、考马斯亮蓝G250:美国Sigma公司;标准蛋白:美国Bio-Rad公司。
Hitachi CR21G高速冷冻离心机:日本日立公司;ChemiDocXRS+凝胶成像仪、Mini-PROTE AN型垂直电泳仪:美国Bio-Rad公司;Zetasizer nano ZS纳米粒度仪:英国马尔文公司;UltraflexTM MALDI-TOF/TOF-MS质谱仪:美国布鲁克·道尔顿有限公司。
1.2 试验方法
1.2.1 生浆的制备
分别称取花生、核桃仁、杏仁、南瓜籽、油菜籽和油茶籽30 g,红花籽50 g浸泡在去离子水(1∶9,m/m)中,在4 ℃冰箱放置18 h。向吸胀的种子中加入新鲜去离子水至总质量分别为300 g(花生、核桃仁、杏仁、南瓜籽和油菜籽)、240 g(油茶籽)和250 g(红花籽),用组织捣碎机以18 000 r/min的速度磨浆60 s,用4层纱布过滤,滤液即为生浆。椰子不需去离子水浸泡,直接取50 g椰子肉加入去离子水至总重为250 g打浆,过滤得生浆。
1.2.2 植物种子油体的提取
水相提取的油体表面会吸附大量的油体外源性蛋白。为了减少这些外源性蛋白对于油体性质的影响,常用的方法有尿素提取[13]和碱性提取,但碱性提取会在一定程度上改变所提取油体的成分和性质[14],尿素通过与蛋白质分子的氨基酸残基形成氢键从而破坏蛋白质的二级结构,本研究利用尿素提取得到较为纯净的油体作为研究对象。生浆中加入尿素至浓度为8 mol/L,离心(20 ℃,15 000 r/min,15 min)。离心后分为3层,收集上浮物即为油体提取物(此法得到的油体纯度较高,以下均简称为植物种子油体),将其以1∶20(m/m)分散到8 mol/L的尿素溶液中,搅拌均匀,离心。重复上述操作1次,得到8种植物种子油体,分别以1∶5(m/m)分散于去离子水中,得到油体乳液,将油体乳液移入截留分子质量为14 000 u的透析袋内,置于去离子水的烧杯内,在4 ℃层析柜内透析。透析后的样品立即进行后续试验。
1.2.3 植物种子油体的显微镜观察
为保证提取的油体能够保持在种子中最原始的状态,避免由于18 000 r/min的速度60 s磨浆造成油体结构破坏,将浸泡过的种子10 g通过手工剁碎,加入15 g去离子水,过滤获得生浆,离心(5 000r/min,5 min),取上浮油体0.1 g分散在10 mL 30 mmol/L pH 9.0 Tris-HCl溶液中,稀释成为1%(m/m)的油体乳液,振荡均匀。滴1滴乳液在载玻片上,盖好盖玻片,在400×显微镜(10倍目镜×40倍物镜)下观察植物种子油体。通过测量并计算显微镜照片中油体的粒径范围和平均粒径。
1.2.4 油菜油体的粒径测定
油菜油体以小油体居多,大油体数目极少,油体平均粒径约为0.57 μm,在光学显微镜下难以观察到[15],因此采用Zetasizer nano ZS纳米粒度仪测定油菜油体的粒径,用30 mmol/L pH 9.0 Tris-HCl溶液稀释成0.01%(m/m)的乳液,折光系数1.33,测定温度25 ℃,平行测定2次。
1.2.5 油体乳液的pH稳定性
取1.2.2中透析过的植物种子油体乳液2.0 g,加入98 g去离子水在磁力搅拌下混合均匀,得到2%植物种子油体乳液。用0.1 mol/L NaOH或0.1 mol/L HCl调节乳液pH为3.0、3.4、3.8、4.2、4.6、5.0、5.4、5.8、6.2、6.6和7.0。取不同pH下的乳液5 mL置于具塞试管中,室温下放置2 h观察其稳定性。其中椰子油体乳液的操作需在30 ℃[16]。
1.2.6 Tricine-SDS-聚丙烯酰胺凝胶电泳(Tricine-SDS-PAGE)
将1.2.2制备的植物种子油体与等体积的样品溶解液(4% SDS)混合[17]。Tricine-SDS-聚丙烯酰胺凝胶电泳参考Schagger[18]的方法,电泳前将样品在沸水浴下煮沸5 min,并在10 000 r /min下离心5 min,取下层液体上样。样品在浓缩胶(4%)内的设定电压为30 mV,当指示剂溴酚蓝进入分离胶(16%)后,将电压调到100 mV,直到电泳结束。取出的电泳胶立即进行固定、染色和脱色步骤,用凝胶成像仪拍照并分析。
1.2.7 基质辅助激光解析飞行时间质谱(MALDI-TOF/TOF-MS)
切割胶上的目标条带,用超纯水清洗胶粒,加入含30%乙腈(ACN)的100 mmol/L NH4HCO3溶液清洗脱色1 h,去上清,冻干。EP管加10 μL 100 mmol/L DTT和90 μL 100 mmol/L NH4HCO3溶液,56 ℃下孵化30 min,去上清,冻干。加70 μL 100 mmol/L NH4HCO3和30 μL 200 mmol/L 碘乙酰胺(IAA)溶液,暗处放置20 min。去上清,EP管加100 mmol/L NH4HCO3溶液,室温放置15 min,去上清,冻干。加5 μL 10 μg/mL胰蛋白酶(Trypsin)溶液,混匀后, 4 ℃放置1 h,使胶块充分吸胀。再加入25 mmol/L NH4HCO3溶液,37 ℃下反应20 h。吸出酶解液,转移到新EP管,冻干,得到冻干干粉。原管加入10 μL含0.1%三氟乙酸(TFA)的60%ACN溶液。超声15 min,吸出溶液于含冻干干粉的EP管中,在靶上依次点样。
MALDI-TOF/TOF质谱仪配备有线性模式25 kVA和激光发射150(337 nm,50 Hz,N2激光),利用此设备获取肽质量指纹谱。在正线性模式下得到每个样品的光谱图,并自动选择和收集200个通过峰值强度接受标准的光谱图。使用flex analysis数据获取软件,在自动模式下,使用胰蛋白酶自溶峰(m/z842.509和m/z2 211.104)内在校正,并进行光谱加工和数据库搜索。被选取肽的片段在PSD模式下进行MS/MS分析。利用Mascot搜索引擎下的 NCBInr数据库鉴定蛋白质。
2 结果与分析
2.1 8种植物种子油体的外观
观察提取的8种植物种子油体外观,发现不同植物种子油体颜色不同,主要是由于各类植物种子中所含的色素不同,植物种子里含有叶绿素、类胡萝卜素、黄酮色素及花色苷,少部分则来自于提油体过程中植物种子内还原糖类物质与氨基酸或蛋白质结合而生成的物质。此外,在植物种子细胞内,还有一种叫色原体的物质,在空气被氧化,而呈现出颜色[19]。其中椰子和花生油体色泽洁白,核桃、油茶籽和杏仁油体呈白色略带黄色,红花籽油体呈白色略带棕色,油菜籽和南瓜籽油体分别呈黄色、绿色;不同植物种子油体具有其独特的气味,很可能是因为油体含有的挥发性风味成分不同,其中椰子油体味道香甜,油菜油体有刺鼻的食用油味道,油茶油体有类似中草药的苦味,红花籽油体有稻谷的味道,核桃仁、杏仁、南瓜和花生油体只有淡淡的植物自身的味道。
2.2 8种植物种子油体的形态观察及粒径分析
在400×显微镜下观察8种植物种子油体的形态,如图2显示,8种植物种子油体乳液分散较为均匀,除油菜外,其余7种植物种子油体形状比较规则,呈球形;油菜油体很小,在显微镜下观察不到。油体是直径为0.5~2.5 μm的小球体,其大小因植物种类不同而不同,研究表明油脂蛋白的积累情况直接影响油体的粒径大小[20]。

图2 8种植物种子油体的显微结构(400×)
经测量计算发现7种植物种子油体的粒径分布情况差距较大,同一种子中既存在极大的油体,也存在极小的油体,油体大小差异很大。其中椰子油体直径为0.8~5.3 μm,其中在0.8~2.3 μm之间的油体数量最多;核桃油体直径为0.6~4.6 μm,其中在1.8~2.2 μm之间的油体数量最多;南瓜油体直径为0.6~5.0 μm,其中在0.6~1.0 μm之间的油体数量最多;花生油体直径为0.8~9.6 μm,其中在0.8~2.4 μm之间的油体数量最多;油茶油体直径为0.6~5.0 μm,其中在1.0~1.4 μm之间的油体数量最多;杏仁油体的直径在0.6~7.0 μm,其中在0.6~1.4 μm之间的油体数量最多;红花油体直径为0.7~7.9 μm,其中在0.7~2.5 μm之间的油体数量最多。通过纳米粒度仪测得油菜油体的平均直径为0.41 μm,与韦存虚等[15]报道的0.57 μm有差异,可能是由于油菜品种不同造成的。因此,可以大概对8种植物种子油体大小由小到大进行排序:油菜、杏仁、南瓜、油茶、椰子、核桃、花生、红花。由此可看出,植物种类不同,油体大小会有很大差异;同种植物种子油体大小分布在一个范围内。不同植物种子间油体大小的差异很可能是因为植物中含油量和油体蛋白含量的比例不同[21]。
2.3 pH对8种植物种子油体乳液的稳定性的影响
不同pH处理后不同植物种子油体乳液分散情况不同。椰子油体乳液在pH 4.6~7.0时比较稳定,pH 3.0~4.2时极不稳定;核桃油体乳液在pH 5.0~7.0比较稳定,pH 3.0~5.0时极不稳定;油菜油体乳液在pH 5.0~5.8时极不稳定;南瓜油体乳液在pH 4.6~5.4时极不稳定;花生油体乳液在pH 4.2~4.6时极不稳定;油茶油体乳液在pH 5.0~5.4时极不稳定;杏仁油体乳液在pH 3.8~5.4时极不稳定;红花油体乳液在pH 3.8~6.2时极不稳定。在这些范围外,油体乳液随着pH变酸变碱逐渐变稳定。植物种子油体乳液在不同pH作用下的分散情况,可以为油体作为乳化剂在饮料、咖啡伴侣等产品中的应用提供参考,对于在实际生产中选择合适的植物种子油体有重要的作用。如花生油体乳液在pH 4.2~4.6除外的环境下均呈现良好的分散状态,在食品体系中适用范围更大,而红花油体只适用于pH>6.6的食品体系。
2.4 8种植物种子油体内源性蛋白组成
通过Tricine-SDS-PAGE电泳表征8种植物种子油体内源性蛋白组成,由图3可以看出8种植物种子油体的相关蛋白组成各不相同。通过MALDI-TOF/TOF-MS对条带1~57进行了鉴定,结果如表1所示。其中椰子油体中蛋白分子质量为12~55 ku,共有7个条带,有2条是油体蛋白(条带2和3);油菜油体中蛋白分子质量为11~65 ku,共有21个条带,有2条是油体固醇蛋白(条带6和7),1条是油体钙蛋白(条带10),5条是油体蛋白(条带12~16);核桃油体中蛋白分子质量为14~25 ku,共有7个条带,有2条油体蛋白(条带23和24);南瓜油体中蛋白分子质量为14~37 ku,共有9个条带,没有鉴定得到油体蛋白;花生油体中蛋白分子质量为13~26 ku,共有5个条带,有3条是油体蛋白(条带33);油茶油体中蛋白分子质量为13~54 ku,共有8个条带,没有鉴定得到油体蛋白;杏仁油体中蛋白分子质量为13~37 ku,共有16个条带,没有鉴定得到油体蛋白;红花油体中蛋白分子质量为13~27 ku,共有7个条带,没有鉴定得到油体蛋白。油茶籽、红花籽、南瓜籽和杏仁均没有鉴定出油体蛋白,很可能是由于数据库(NCBI和UniProt)里还没有相关油体蛋白的信息。但由于植物的油体蛋白的分子质量一般在14~26 ku之间[22],因此可以从图3中初步得到各种植物种子油体的油体蛋白的种类。
如杏仁油体主要含有1种油体蛋白(条带50),红花油体主要含有3种油体蛋白(条带54、55和56),依此类推。

注:M为Marker,1 椰子,2 油菜,3 核桃,4 南瓜,5 花生,6 油茶,7 杏仁,8 红花。图3 8种植物种子油体蛋白的Tricine-SDS-PAGE电泳分析
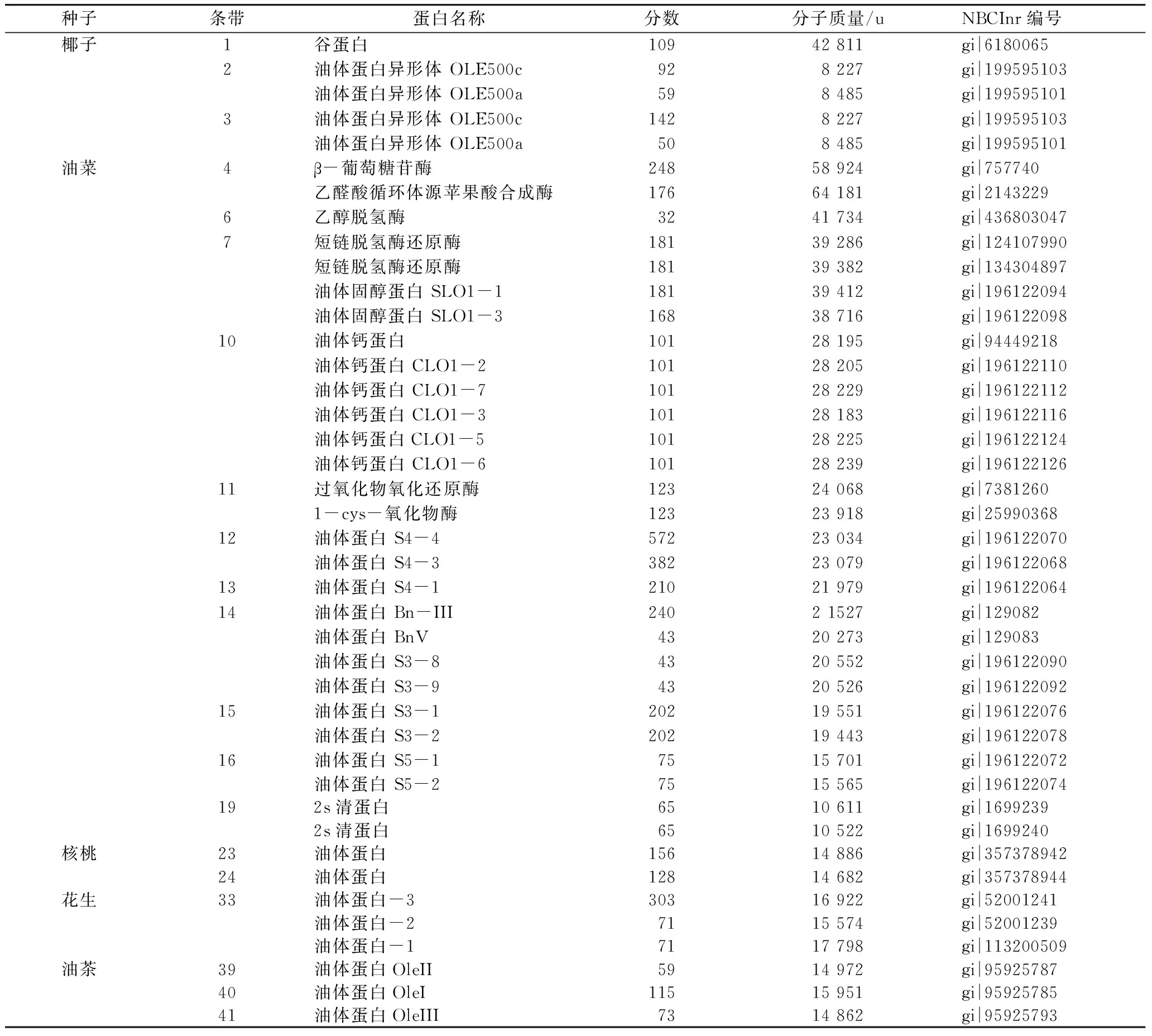
表1 蛋白条带的质谱鉴定结果
3 结论
本研究考察了8种植物种子油体的基本性质。研究结果显示,8种植物种子油体颜色、气味等表观特性各不相同,其中椰子和花生颜色洁白、气味清新。有特殊颜色、气味的油体在实际应用时可以根据需求选择。8种植物种子油体乳液分散均较为均匀,油体形状比较规则,呈球形;植物种类不同,油体大小会有很大差异;同种植物种子油体大小集中分布在一个范围内。在不同pH下,植物种类不同,油体乳液分散稳定性不同,会在不同pH范围内出现乳析现象,本试验结果可以为8种植物种子油体在食品中的应用提供参考,经比较花生油体稳定性最好,是食品中作为添加剂的良好选择,植物种类不同,油体蛋白组成不同。
[1]李小鹏,董文斌.植物油脂提取工艺研究新进展[J].现代商贸工业,2007,19(8):201-202 Li Xiaopeng, Dong Wenbin. Plant oil extraction technology research progress[J]. Modern Business Trade Industry, 2007, 19(8):201-202
[2]Cercasov C, Manolescu B. Biochemical and therapeutical aspects of vitamin E[J]. Revue Roumaine de Chimie, 2005, 50: 419-432
[3] Tzen J T, Huang A H. Surface structure and properties of plant seed oil bodies[J]. The Journal of Cell Biology, 1992, 117: 327-335
[4] Deckers H M, Rooijen G V, Boothe J, et al. Oil body based personal care products: United States, US6183762 B1[P]. 2001-02-06
[5] Tzen J T, Roberts N J, Scott R W. Recent biotechnological applications using oleosins[J]. Open Biothechnology Journal, 2008, 2: 13-21
[6] Chiang C J, Chen H C, Kuo H F, et al. A simple and effective method to prepare immobilized enzymes using artificial oil bodies[J]. Enzyme and Microbial Technology, 2006, 39(5): 1152-1158
[7] Chiang C J, Chen H C, Chao Y P, et al. One-step purification of insoluble hydantoinase overproduced in escherichica coli[J]. Protein Expression and Purification, 2007, 52(1): 14-18
[8] Bhatlaa S C, Vandanab S, Kaushika V. Recent developments in the localization of oil body associated signalling molecules during lipolysis in oilseeds[J]. Plant Signaling and Behavior, 2009, 4(3): 176-182
[9]应玉桑,孔令知,陈业明,等.大豆水酶法提油所得乳油的稳定性和流变性分析[J].中国油脂,2015,40(10):59-63 Ying Yusang, Kong Lingzhi, Chen Yeming,et al. Stability and rheological property of cream formed during aqueous enzymatic extraction of soybean oil[J]. China Oils and Fats, 2015,40(10):59-63
[10] 吴娜娜,杨晓泉,郑二丽,等.大豆油体乳液稳定性和流变性分析[J].农业工程学报,2012,28(1):369-374 Wu Nana, Yang Xiaoquan, Zheng Erli, et al. Analysis of stability and rheology of soybean oil body emulsions[J]. Transactions of the Chinese Society of Agricultural Engineering ,2012,28(1):369-374
[11]杨晶,韩高强,刘忠良,等.红花油体提取条件优化及稳定性研究[J].生物技术通报,2015,31(3):185-190 Yang Jing, Han Gaoqiang, Liu Zhongliang, et al. Optimization of extract condition of safflower oil body and analysis of stability[J]. Biotechnology Bulletin,2015,31(3):185-190
[12]刘玉君,沈世华.小桐子种子油体蛋白的提取及其电泳分析[J].林业科学,2008,44(8):37-41 Liu Yujun, Shen Shihua. Isolation and polyacrylamide gel electrophoresis analysis of oil body proteins from jatropha curcas seeds[J]. Scientia Silvae Sinicae,2008,44(8):37-41
[13]赵路苹,陈业明,张彩猛,等.提取条件对大豆油体表面蛋白质去除效果的研究[J].大豆科学,2013,32(6):835-839 Zhao Luping, Chen Yeming, Zhang Caimeng, et al. Removing effects of extract conditions on surface proteins from soybean oil body[J]. Soybean Science,2013,32(6):835-839
[14]曹艳芸, 陈业明, 华欲飞.高碱性提取的大豆油体的成分变化研究[J].中国粮油学报,2014(3):37-41 Cao Yanyun, Chen Yeming, Hua Yufei. Composition changes of soybean seed oil body by high-alkaline extraction[J]. Journal of the Chinese Cereals and Oils Association,2014(3):37-41
[15]韦存虚,钦风凌,李爱民,等.油菜种子油体的观察和大小分析[J].中国油料作物学报,2009,31(4):445-448 Wei Cunxu, Qin Fengling, Li Aimin, et al. Oil body observation in seeds ofBrassicanapusL.[J]. Chinese Journal of Oil Crop Science,2009,31(4):445-448
[16]李瑞,李希娟,夏秋瑜,等.原生态椰子油的相关标准分析[J].中国农学通报,2009,25(23):122-125 Li Rui, Li Xijuan, Xia Qiuyu, et al. Analysis of the relative foreign standards of virgin coconut oil[J]. Chinese Agricultural Science Bulletin,2009,25(23):122-125
[17]Ying Y S, Zhao L P, Kong L Z, et al. Solubilization of proteins in extracted oil bodies by SDS: A simple and efficient protein sample preparation method for Tricine-SDS-PAGE[J]. Food Chemistry, 181, 179-185
[18]Schagger H. Tricine-SDS-PAGE[J]. Nature Protocols, 2006, 1(1): 16-22
[19]陶银.浅析食用植物油因品质变化对油脂色泽的影响[J].中外食品工业,2014(8):20-22 Tao Yin. Edible vegetable oil is analysed by the influence of the quality change of oil color[J]. Sino-foreign Food Industry,2014(8):20-22
[20]Siloto R M P,Findlay K, Lopez-Villalobos A, et al. The accumulation of oleosins determines the size of seed oil bodies in Arabidopsis[J]. The Plant Cell, 2006, 18 (8): 1961-1974
[21]Ting J T, Lee K, Ratnayake C, et al. Oleosin genes in maize kernels having diverse oil contents are constitutively expressed independent of oil contents: Size and shape of intracellular oil bodies are determined by the oleosins/oils ratio[J]. Planta, 1996, 199(1):158-165
[22]Tzen J T, Lai Y K, Chan K L, et al. Oleosin isoforms of high and low molecular weights are present in the oil bodies of diverse seed species[J]. Plant Physiology, 1990, 94(3):1282-1289.
Preliminary Study of Extraction and Properties of Plant Seed Oil Bodies
Chen Yajing Zhao Luping Hua Yufei Chen Yeming
(State Key Laboratory of Food Science and Technology; School of Food Science and Technology,Jiangnan University, Wuxi 214122)
Plant seed oil bodies, one kind of natural microcapsules, contain plentiful unsaturated fatty acids and bioactive small molecules, such as phospholipids, tocopherol and phytosterol. They have great potentials to be used in foods, cosmetics, pharmaceutical and other application. In this study, eight varieties of plant seeds (coconut, rapeseed, walnut kernel, pumpkin seed, peanut, camellia seed, almond and safflower seed) were selected to extract various seed oil bodies, investigate and compare appearance, particle size, pH stability and protein composition of these plant seed oil bodies under the urea conditions, which would provide the theoretical basis for the utilization of the plant seed oil bodies. The main results indicated that it could obtain highly purified oil bodies with 8 mol/L urea and each plant seed oil body had its unique characteristics in color and odor; eight plant seed oil bodies emulsions were uniformly dispersed and their shapes were spherical by microscope (400×), whereas rapeseed was excluded as its oil body was too small to observe; eight plant seed oil body had different particle sizes; dispersion stability of eight plant seed oil bodies emulsions showed different trends as a function of pH; distribution condition of protein molecular weights were different in these eight plant see oil bodies by electrophoresis characterization and mass spectrometry.
plant seeds,oil bodies, dispersion stability,particle size, oleosin
国家自然科学基金青年科学基金(31301496)
2015-10-19
陈雅静,女,1992年出生,硕士,植物蛋白
陈业明,男,1982年出生,副教授,植物蛋白
TS225.1
A
1003-0174(2017)05-0062-06
