菜籽肽的ACE、肾素抑制活性及抗氧化性研究
2017-07-19王凤章杨毅杰鞠兴荣
王凤章 杨毅杰 何 荣 鞠兴荣 袁 建
(南京财经大学食品科学与工程学院;江苏高校粮油质量安全控制及深加工重点实验室,南京 210023)
菜籽肽的ACE、肾素抑制活性及抗氧化性研究
王凤章 杨毅杰 何 荣 鞠兴荣 袁 建
(南京财经大学食品科学与工程学院;江苏高校粮油质量安全控制及深加工重点实验室,南京 210023)
本研究采用1、3 、5 、10 ku的超滤膜分离菜籽蛋白嗜热菌蛋白酶水解物(TPH),得到了4种不同分子质量的菜籽肽,研究了各菜籽肽的血管紧张素转化酶-Ⅰ(ACE)抑制活性、肾素抑制活性、氧自由基吸附能力(ORAC)和细胞抗氧化(CAA)活性。结果表明,菜籽肽的分子质量与其ACE抑制活性、肾素抑制活性以及ORAC值有明显的正相关性(P<0.05);<1 ku的菜籽肽的ORAC值远高于TPH的,其ORAC值(Trolox)高达(4 363.53±45.87)μmol TE/g,是谷胱甘肽(GSH)的2.4倍,其中2个菜籽肽的ORAC值与GSH相当(P<0.05);细胞抗氧化试验表明TPH的CAA值最高,为(26.53±1.71)μmol QE/g,其次是<1 ku组分,其CAA值是(23.91±0.69)μmol QE/g。研究认为,菜籽蛋白酶水解物及各菜籽肽不仅具有ACE和肾素双重抑制活性,还有一定的氧自由基吸收能力。因此,菜籽蛋白可用于开发降血压制剂或相关功能性产品。
菜籽蛋白 膜分离 ACE抑制活性 肾素抑制活性 抗氧化性
据WHO统计,心血管疾病已成为全球最大的致死因素,而高血压是造成心血管疾病的主要原因之一[1]。肾素-血管紧张素系统(RAS)是重要的机体血压调节系统,在RAS中,肾素是系统链的初始限速酶,肾素水解血管紧张素原生成血管紧张素-Ⅰ,而血管紧张素-Ⅰ会在血管紧张素转化酶-Ⅰ(ACE)的作用下进一步水解成血管紧张素-Ⅱ,血管紧张素-Ⅱ会与血管紧张素受体结合,使血管收缩,引起醛固酮的释放,进而导致钠离子浓度的增加和高血压[2]。因此,RAS系统中最重要的2种水解酶:肾素和ACE的活性对于调节血压的高低有重要的作用。
研究表明,许多来源于食物蛋白酶解的多肽都具有显著的降血压活性功能。食物源生物活性肽因具有安全、低成本、高活性、易吸收、营养价值高等特点,现已成为食品工业研究的热点领域之一。Udenigwe等[3]用不同的蛋白酶水解亚麻籽蛋白得到的多肽片段表现出肾素和ACE双重抑制活性。Garcia-Mora等[4]用碱性蛋白酶解得到的豌豆多肽不仅具有ACE抑制活性,还具有氧自由基吸收能力(ORAC)。此外,氧化应激反应也是引起高血压的重要原因之一,朱丽娟[5]研究发现,玉米蛋白水解物的抗氧化性与ACE抑制活性间存在显著相关性。因此,抗氧化性的强弱与机体血压升高或降低也有一定的关系。
我国是世界上菜籽粕产量最大的国家,菜籽中含有21%~24%的蛋白质,脱脂菜籽粕中含有33%~39%的蛋白质[6]。菜籽蛋白中含有丰富的含硫氨基酸和赖氨酸,它除了具有较好的营养特性外,其功能特性也优于其它蛋白,特别是吸油性、保水性和乳化性能优于大豆蛋白[7],是极具开发潜力的植物蛋白资源。研究认为,菜籽蛋白水解物有较强的抗氧化性和抗肿瘤活性[8-9]。因此,本研究将菜籽蛋白的嗜热菌蛋白酶水解物(TPH)经过超滤获得4种分子质量不同的肽组分,采用体外ORAC和细胞内CAA 2种抗氧化方法评价TPH及各菜籽肽的抗氧化能力,进一步探讨了分子质量大小、氨基酸组成对菜籽肽ACE、肾素抑制活性以及抗氧化能力的影响,为研究菜籽蛋白降血压肽或相关功能性产品提供参考。
1 材料与方法
1.1 材料与试剂
菜籽粕(Brassicanapus):东海粮油工业有限公司;嗜热菌蛋白酶Thermolysin、血管紧张素转化酶-Ⅰ(ACE)、6-羟基-2,5,7,8-四甲基色满-2-羧基(Trolox)、2,2'-偶氮二异丁基脒二盐酸盐(2, 2'-Azobis (2-amidinopropane) dihydrochloride,ABAP)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、槲皮素、Trolox、2',7'-二氯荧光素二乙酸酯(2',7'-Dichlorofluorescin diacetate,DCFH-DA)和还原型谷胱甘肽(GHS):美国Sigma公司;青霉素、链霉素、磷酸盐缓冲液(PBS)、二甲基亚砜(DMSO)、胰蛋白酶-EDTA消化液、高糖培养基(DMEM)、胎牛血清(FBS)、Hank′s平衡盐溶液(HBSS):美国Thermo Fisher公司;肾素活性测定试剂盒:Cayman Chemical公司。试验所用试剂均为分析纯。
1.2 仪器与设备
FP-6300荧光分光光度计:日本JASCO;SpectraMax M2e型荧光酶标仪:美国Sspectra MAX Gemini; AKTA purify10蛋白质纯化仪:美国通用公司;Stirred Cell 8010超滤装置:美国Millipore;96孔白色底部透明微孔板:美国Corning公司;MSC-Advantage-12生物安全柜、SL16R冷冻离心机、XD30A倒置显微镜、HERACELL-150i型CO2培养箱:美国Thermo Fisher公司。
1.3 试验方法
1.3.1 菜籽蛋白质的制备
采用He等[10]的方法制备菜籽蛋白。将菜籽粕粉碎、过80 目筛,分散于10 倍体积的蒸馏水中,用1 mol/L NaOH调节pH 为11.0,并维持不变,室温搅拌2 h 后,8 000×g 离心1 h,收集上清液,用1 mol/L HCl 调节上清液pH 至4.5,静置2 h 后离心,得到下层沉淀蛋白质。
1.3.2 菜籽蛋白质水解物和膜分离组分的制备
采用He等[10]的方法制备菜籽蛋白水解物及各膜分离组分。将菜籽蛋白质溶解在蒸馏水中,配制成5%的溶液,调pH 为7.5、温度37 ℃,向其中加入4% (以样品菜籽蛋白质量计) 的嗜热菌蛋白酶,水解4 h,水解过程中通过滴加1 mol/L 的NaOH 保持反应体系的pH 恒定。水解反应结束后,将水解物加热至90 ℃ 并保温10 min 灭酶,冰水浴快速冷却后以8 000×g 离心1 h,上清液依次通过截留分子质量1、3、5、10 ku的超滤膜,透过液和水解液冷冻干燥得到菜籽蛋白水解物和不同分子质量组分。采用lowry法[11]测定组分中蛋白质的含量。根据式(1)计算菜籽蛋白各膜分离组分的得率。

(1)
1.3.3 氨基酸组成的测定
采用氨基酸自动分析仪,按照说明书对样品进行酸水解后再进行氨基酸组成的测定。
1.3.4 ACE抑制活性的测定
采用Holmquist等[12]方法测定菜籽蛋白水解物和不同分子量组分的ACE抑制活性。在比色杯中加入1 mL 0.5 mmol/L FAPPG(溶解于50 mmol/L Tris-HCl缓冲液,含0.3 mol/L NaCl,pH 7.5),20 μL ACE(1 U/mL,最终活力为20 mU),200 μL样品(溶解于上述缓冲液,最终质量浓度1 mg/mL),室温下混匀,于2 min内在345 nm下测定吸光值的降低速率。空白以Tris-HCl缓冲液代替样品。根据式(2)计算ACE抑制活性:
(2)
式中,ΔA·min-1(样品)和ΔA·min-1(空白)分别为样品和空白的ACE活性变化速率。
1.3.5 肾素活性的测定
采用He等[10]的方法测定菜籽蛋白水解物和各分子质量组分的肾素抑制活性。具体方法为:在96孔板中依次加入:(1)空白:20 μL底物,160 μL测试用缓冲液,10 μL纯水;(2)空白对照:20 μL底物,150 μL测试用缓冲液,10 μL纯水;(3)样品:20 μL底物,150 μL测试用缓冲液,10 μL样品(最终浓度为1 mg/mL)。然后分别向每个孔中加入10 μL肾素以启动反应,37 ℃下预热15 min后,在10 min内应用荧光酶标仪测定样品的荧光强度(FI),激发波长340 nm,发射波长490 nm。根据式(3)计算样品的肾素活性抑制率:
(3)
式中:ΔFI·min-1(样品)和ΔFI·min-1(空白)分别为样品和空白的肾素活性变化速率。
1.3.6 氧自由基吸附能力(ORAC)的测定
根据You等[13]的方法,测定菜籽蛋白水解物及其膜分离组分的氧自由基吸附能力。将样品溶解于pH为7.4,0.075 mol/L磷酸盐缓冲溶液(荧光素、Trolox和AAPH也用该溶液配制),使其质量浓度为50 mg/L。在96孔板中依次加入120 μL荧光素(0.008 μmol/L)和20 μL 的样品或者浓度分别为50、25、12.5、6.25 μmol/L抗氧化剂Trolox,在37 ℃下保温20 min后,向每个样品孔中加入60 μL AAPH (0.15 mol/L)以启动反应,荧光酶标仪在60 min 内每隔1 min记录1次样品的荧光强度 (λex=485 nm, λem=530 nm)。抗氧化剂作用时荧光衰减曲线下面积分面积,扣除无抗氧化剂的空白曲线下面积,得出抗氧化剂的保护面积(AUC)。通过对比样品荧光衰退曲线的AUC与标准抗氧化剂Trolox的AUC,计算样品的ORAC值。
1.3.7 细胞培养
采用DMEM高糖完全培养基,含10%胎牛血清,1%双抗(青霉素和链霉素)、1%非必需氨基酸,1%谷氨酰胺。HepG2细胞于37 ℃、5%CO2、相对湿度90%的培养箱中培养,隔天换液,待细胞贴壁生长至70%~80%,用含0.25%EDTA的胰蛋白酶消化,按1∶4比例传代。
1.3.8 MTT细胞毒性试验
采用MTT法[14]进行细胞毒性试验。将TPH和4种肽用培养液配制成7个质量浓度梯度:50、100、200、400、600、800、1 000 mg/L。取对数生长期的HepG2细胞,于96孔板中每孔接种104个细胞,于37 ℃、5%CO2细胞培养箱中培养24 h后,弃去培养液,向每孔中加入100 μL不同浓度梯度的样品,每个浓度均设6个复孔,对照组不加入样品,只加培养液,继续培养24 h后,向每孔中加入20 μL的MTT(5 mg/mL),继续培养4 h,弃去培养液后,每孔加入150 μL DMSO,于37 ℃下振荡20 min,使蓝紫色结晶充分溶解,然后在酶标仪波长570 nm下测吸光值,按照式(4)计算细胞成活率。
(4)
1.3.9 细胞抗氧化(CAA)活性试验
采用Wolfe等[15]和Song等[16]建立的细胞模型进行细胞内抗氧化活性试验。在96孔板上接种HepG2细胞,每孔加入100 μL细胞悬液,使细胞密度达到每孔6×104个,培养24 h细胞贴壁后,去除上清液,用PBS清洗每个孔。然后每孔加入100 μL样品处理液(含有25 μmol/L的DCFH-DA),以不含样品的处理液为对照,在37 ℃、5%CO2培养箱中继续培养1 h。取出96孔板,去除上清液,每孔加入100 μL HBSS(含有600 μmol/L的ABAP),将96孔板放入荧光酶标仪中扫描,保持恒温37 ℃,在波长485 nm处激发,每5 min在波长538 nm处释放,测定1h。
1.3.10 细胞抗氧化能力的定量
扣去空白和初始荧光在值后,每个多肽浓度对应时间-荧光值曲线下的面积即为CAA 值,根据式(5)计算样品的CAA(unit):
(5)
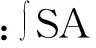
1.3.11 数据分析
采用SAS软件对数据进行单因素方差分析Duncan多重比较,以P<0.05为有显著差异。每组试验重复3次,结果均采用“平均值±标准差”表示。
2 结果与讨论
2.1 菜籽蛋白TPH及其膜分离组分的得率
嗜热菌蛋白酶是一种内肽酶,采用其水解菜籽蛋白质,并根据分子质量大小用超滤膜分离水解物得到了4种不同分子质量的菜籽肽,得率如图1所示。由图1可知,TPH的得率最高,为(70.92±2.05)%,其次是分子质量小于1 ku的菜籽肽,得率是(40.96±0.60)%,随着菜籽肽分子质量的增大,得率逐渐减小,说明嗜热菌蛋白酶水解菜籽分离蛋白可以有效的释放低分子质量的多肽。并且,水解物中分子质量小于3 ku的多肽占比多达60%以上。有研究表明,肽的抗氧化能力和肽链的长短、分子质量的大小有关。Pena-Ramos等[17]研究发现,分子质量在350~1 500 u的肽对脂质体系中乳清蛋白水解物的总抗氧化能力起着重要作用,Wu等[18]认为分子质量在1 400 u左右的肽,比大于1 400 u的肽具有更强的抗氧化活性。
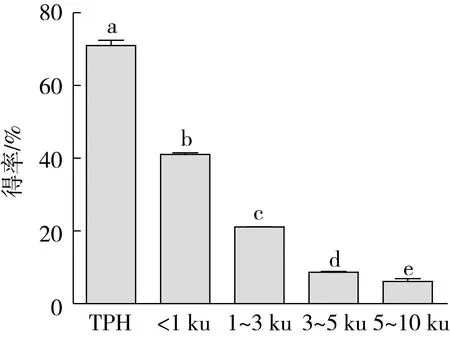
图1 菜籽蛋白水解物及各膜分离组分的得率
2.2 菜籽蛋白水解物及各膜分离组分的氨基酸组成分析
研究认为,肽所含的亲疏水性氨基酸的比例、相对分子质量及肽段中携带的氨基酸的电性或酸碱性等对肽的抗氧化性都有一定的影响[19]。TPH及其膜分离组分的氨基酸组成如表1所示。由表1可知,TPH及不同分子质量的肽都含有较高比例的疏水性氨基酸(HAA),其中>10 ku肽的HAA比例高达52.08%,其余组分所含的HAA也在40%以上。研究发现,疏水性可增强肽与脂类的相互作用,以及与靶器官的疏水性结合,有利于实现其抗氧化作用[20]。此外,TPH的Tyr含量最高,Tyr中的酚羟基可以作为氢供体,有利于提高肽的抗氧化能力[21]。另外,3~5 ku的肽则含有较高的His,His中的咪唑环可以干扰氧化还原反应产生的羟基自由基,还可与单线态氧直接作用[22],其本身就有抗氧化性。因此,His、Tyr、Lys的存在有利于提高肽的抗氧化能力。
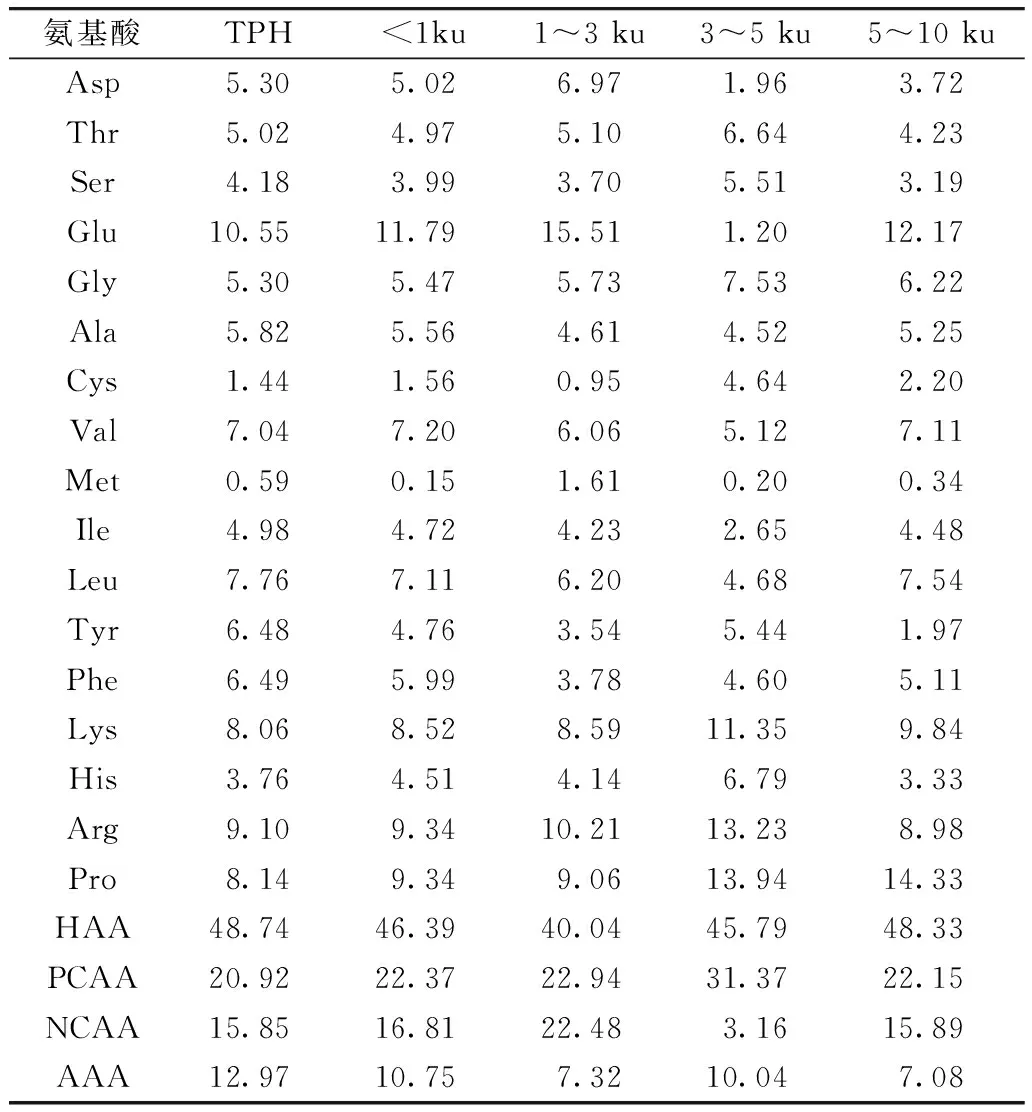
表1 菜籽蛋白嗜热菌蛋白酶水解物(TPH)及其膜分离组分的氨基酸组成
注:疏水性氨基酸(HAA) 为Ala、Val、Ile、Leu、Tyr、Phe、Pro、Met、Cys;带正电荷的氨基酸(PCAA) 为Arg、His、Lys;带负电荷的氨基酸(NCAA) 为Asp、Glu;芳香族氨基酸(AAA) 为Phe、Tyr。
2.3 ACE抑制活性分析
菜籽蛋白水解物及其膜分离组分的血管紧张素转化酶-Ⅰ(ACE)抑制活性如图2所示。由图2可知,<1 ku的肽的ACE抑制活性最高,为87.39%,并随着分子质量增大,ACE抑制活性逐渐降低,其中1~3 ku和3~5 ku组分的ACE抑制率相当,分别为(80.63±0.64)%和78.38%,TPH的ACE抑制率最低,为(70.27±2.50)%。由图2可得,<5 ku的各菜籽肽的ACE抑制活性高于5~10 ku菜籽肽的ACE抑制活性。这与之前的研究结果一致[23],低分子质量的肽具有更高的ACE抑制活性。这可能是因为,低分子质量的肽含有更多的疏水性氨基酸和芳香族氨基酸,而芳香族氨基酸C-末端的环状结构有利于与ACE活性部位的结合,疏水性氨基酸则加强了肽与ACE的亲和力,从而增强了低分子质量菜籽多肽的ACE抑制活性。刘萍[24]和张宁浩[25]对玉米蛋白酶解产物和花生短肽的研究也有相似的结论。
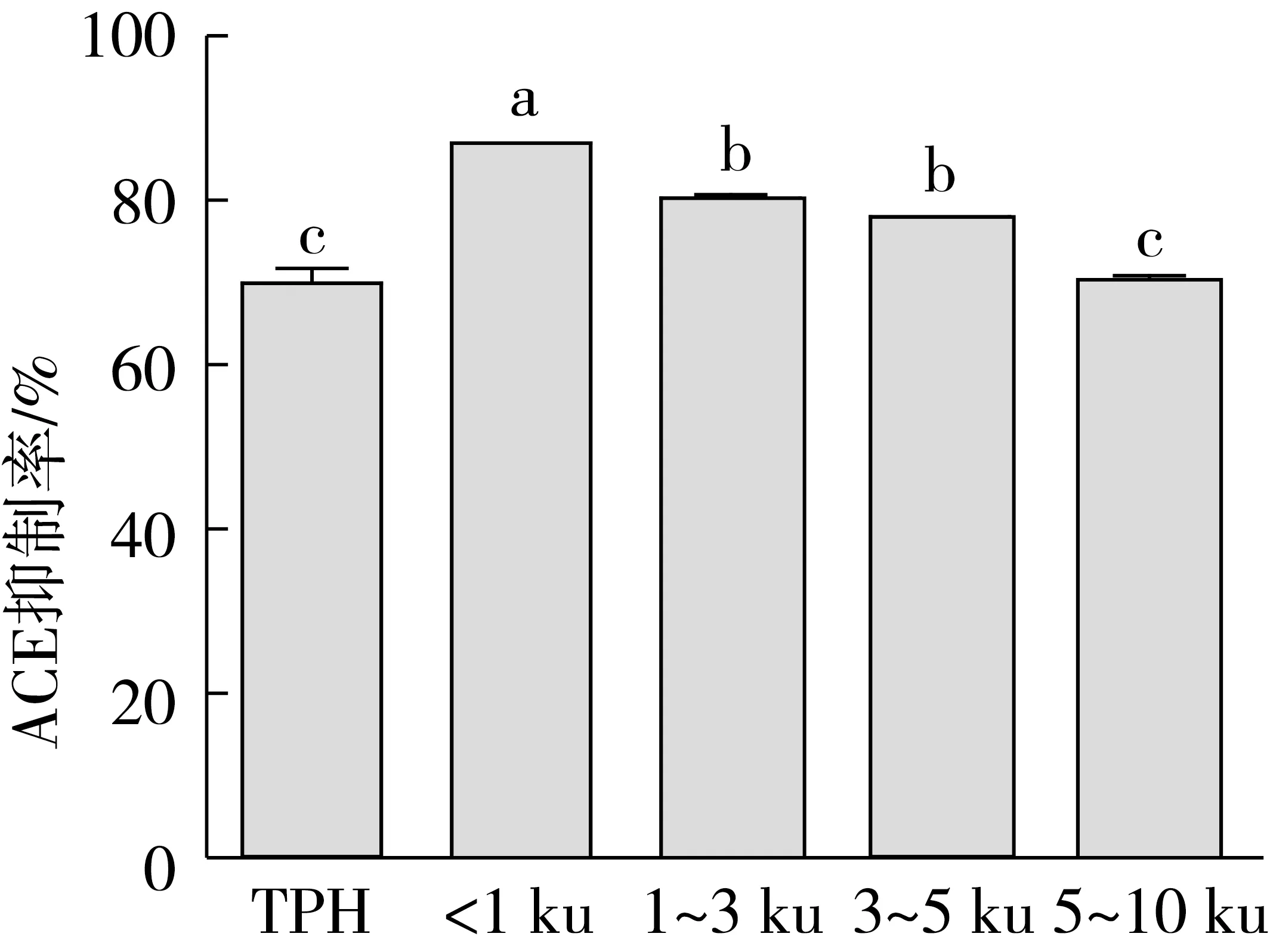
图2 菜籽蛋白水解物及其膜分离组分的血管紧张素转化酶-Ⅰ(ACE)抑制活性
2.4 肾素抑制活性分析
由图3可知,TPH的肾素抑制活性很低,只有(10.32±2.51)%,而<1 ku的组分和1~3 ku组分的肾素抑制活性很高,分别为(78.89±1.24)%和(59.10±2.11)%,随着分子质量的增大,肽的肾素抑制活性逐渐减小。和图2相比得出,低分子质量的肽不仅有较高的ACE活性,还有较高的肾素抑制活性,因此,低分子质量的菜籽肽对ACE和肾素具有双重抑制功能。

图3 菜籽蛋白水解物及其膜分离组分的肾素抑制活力
2.5 抗氧化性分析(ORAC法)
ORAC法是评价食品抗氧化性的标准方法,用于检测抗氧化物质对过氧化自由基的清除能力。菜籽蛋白水解物及其膜分离组分吸附氧自由基能力如图4所示。<1 ku的肽显示出最高的抗氧化活性,为(4 363.53±45.87)μmol TE/g,其次是TPH水解物,为(2 123.42±68.74) μmol TE/g,1~3 ku和3~5 ku的ORAC值与GSH相当,分别为(1 935.98±70.06)μmol TE/g和(1 864.86±24.40)μmol TE/g。当分子质量超过5 ku时,肽的ORAC值明显降低,说明菜籽蛋白水解物的ORAC值与分子质量之间存在着相关性(P<0.05),随着分子质量的增大,ORAC值逐渐减小。与其他相关研究相比,菜籽蛋白具有较高的氧自由基吸附能力。例如,Zhang等[26]研究的大豆蛋白的Alcalase水解物的ORAC值为23~83.3μmol TE/mg蛋白质,Wattanasirit等[27]用胰蛋白酶水解米糠蛋白的水解物的ORAC值为1.096~4.067 μmol TE/mg蛋白质,都显著低于本研究中TPH及各菜籽肽的ORAC值。
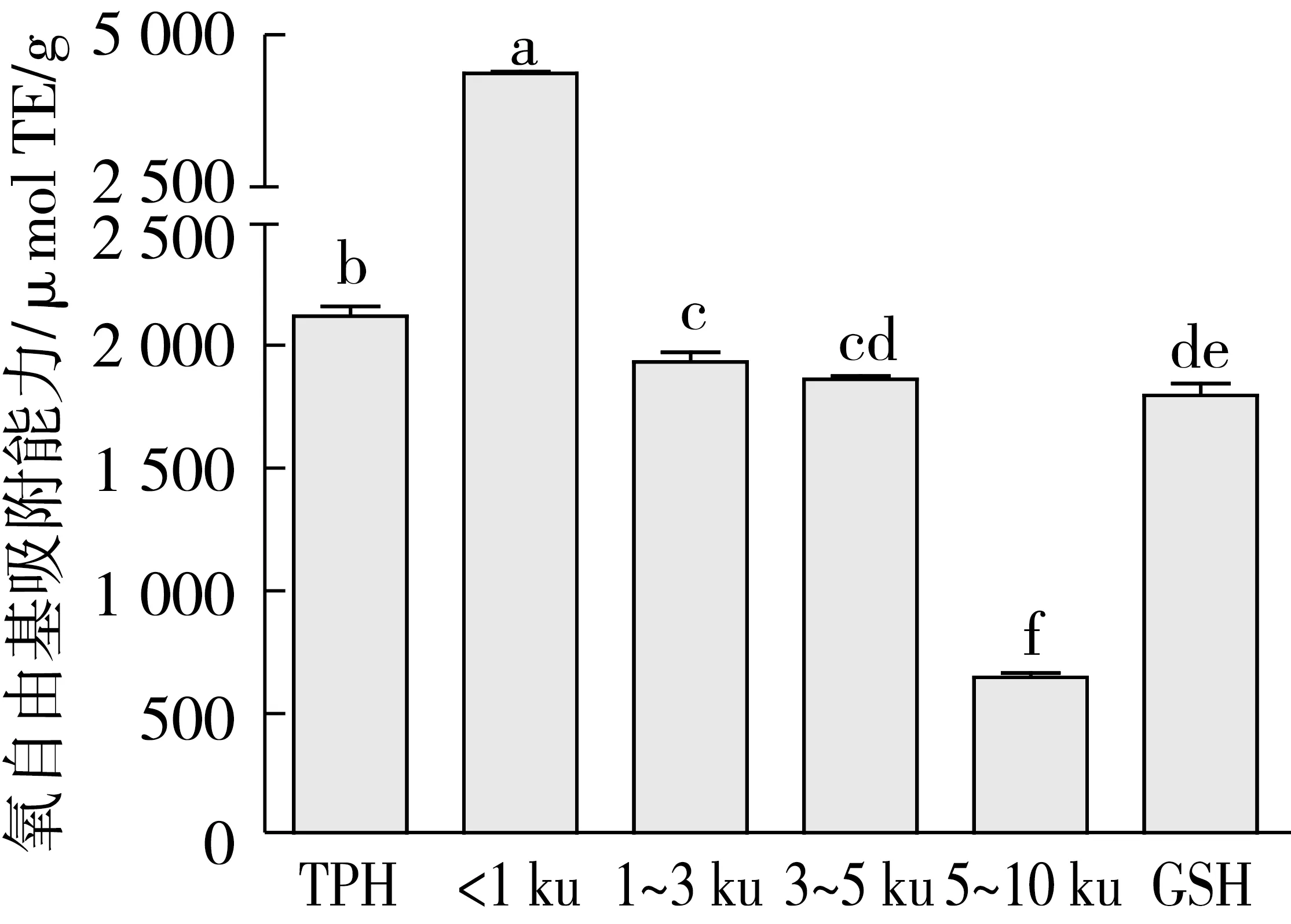
图4 菜籽蛋白水解物及其膜分离组分的氧自由基吸附能力
2.6 细胞毒性分析
本试验配制的样品浓度梯度为50~1 000 mg/L,菜籽蛋白水解物及各分离组分对HepG2细胞的毒性如图5所示。当样品质量浓度在100 mg/L以下时,细胞成活率大都在90%以上,当质量浓度超过600 mg/L时,加有分子质量大于3 ku组分的细胞成活率基本下降到80%以下,当质量浓度增大到1 000 mg/L时,样品各组分都显示了一定的细胞毒性,细胞成活率只有70%左右。因此在后续CAA试验中,以50~600 mg/L的质量浓度范围为依据,作为细胞无毒性的试验剂量。
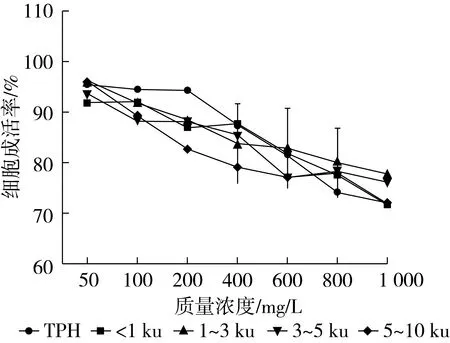
图5 菜籽蛋白水解物及各膜分离组分对细胞的毒性影响
2.7 抗氧化性分析(CAA法)
CAA法比一般的化学抗氧化分析方法更具有生物学意义,它涉及到细胞对抗氧化物质的吸收及细胞的新陈代谢等。CAA的主要原理是,荧光探针DCFH-DA进入细胞后被胞内酯酶水解为DCFH,然后加入自由基引发剂AAPH,AAPH可产生稳定的过氧自由基(ROO·),DCFH可被ROO·氧化生成荧光物质DCF,而抗氧化剂能有效猝灭ROO·。因此,荧光强度越低,说明抗氧化剂能力越强。菜籽蛋白水解物及各膜分离组分的EC50值和CAA值分别如图6、图7所示。其中,TPH组分的EC50值最低,为(134.36±8.67)mg/L,而CAA值最高,为(26.53±1.71)μmol QE/g;5~10 ku组分的EC50值最高,为(289.42±10.52)mg/L,而CAA值最低,为(12.30±0.45)μmol QE/g,说明菜籽蛋白水解物TPH的抗氧化性最高。随着分子质量的增大,各组分的CAA值在逐渐减小,<1 ku的肽的抗氧化性高于其它分子质量肽的抗氧化性,这可能是因为分子质量较小的物质更容易进入到细胞发挥抗氧化能力。陈源[28]在研究不同分子质量的麦麸小分子肽的抗氧化性时,也得出超滤膜透过液的 CAA 值随着超滤膜孔径的增大而减小的结论。

图6 菜籽蛋白水解物及各膜分离组分的EC50值

图7 菜籽蛋白水解物及各膜分离组分的CAA值
3 结论
嗜热菌蛋白酶可以有效水解菜籽蛋白释放其中的抗氧化肽,其水解物中小于1 ku的肽得率高达(40.96±0.60)%,不同分子质量的的肽中都含有40% 以上的疏水性氨基酸,疏水性氨基酸的存在有利于提高肽的抗氧化性;菜籽肽的分子质量与其ACE抑制活性、肾素抑制活性以及氧自由基吸附能力都有明显的正相关性(P<0.05),随着分子质量的增大,其ACE抑制活性与肾素抑制活性都逐渐降低;<1 ku离组分的氧自由基吸附能力(ORAC)远高于菜籽蛋白嗜热菌蛋白酶水解物TPH的,其ORAC值高达(4 363.53±45.87)μmol TE/g,是GSH的2.4倍,其中1~3 ku和3~5 ku 2个组分的ORAC值与GSH相当(P<0.05);体外抗氧化法(ORAC)和细胞内抗氧化法(CAA)的结果表明,4种不同分子质量的肽具有相同的变化规律,<1 ku肽抗氧化活性最高,其余组分的抗氧化性强弱为1~3 ku肽>3~5 ku肽>5~10 ku肽。本试验研究表明,菜籽蛋白水解物及各膜分离组分不仅具有ACE和肾素双重抑制活性,还有一定的抗氧化性,这为菜籽肽在降血压制剂的开发或相关功能性产品的应用上提供了参考。
[1]World Health Organization.Global status report on noncommunicable diseases 2014. Geneva, Switzerland
[2]Daien V, Duny Y, Ribstein J, et al. Treatment of hypertension with renin-angiotensin system inhibitors and renal dysfunction:a systematic review and meta-analysis[J]. American Journal of Hypertension, 2012, 25(1): 126-132
[3]Udenigwe C C, Lin Y S, Hou W C, et al. Kinetics of the inhibition of renin and angiotensin I-converting enzyme by flaxseed protein hydrolysate fractions[J]. Journal of Functional Foods, 2009, 1(2): 199-207
[4]Patricia G M, Juana F, Elena P, et al. Simultaneous release of peptides and phenolics with antioxidant, ACE-inhibitory and anti-inflammatory activities from pinto bean(PhaseolusvulgarisL. var. pinto) proteins by subtilisins[J]. Journal of Functional Foods, 2015, 18: 319-332
[5]朱丽娟. 玉米蛋白水解物体外消化产物的抗氧化ACE抑制活性研究 [D]. 无锡:江南大学,2008 Zhu Lijuan. The Research of in vitro digestion product of corn protein hydrolysates’ antioxidant and ACE Inhibitory Activity [D]. Wuxi: Jiangnan University, 2008
[6]Schwenke K D. Rapeseed proteins[M] //Hudson B J F New and Development Sources of Food Proteins. Chapman&Hall, 1994
[7]郭兴凤,周瑞宝,汤坚,等. 菜籽蛋白的制备[J]. 郑州工程学院学报,2001,3 (22):60 Guo Xingfeng, Zhou Ruibao, Tang jian, et al. The preparation of rapeseed protein [J]. Journal of Zhengzhou Engineering College, 2001, 3 (22): 60
[8]Zhang S B, Wang Z, Xu S Y, et al. Purification and characterization of a radical scavenging peptide from rapeseed protein hydrolysates[J]. Journal of the American Oil Chemists,Society, 2009, 86: 959-966
[9]Xue Z H, Liu Z W, Wu M C, et al. Effect of rapeseed peptide on DNA damage and apoptosis in Hela cells[J]. Experimental and Toxicologic Pathology, 2010, 62(5): 519-523
[10]He R, Girgih A T, Malomo S A, et al. Antioxidant activities of enzymatic rapeseed protein hydrolysates and the membrane ultrafiltration fractions[J]. Journal of Functional Foods, 2013, 5(1) : 219-227
[11]Markwell M A K, Haas S M, Bieber L, et al. A modification of the Lowry procedure to simplify protein determination in membrane and lipoprotein samples[J]. Analytical biochemistry, 1978, 87(1): 206-210
[12]Holmquist B, Bünning P, Riordant J F. A continuous spectrophotometric assay for angiotensin converting enzyme[J]. Analytical biochemistry, 1979, 95(2): 540-548
[13]You S J, Udenigwe C C, Aluko R E, et al. Multifunctional peptides from egg white lysozyme [J].Food Research International, 2010, 43(3): 848-855
[14]王立峰,王玉梅,鞠兴荣,等. 菜籽蛋白水解物体外和细胞内抗氧化性评价及氨基酸分析研究[J]. 食品科学,2014,13:49-53 Wang Lifeng, Wang Yumei, Ju Xingrong, et al. In vitro and cellular antioxidant activity evaluation and amino acid analysis of rapeseed protein hydrolysates [J]. Food Science, 2014, 13:49-53
[15]Wolfe K L, Liu R H. Cellular antioxidant activity (CAA) assay for assessing antioxidants,foods, and dietary supplements[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22):8896-8907
[16]Song W, Derito C M, Liu R H, et al. Cellular antioxidant activity of common vegetables[J]. Journal of Agricultural and Food Chemistry, 2010, 58(11): 6621-6629
[17]Pena-Ramos E A, Xiong Y L. Antioxidative activity of soy protein hydrolysates in aliposomal system[J]. Food Science, 2002(67): 2952-2956
[18]Wu H C, Chen H M, Shiau C Y. Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomberaustriasicus)[J]. Food Research International, 2003, 36(9): 949-957
[19]陈洁, 胡晓赟. 蛋白水解物的抗氧化性研究与展望[J]. 中国食品学报,2011,9:111-119 Chen Jie, Hu Xiaoyun. Antioxidant activity research and prospect of protein hydrolysates[J]. Journal of Chinese Food, 2011, 9: 111-119
[20]Samaranayaka A G P, Eunice C Y,Lic. Food-derived peptidic antioxidants: a review of their production, assessment, and potential applications[J]. Journal of Functional Foods, 2011, 3(4): 229-254
[21]Pihlanto A. Antioxidative peptides derived from milk proteins[J].International Dairy Journal, 2006, 16(11): 1306-1314
[22]Wade A M, Tucker H N. Antioxidant characteristics of L-histidine[J].The Journal of Nutritional Biochemistry, 1998, 9(6): 308-315
[23]He R, Abraham T G, Sunday A, et al. Antioxidant activities of enzymatic rapeseed protein hydrolysates and the membrane ultrafiltration fractions[J]. Journal of Functional Foods, 2013, 5(1): 219-227
[24]刘萍. 酶解玉米蛋白提取ACE抑制肽的研究 [D]. 无锡:江南大学,2006 Liu Ping. The Research of enzymatic hydrolysis of corn protein and extraction of ACE inhibitory peptides [D]. Wuxi: Jiangnan University, 2006
[25]张宇昊. 花生短肽制备及其功能活性研究 [D]. 北京:中国农业科学院,2007 Zhang Yuhao. The research of preparation and functional activities of short peanut peptides [D]. Beijing: Chinese Academy of Agricultural Science, 2007
[26]Zhang Lei, Li Jianrong, Zhou Kequn. Chelating and radical scavenging activities of soy protein hydrolysates prepared from microbial proteases and their effect on meat lipid peroxidation[J]. Bioresource Technology, 2010, 101(7): 2084-2089
[27]Wattanasiritham L, Theerakulkait C, Wickramasekara S, et al. Isolation and identification of antioxidant peptides from enzymatically hydrolyzedrice bran protein[J]. Food Chemistry, 2016, 192: 156-162
[28]陈源. 酶膜耦连制备麦麸小分子肽及其抗氧化活性研究 [D]. 乌鲁木齐: 新疆农业大学,2014 Chen Yuan.Study on antioxidant activity of low-molecular weight peptides from wheat bran by enzymatic membrance reactor[D].Wulumuqi:Xinjiang Agricultwal University,2014.
Research of Rapeseed Peptides′ ACE, Renin Inhibition and Antioxidant Activity
Wang Fengzhang Yang Yijie He Rong Ju Xingrong Yuan Jian
(College of Food Science and Engineering; Key Laboratory of Grains and Oils Quality Safety Control and Further Processing of Jiangsu Province,Nanjing University of Finaces & Economics, Nanjing 210023)
This paper studied the ACE-I inhibition activity, renin inhibition activity, ORAC and CAA of rapeseed peptides with four different molecular masses obtained from TPH of rapeseed protein seperated by membrane ultrafiltration of 1,3,5,10 ku. The results showed that there was a significant positive correlation (P<0.05) between molecular masse of rapeseed and its ACE-I inhibition activity, renin inhibition activity as well as ORAC. The ORAC value of rapeseed peptides <1 ku was (4 363.53±45.87) μmol TE/g, much higher than that of TPHs and 2.4 times of GSH. The ORAC values of two rapeseed peptides were equal to that of GSH (P<0.05). Cellular antioxidant experiment showed that CAA value (26.53±1.71)μmol QE/g of TPH is the highest, followed by <1 ku component with the CAA value being (23.91±0.69) μmol QE/g. It was concluded that rapeseed protein hydrolysates and rapeseed peptides had ACE and dual inhibitory activity of renin and also had certain absorptive capacity of oxygen free radicals. So rapeseed protein could be used to develop natural blood pressure-lowering agents or other related functional products.
rapeseed protein, membrane separation, ACE-inhibitory activity, renin inhibitory activity, antioxidant activity
国家自然科学基金(31501522,31571767),江苏省高校自然科学基金(14KJB550003),南京市农业科技攻关计划(2015SA213018)
2015-11-20
王凤章,女,1993年出生,硕士,粮食、油脂及植物蛋白质工程
何荣,男,1983年出生,讲师,食品营养 鞠兴荣,男,1957年出生,教授,博士生导师,食品营养、功能食品及农产品深加工
Q514
A
1003-0174(2017)05-0050-07
