基于电子鼻技术的糙米黄曲霉毒素污染快速检测方法研究
2017-07-19吴启芳姜大峰魏颖琪唐培安
沈 飞 吴启芳 姜大峰 魏颖琪唐培安 刘 兵 宋 伟
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心;江苏高校粮油质量安全控制及深加工重点实验室1,南京 210023) (山东省疾病预防控制中心2,济南 250014)
基于电子鼻技术的糙米黄曲霉毒素污染快速检测方法研究
沈 飞1吴启芳1姜大峰2魏颖琪1唐培安1刘 兵1宋 伟1
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心;江苏高校粮油质量安全控制及深加工重点实验室1,南京 210023) (山东省疾病预防控制中心2,济南 250014)
为验证电子鼻技术用于粮食真菌毒素污染快速检测的可行性,本研究利用Fox3000型电子鼻对受黄曲霉毒素侵染的糙米样品的挥发性物质进行了检测分析,建立了电子鼻响应信号与黄曲霉毒素水平的相关关系模型。结果显示,偏最小二乘判别分析(PLS-DA)法可较好区分不同黄曲霉毒素含量水平的糙米样品,模型的留一交互验证正确率高于80%。PLS回归分析显示电子鼻响应信号与糙米中黄曲霉毒素B1、B2、G1、G2及总量之间呈现较高相关性,其中对黄曲霉毒素B1的预测精度最高,预测相关系数和均方根误差分别达到0.808和127.3 μg/kg。进一步,通过对电子鼻各气体传感器响应信号的载荷分析确定了各传感器贡献率的差异,结合气相色谱-质谱联用(GC-MS)技术揭示了受黄曲霉毒素污染糙米样品的挥发性组分的变化主要体现在酮醛类、醇类、芳香烃类和烷烃类上。结果表明,利用电子鼻对糙米的黄曲霉毒素污染的快速检测具有一定可行性,为粮食真菌毒素污染的早期预警提供一种新思路和新方法。
糙米 黄曲霉毒素 电子鼻 快速检测 偏最小二乘回归
黄曲霉毒素(aflatoxin,AF)是由黄曲霉(A.flavus)、寄生曲霉(A.parasiticus)和模式曲霉(A.nomius)等真菌产生的次生代谢产物,具有强致畸、致癌和致突变特性,广泛分布于霉变的稻谷、玉米、花生等粮食及相关食品中[1]。谷物中常见的AF有B1、B2、G1和G2等4种形式,其中,以AFB1毒性最强,1993年被国际癌症研究组织(IARC)划定为Ⅰ类致癌物[2]。据联合国粮农组织统计,全球每年约25%的粮食因监管不当发生霉变,甚至侵染真菌毒素,不仅造成巨额经济损失,且严重威胁人畜健康[3]。目前,AF检测方法主要有薄层色谱法(TLC)[4]、高效液相色谱法(HPLC)[5]、液相色谱-质谱联用法(LC-MS)[6]、酶联免疫法(ELISA)[7]等,然而,上述方法或者操作繁琐、成本高,或者灵敏度低、准确性差,难以实现快速检测。因此,发展一种快速、准确的AF检测方法,对确保粮食质量与安全具有重要意义。
电子鼻作为一种快速、无损的气味检测手段,已广泛用于果蔬[8]、肉禽[9]、茶酒[10]和油脂[11]等各类食品质量检测中。近年来,越来越多的学者报道了电子鼻技术在粮食品种及品质[12]、虫害[13]、新鲜度[14]和霉变程度[15]等检测中的应用,且对谷物真菌毒素污染的检测研究已有少量报道。Lippolis等[16]采用电子鼻进行侵染不同水平脱氧雪腐镰刀菌烯醇(DON)硬质小麦的检测,完整颗粒与粉碎后样品判别模型的判别正确率分别为69.3%和86.7%。Olsson等[17]采用电子鼻检测大麦中DON的含量水平,PLS模型预测均方根误差为25 μg/kg。Abramson等[18]对20%含水量的小麦中的赭曲霉毒素和黄绿青霉毒素进行了分析,结果显示,电子鼻传感器响应值与这2种毒素含量的相关系数分别为0.87和0.83。
然而,利用电子鼻技术检测粮食真菌毒素污染还处于探索阶段,且研究对象多集中在麦类、玉米和花生等,对稻米的研究较少。因此,本试验拟采用电子鼻检测侵染AF糙米样品的气味信息,结合多元统计分析方法建立糙米AF含量的定性及定量分析模型,研究基于气味信息进行侵染AF糙米检测的可行性,为建立粮食真菌毒素污染的早期、实时监测及预警系统提供一种新方法。
1 材料与方法
1.1 试验材料
糙米样品采自黑龙江省(2014年收获),密封,4 ℃冷藏待用;2种产AF标准菌株:黄曲霉3.17和寄生曲霉3.395,均购于中国北京北纳创联研究院,适宜条件下(28 ℃、85% RH)活化后,-18 ℃冷藏;黄曲霉毒素B1、B2、G1、G2混标:美国Sigma公司。
1.2 样品制备与分析
1.2.1 霉菌培养与接种
首先,将黄曲霉和寄生曲霉置于高盐察氏培养基上,在28 ℃、85% RH条件下培养7 d,采用无菌水冲洗培养基表面,参照GB 4789.3—2010,采用平板计数法分别测定2种霉菌孢子悬浮液的浓度,并调整至约6.0×106CFU/mL。其次,将经钴-60(12kGy)辐照灭菌的糙米样品以250 g/份分装为16份。其中8份喷洒接种寄生曲霉3.395,另8份接种黄曲霉3.17,平板计数确定接种浓度,约为1.02×105CFU/g。然后,将所有样品置于28 ℃、85% RH条件下储藏30 d后取样分析。
1.2.2 HPLC检测
参照GB/T 5009.23—2006,采用HPLC法测定样品中AF含量。步骤简述如下:准确称取50 g粉碎后的糙米样品,加入200 mL乙腈-水(84/16)振荡提取30 min。取8 mL提取液至MycoSepTM226多功能柱过滤,取滤液2 mL于50 ℃下N2吹干。然后,加入200 μL正己烷和100 μL三氟乙酸,于40 ℃下衍生反应15 min。室温下干燥后,加入1 mL乙腈/水(15/85)复溶,过0.45 μm滤膜,装瓶进行测定。检测器:荧光检测器,激发波长360 nm,发射波长440 nm。进样体积和流速分别为10 μL、1.0 mL/min。每份样品重复测定3次,取平均值进行分析,外标法定量。
1.2.3 AF梯度浓度样品准备
HPLC检测结果显示空白样品中未检出AF,而16份接种霉菌样品中AF含量均偏高。因此,为得到更具代表性和AF浓度范围分布较广的样品,首先,分别将空白和侵染AF样品磨粉,过筛(粒径<40目)。然后,准确称取含AF样品10 g,按照1∶2、1∶4、1∶6、1∶8、1∶10、1∶12、1∶14(m/m)7个质量比例分别掺入空白样品,共计得到AF的含量范围为0~2 406.40 μg/kg的糙米样品128份(16份空白+16×7份AF侵染样品)。
1.3 电子鼻检测试验
称取3 g样品,转移至20 mL顶空瓶中,密封,进行电子鼻(α Fox3000,法国)检测。参数条件如下:采用顶空自动进样方式,平衡温度和时间分别为60 ℃、120 s;采样体积、频次和速度分别为1 mL、1次/s、1 mL/s;载气流速为150 mL/min;检测时间为60 s。采用仪器自带软件收集每份样品所对应的12个传感器(表1)的响应信号,提取每个传感器响应信号的最大特征值。每份样品测定2次,取平均值进行分析。

表1 Fox 3000型电子鼻12个传感器的检测范围
1.4 GC-MS检测试验
称取15 g样品,置于100 mL顶空瓶中,于60 ℃水浴平衡50 min,插入50 μm-PDMS/DVB/CAR固相微萃取头(美国Supelco公司)萃取1 h,采用GC(7890A)-MS(5975C) 气质联用分析仪(美国安捷伦公司)进行检测,解析时间为5 min。参数条件:色谱柱为HP-5MS毛细管柱(30 m×0.25 mm,0.25 μm);载气为N2,流速为24.00 mL/min;AUX-2温度为280 ℃;离子源为EI,温度为230 ℃;电子能量70 eV;采集模式为全扫描。通过与计算机中NIST08标准质谱库匹配实现样品中未知挥发性组分的定性分析,仅采用匹配度大于80(最大值为100)的挥发性物质。
1.5 数据分析
采用MATLABv8.4和SPSSv16.0 软件对传感器响应信号进行处理。采用偏最小二乘判别分析(PLS-DA)、线性判别分析(LDA)和支持向量机判别分析(SVM-DA)建立判别模型,运用留一交互验证法对模型进行验证。采用PLS法建立AF含量预测分析模型,以建模集/验证集相关系数(rc/rv)、模型均方根误差(RMSEC)、交互验证均方根误差(RMSECV)、预测均方根误差(RMSEP)和相对分析误差(RPD)作为评价模型性能的指标,r、RPD值越大,RMSEC、RMSECV和RMSEP值越小,模型性能越好。
2 结果与分析
2.1 糙米样品的电子鼻信号响应分析
图1为受AF感染糙米样品的电子鼻传感器响应信号随时间变化的曲线图,曲线上的点表示挥发性成分进入电子鼻系统时各个传感器相对电导率(G/G0)随检测时间的变化情况。观察可知,初始测定阶段各传感器相对电导率变化速率大,在10~20 s间,12个传感器均达到最大响应值,20 s后逐渐趋于平缓。其中,P10/1、P10/2和P40/1的相对电导率变化最大,其次为T30/1、PA/2和T70/2,P型传感器的变化最小。结果表明,电子鼻对糙米样品的挥发性气味成分有明显响应,且不同传感器对其响应灵敏度存在差异。结合各传感器的检测范围初步确定霉变糙米产生较多的烷烃类、醇类和芳香类化合物,从而引起特征传感器响应值产生显著变化,而胺类、硫化物及氧化性类气体成分较少,其响应值相对较弱[19]。

图1 糙米样品的传感器响应信号图
2.2 电子鼻信号载荷分析
图2为128份糙米样品电子鼻传感器响应信号的载荷分析图。其中,第一和第二主成分的总贡献率为90.63%,表明其在样品分析中发挥主要作用。由图2可知,各个传感器贡献率存在显著差异。其中,LY2/GH、LY2/LG、LY2/G、LY2/gCTL和LY/gCT这5个传感器的分布位置与(0,0)接近,且较为集中,说明其对糙米响应信号的差异较小,其贡献率较低,可能与样品中含较少的胺类,硫化物及氧化性气体有关。P10/2、P40/1、P10/1的权重最高,T70/2、PA/2和T30/1次之,表明样品受霉菌感染后产生较多的烷烃类、醇类和芳香烃类气体,从而引起传感器信号变化,并在后续分析中起到主导作用。
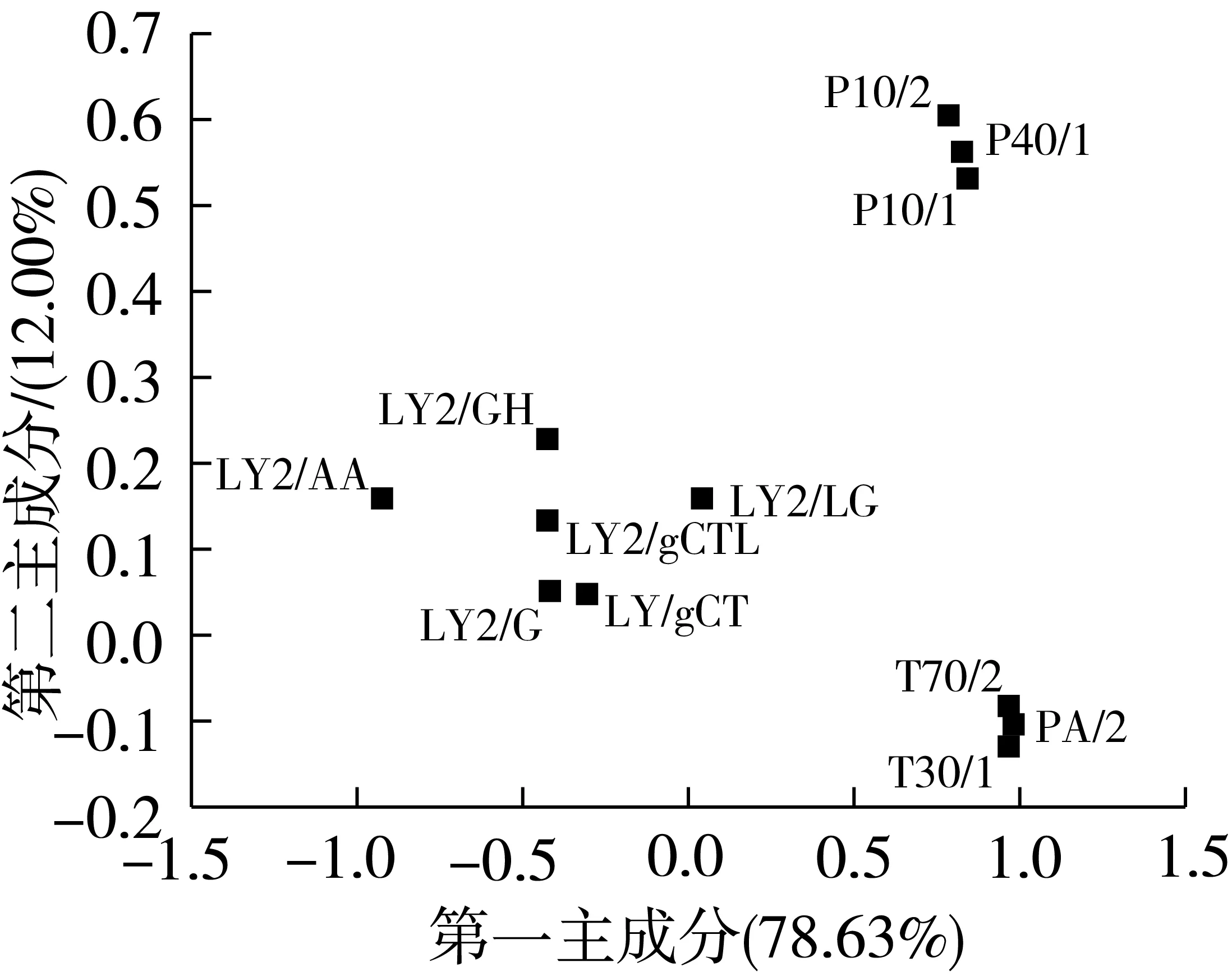
图2 糙米样品电子鼻传感器响应信号的载荷分析图
2.3 糙米挥发性组分结果分析
采用GC-MS分别测定了空白组、侵染黄曲霉组和侵染寄生曲霉组样品(每组5个代表性样品),结果显示3组样品的挥发性成分中以烷烃类最多,其次为酸酯类、烯类和醛类,而醇类、酮类和芳香烃类相对较少,结果验证了传感器P10/1、P10/2和P40/1的响应信号最强。对比空白组与侵染霉菌组,发现挥发性物质的种类存在明显差异,其中,1-辛烯-3-醇、3-辛醇、1-丁醇、3-甲基-1-丁醇、3-辛酮、乙醛、2-十二烯醛、2-壬烯醛和2-甲基-呋喃等仅在侵染霉菌组中检出,空白样品中未检出,与前人研究结果一致[20],说明此类物质与霉菌代谢活动存在密切联系。依据特征气体的类型,发现上述物质主要与传感器P10/1、PA/2、T30/1、T70/2和LY2/AA的响应密切相关,同载荷分析结果相对应,为电子鼻检测霉变糙米的挥发性组分提供了理论依据。进一步分析发现,2种霉菌所产生的挥发性组分存在一定差异,其中二甲基苯和呋喃酮只在黄曲霉组中检出,而2-庚烯醛和丁基十四烷基酯则只在寄生曲霉组中测出,表明利用挥发性成分区分不同的霉菌感染具有一定可行性。然而,由于样品霉变产生大量挥发性成分,组成十分复杂,不仅包含次级代谢产物的气味信息,也包含初级代谢产物的信息,且本研究中所使用的霉菌种类较少,因此与有害霉菌以及黄曲霉毒素密切相关的指示性气体的确定还需进一步研究。
2.4 糙米样品中AF水平判别分析结果
参考欧盟对食品中AF的限量标准,将样品划分为3组,如表2所示。提取糙米样品传感器响应信号的前10个主成分,采用留一交互验证法,建立偏最小二乘判别分析(PLS-DA)、线性判别分析(LDA)和支持向量机判别分析(SVM-DA)模型,判别结果如表3所示。在PLS-DA中,AFB1、B2、G1、G2和AFs建模集的整体判别正确率均大于85.0%。验证集中,AFG1和G2模型的判别正确率最高,为82.7%和82.4%,AFB1、B2和AFs的正确率略有下降,但均高于80.0%,显示出一定的区分效果。与PLS-DA结果相比,LDA模型的判别正确率稍低,其中,建模集的判别正确率均大于80.0%,但验证集误判率偏高。SVM-DA模型的结果不佳。图3为AFB1的判别函数得分图(其他黄曲霉毒素的判别函数图类似)。观察可知,3组样品间存在一定的整体分离趋势,但是部分样品存在重叠,与模型判别结果一致。判别分析结果表明,利用电子鼻技术快速区分不同AF含量的糙米样品具有一定可行性,但模型精度有待进一步提升。

表2 糙米样品AF分组情况统计结果/μg/kg

表3 侵染不同AF浓度糙米样品判别分析结果

图3 糙米样品中AFB1含量的判别函数得分图
2.5 糙米样品中AF水平定量分析结果
表4为128份糙米样品中AFB1、B2、G1、G2和AFs含量的统计结果。由表4可知,AFs含量范围覆盖广,包含多数农产品/食品侵染AF的水平,有利于模型的建立。为确保样本选取的随机性和代表性,采用Kennard-stone(KS)算法[21]选取86个样品作为建模集(86),其余42个样品作为验证集(42)。采用PLS方法建立电子鼻响应信号值与AF含量的定量分析模型,结果见表5。建模集中,AFB1、B2、G1、G2和AFs模型的rc均大于0.80,其中AFB1和B2的相关系数最高,分别为0.871和0.860,其次为AFs,AFG1和G2的稍低。由于AFB1、B2、G1、G2和AFs含量覆盖范围不同,导致不同模型间RMSEC和RMSECV值差异较大[22]。验证集中,AFB1模型的预测精度最高,rv=0.808,RMSEP=127.3 μg/kg。AFB2、G1和AFs模型的rv均大于0.74,预测精度略低。AFG2模型的精度最低,rv和RMSEP分别为0.715、14.0 μg/kg。总体而言,各分析模型的RPD值普遍不高,定量精度较差。但各模型的RPD值均达到或接近1.5,有一定定性分析潜力,可用于样品污染状况的初步筛选[23]。模型精度不佳的主要原因在于样品中AF含量极低,其特征挥发性成分也十分复杂,且受到样品预处理步骤和样品中其他气味成分的干扰,因此造成电子鼻传感器信号噪音较大。进一步应该改善样品预处理措施,优化传感器特征信号提取手段和建模算法,来提高模型精度,进一步提升模型的稳健性和适用性。

表4 糙米中AF含量统计结果/μg/kg

表5 糙米中AF的PLS模型的建模及验证结果
3 结论
载荷分析及GC-MS结果显示酮醛类、醇类、芳香烃类及烷烃类物质对侵染AF糙米的检测分析具有重要作用,但与AF密切相关的指示性气味的鉴定还需进一步研究。PLS-DA可较好的区分侵染不同AF水平的糙米。多元回归分析结果显示电子鼻信号与AFB1、B2、G1、G2和AFs的含量有紧密相关性,其中PLS对AFB1的预测精度最高(rv=0.808,RMSEP=127.3 μg/kg)。初步研究表明,利用电子鼻进行侵染AF糙米的检测具有一定潜力,但离实际应用仍有一定距离。后续研究将进一步扩大样品数量和种类,如采用自然侵染AF样品,并优化分析步骤来提升模型性能,为粮食真菌毒素污染的早期监测与预警提供一种新方法。
[1]罗自生,秦雨,徐艳群,等. 黄曲霉毒素的生物合成、代谢和毒性研究进展[J]. 食品科学,2015,36(3):250-257 Luo Z S, Qin Y, Xu Y Q, et al. Recent progress in the biosynthesis, metabolism and toxicity of aflatoxins[J]. Food Science, 2015, 36(3): 250-257
[2]李娟娟,索德成,苏晓鸥. 3种吸附剂对黄曲霉毒素B1吸附能力的研究[J]. 中国农业科学,2009,42(11):4027-4034 Li J J, Suo D C, Su X O. Binding assay for aflatoxin B1by 3 absorbents[J]. Scientia Agricultura Sinica, 2009, 42(11): 4027-4034
[3]Zhang D H, Li P W, Zhang Q, et al. Production of ultrasensitive generic monoclonal antibodies against major aflatoxins using a modified two-step screening procedure[J]. Analytica Chimica Acta, 2009, 636(1): 63-69
[4]Braicu C, Puia C, Bodokii E, et al. Screening and quantification of aflatoxins and ochratoxin A in different cereals cultivated in Romania using thin-layer chromatography densitometry[J]. Journal of Food Quality, 2008, 31(1): 108-120
[5]Golge O, Hepsag F, Kabak B.Determination of aflatoxins in walnut sujuk and Turkish delightby HPLC-FLD method[J]. Food Control, 2016, 59:731-736
[6]Solfrizzo M, Gambacorta L, Lattanzio V M T, et al. Simultaneous LC-MS/MS determination of aflatoxin M1, ochratoxin A, deoxynivalenol, de-epoxydeoxynivalenol, α and β-zearalenols and fumonisin B1 in urine as a multi-biomarker method to assess exposure to mycotoxins[J]. 2011, 401(9):2831-2841
[7]Beley M A J, Teves F G, Madamba M R S B.Isolation of fungal species and detection of aflatoxin from soy milk products using ELISA method[J]. International Research Journal of Biological Sciences, 2013, 2(5):45-48
[8]Hui G H, Wu Y L, Ye D D, et al. Fuji apple storage time predictive method using electronic nose[J]. Food Analytical Methods, 2013, 6(1):82-88
[9]Papadopoulou O S, Panagou E Z, Mohareb F R, et al. Sensory and microbiological quality assessment of beef fillets using a portable electronic nose in tandem with support vector machine analysis[J]. Food Research Internation, 2013, 50(1):241-249
[10]Banerjee R, Tudu B, Shaw L, et al. Instrumental testing of tea by combining the responses of electronic nose and tongue[J]. Journal of Food Engineering, 2012, 110(3):356-363
[11]Pacioni G, Cerretani L, Procida G, et al. Composition of commercial truffle flavored oils with GC-MS analysis and discrimination with an electronic nose[J]. Food Chemistry, 2014, 146:30-35
[12]席志勇,王凤花. 谷物品质无损检测方法的研究进展[J]. 食品工业科技,2012(15):394-400 Xi Z Y, Wang F H. Research progress in grain quality non-destructive testing methods[J]. Science and Technology of Food Industry, 2012(15): 394-400
[13]胡丽华,郭敏,张景虎,等. 储粮害虫检测新技术及应用现状[J]. 农业工程学报,2007,23(11):286-290 Hu L H, Guo M, Zhang J H, et al. New detection technology and application status of stored-grain in insects[J]. Transactions of the Chinese Society of Agricultural Engineering, 2007, 23(11): 286-290
[14]任广跃,李秀娟,尹君,等. 稻米品质检测技术研究进展及展望[J]. 中国粮油学报,2014,29(2):115-128 Ren G Y, Li X J, Yin J, et al. The research progress of ricinoleate biosynthetic pathways and key enzymes[J]. Journal of the Chinese Cereals and Oils Association, 2014, 29(2): 115-128
[15]胡桂仙,王建军,王小骊,等. 粮油品质检测评价新技术的研究进展及展望[J]. 中国粮油学报,2011,26(3):110-118 Hu G X, Wang J J, Wang X L, et al. Study progress and prospects for technology of detection for quality evaluation in cereal and oil[J]. Journal of the Chinese Cereals and Oils Association, 2011, 26(3): 110-118
[16]Lippolis V, Pascale M, Cervellieri S, et al. Screening of deoxynivalenol contamination in durum wheat by MOS-based electronic nose and identification of the relevant pattern of volatile compounds[J]. Food Control, 2014, 37:263-271[17]Olsson J, Börjessonb T, Lundstedtc T, et al. Detection and quantification of ochratoxin A and deoxynivalenol in barley grains by GC-MS and electronic nose[J]. International Journal of Food Microbiology, 2002, 72(3): 203-214
[18]Abramson D, Hulasare R, York R K, et al. Mycotoxins, ergosterol, and odor volatiles in durum wheat during granary storage at 16% and 20% moisture content[J]. Journal of Stored ProductsResearch, 2005, 41(1): 67-76
[19]Wang M M, Du J S, Zhao M T, et al. Paddy and maize moldy status characterization using electronic nose[J]. Journal of Food Measurement and Characterization, 2014, 8(1): 54-60
[20]Magan N, Evans P. Volatiles as an indicator of fungal activity and differentiation between species, and the potential use of electronic nose technology for early detection of grain spoilage[J]. Journal of Stored Products Research, 2000, 36: 319-340
[21]Costa G B D, Fernandes D D S, Gomes A A, et al. Using near infrared spectroscopy to classify soybean oil according to expiration date[J]. Food Chemistry, 2016, 196: 539-543
[22]Yu H Y, Ying Y B, Fu X P, et al. Quality determination of Chinese rice wine based on Fourier transform near infrared spectroscopy[J]. Journal of Near Infrared Spectroscopy, 2006, 14(1): 37-44
[23]Chang C W, Laird, David A, et al. Near-infrared reflectance spectroscopy-principal components regression analyses of soil properties[J]. Soil Science Society of America Journal, 2001, 65(2): 480-490.
Rapid Detection of Aflatoxin Contamination in Brown Rice Based on Electronic Nose Technology
Shen Fei1Wu Qifang1Jiang Dafeng2Wei Yingqi1
Tang Peian1Liu Bing1Song Wei1
(College of Food Science and Engineering; Collaborative Innovation Center for Modern Grain Circulation and Safety; Key Laboratory of Grains and Oils Quality Control and Processing, Nanjing University of Finance and Economics1, Nanjing 210023) (Shandong Center for Disease Control and Prevention2, Jin′an 250014)
In order to explore the feasibility use of electronic nose (E-nose) for mycotoxin contamination detection in grain, the analysis for volatile compounds of brown rice contaminated with aflatoxin was carried out using a Fox 3000 E-nose system. The corresponding correlation models between aflatoxin levels in brown rice and the responses of E-nose signals were established. The results showed that samples contaminated with different levels of aflatoxin could be distinguished by partial least square-discriminant analysis (PLS-DA) algorithm, and the overall correct classification rate in leave-one-out cross validation was over 80%. In addition, good calibration statistics were obtained for the prediction of aflatoxin B1, B2, G1, G2and total aflatoxins in samples by PLS regression analysis. The best result was obtained for aflatoxin B1. The correlation coefficient and root-mean-square error of prediction obtained was 0.808 and 127.3 μg/kg, respectively. Further, the contribution rate of E-nose sensors was revealed by loadings analysis. Gas chromatography-mass spectroscopy (GC-MS) indicated that the changes in volatile compounds of aflatoxin-contamination samples could be mainly attributed to ketones, aldehydes, alcohols, aromatics and alkanes. Overall, the results demonstrated that E-nose offered the feasibility as a rapid tool for the screening of aflatoxin-contamination in brown rice. This methodology provided a new idea and approach for early detection of mycotoxin contamination in grain.
brown rice, aflatoxin, electronic nose, rapid detection, PLS regression
国家自然科学基金青年基金(31301482),江苏省自然科学基金青年基金(BK20131007),江苏省高校自然科学研究基金(13KJB550009), 江苏高校优势学科建设工程(JSYXK201403)
2015-11-24
沈飞,男,1984年出生,副教授,粮食储藏和检测技术研究
TS272.7;O657.3
A
1003-0174(2017)06-0146-06
