卵裂期与囊胚期胚胎移植妊娠安全性和出生性别比的比较
2017-07-18刘玲许蓬杨逸尘王欢李伟任海琴
刘玲,许蓬,杨逸尘,王欢,李伟,任海琴
(辽宁省沈阳东方医疗集团菁华医院,沈阳 110005)
卵裂期与囊胚期胚胎移植妊娠安全性和出生性别比的比较
刘玲,许蓬,杨逸尘,王欢,李伟,任海琴*
(辽宁省沈阳东方医疗集团菁华医院,沈阳 110005)
目的 探讨卵裂期和囊胚期胚胎移植对妊娠安全性及出生性别比的影响。 方法 回顾性分析2012年8月至2015年8月在我院行助孕治疗的19 684个周期的临床资料,根据胚胎移植时间及方式的不同进行分组:卵裂期胚胎移植组(D3组,13 968个周期)和囊胚移植组(D5组,5 716个周期),D3组又分为D3鲜胚组(13 566个周期)和D3冻胚组(402个周期);D5组分为D5鲜胚组(153个周期)和D5冻胚组(5 563个周期)。分别比较各组的妊娠结局及出生男/女性别比情况。 结果 D3组的移植胚胎数显著高于D5组(P<0.05),但临床妊娠率、胚胎种植率、活产率均显著低于D5组(P<0.05),出生男/女性别比亦显著低于D5组(P<0.05),多胎率、流产率、早产率、围生儿死亡率和低出生体重儿率则显著高于D5组(P均<0.05);D3鲜胚组的胚胎种植率显著低于D5鲜胚组(P<0.05),多胎率、流产率、早产率和低出生体重儿率显著高于D5鲜胚组(P均<0.05);D3冻胚组的临床妊娠率、胚胎种植率、剖宫产率和活产率显著低于D5冻胚组,流产率则显著高于D5冻胚组(P均<0.05);D3鲜胚组的临床妊娠率、胚胎种植率和活产率显著低于D5冻胚组(P<0.05),出生性别比亦显著低于D5冻胚组(P<0.05),多胎率、流产率、早产率、剖宫产率、围生儿死亡率、胎儿畸形发生率、低出生体重儿率则显著高于D5冻胚组(P均<0.05)。 结论 囊胚移植在移植较少胚胎的情况下,仍可获得较高的种植率、临床妊娠率和活产率,同时降低多胎率,且不增加过期产、巨大儿和胎儿畸形的风险。但其可能会提高出生男/女性别比,其对性别比的长远影响尚需进一步深入研究。
卵裂期胚胎移植; 囊胚期胚胎移植; 妊娠结局; 出生男/女性别比
(JReprodMed2017,26(7):640-645)
随着辅助生殖技术(ART)的发展,人们愈加认识到ART的目的是生育一个健康婴儿,更关注单胎活产和母婴安全。理论上囊胚发育经过了一个再筛选的过程,囊胚移植可以提高种植率,增加活产率,减少移植胚胎数,且并不降低妊娠率,使得临床移植策略逐渐向单囊胚移植倾斜,以避免多胎妊娠及相关并发症[1-2]。但受体外培养环境限制,并非所有优质胚胎都能发育至囊胚;体外培养时间的延长,可能会导致基因后天修饰的异常(基因印记异常);男性胚胎的发育速度快于女性胚胎,导致更多的男性胚胎作为优质胚胎被移植,可能出现男胎出生比率高等一系列问题[3-5]。因此,本研究通过比较不同发育时期胚胎移植的妊娠结局和出生性别比,评估卵裂期和囊胚期胚胎移植的安全性和性别比,为临床实践提供参考。
资料与方法
一、研究对象
回顾性分析2012年8月至2015年8月在我院生殖中心接受助孕治疗的19 684个周期的临床资料,根据胚胎移植时间及方式的不同进行分组:卵裂期胚胎移植组13 968个周期(D3组),囊胚期胚胎移植组5 716个周期(D5组),其中D3组分为D3鲜胚组(卵裂期胚胎新鲜周期移植,13 566个周期)和D3冻胚组(卵裂期胚胎冻融移植,402个周期),D5组分为D5鲜胚组(囊胚新鲜周期移植,153个周期)和D5冻胚组(囊胚冻融移植,5 563个周期)。纳入标准:因输卵管、盆腔因素或男方因素不育,经促排卵后行IVF/卵胞浆内单精子注射(ICSI)的患者。排除标准:行胚胎植入前遗传学诊断和筛查(PGD/PGS)、接受赠卵、行未成熟卵体外培养成熟(IVM)、病例资料不全的患者。
二、研究方法
1.助孕治疗:(1)控制性促排卵和取卵术:根据患者情况选择相应的促排卵方案和Gn启动剂量,5~7 d后根据卵泡生长情况调整剂量,晚卵泡期根据患者具体情况加用HMG(75 U/支,珠海丽珠制药)或贺美奇(75 U/支,辉凌,德国)。当优势卵泡直径≥18 mm达到2个以上或至少有3枚卵泡直径≥17 mm,给予人绒毛膜促性腺激素(HCG,珠海丽珠)8 000~10 000 U肌肉注射或艾泽(默克雪兰诺,意大利)0.25 mg皮下注射。注射HCG 36 h后在B超引导下经阴道穿刺取卵。(2)体外受精和胚胎培养:行常规IVF/ICSI体外人工授精,第1天观察受精情况,第2天观察胚胎的卵裂情况,第3天根据Peter分级标准记录胚胎的分级及卵裂球数,第5天根据Gardner评分标准观察囊胚形成情况并评分。(3)胚胎移植、黄体支持及随访:取卵术后第3日或第5日,选择优质胚胎或囊胚移植,移植1~3个卵裂期胚胎或1~2个囊胚,将剩余胚胎进行玻璃化冷冻。移植日给予黄体支持,肌肉注射黄体酮针剂(20 mg/支,浙江仙琚)60 mg/d或雪诺酮(默克雪兰诺,意大利)90 mg/d,同时加用地屈孕酮片(达芙通,雅培,荷兰)20 mg/d。若取卵周期有卵巢过度刺激综合征(OHSS)发生风险、孕酮(P)水平提前升高、输卵管积水及其他原因(如宫腔积液等)不能移植的患者,冻存胚胎或全部行囊胚培养后再冷冻,择期行冻融胚胎移植(FET)。行FET前需根据患者排卵情况选择内膜准备方案。排卵正常者一般选择自然周期移植,排卵异常者则采用激素替代周期或使用小剂量促性腺激素(Gn)进行内膜准备。卵裂期胚胎于移植前1 d下午解冻,在囊胚培养液中过夜,至第2天上午移植;囊胚期胚胎于移植当天早上解冻。胚胎移植术后14 d测血尿HCG,血HCG>5 U/L者胚胎移植术后35 d行彩超检查,确诊有无临床妊娠及妊娠胎数,双胎妊娠者1周后复查彩超,确认胎数,发现三胎及以上妊娠立即行减胎术。分娩后电话随访母婴产科结局。
2.观察指标及判断标准:收集患者的一般信息,Gn天数及用量、移植胚胎数及随访结局,包括胚胎种植率、临床妊娠率、流产率、异位妊娠率、多胎妊娠率、高序多胎妊娠率、减胎比例、早产率、活产率、剖宫产率、围生儿死亡率、胎儿畸形发生率、低出生体重发生率、巨大儿发生率、出生男/女性别比等。
判断标准:移植后35 d行B超检查可见孕囊者为临床妊娠;妊娠不足28周、胎儿体重不足1 000 g而终止者为流产;超声检查宫外可见孕囊和/或原始心管搏动和/或孕囊破裂,经开腹或腹腔镜术后病理检查确诊,包括宫内外同时妊娠均视为异位妊娠;三胎及以上的多胎妊娠为高序多胎妊娠;妊娠满28周至不足37周间分娩者为早产;妊娠达到或超过42周分娩者为过期产。妊娠28周至生后7 d是围生期。出生时体重<2 500 g为低出生体重儿;出生时体重>4 000 g为巨大儿。出生男婴数/出生女婴数为出生性别比。
三、统计方法
采用SPSS18.0软件进行统计分析,计量资料组间比较采用t检验;计数资料组间比较采用卡方检验,P<0.05认为有统计学差异。
结 果
一、各组间一般资料比较
D3组平均年龄为(33.78±5.64)岁,D5组平均年龄(32.33±4.68)岁,组间比较有统计学差异(P<0.05);两组患者的体重指数(BMI)、基础FSH水平比较无统计学差异(P>0.05)。D3鲜胚组和D5鲜胚组的平均年龄、BMI、基础FSH水平比较均无统计学差异(P>0.05)。D3冻胚组的平均年龄和基础FSH水平显著高于D5冻胚组(P<0.05),BMI两组间无统计学差异(P>0.05)。D3鲜胚组与D5冻胚组的平均年龄、BMI、基础FSH水平比较均无统计学差异(P>0.05)(表1)。
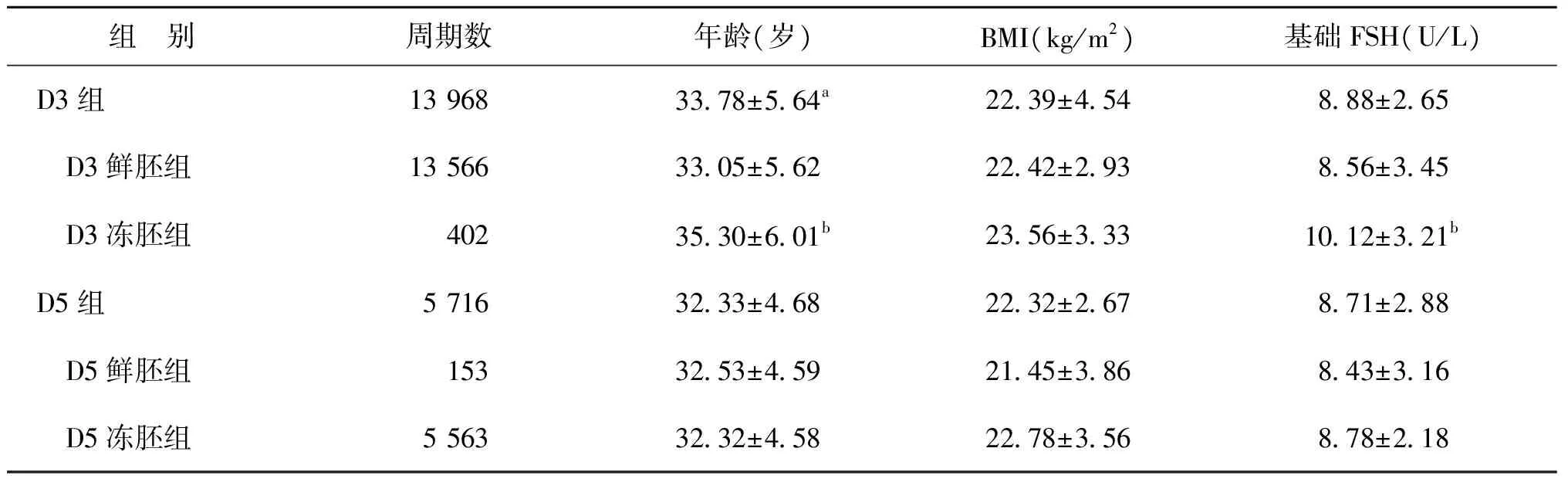
表1 各组患者一般资料比较(x-±s)
注:与D5组比较,aP<0.05;与D5冻胚组比较,bP<0.05
二、各组间临床结局比较
D3组的移植胚胎数显著高于D5组,临床妊娠率、胚胎种植率、活产率显著低于D5组,多胎率、流产率、早产率、围生儿死亡率和低出生体重儿率显著高于D5组,出生男/女性别比显著低于D5组(P均<0.05)其他指标组间比较无显著性差异(P>0.05)(表2)。
D3鲜胚组的移植胚胎数显著高于D5鲜胚组,胚胎种植率显著低于D5鲜胚组,多胎率、流产率、早产率和低出生体重儿率显著高于D5鲜胚组(P均<0.05);其余各指标无显著性差异(P>0.05)(表3)。
D3冻胚组的移植胚胎数显著高于D5冻胚组,临床妊娠率、胚胎种植率、剖宫产率和活产率显著低于D5冻胚组,流产率显著高于D5冻胚组(P均<0.05);其余各指标无显著性差异(P>0.05)(表4)。
D3鲜胚组的移植胚胎数显著高于D5冻胚组,临床妊娠率、胚胎种植率和活产率显著低于D5冻胚组,多胎率、流产率、早产率、剖宫产率、围生儿死亡率、胎儿畸形发生率、低出生体重儿率显著高于D5冻胚组,出生性别比显著低于D5冻胚组(P均<0.05)。

表2 D3组与D5组临床结局比较 [(x-±s),n(%)]
注:与D5组比较,*P<0.05

表3 D3鲜胚组与D5鲜胚组临床结局比较 [(x-±s),n(%)]
注:与D5鲜胚组比较,*P<0.05

表4 D3冻胚组与D5冻胚组临床结局比较 [(x-±s),n(%)]
注:与D5冻胚组比较,*P<0.05
讨 论
随着囊胚体外培养技术和玻璃化冷冻技术的不断完善,临床上,开始考虑将胚胎在体外培养至囊胚期,经过自我筛选,保留发育潜能较好的胚胎,淘汰无发育潜能胚胎,从而提高胚胎种植率、临床妊娠率和活产率,同时减少了移植胚胎数,避免多胎妊娠及相关并发症[6-8]。本研究从妊娠结局、安全性和出生性别比方面进行分析,以全面评估囊胚移植的临床应用价值。
一、卵裂期与囊胚期胚胎移植的妊娠情况比较
近年,部分IVF中心倾向于对获卵数较多或有较多优质胚胎的患者行囊胚培养,在胚胎发育至第5或第6天时移植1~2个优质囊胚[9-11]。本研究中D5组的移植胚胎数显著低于D3组,但D5组的临床妊娠率、胚胎种植率及活产率却显著高于D3组(P<0.05)。为了排除年龄这一混杂因素,将新鲜周期的卵裂期胚胎和囊胚进行比较,D5鲜胚组在移植胚胎数显著低于D3鲜胚组时,仍保持明显高的胚胎种植率(P<0.05),提示囊胚移植可能更符合自然形态,有利于胚胎着床,获得较好的临床结局。本中心的移植策略是:新鲜周期移植患者一般移植2枚D3卵裂期胚胎,剩余胚胎均行囊胚培养,冻胚复苏移植的患者常规移植1枚囊胚。即冻胚复苏移植大部分为囊胚移植。只有年龄大、胚胎数少或胚胎质量差的患者为避免囊胚培养失败、下一个周期无可移植胚胎而选择卵裂期胚胎冷冻。因此,本研究纳入的周期中D5鲜胚组和D3冻胚组样本数较少,未进行统计学比较。
二、卵裂期与囊胚期胚胎移植的妊娠安全性比较
在行ART时为了保证成功率倾向于移植1个以上的卵裂期胚胎,导致ART的多胎妊娠率及母胎并发症一直居高不下[12]。随着囊胚培养和冷冻技术的发展,逐步倾向于将优质的卵裂期胚胎体外培养,形成囊胚后行单囊胚移植以降低多胎妊娠率。但是,囊胚培养也有一定的风险和安全隐患。即使卵裂期胚胎形态良好,也难以避免无囊胚形成的风险,导致周期取消,降低了胚胎利用率。有文献报道,基因组印记的重建与维持主要在生殖细胞发生、成熟、受精以及胚胎着床前进行,如果受到外界环境因素干扰,极有可能发生基因组印记模式异常而导致严重的不良后果[13]。囊胚培养延长了体外培养时间,在很大程度上增加了胚胎在体外环境下发生表观遗传印记的可能性,进而影响胚胎发育及分化过程,影响子代安全。本研究结果中,D3组的多胎率、流产率、早产率、围生儿死亡率和低出生体重儿发生率显著高于D5组(P<0.05),可能与卵裂期移植的胚胎数多有关。而围生儿死亡率和低出生体重儿率的增加和高的早产率息息相关。排除年龄的影响,D3鲜胚组和D5冻胚组相比,结果一致。在均行新鲜周期移植的情况下,D3鲜胚组的多胎率、流产率、早产率和低出生体重儿发生率均显著高于D5鲜胚组(P<0.05)。关于表观遗传的改变,本研究比较了D3组和D5组的过期产率、巨大儿发生率和胎儿畸形率等,结果未发现囊胚移植增加其发生率。另外,研究结果中,各组的剖宫产率均较高,可能与IVF中心对医学知识宣教不足、患者对ART的认识不够及患者的精神心理压力大有关。
三、出生性别比比较
出生性别比,通常用每100名出生女婴数相对应的出生男婴数表示[14]。自然生育模式下男女婴的出生比为106~110:100[15]。Chang等[4]进行Meta分析显示囊胚移植后出生的子代男/女性别比例为1.32,而卵裂期胚胎移植后出生的子代男/女性别比例为1.04。本研究结果中,D5组的出生男女性别比为1.24显著高于D3组的1.03(P<0.05),提示卵裂期胚胎移植的男女性别比更接近自然模式,而囊胚移植的男婴比例明显高于女婴,可能与体外培养环境中,胚胎从第3天发育至第5天时,男性胚胎较女性胚胎发育速度更快有关。细胞分裂速度越快、细胞数越多的胚胎其遗传物质为男性的可能性越大,导致男性胚胎被选为优质囊胚进行移植的几率更大[16-17]。本研究中,D3鲜胚组与D5鲜胚组、D3冻胚组与D5冻胚组的出生男女性别比均无显著性差异(P>0.05),可能与组间样本量差异较大有关;而D5冻胚组的性别比显著高于D3鲜胚组(P<0.05),是否提示冷冻及复苏操作影响囊胚发育尚需进一步研究探讨。
综上所述,与卵裂期胚胎移植相比,囊胚移植在移植较少胚胎的情况下,仍可获得较高的种植率、临床妊娠率和活产率,同时降低多胎率。而且囊胚移植未增加过期产、巨大儿和胎儿畸形的风险。由于胚胎在体外发育速度的不一致性,囊胚移植可能对男/女性别比有影响,但目前ART出生的子代尤其是囊胚移植后出生的子代在整体人群中所占的比例较小,短期内不会导致整个社会人口的性别比失衡[18],其对性别比的长远影响有待于进一步的研究。因此,临床上可以考虑囊胚的新鲜和冷冻周期移植,特别是对于身材矮小、子宫畸形、宫颈机能不全、瘢痕子宫(剖宫产、子宫肌瘤剔除术后)或既往合并孕期并发症的患者,建议单囊胚移植,既能获得满意的妊娠率,又能减少多胎妊娠导致的孕期和新生儿并发症。
[1] JointSogc-cfas. Guidelines for the number of embryos to transfer following in vitro fertilization No.182,September 2006[J].Int J Gynaecol Obstet,2008,102:203-216.
[2] Glujovsky D,Blake D,Farquhar C,et al.Cleavage stage versus blastocyst stage embryo transfer in assisted reproductive technology[J/CD].Cochrane Database Syst Rev,2012,(7):CD002118.
[3] Mullin CM,Fino ME,Talebian S,et al.Comparison of pregnancy outcomes in electivesingle blastocyst transfer versus double blastocyst transfer stratified by age[J].Fertil Steril,2010,93:1837-1843.
[4] Chang HJ,Lee JR,Jee BC,et al.Impact of blastocyst transfer on offspring sex ratio and the monozygotic twinning rate:a systematic review and meta-analysis[J].Fertil Steril,2009,91:2381-2390.
[5] Alfarawati S,Fragouli E,Colls P,et al.The relationship between blastocyst morphology,chromosomal abnormalityand embryo gender[J].Fertil Steril,2011,95:520-524.
[6] Kaur P,Swarankar ML,Maheshwari M,et al.A comparative study between cleavage stage embryo transfer at day 3 and blastocyst stage transfer at day 5 in in-vitro fertilization/intra-cytoplasmic sperm injection on clinical pregnancy rates[J].J Hum ReprodSci,2014,7:194-197.
[7] Ezugwu E,der Burg SV.Debating elective single embryo transferafter in vitro fertilization:a plea for a context-sensitive approach[J].Ann Med Health Sci Res,2015,5:1-7.
[8] Glujovsky D,Farquhar C.Cleavage-stage or blastocyst transfer:what are the benefits and harms?[J].Fertil Steril,2016,106:244-250.
[9] 倪晓蓓,王珊珊,张宁媛,等.在OHSS高危患者中卵裂期胚胎移植与囊胚移植的临床结局分析[J].生殖医学杂志,2016,25:610-613.
[10] Chun S,Seo JE,Rim YJ,et al.Efficacy of hyaluronan-rich transfer medium on implantation and pregnancy rates in fresh and frozen-thawed blastocyst transfers in Korean women with previous implantation failure[J].Obstet GynecolSci,2016,59:201-207.
[11] Pereira N,Petrini AC,Lekovich JP,et al.Comparison of perinatal outcomes following fresh and frozen-thawed blastocyst transfer[J].Int J Gynaecol Obstet,2016,135:96-100.
[12] Luke B,Brown MB,Wantman E,et al.Cumulative birth rates with linked assisted reproductive technology cycles[J].N Engl J Med,2012,366:2483-2491.
[13] 张福利.卵裂期与囊胚期胚胎移植妊娠结局的安全性研究[D].郑州大学,2014.
[14] 崔祥芬,戴力辉,苗苗,等.基于医疗机构出生登记的出生性别比实证研究[J].中国社会医学杂志,2014,21:206-208.
[15] 马海兰,罗克莉,龚斐,等.辅助生殖技术助孕出生婴儿性别比例的初步调查[J].生殖医学杂志,2013,22:203-204.
[16] Maalouf WE,Mincheva MN,Campbell BK,et al.Effects of assisted reproductive technologies on human sex ratio at birth[J].Fertil Steril,2014,101:1321-1325.
[17] Milki AA,Jun SH,Hinckley MD,et al.Comparison of the sex ratio with blastocyst transfer and cleavage stage transfer[J].J Assist Reprod Genet,2003,20:323-326.
[18] Csokmay JM,Hill MJ,Cioppettini FV,et al.Live birth sex ratios are not influenced by blastocyst-stage embryo transfer[J].Fertil Steril,2009,92:913-917.
[编辑:肖晓辉]
DOI:10.3969/j.issn.1004-3845.2017.07.005
Comparison of pregnancy safety and sex ratio at birth of embryo transfer at cleavage stage or blastocyst stage
LIULing,XUPeng,YANGYi-chen,WANGHuan,LIWei,RENHai-qin*
ReproductiveMedicineCenterofJinghuaHospital,Shenyang110005
Objective:To study the effect of embryo transfer at cleavage stage or blastocyst stage on pregnancy outcome and sex ratio at birth.
Methods:The data of 19 684 cycles of undergone assisted reproductive technology (ART) including 13 968 cycles of embryo transfer at cleavage stage and 5716 cycles of blastocyst transfer in our centers from Aug.2012 to Aug.2015 were retrospectively analyzed.The patients were divided into four groups:Day 3 fresh group (13 566 cycles of fresh embryo transfer at cleavage stage),Day 3 frozen-thawed group (402 cycles of frozen-thawed embryo transfer at cleavage stage),Day 5 fresh group (153 cycles of fresh blastocyst transfer),Day 5 frozen-thawed group (5 563 cycles of frozen-thawed blastocyst transfer).Clinical outcomes and sex ratio at birth were compared between cleavage stage and blastocyst embryo transfer.
Results:The number of embryo transfer in Day 3 group was significantly higher than that in Day 5 group (P<0.05).The clinical pregnancy rate,implantation rate,live birth rate and male/female ratio at birth in Day 3 group were significantly lower than those in Day 5 group (allP<0.05).The multiple pregnancy rate,abortion rate,premature birth rate,perinatal mortality and incidence of low birth weight infant in Day 3 group were significantly higher than those in Day 5 group (allP<0.05).The implantation rate in Day 3 fresh group was significantly lower than in Day 5 fresh group (P<0.05).The multiple pregnancy rate,abortion rate,premature birth rate and incidence of lower birth weight in Day 3 fresh group were significantly higher than those in Day 5 fresh group (P<0.05).The clinical pregnancy rate,implantation rate,cesarean section rate,live births rate in group Day 3 frozen-thawed group were significantly lower,but the abortion rate was significantly higher than Day 5 frozen-thawed group (allP<0.05).The clinical pregnancy rate,embryo implantation rate and live birth rate and the male/female ratio at birth in Day 3 fresh embryo group were significantly lower than those in Day 5 frozen-thawed group (allP<0.05).The multiple birth rate,abortion rate,premature delivery rate,cesarean section rate,perinatal mortality rate,fetal malformations rate,low birth weight infant rate in Day 3 fresh group were significantly higher than Day 5 frozen embryo group (allP<0.05).
Conclusions:Blastocyst transplantation even transplanting fewer embryos can result in higher implantation rate,clinical pregnancy rate and live birth rate,while reducing multiple birth rate without increasing the risk of overdue birth rate,macrosomia or fetal malformation rate.It may increase male/female ratio at birth,but its long-term impact on the sex ratio still needs further study.
Embryo transfer at cleavage stage; Blastocyst transfer; Pregnancy outcome; Sex ratio at birth
10.3969/j.issn.1004-3845.2017.07.004
2017-03-28;
2017-05-13
刘玲,女,安徽人,硕士,主治医生,生殖内分泌专业.(*
)
